基于一步物理化学法成胶的可注射水凝胶及其制备方法与流程
本发明属于医用生物材料技术领域,涉及一种可注射水凝胶,具体涉及一种基于一步物理化学法成胶的可注射水凝胶及其制备方法。
背景技术:
可注射水凝胶是指注射前为流动液体,通过注射器注入皮下或肌肉组织后,可在注射部位原位凝胶化的水凝胶。较之于传统的水凝胶,可注射水凝胶应用于生物医药领域具有诸多优异性能。如应用于药物、基因或细胞包封时,可通过简单的物理混合负载各种药物分子、基因或细胞,并实现病变部位的局部给药和长效释药,同时还可最大限度地保持药物、基因、细胞的生物活性;应用于组织工程时,注入的液体可充满整个具有不规则形状的缺损部位,避免了预塑型支架材料难以与修复部位吻合的缺陷。此外,可注射水凝胶无需外科手术植入,避免了植入型支架材料带来的手术创伤及并发炎症。
根据凝胶化原理的不同,可注射水凝胶分为物理水凝胶和化学水凝胶两类。目前普遍采用三种方法制备可注射水凝胶:(i)聚合物响应于各种刺激如pH变化、温度变化、光等的多层次自组装;(ii)乙烯基单体包括乙烯基功能化的PEG、PVA与多糖的原位自由基交联;(iii)大分子前体的缩聚如迈克尔型加成反应、Diels-Alder反应、席夫碱反应和施陶丁格连接反应。其中,聚合物的自组装属于物理交联,具有相对温和细胞毒性小等优点,其凝胶化过程通常是可逆的,所得水凝胶具有良好的自愈合性能。尽管如此,物理水凝胶通常不如化学水凝胶坚固,且物理水凝胶的结构稳定性也远不如化学水凝胶。然而,化学交联方法由于其相对快速的凝胶化过程和交联剂的使用往往具有较强的细胞毒性。
为解决上述问题,基于次序多步交联法制备的双网络水凝胶已被广泛报道,这种方法是通过先物理交联后化学交联或先化学交联后物理交联。其制备的水凝胶具有极高的机械强度(约几十兆帕)、低摩擦系数、与天然软骨相当的耐磨性,以及优异的可调节的多响应性能、热稳定性和适宜细胞培养的特性。这些特点虽然克服了传统纯物理水凝胶或化学水凝胶相对较差的机械性能和功能单一性等问题,但次序多步交联仍面临诸多实际问题,如具有步骤繁琐、复杂和耗时的凝胶过程,并且难以精确控制每种组分的摩尔比,导致最终形成的水凝胶可塑性差、3D网络各向异性以及凝胶机械强度重复性有限。因此,迫切需要建立一种更简单和通用的方法来实现纯物理交联和化学交联的功能互补,并简化次序多步交联繁琐的凝胶化过程。
技术实现要素:
基于以上技术问题,本发明提供了一种基于一步物理化学法成胶的可注射水凝胶。该水凝胶同时结合物理和化学交联,实现了一步凝胶化,且原料易得,制备方法简单,可行性强。
为了实现上述发明目的,本发明采用如下技术方案:
基于一步物理化学法成胶的可注射水凝胶,由以下质量百分比的原料组成:活性酯聚乙二醇马来酰亚胺(NHS-PEG-MAL)5-35%和聚酰胺基胺(PAMAM)5%,余量为水。
本发明所述活性酯聚乙二醇马来酰亚胺与聚酰胺基胺的质量比例为1~7:1,在该质量比范围内的凝胶化速率非常适用于原位注射,所得凝胶孔隙均匀,机械性能好,可塑性强,细胞毒性小。
NHS-PEG-MAL和PAMAM可同时提供物理和化学交联位点,并基于MAL和NH2的氢键作用,NHS和NH2的酯交换作用,以及MAL自身的π-π叠加作用,实现一步凝胶化。
本发明所述的聚酰胺基胺为三代树状大分子。PAMAM代数低于三代无法成胶,因为低代数的PAMAM刚性较差,树枝状结构堆叠松散,不利于成胶。
本发明所述活性酯聚乙二醇马来酰亚胺的分子量为5000Da。NHS-PEG-MAL分子量低于5000Da无法成胶,因为低分子量的PEG柔韧性较差,链段较短,无法将PAMAM分子交联在一起。
本发明可注射水凝胶的pH为6~8。在酸性条件(即pH<6)下,NH2易质子化并形成相应的铵离子(NH3+),导致MAL和NH2之间的氢键减少甚至消失,难以成胶;在碱性条件(即pH>8)下,MAL基团的缓慢水解也可能阻碍氢键以及水凝胶的形成。
本发明还提供了该可注射水凝胶的制备方法:在室温下将活性酯聚乙二醇马来酰亚胺和聚酰胺基胺分别溶解在pH为7.2-7.5的磷酸盐缓冲液中,再按比例混合,得水凝胶。
本发明的有益效果在于:
1、本发明的可注射水凝胶可以同时提供物理和化学交联位点,并基于MAL和NH2的氢键作用,基于NHS和NH2的酯交换作用,以及MAL自身的π-π叠加作用,实现一步凝胶化。
2、传统的化学交联存在相对快速和高毒性的凝胶化过程,而物理交联存在机械强度差等问题,针对这些缺点,本发明首次提出了物理和化学交联同时进行的一步交联法。该方法具有诸多优点:1)与传统化学交联相比,由于引入了物理交联位点,其凝胶过程相对温和安全;2)与传统物理凝胶相比,由于引入化学交联位点,所得水凝胶具有较好的机械性能,且可以通过简单地调节两种凝胶单元的浓度和官能团的摩尔比,实现对凝胶速率和机械性能的高度可控;3)与次序多步交联相比,具有非常简单且易于控制的胶凝化步骤,所得凝胶的3D网络具有高度的均质性,且凝胶形状具有优异的可塑性。
3、本发明选用PAMAM和NHS-PEG-MAL为水凝胶原料,两种原料能同时发生物理(氢键)和化学(酯交换)交联作用,且制备简单,并已实现商业化。因此,其选用及对此类凝胶方法的建立、推广和促进其在组织工程和再生医学中的应用具有非常重要的价值。
附图说明
图1为本发明浓度为10%、25%和40%w/v水凝胶的FT-IR光谱。
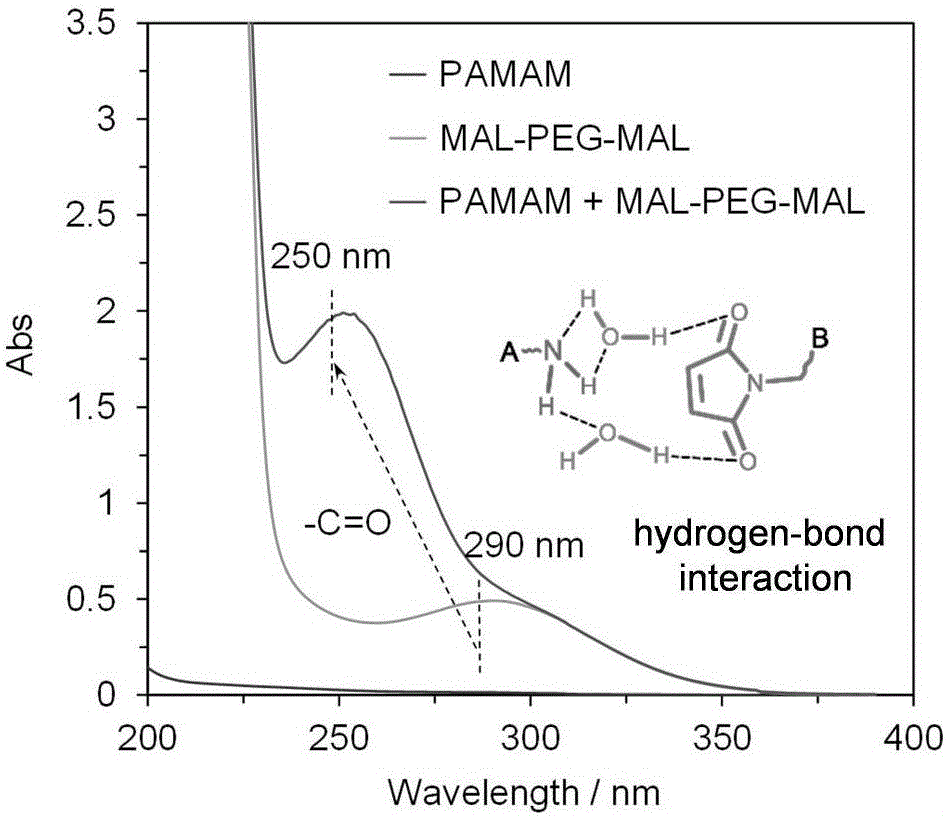
图2为0.1%w/v的PAMAM、MAL-PEG-MAL和MAL-PEG-MAL/PAMAM水溶液的UV-vis光谱。
图3为MAL-PEG-MAL/PAMAM水凝胶(25%w/v)的pH敏感性示意图
图4为0.1%w/v的4arm-PEG-MAL的UV-vis光谱。
图5为MAL-PEG-MAL分子量和PAMAM代数依赖性的凝胶化行为示意图。
图6为本发明中一步成胶法制得的可注射水凝胶的TEM图片,比例尺=500nm。
图7为10%(A1)、25%(A2)和40%w/v(A3)的NHS-PEG-MAL/PAMAM水凝胶的SEM照片(插图显示相应浓度下更高分辨率的SEM照片),比例尺=10μm;(B)新鲜制备的NHS-PEG-MAL/PAMAM水凝胶(25%w/v)的CLSM照片,其中PAMAM由Cy5.5荧光标记,比例尺=50μm。
图8为10%(A1)、25%(A2)和40%w/v(A3)的NHS-PEG-MAL/PAMAM水凝胶的流变性能;(B)不同形状的NHS-PEG-MAL/PAMAM水凝胶,比例尺=1cm。
图9为HeLa细胞(A1)和NIH 3T3成纤维细胞(A2)在25%w/vNHS-PEG-MAL/PAMAM水凝胶中包封12小时、24小时和48小时的CCK-8检测。(**:p<0.01,*:p<0.05,分别与12小时的对应浓度相比)。
具体实施方式
下面结合具体实施方式对本发明的实质性内容作进一步详细的描述。
实施例1
基于一步物理化学法成胶的可注射水凝胶,由以下质量百分比的原料组成:活性酯聚乙二醇马来酰亚胺5%和聚酰胺基胺5%,余量为水。
实施例2
基于一步物理化学法成胶的可注射水凝胶,由以下质量百分比的原料组成:活性酯聚乙二醇马来酰亚胺35%和聚酰胺基胺5%,余量为水。
所述活性酯聚乙二醇马来酰亚胺的分子量为5000Da。
所述的聚酰胺基胺为三代树状大分子。
该可注射水凝胶的pH为8。
实施例3
基于一步物理化学法成胶的可注射水凝胶,由以下质量百分比的原料组成:活性酯聚乙二醇马来酰亚胺20%和聚酰胺基胺5%,余量为水。
所述活性酯聚乙二醇马来酰亚胺的分子量为5000Da。
所述的聚酰胺基胺为三代树状大分子。
该可注射水凝胶的pH为7.4。
实施例4
基于一步物理化学法成胶的可注射水凝胶,由以下质量百分比的原料组成:活性酯聚乙二醇马来酰亚胺15%和聚酰胺基胺5%,余量为水。
所述活性酯聚乙二醇马来酰亚胺的分子量为5000Da。
所述的聚酰胺基胺为三代树状大分子。
该可注射水凝胶的pH为7.5。
实施例5
基于一步物理化学法成胶的可注射水凝胶,由以下质量百分比的原料组成:活性酯聚乙二醇马来酰亚胺10%和聚酰胺基胺5%,余量为水。
所述活性酯聚乙二醇马来酰亚胺的分子量为5000Da。
所述的聚酰胺基胺为三代树状大分子。
该可注射水凝胶的pH为6。
实施例6
本实施例为实施例1的可注射水凝胶的制备方法,包括以下步骤:
A、在室温下将活性酯聚乙二醇马来酰亚胺和聚酰胺基胺分别溶解在pH 7.2的磷酸盐缓冲液中,将活性酯聚乙二醇马来酰亚胺配制为100g/L的溶液,将聚酰胺基胺配制为100g/L的溶液。
B、将A步骤得到的活性酯聚乙二醇马来酰亚胺溶液与聚酰胺基胺溶液按1:1体积混合,得水凝胶。
实施例7
本实施例为实施例2的可注射水凝胶的制备方法,包括以下步骤:
A、在室温下将活性酯聚乙二醇马来酰亚胺和聚酰胺基胺分别溶解在pH 7.5的磷酸盐缓冲液中,将聚酰胺基胺配制为100g/L的溶液,将活性酯聚乙二醇马来酰亚胺配制为700g/L的溶液。
B、将A步骤得到的活性酯聚乙二醇马来酰亚胺溶液与聚酰胺基胺溶液按1:1体积混合,得水凝胶。
实施例8
本实施例为实施例3的可注射水凝胶的制备方法,包括以下步骤:
A、在室温下将活性酯聚乙二醇马来酰亚胺和聚酰胺基胺分别溶解在pH 7.4的磷酸盐缓冲液中,将聚酰胺基胺配制为100g/L的溶液,将活性酯聚乙二醇马来酰亚胺配制为400g/L的溶液。
B、将A步骤得到的活性酯聚乙二醇马来酰亚胺溶液与聚酰胺基胺溶液按1:1体积混合,得水凝胶。
对照实验
本发明选择三代(G3)的PAMAM和NHS-PEG5000-MAL作为模型元素A和B。
实验条件:室温下在pH 7.4的磷酸盐缓冲液(PBS)中混合100g/L的PAMAM与400g/L的NHS-PEG-MAL(质量比为1:4)得到25%w/v凝胶。
对照品:使用相同PEG分子量为5000Da的(A组)马来酰亚胺聚乙二醇甲氧基(MAL-PEG-OMe)和PAMAM、(B组)N-羟基琥珀酰亚胺聚乙二醇甲氧基(NHS-PEG-OMe)和PAMAM、(C组)MAL-PEG-MAL和PAMAM、(D组)NHS-PEG-NHS和PAMAM作为对照。
结果:A组和B组的混合溶液未发生凝胶化;而C组、D组和NHS-PEG-MAL在几分钟内均与PAMAM形成稳定的水凝胶。
由此可见,具有单一物理(仅MAL)或化学(仅NHS)交联位点的PEG不能与PAMAM形成水凝胶。相反,如果它具有两个交联位点,两个MAL或两个NHS都可以与PAMAM形成稳定的水凝胶。表明基于MAL的纯物理交联和基于NHS的纯化学交联均可以与PAMAM形成水凝胶。此外,基于NHS-PEG-MAL的水凝胶的形成强有力地证明了我们一步凝胶化方法的可行性,并通过以下驱动力实现:基于NHS和NH2的酯交换作用,MAL和NH2的氢键作用,以及NHS-PEG-PEG上的MAL基团之间的非共价π-π叠加作用。
光谱分析
为了证实两个模型元素之间的氢键作用,进行傅里叶变换红外(FT-IR)光谱分析。如图1所示,NHS-PEG-MAL上的MAL基团的α,β-不饱和酮羰基(-C=O)的伸缩振动在1720cm-1处具有典型的吸收带。然而,当10g/L的NHS-PEG-MAL与不同浓度的PAMAM(100g/L,400g/L和700g/L)形成凝胶时,1720cm-1处吸收强度显著降低,表明MAL上的酮羰基与PAMAM上的NH2之间存在氢键作用。
此外,碳-碳双键(-C=C)在1650cm-1处的典型伸缩振动吸收强度的恒定,进一步证实了基于MAL和NH2的相互作用是氢键而不是其它化学作用,如迈克尔加成。0.1%w/v PAMAM、MAL-PEG-MAL和MAL-PEG-MAL/PAMAM水溶液的UV-vis光谱可以进一步验证该结论。
如图2所示,PAMAM由于其饱和烷烃结构无特征吸收带,MAL-PEG-MAL在290nm处的特征吸收峰是源于MAL基团上ππ(C=C)和nπ(C=O)发色团的共轭效应激发的。随着PAMAM的加入,其吸收强度显著的增加并伴随明显的蓝移(从290移动到250nm)进一步表明MAL和NH2之间未发生迈克尔加成反应。因此,这些结果进一步证实了MAL和NH2之间氢键作用的存在。
MAL-PEG-MAL/PAMAM水凝胶(25%w/v,通过混合100g/L PAMAM和400g/L MAL-PEG-MAL)优异的pH敏感性和可逆性也证实了MAL和NH2之间的氢键作用。如图3所示,MAL-PEG-MAL/PAMAM水凝胶只能在中性条件(pH6~8)下形成。在酸性条件(即pH<6)下,NH2易质子化并形成相应的铵离子(NH3+),导致MAL和NH2基团之间的氢键作用减少甚至消失,难以成胶;在碱性条件(即pH>8)下,MAL基团的缓慢水解也可能阻碍氢键以及水凝胶的形成。
除了酯交换和氢键作用外,非共价π-π叠加也参与了一步物理化学水凝胶的形成,通过4arm-PEG-MAL水凝胶的形成可以证明这一结论。在这个体系中MAL基团是唯一的交联位点,其非共价π-π叠加是形成水凝胶的唯一驱动力。为证明这一结论,在48小时内跟踪了4arm-PEG-MAL水溶液(0.1%w/v)的UV-vis光谱。如图4所示,由于MAL基团的非共价π-π叠加作用,其在290nm处的特征发色团强度随时间的推移逐渐增加。并且值得注意的是,25%w/v的4arm-PEG-MAL水凝胶的凝胶化时间(约12小时)远远长于比本发明的一步法水凝胶的凝胶时间(约几十秒至几分钟),表明非共价π-π堆叠是相对较弱的驱动力,可缓慢地参与3D网络的逐渐完善过程。
图1-图4充分证明了酯交换、氢键作用和非共价π-π叠加是形成一步物理化学水凝胶的主要驱动力。除此之外,本发明还发现其他因素,如PEG的分子量和PAMAM的代数也可显著影响水凝胶的形成。如图5所示,PEG分子量低于5000Da(即2000和3500Da)的NHS-PEG-MAL在任何浓度和任何摩尔比下均不能与3代的PAMAM形成水凝胶。类似地,当PAMAM代数低于三代(即G2)时也不能与NHS-PEG5000-MAL在任何浓度和任何摩尔比下发生凝胶化。PEG分子量依赖性凝胶化行为可能与PEG的链长度和柔性相关。因为低分子量的PEG柔韧性较差,链段较短,无法将PAMAM分子交联在一起;此外,PAMAM代数依赖性凝胶化行为可归因于不同代数PAMAM的表面结构和刚度的不同。代数低的PAMAM刚性较差,树枝状结构堆叠胶松散,不利于成胶。
总之,上述结果验证了本发明的一步凝胶化的可行性,这种水凝胶可通过两种常见的,广泛使用的和商业化的成胶单元(PAMAM和NHS-PEG-MAL)之间同时发生的物理(氢键和π-π堆叠)和化学(酯交换)交联作用来实现。通过水凝胶的微观结构进一步证实了这一结论。如图6所示,25%w/v水凝胶的TEM照片显示其具有均匀且直径约500nm的树枝状交联结构,这种树枝状的纳米结构很好地表明了PAMAM和NHS-PEG-MAL之间通过在PAMAM的纳米球状结构表面上发生的酯交换作用,氢键作用和π-π堆叠相互作用缠结在一起。这种枝晶形态也在以前的研究中也曾被观察到过。
性能评估
在建立这种新颖的一步凝胶化方法之后,本发明通过以下实验系统地评估了该水凝胶在孔隙率、凝胶化速率、机械强度方面的可控性以及水凝胶的均匀性、可塑性和细胞毒性。
1、电子显微镜扫描
采用SEM观察一步物理化学水凝胶的内部形态,将100g/L PAMAM分别与不同质量浓度(100g/L,400g/L和700g/L)的NHS-PEG-MAL混合(PAMAM:NHS-PEG-MAL=1/1、1/4和1/7)制备10%,25%和40%w/v的水凝胶。如图7A所示,三种冻干水凝胶的截面都呈现出连续的多孔结构,孔隙率随凝胶浓度的增加而逐渐增加。本发明的一步物理化学水凝胶除了在孔隙度方面具有良好的可控性外,还具有高度的均质性,其结果如新鲜制备的25%w/v水凝胶的共聚焦显微镜照片所示(图7B)。该水凝胶均匀的多孔结构赋予它们诸多优点,如可作为各种生物活性分子递送或用于细胞包封和培养的理想载体或支架。此外,有研究表明水凝胶的高度均质性有利于提高水凝胶的机械强度并为细胞粘附和增殖提供更合适的框架。
2、流变性能测试
使用动态流变仪测量水凝胶的凝胶化速率和机械性能,如图8所示。图8A1中,水凝胶的凝胶化时间(G'和G"之间的交叉点对应的横坐标)表现出对凝胶浓度的高度依赖性。通过将凝胶浓度从40%调节至10%w/v,凝胶化时间对应的从几十秒变为几分钟,表明了胶凝时间的优异可控性,这是水凝聚用于原位注射的一个最基本和最重要的先决条件。此外,此类水凝胶的最低凝胶化浓度(MGC)为10%w/v。有趣的是,此类水凝胶的储能模量(G')也具有凝胶浓度的高度依赖性,随凝胶浓度从10%增加到40%w/v,G'从400Pa迅速增加1MPa。值得注意的是,40%w/v水凝胶的储能模量(1MPa)显著高于目前报道的大多数物理水凝胶。频率扫描实验进一步证实了此类水凝胶机械强度的良好可控性和40%w/v水凝胶超高的机械强度(图8A2)。如图8A3所示,在应力小于等于100%时,40%w/v水凝胶的G'和G"值保持恒定,应变达到1000%以上时,G'和G"值开始快速降低。以上结果表明一步凝胶法形成的水凝胶在承受相当大的外力破坏下能够保持结构完整性,并且这种抗破坏能力随水凝胶浓度而增加。这种优异的机械强度完全符合药物递送和组织工程应用的期望,因为水凝胶应用在这些领域时需要承受由外部机械负载引起的环境变化,还需要抵抗损伤区域中的高压以避免包载的生物活性分子或细胞的突释。
除了高度的均质性,及孔隙率,凝胶速率和机械性能的优异可控性外,本发明的水凝胶还具有优异的可塑性。如图8B所示,水凝胶可以形成我们期望的各种形状,例如正方形,圆形,菱形和三角形,说明可以将凝胶的前体溶液直接注射到复杂形状的病变区域中以实现原位和微创的凝胶过程。
如上所述,本发明的一步凝胶法与传统的物理,化学和次序多步交联策略相比具有诸多优点,包括优异的机械性能,良好的均质性和可塑性,以及在凝胶化速率,孔隙率和机械性能等方面的优异可控性。这种高度可控性可能源于交联位点的确定性,参与交联的官能团数目的精确性,以及两种凝胶单元浓度的精确调控性。
3.细胞毒性检测
众所周知,阻碍可注射水凝胶广泛使用的重要原因之一是原位凝胶化过程引起的细胞毒性。因此,本发明通过活/死细胞染色来检测我们一步凝胶化过程的细胞毒性。本发明直接在已经铺展开的HeLa细胞和鼠源NIH 3T3成纤维细胞的表面原位成胶。并以相同质量分数(25%w/v)的基于NHS-PEG-NHS和MAL-PEG-MAL的纯化学和物理凝胶为对照材料。
孵育24小时后,在基于NHS-PEG-NHS的纯化学水凝胶中可见大量死细胞,这可能是由于它们相对快速的凝胶化过程造成的。相比之下,在基于MAL-PEG-MAL的纯物理水凝胶和本发明的一步物理化学水凝胶中几乎无死细胞,表明本发明的一步凝胶化方法具有相对温和安全的凝胶化过程。这是可注射水凝胶应用于原位注射的一个先决条件。该结果表明本发明的一步物理化学水凝胶在各种生物医学应用(如原位药物输送系统)中具有巨大的潜力。
本发明进一步将105个HeLa细胞和NIH 3T3成纤维细胞直接与水凝胶前提溶液混合用于制备包封有细胞的水凝胶,并在分别培养12,24和48小时后进行活/死细胞染色和CCK8检测。封装在25%w/v水凝胶中的HeLa细胞和NIH3T3成纤维细胞在12至48小时内呈现良好的生长趋势,并且在成胶24小时后可以观察到良好的拉伸纺锤形形态。CCK8结果也表明,所有水凝胶中的细胞都保持良好的活性,例如,在10%,25%和40%w/v水凝胶中HeLa细胞(图9A1)的细胞存活率分别达到94%、85%和82%,略高于NIH 3T3细胞的约92%、86%和77%(图9A2)。这些结果进一步证实本发明的一步凝胶化方法是温和安全的,并具有良好的生物相容性,这可能归结于此类水凝胶适宜的孔隙率和机械强度为细胞生长和增值提供了理想的微环境。
因此,本发明的一步物理化学水凝胶具有巨大的应用潜力,如在再生医学中用于细胞包封,甚至用作3D生物打印的生物墨水。此外,PAMAM独特的纳米球状结构不仅可以提供大的内腔用于包封各种生物活性分子或药物,而且还提供丰富的外周NH2基团用于携载或化学键合各种药物或治疗分子(即光敏剂,CO/NO释放分子)用于化疗、光动力学治疗(PDT)、气体治疗,以及多种药物联合治疗。
综上,本发明提供了一种用于制备可注射水凝胶的同时结合了物理和化学交联的一步凝胶化方法,该方法制备超简便且具有多功能性。由于其确定的交联位点,精确的交联基团数目,以及两种胶凝单元浓度(NHS-PEG-MAL和PAMAM)的精确可控性,该方法不仅在凝胶化速率,孔隙率和机械性能方面表现出优异的可控性,还显示出优于传统水凝胶的诸多优点,如优异的机械性能,良好的均质性、可塑性和生物相容性。此外,PAMAM内部的大内腔和丰富的外围NH2赋予所获得的水凝胶具有多重功能,使其可以成为联合多种治疗方法的平台。
- 还没有人留言评论。精彩留言会获得点赞!