一种固态发酵制备耐热耐酸葡萄糖氧化酶的方法及应用与流程
本发明属于微生物技术领域,具体涉及一种产耐热耐酸葡萄糖氧化酶的嗜热拟青霉菌株固态发酵制备葡萄糖氧化酶的方法及应用。
背景技术:
葡萄糖氧化酶(glucoseoxidase,简称god),能高度专一性地催化β-d-葡萄糖与空气中的氧反应,使葡萄糖氧化成为1,5-葡萄糖酸内酯和过氧化氢,而后葡萄糖酸内酯又自发和水结合产生葡萄糖酸。由于该酶具有的独特性质和安全性,使其在食品、医药、饲料等行业展示了较高的应用价值。在食品方面,葡萄糖氧化酶可以作为面粉改良剂,改善面筋的组织结构,提高面团的持气性、弹性、持水性;由于葡萄糖氧化酶有氧情况下可以从系统中除去葡萄糖,在葡萄糖的存在下可除去氧气,因此广泛应用于各类食品制造、器械除氧防锈等方面,如可用于蛋粉加工中脱糖、护色,同时还可用于葡萄酒、啤酒、果汁等的除氧保鲜;用于防止虾肉、干鲜食品的氧化。另外葡萄糖氧化酶还可以用于葡萄糖酸和葡萄糖酸盐的工业化生产。由于god作用的高度专一性,它还被用于葡萄糖的定量测定,如用于血糖含量的测定和口腔疾病的防治。在饲料方面,葡萄糖氧化酶葡可以解除饲料中真菌素的危害,提高动物免疫能力,替代药物促生长剂使用。
目前,把葡萄糖氧化酶作为面粉及饲料添加剂已应用于实际生产,但仍然存在阻碍其广泛应用的技术难题。例如饲料加工中为防止沙门氏菌的污染,需要采用高温灭菌;同时颗粒饲料的制粒工艺也要经过一个短暂的高温(73℃-95℃)过程,一般葡萄糖氧化酶的活性在此温度下不可避免地失活,因此耐热是葡萄糖氧化酶作为饲用添加剂应用的关键性问题。因此耐热性是葡萄糖氧化酶工业应用中最主要的问题。
技术实现要素:
本发明要解决的问题是提供一种生产设备要求简单,可操作性强,并且所制备得到的葡萄糖氧化酶稳定性强和活性强的一种嗜热拟青霉固态发酵制备耐热耐酸葡萄糖氧化酶的方法。
本发明提供一种嗜热拟青霉固态发酵制备耐热耐酸葡萄糖氧化酶的方法,包括如下步骤:
步骤1,菌种制备:首先,在无菌条件下挑取两环保藏的嗜热拟青霉菌种试管孢子接种于活化斜面培养基上活化,将活化斜面培养基置于30-35℃培养箱中培养3-5天;然后,向活化好的嗜热拟青霉斜面培养基中注入1ml无菌生理盐水,移液枪反复吹打斜面培养基上的孢子,进一步将孢子浓度稀释至107个/ml,再取2ml稀释后的孢子接种到装有50g固态孢子培养基的三角瓶中,充分摇动三角瓶使孢子同培养基充分混匀,将三角瓶置于30-40℃培养箱中培养3-4天,每天翻动一次固态孢子培养基;最后,在三角瓶中装液体种子培养基,灭菌冷却,然后再制备成嗜热拟青霉孢子悬液,再接种2ml的嗜热拟青霉孢子悬液,置于旋转式摇床上30-40℃培养1-2天,摇床转速160-250r/min;
步骤2,嗜热拟青霉三角瓶固态发酵:在三角瓶中加入固态发酵培养基100-180g,固体培养基原料初始含水率为50%,拌料水的ph为5;121℃灭菌后接入步骤1制得的嗜热拟青霉孢子悬液2ml,32-42℃条件下培养48h,晃动三角瓶,使三角瓶培养基松散不结块。再将温度降低至28-37℃条件下继续培养至96h,中间翻料2次,无菌条件下向三角瓶中添加补料营养液10-20ml,将三角瓶摇晃均匀,继续培养至110-120h;
步骤3,嗜热拟青霉曲盘固态发酵:在三角瓶固态发酵的基础上进行曲盘放大试验;将步骤2制得的嗜热拟青霉孢子接种到装有固态发酵培养基的曲盘中,所述曲盘固态发酵分两阶段进行,发酵第一阶段,35-45℃下培养48-72h,期间翻曲1-3次;发酵第二阶段,培养至72h时,向曲盘中淋加补料液体营养液30-60ml,同时培养温度降至32-37℃,继续培养至96h,再次向曲盘中淋加补料营养液40-80ml,培养温度不变,培养至120-144h,结束发酵,得到粗酶液;
步骤4,葡萄糖氧化酶酶制剂制备:将步骤3所得粗酶液依次经过浸提、超滤、旋转蒸发,得粗酶浓缩液,最后再将制得的粗酶浓缩液进行喷雾干燥,得到葡萄糖氧化粗酶剂。
对上述方案的进一步改进,在步骤1中,所述活化斜面培养基的配方为:土豆浸出液100ml,麸皮浸出液100ml,无机盐液1ml,蔗糖1g,琼脂粉3g,ph5.0-6.0;固态孢子培养基配方为:麸皮5g,玉米粉1g,谷糠1g,豆饼粉2g,无机盐溶液1ml,土豆浸出液8ml。
对上述方案的进一步改进,在步骤1中,所述嗜热拟青霉孢子悬液的制备步骤如下:在无菌条件下,将无菌生理盐水倒入成熟的嗜热拟青霉麸曲中,使生理盐水完全覆盖固体培养基,然后将三角瓶置于磁力搅拌机上中速搅拌30min,使得充分打碎菌丝体,从而释放孢子,然后将制备好的孢子悬液取样在雪球计数板上计数,调节孢子浓度至1.2-1.6×108cfu/ml。
对上述方案的进一步改进,在步骤3中,所述曲盘大小为:40cm×25cm×10cm,装有500-1000克的固态发酵培养基,表面用四层无菌湿纱布覆盖。
对上述方案的进一步改进,在步骤2和步骤3中,所述固态发酵培养基的配方均为:固体基质麸皮10-20g,稻壳粉5-10g、花生壳粉5-10g、玉米粉10-20g、豆粕粉5-10g、酵母粉5-8g,食用菌栽培菌渣5-6g,无机盐液10ml,无机盐液的起始ph为5.0,按照固液比1:1.5-1:1.1加入ph为5.5-7.0的去离子水,混合均匀。
对上述方案的进一步改进,无机盐液的制备方法如下为:取(nh4)2so4:5-10g,kh2po4:5-10g,mgso4·7h20:1-2g,nano3:1-5g,cacl2:1-5g,fecl3:1-2g,吐温80:5-10ml,加水至1000ml;补料营养液制备方法如下:取蔗糖10-20g,酵母粉5-8g,玉米浆5-20ml,土豆浸出液200ml,麸皮浸出液200ml,尿素5-10g,硫酸铵5-10g,加去离子水至1000ml;其中土豆浸出液的制备方法为:100g土豆切成1cm3方块,煮沸30min,4层纱布过滤后,补充水至100ml;其中麸皮浸出液的制备方法为:麸皮15g,加水100ml,煮沸30min,过滤得滤液,补充水至100ml。
对上述方案的进一步改进,浸提脱色的方法为:取出步骤3中发酵96h的培养基,在盛有培养基的容器中加入4-5倍体积的ph6.0的磷酸缓冲溶液,加有缓冲液后搅拌均匀,10-20℃条件下、浸提4-6h,每1小时搅拌一次;将浸提后的培养基过滤,收集滤液8000r/min离心10-20min,取上清液保存备用;向上清液中按10-20g/l的量加入颗粒状活性炭,35-45℃脱色30-60min,然后用硅藻土作为助滤剂过滤除去活性炭渣滓;
超滤的方法为:分为两次超滤,先利用截留分子量为100kda的平板式超滤膜对脱色后的粗酶液超滤分离,超滤截留液的体积减少至原体积的6~10%时,添加去离子水至原体积的1/2,继续超滤至截留液为原体积的3-5%。收集两次的滤出液;再利用截留分子量为40kda的平板式超滤膜对之前获得的滤出液进行超滤浓缩,当超滤截留液为原体积的20%时,停止超滤,收集截留液。
对上述方案的进一步改进,第一次超滤条件为:进口压力0.3mpa,出口压力0.2mpa,流速1.4l/h;第二次超滤条件为:进口压力0.4mpa,出口压力0.5mpa,流速1.1l/h。
对上述方案的进一步改进,将超滤得到的截留液进行喷雾干燥,选用麦芽糊精作为喷雾干燥时葡萄糖氧化酶的保护剂,喷雾条件为进风温度90-110℃、进料速度150-175ml/h、固形物含量7-12%,在此条件下,最大葡萄糖氧化酶回收率为79.8%。
上述方案所述的一种嗜热拟青霉固态发酵制备耐热耐酸葡萄糖氧化酶的方法所制得的酶制剂添加到肉鸡日粮中,提高饲料转化率。
相比现有技术,本发明的有益效果在于:
(1)本发明采用固态发酵制备葡萄糖氧化酶,发酵过程中根据菌体的生长特点和产酶特性,进行阶段性的补充营养液,促进菌体生长和酶的合成,延长菌体产酶时间,有效防止菌体过早衰老;发酵过程采用分阶段发酵参数控制,这种精细的控制技术促进了酶的大量产生,因此此方法生产制得的葡萄糖氧化酶活性提高了45%。
(2)发酵采用的菌株是嗜热拟青霉,该菌株固态发酵得到的葡萄糖氧化酶稳定性增强,半年时间内,4℃下葡萄糖氧化酶酶活性保存率都在90%以上,室温条件下酶活性也在80%以上。本发明生产的葡萄糖氧化酶耐热性好,在75℃下,保温3小时,残余酶活性达85%;另外,酶的耐酸性强,在ph2.0-8.0范围内24h葡萄糖氧化酶酶活性基本不发生变化,活性稳定,相对酶活性均在80%以上,另外,本发明所制备的葡萄糖氧化酶的稳定性强,半年时间内,4℃下葡萄糖氧化酶酶活性保存率都在90%以上,室温条件下酶活性也在80%以上。
(3)本发明所采用的活化斜面培养基、固体发酵培养基以及补料营养液的培养基原料低廉,主要为普通农副产物麸皮、玉米秸秆粉、玉米粉、豆粕、蛹虫草栽培后废弃培养基等,这样会使所述嗜热拟青霉的培养成本降低,同时所用原料不仅提供基本的碳源氮源,还能提供丰富的生长因子及酶的促进剂。
(4)本发明较为详细的阐述了耐热性葡萄糖氧化酶制剂生产方法,与采用普通固态发酵法相比,本发明利用三角瓶和圆盘进行固态发酵,其中,三角瓶固态发酵有效防止污染,圆盘固态发酵产量大,操作方便;固态发酵生产设备要求简单;另外在生产过程中进行了浸提脱色和超滤,浸提脱色可去除葡萄糖氧化酶外的多余的色素,颜色更加好看;超滤的作用是去除葡萄糖氧化酶中多余的蛋白质,使制得的葡萄糖氧化酶的纯度更高。
(5)本发明将得到葡萄糖氧化酶酶制剂添加到肉鸡日粮中可以显著提高肉鸡的饲料转化效率,明显提高肉鸡的生产性能。
附图说明
图1本发明实施例1所制备的葡萄糖氧化酶的活性随温度变化而变化的示意图。
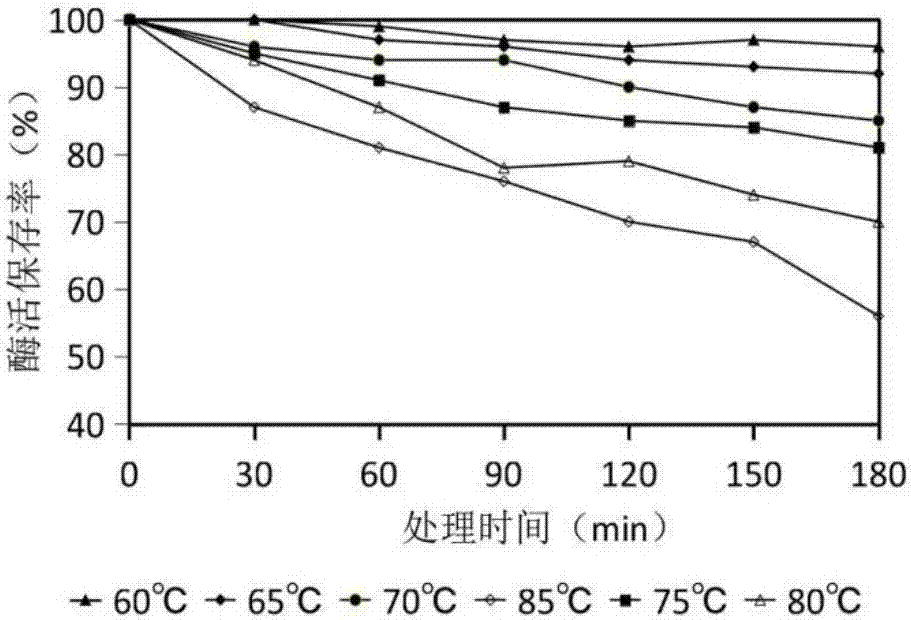
图2本发明实施例1所制备的葡萄糖氧化酶的活性随温度和保温时间变化而变化的示意图。
图3本发明实施例2所制备的葡萄糖氧化酶的活性随ph变化而变化的示意图。
具体实施方式
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明。
实施例1
步骤1,菌种制备:首先,在无菌条件下挑取两环保藏的嗜热拟青霉菌种试管孢子接种于活化斜面培养基(土豆浸出液(100g土豆切成1cm3方块,煮沸30min,4层纱布过滤后,补充水至100ml)100ml,麸皮浸出液(麸皮15g,加水100ml,煮沸30min,过滤得滤液,补充水至100ml)100ml,无机盐液(取(nh4)2so4:5g,kh2po4:5g,mgso4·7h20:1g,nano3:1g,cacl2:1g,fecl3:1g,吐温80:5ml)1ml,蔗糖1g,琼脂粉3g,ph5.0,加水至1000ml)上活化;将活化斜面培养基置于30-35℃培养箱中培养3-5天;然后,向活化好的嗜热拟青霉斜面培养基中注入1ml无菌生理盐水,移液枪反复吹打斜面培养基上的孢子,进一步将孢子浓度稀释至107个/ml,再取2ml稀释后的孢子接种到装有50g固态孢子培养基(麸皮5g,玉米粉1g,谷糠1g,豆饼粉2g,无机盐溶液1ml,土豆浸出液8ml)的三角瓶中,充分摇动三角瓶使孢子同培养基充分混匀,将三角瓶置于3℃培养箱中培养天,每天翻动一次固态孢子培养基;最后,在三角瓶中装液体种子培养基,灭菌冷却,在无菌条件下,将无菌生理盐水倒入成熟的嗜热拟青霉麸曲中,使生理盐水完全覆盖固体培养基,然后将三角瓶置于磁力搅拌机上中速搅拌30min,使得充分打碎菌丝体,从而释放孢子,然后将制备好的孢子悬液取样在雪球计数板上计数,调节孢子浓度至1.2×108cfu/ml。再接种2ml的嗜热拟青霉孢子悬液,置于旋转式摇床上30℃培养1-2天,摇床转速160r/min;
步骤2,嗜热拟青霉三角瓶固态发酵:在三角瓶中加入固态发酵培养基(固体基质麸皮10g,稻壳粉5g、花生壳粉5g、玉米粉10g、豆粕粉5g、酵母粉5g,食用菌栽培菌渣5g,无机盐液10ml,无机盐液的起始ph为5.0,按照固液比1:1.5加入ph为5.5的去离子水,混合均匀)100g,固体发酵培养基原料初始含水率为50%,拌料水的ph为5;121℃灭菌后接入步骤1制得的嗜热拟青霉孢子悬液2ml,32℃条件下培养48h,晃动三角瓶,使三角瓶培养基松散不结块。再将温度降低至28℃条件下继续培养至96h,中间翻料2次,无菌条件下向三角瓶中添加补料营养液(取蔗糖10g,酵母粉5g,玉米浆5ml,土豆浸出液200ml,麸皮浸出液200ml,尿素5g,硫酸铵5g,加去离子水至1000ml)10ml,将三角瓶摇晃均匀,继续培养至110h;
步骤3,嗜热拟青霉曲盘固态发酵:在三角瓶固态发酵的基础上进行曲盘放大试验;所述曲盘大小为:40cm×25cm×10cm,装有500克的固态发酵培养基,表面用四层无菌湿纱布覆盖,将步骤2制得的嗜热拟青霉孢子接种到装有固态发酵培养基的曲盘中,所述曲盘固态发酵分两阶段进行,发酵第一阶段,35℃下培养48h,期间翻曲1次;发酵第二阶段,培养至72h时,向曲盘中淋加补料液体营养液30ml,同时培养温度降至32℃,继续培养至96h,再次向曲盘中淋加补料营养液40ml,培养温度不变,培养至120h,结束发酵,得到粗酶液;
步骤4,葡萄糖氧化酶酶制剂制备:将步骤3所得粗酶液依次经过取出步骤3中发酵的培养基,在盛有培养基的容器中加入4-5倍体积的ph6.0的磷酸缓冲溶液,加有缓冲液后搅拌均匀,10℃条件下、浸提4h,每1小时搅拌一次;将浸提后的培养基过滤,收集滤液8000r/min离心10min,取上清液保存备用;向上清液中按10g/l的量加入颗粒状活性炭,35℃脱色30min,然后用硅藻土作为助滤剂过滤除去活性炭渣滓;然后在进口压力0.3mpa,出口压力0.2mpa,流速1.4l/h的条件下,先利用截留分子量为100kda的平板式超滤膜对脱色后的粗酶液超滤分离,超滤截留液的体积减少至原体积的6~10%时,添加去离子水至原体积的1/2,继续超滤至截留液为原体积的3-5%。收集两次的滤出液;然后在进口压力0.4mpa,出口压力0.5mpa,流速1.1l/h的条件下,利用截留分子量为40kda的平板式超滤膜对之前获得的滤出液进行超滤浓缩,当超滤截留液为原体积的20%时,停止超滤,收集截留液;最后选用麦芽糊精作为喷雾干燥时葡萄糖氧化酶的保护剂,喷雾条件为进风温度90℃、进料速度150ml/h、固形物含量7-12%,制得葡萄糖氧化酶剂。
将上述方法制得的葡萄糖氧化酶制剂制成葡萄糖氧化酶液,分别在不同的温度下,35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃,测定其葡萄糖氧化酶酶的活力(ph5.0),并将最高的酶活力定义为100%,计算不同温度条件下葡萄糖氧化酶的活力。结果如图1所示,葡萄糖氧化酶从35℃到65℃,随着温度升高酶活性逐渐增加,温度达到65℃时,酶活达到最大值。以后随着温度升高,酶活逐渐降低,故酶的葡萄糖氧化酶最适作用温度为65℃。整体看葡萄糖氧化酶是高温酶,在50℃-70℃之间酶的酶活都在80%以上,故在这个温度范围内酶制剂都会发挥高效的酶解作用,本发明所制备的葡萄糖氧化酶的耐热性比较好。
然后再将葡萄糖氧化酶酶制剂制成将葡萄糖氧化酶酶液,分别置于不同的温度条件下(60℃、65℃、67℃、70℃)保温不同的时间(ph=4.5),然后立即放置于4℃的环境中复性2h以上,再按标准的酶活测定方法测定其剩余酶活力。以未经保温失活处理的酶活力为100%,分别计算不同温度条件下葡萄糖氧化酶的相对剩余酶活。结果见图2所示,酶基本随温度的上升以及热处理时间的延长酶活力逐渐降低,在温度高于75℃时,葡萄糖氧化酶酶活性下降显著。酶在75℃以下,保温时间3小时以内酶活保存率都在80%以上;65℃以下,热处理3小时剩余酶活都在90%以上。因此酶制剂的耐热性非常好,进一步说明了本方法制得的葡萄糖氧化酶剂属于是耐高温型。
实施例2
步骤1,菌种制备:首先,在无菌条件下挑取两环保藏的嗜热拟青霉菌种试管孢子接种于活化斜面培养基(土豆浸出液(100g土豆切成1cm3方块,煮沸30min,4层纱布过滤后,补充水至100ml)100ml,麸皮浸出液(麸皮15g,加水100ml,煮沸30min,过滤得滤液,补充水至100ml)100ml,无机盐液(取(nh4)2so4:8g,kh2po4:8g,mgso4·7h20:1.5g,nano3:3g,cacl2:3g,fecl3:1.5g,吐温80:8ml)1ml,蔗糖1g,琼脂粉3g,ph5.5,加水至1000ml)上活化;将活化斜面培养基置于33℃培养箱中培养4天;然后,向活化好的嗜热拟青霉斜面培养基中注入1ml无菌生理盐水,移液枪反复吹打斜面培养基上的孢子,进一步将孢子浓度稀释至107个/ml,再取2ml稀释后的孢子接种到装有50g固态孢子培养基(麸皮5g,玉米粉1g,谷糠1g,豆饼粉2g,无机盐溶液1ml,土豆浸出液8ml)的三角瓶中,充分摇动三角瓶使孢子同培养基充分混匀,将三角瓶置于35℃培养箱中培养3-4天,每天翻动一次固态孢子培养基;最后,在三角瓶中装液体种子培养基,灭菌冷却,在无菌条件下,将无菌生理盐水倒入成熟的嗜热拟青霉麸曲中,使生理盐水完全覆盖固体培养基,然后将三角瓶置于磁力搅拌机上中速搅拌30min,使得充分打碎菌丝体,从而释放孢子,然后将制备好的孢子悬液取样在雪球计数板上计数,调节孢子浓度至1.4×108cfu/ml。再接种2ml的嗜热拟青霉孢子悬液,置于旋转式摇床上35℃培养1-2天,摇床转速200r/min;
步骤2,嗜热拟青霉三角瓶固态发酵:在三角瓶中加入固态发酵培养基(固体基质麸皮15g,稻壳粉8g、花生壳粉8g、玉米粉15g、豆粕粉8g、酵母粉6g,食用菌栽培菌渣5g,无机盐液10ml,无机盐液的起始ph为5.0,按照固液比1:1.3加入ph为6的去离子水,混合均匀)100-180g,固体发酵培养基原料初始含水率为50%,拌料水的ph为5;121℃灭菌后接入步骤1制得的嗜热拟青霉孢子悬液2ml,38℃条件下培养48h,晃动三角瓶,使三角瓶培养基松散不结块。再将温度降低至33℃条件下继续培养至96h,中间翻料2次,无菌条件下向三角瓶中添加补料营养液(取蔗糖15g,酵母粉6g,玉米浆16ml,土豆浸出液200ml,麸皮浸出液200ml,尿素8g,硫酸铵8g,加去离子水至1000ml)15ml,将三角瓶摇晃均匀,继续培养至115h;
步骤3,嗜热拟青霉曲盘固态发酵:在三角瓶固态发酵的基础上进行曲盘放大试验;所述曲盘大小为:40cm×25cm×10cm,装有800克的固态发酵培养基,表面用四层无菌湿纱布覆盖,将步骤2制得的嗜热拟青霉孢子接种到装有固态发酵培养基的曲盘中,所述曲盘固态发酵分两阶段进行,发酵第一阶段,40℃下培养64h,期间翻曲2次;发酵第二阶段,培养至72h时,向曲盘中淋加补料液体营养液45ml,同时培养温度降至35℃,继续培养至96h,再次向曲盘中淋加补料营养液60ml,培养温度不变,培养至130h,结束发酵,得到粗酶液;
步骤4,葡萄糖氧化酶酶制剂制备:将步骤3所得粗酶液依次经过取出步骤3中发酵的培养基,在盛有培养基的容器中加入4-5倍体积的ph6.0的磷酸缓冲溶液,加有缓冲液后搅拌均匀,10-20℃条件下、浸提5h,每1小时搅拌一次;将浸提后的培养基过滤,收集滤液8000r/min离心15min,取上清液保存备用;向上清液中按15g/l的量加入颗粒状活性炭,40℃脱色45min,然后用硅藻土作为助滤剂过滤除去活性炭渣滓;然后在进口压力0.3mpa,出口压力0.2mpa,流速1.4l/h的条件下,先利用截留分子量为100kda的平板式超滤膜对脱色后的粗酶液超滤分离,超滤截留液的体积减少至原体积的6~10%时,添加去离子水至原体积的1/2,继续超滤至截留液为原体积的3-5%。收集两次的滤出液;然后在进口压力0.4mpa,出口压力0.5mpa,流速1.1l/h的条件下,利用截留分子量为40kda的平板式超滤膜对之前获得的滤出液进行超滤浓缩,当超滤截留液为原体积的20%时,停止超滤,收集截留液;最后选用麦芽糊精作为喷雾干燥时葡萄糖氧化酶的保护剂,喷雾条件为进风温度100℃、进料速度160ml/h、固形物含量7-12%,制得葡萄糖氧化酶剂。
将上述方法制备的葡萄糖氧化酶酶剂制备成葡萄糖氧化酶液,分别在不同的ph下,ph2.0、ph3.0、ph4.0、ph5.0、ph6.0、ph7.0、ph8.0、ph9.0,下测定其葡萄糖氧化酶酶活力。将最高的酶活力定义为100%,分别计算不同ph值条件下葡萄糖氧化酶的相对酶活性。所用缓冲液为:ph2.0~3.0的甘氨酸-盐酸缓冲溶液,ph3.0~4.0柠檬酸磷酸缓冲液,ph4.0~5.0的乙酸-乙酸钠缓冲液,ph5.0~7.0磷酸氢二钠-磷酸二氢钾缓冲液,ph7.0~9.0tris-hcl缓冲溶液。以酶在最适ph值下所测酶活为100%,其它ph值下所测为对其相对酶活。酶制剂在以上不同ph缓冲体系中,在65℃下测定葡萄糖氧化酶酶活性,结果如图3所示,葡萄糖氧化酶在ph3.0~7.0之间酶活性在80%以上,最适作用ph为5.0。整体看酶制剂适合在酸性条件下酶解反应。所述本发明制备的葡萄糖氧化酶的耐酸性好。
实施例3
步骤1,菌种制备:首先,在无菌条件下挑取两环保藏的嗜热拟青霉菌种试管孢子接种于活化斜面培养基(土豆浸出液(100g土豆切成1cm3方块,煮沸30min,4层纱布过滤后,补充水至100ml)100ml,麸皮浸出液(麸皮15g,加水100ml,煮沸30min,过滤得滤液,补充水至100ml)100ml,无机盐液(取(nh4)2so4:10g,kh2po4:10g,mgso4·7h20:2g,nano3:5g,cacl2:5g,fecl3:2g,吐温80:10ml)1ml,蔗糖1g,琼脂粉3g,ph6.0,加水至1000ml)上活化;将活化斜面培养基置于35℃培养箱中培养3-5天;然后,向活化好的嗜热拟青霉斜面培养基中注入1ml无菌生理盐水,移液枪反复吹打斜面培养基上的孢子,进一步将孢子浓度稀释至107个/ml,再取2ml稀释后的孢子接种到装有50g固态孢子培养基(麸皮5g,玉米粉1g,谷糠1g,豆饼粉2g,无机盐溶液1ml,土豆浸出液8ml)的三角瓶中,充分摇动三角瓶使孢子同培养基充分混匀,将三角瓶置于40℃培养箱中培养4天,每天翻动一次固态孢子培养基;最后,在三角瓶中装液体种子培养基,灭菌冷却,在无菌条件下,将无菌生理盐水倒入成熟的嗜热拟青霉麸曲中,使生理盐水完全覆盖固体培养基,然后将三角瓶置于磁力搅拌机上中速搅拌30min,使得充分打碎菌丝体,从而释放孢子,然后将制备好的孢子悬液取样在雪球计数板上计数,调节孢子浓度至1.6×108cfu/ml。再接种2ml的嗜热拟青霉孢子悬液,置于旋转式摇床上40℃培养2天,摇床转速250r/min;
步骤2,嗜热拟青霉三角瓶固态发酵:在三角瓶中加入固态发酵培养基(固体基质麸皮20g,稻壳粉10g、花生壳粉10g、玉米粉20g、豆粕粉10g、酵母粉8g,食用菌栽培菌渣6g,无机盐液10ml,无机盐液的起始ph为5.0,按照固液比1:1.1加入ph为7.0的去离子水,混合均匀)180g,固体发酵培养基原料初始含水率为50%,拌料水的ph为5;121℃灭菌后接入步骤1制得的嗜热拟青霉孢子悬液2ml,42℃条件下培养48h,晃动三角瓶,使三角瓶培养基松散不结块。再将温度降低至37℃条件下继续培养至96h,中间翻料2次,无菌条件下向三角瓶中添加补料营养液(取蔗糖20g,酵母粉8g,玉米浆20ml,土豆浸出液200ml,麸皮浸出液200ml,尿素10g,硫酸铵10g,加去离子水至1000ml)20ml,将三角瓶摇晃均匀,继续培养至120h;
步骤3,嗜热拟青霉曲盘固态发酵:在三角瓶固态发酵的基础上进行曲盘放大试验;所述曲盘大小为:40cm×25cm×10cm,装有1000克的固态发酵培养基,表面用四层无菌湿纱布覆盖,将步骤2制得的嗜热拟青霉孢子接种到装有固态发酵培养基的曲盘中,所述曲盘固态发酵分两阶段进行,发酵第一阶段,45℃下培养72h,期间翻曲3次;发酵第二阶段,培养至72h时,向曲盘中淋加补料液体营养液60ml,同时培养温度降至37℃,继续培养至96h,再次向曲盘中淋加补料营养液80ml,培养温度不变,培养至144h,结束发酵,得到粗酶液;
步骤4,葡萄糖氧化酶酶制剂制备:将步骤3所得粗酶液依次经过取出步骤3中发酵的培养基,在盛有培养基的容器中加入5倍体积的ph6.0的磷酸缓冲溶液,加有缓冲液后搅拌均匀,20℃条件下、浸提6h,每1小时搅拌一次;将浸提后的培养基过滤,收集滤液8000r/min离心20min,取上清液保存备用;向上清液中按20g/l的量加入颗粒状活性炭,45℃脱色60min,然后用硅藻土作为助滤剂过滤除去活性炭渣滓;然后在进口压力0.3mpa,出口压力0.2mpa,流速1.4l/h的条件下,先利用截留分子量为100kda的平板式超滤膜对脱色后的粗酶液超滤分离,超滤截留液的体积减少至原体积的6~10%时,添加去离子水至原体积的1/2,继续超滤至截留液为原体积的3-5%。收集两次的滤出液;然后在进口压力0.4mpa,出口压力0.5mpa,流速1.1l/h的条件下,利用截留分子量为40kda的平板式超滤膜对之前获得的滤出液进行超滤浓缩,当超滤截留液为原体积的20%时,停止超滤,收集截留液;最后选用麦芽糊精作为喷雾干燥时葡萄糖氧化酶的保护剂,喷雾条件为进风温度90-110℃、进料速度150-175ml/h、固形物含量7-12%,制得葡萄糖氧化酶剂。
将制备好的葡萄糖氧化酶固态剂分别在4℃和室温下保存,每一个月检测一次酶活力,共检测6个月,查看酶活保留情况。结果如表1所示:
表1
从上表可以看出,在半年时间内,4℃下葡萄糖氧化酶酶活性保存率都在90%以上,室温条件下酶活也在80%以上,可以看出酶的稳定性好。
应用例1
实施例1制得的葡萄糖氧化酶对肉鸡生产性能的影响
选取1日龄的商品罗斯308肉鸡为试验对象,随机分2个处理组,每组设三个重复,各有雏鸡20只。在肉鸡饲料中添加实施例1制得的葡萄糖氧化酶制成葡萄糖氧化酶制剂。然后将制备的葡萄糖氧化酶制剂以基础日粮为载体做成1%葡萄糖氧化酶预混剂,试验组是将基础日粮同葡萄糖氧化酶预混剂混匀,使葡萄糖氧还酶酶制剂的含量达到0.5%。所有鸡笼养群饲,粉料,自由采食,乳头式自动饮水器饮水,按常规进行饲养管理。按饲养程序进行免疫,消毒。在42日龄分别单个称重。每天记录各组各重复的耗料量和剩料量,计算每周饲料增重比。每天记录死亡鸡的数目,计算死亡率。始重、末重、平均日增重、平均日采食量、饲料增重比。平均日增重=(末重-初重)/天数,平均日采食量=耗料量/天数,饲料增重比=耗料量/增重。其中葡萄糖氧化酶对肉鸡生产性能的影响如表2;
表2
由表2可以看出,试验组日粮中添加葡萄糖氧化酶比对照组日增重增加17.52%,耗料增重比,实验组比对照组降低20%,从而提高肉鸡的饲料转化效率。由此表明,葡萄糖氧化酶能够显著提高肉鸡的生产性能。
本技术领域中的普通技术人员应当认识到,以上的实施例仅是用来说明本发明,而并非用作为对本发明的限定,只要在本发明的实质精神范围内,对以上所述实施例的变化、变型都将落在本发明的权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!