用于从包含污染宿主细胞蛋白质的材料纯化重组人α‑半乳糖苷酶A的方法与流程
本发明一般涉及采用宿主细胞产生人α-半乳糖苷酶a(rhα-gala)的方法,并且涉及从包含污染宿主细胞蛋白质的材料中纯化由此产生的所述rhα-gala的方法。更具体地,本发明涉及通过在无血清培养基中培养产生rhα-gala的哺乳动物细胞来产生rhα-gala的方法,以及,采用柱色谱(包括染料-亲和柱色谱)从培养物上清液纯化由此产生的rhα-gala的方法,所述方法实现高产量,并且达到高纯度以允许该纯化的蛋白质作为医药药物直接使用。
背景技术:
α-半乳糖苷酶a(α-gala)是一种溶酶体酶,其具有水解糖脂和糖蛋白的末端α-半乳糖基键的活性。三己糖神经酰胺,其包含三个己糖部分,是α-半乳糖苷酶a的底物之一,并且接受该酶在其末端己糖部分处水解。人α-gala表达为包含429个氨基酸的前体肽,其中n末端的31个氨基酸构成信号肽。该前体经加工成成熟肽,其在移除该信号肽之后剩下的部分由398个氨基酸组成,并且,一对成熟肽分子容易形成同二聚体,只要条件允许,其即为人α-gala的酶活形式。人α-gala具有包含甘露糖-6-磷酸残基的寡糖链,并且能通过甘露糖-6-磷酸受体被靶向至溶酶体。
法布瑞氏病是x连锁的遗传性溶酶体贮积病,其由编码α-gala的基因的遗传异常所致。该酶活性的缺乏造成三己糖神经酰胺在多种组织中的累积,导致肾损伤、血管扩张性疣和心血管异常,包括心室扩大和二尖瓣闭锁不全。
在上世纪60年代已知晓,在患有法布瑞氏病(fabry'sdisease)的患者的组织中几乎检测不到或仅能微弱地检测到α-半乳糖苷酶a的酶活。因此,已推测编码α-gala的基因的一些遗传异常应是法布瑞氏病的病因。基于该推测,已通过如下方式进行了针对法布瑞氏病的α-gala替代治疗(replacementtherapy):将从人血浆或脾提取并纯化的α-gala输注给所述患者,获得如下证实结果:α-gala替代治疗可降低患有法布瑞氏病的患者血液中三己糖神经酰胺的水平(见npl1、npl2、npl3)。因此,人们认定了α-gala酶替代治疗对于法布瑞氏病而言一定是具有前景的。然而,α-gala替代治疗的实践应用受到该酶供应缺乏的高度限制。
在1986年,分离了编码人α-gala的基因(见npl4),进一步地,在1988年,报到了通过采用转化有人α-gala表达载体的cho细胞来表达并产生rhα-gala的方法(见npl5)。利用重组技术,这些发现使得以大规模产生人α-gala并利用该酶作为用于法布瑞氏病的酶替代治疗的药物成为可能。还在昆虫细胞中表达了rhα-gala(ptl1)。
此外,报道了一些用于纯化rhα-gala的方法,其包括采用疏水柱色谱、肝素琼脂糖柱色谱、羟基磷灰石柱色谱、阴离子-交换柱色谱,和凝胶过滤柱色谱(ptl2、ptl3)。尽管已显示ptl2或ptl3中所描述的用于纯化的方法获得的rhα-gala的纯度充分地高,并不认为其能完全适用于人类应用。原因在于,待输注给患者的任何药物均必须不含污染物,具体而言,例如,源自所用宿主细胞的蛋白质,无论ptl2还是ptl3均没有显示纯化的rhα-gal中是否余留有这样的污染物。此外,据报道,用于纯化rhα-gala的方法包括,按顺序使用阴离子-交换柱色谱、疏水柱色谱、采用对磷酸基团具有亲和性的材料作为固相的柱色谱、阳离子-交换柱色谱,和凝胶过滤柱色谱(ptl4)。然而ptl没有提及rhα-gala的宿主细胞蛋白质污染。
目前,包含rhα-gala作为活性成分的法布瑞氏病的医药药物已在市场上以商品名例如replagaltm和fabrazymetm出售。
引用列表
专利文献
ptl1:wo90/11353
ptl2:wo98/11206
ptl3:wo00/53730
ptl4:wo14/017088
非专利文献
npl1:mapes等:science169:987-9(1970)
npl2:brady等:n.engl.j.med.289:9-14(1973)
npl3:desnick等:procnatlacadsciusa76:5326-30(1979).
npl4:bishop等:procnatlacadsciusa83:4859-63(1986)
npl5:bishop等:《脂质贮积疾病-生物学与医学方面》(lipidstoragedisorders-biologicalandmedicalaspects),纽约普莱纽姆出版社(nyplenumpress)p809-823(1988)
技术实现要素:
技术问题
针对上述背景,本发明的一个目的在于:提供以在无血清培养基中培养产生rhα-gala的哺乳动物细胞开始的,产生和纯化重组人α-半乳糖苷酶a(rhα-gala)的方法。
本发明的另一个目的在于,提供用于从包含污染物宿主细胞蛋白质的培养物上清液纯化rhα-gala的方法,通过包括染料-亲和柱色谱的柱色谱,以实现高产量,并且达到高纯度以允许该纯化的蛋白质作为医药药物直接使用。
解决技术问题所采用的技术方案
本发明的发明人发现,在无血清培养基中培养产生rhα-gala的细胞的上清液中所含的rhα-gala,可从包含污染宿主细胞蛋白质的该上清液纯化至极高纯度,并且同时获得极高的产量,通过使rhα-gala经过包括阴离子-交换柱色谱、疏水柱色谱、采用对磷酸基团具有亲和性的柱的色谱、阳离子-交换柱色谱、染料-亲和柱色谱,和凝胶过滤柱色谱的组合的纯化方法来实现。本发明通过基于该发现做出进一步研究而完成。
因此,本发明提供如下内容:
1.用于产生重组人α-gala的方法,其包括如下步骤:
(a)在无血清培养基中培养产生重组人α-gala的哺乳动物细胞,以让其在该培养基中分泌重组人α-gala,
(b)通过从在上述步骤(a)中获得的培养物去除细胞来收集培养物上清液,
(c)使在上述步骤(b)中收集的培养物上清液经过阴离子-交换柱色谱,以收集重组人α-gala-活性分级分离部分,
(d)使在上述步骤(c)中收集的该分级分离部分经过疏水柱色谱,以收集重组人α-gala-活性分级分离部分,
(e)使在上述步骤(d)中收集的该分级分离部分经过采用对磷酸基团具有亲和性的材料作为固相的柱色谱,以收集重组人α-gala-活性分级分离部分,
(f)使在上述步骤(e)中收集的该分级分离部分经过阳离子-交换柱色谱,以收集重组人α-gala-活性分级分离部分,
(g)使在上述步骤(f)中收集的该分级分离部分经过染料-亲和柱色谱,以收集重组人α-gala-活性分级分离部分,和
(h)使在上述步骤(g)中收集的该分级分离部分经过凝胶过滤柱色谱,以收集重组人α-gala-活性分级分离部分,以所述顺序进行。
2.如上述(1)所述的方法,其中,阳离子-交换柱色谱中所用的阳离子交换器是弱阳离子交换器。
3.如上述(2)所述的方法,其中,所述弱阳离子交换器具有基于疏水相互作用和氢键形成的选择性。
4.如上述(2)或(3)所述的方法,其中,弱阳离子交换器具有苯基基团、酰胺键和羧基基团。
5.如上述(1)-(4)之一所述的方法,其中,所述染料-亲和柱色谱中所用的染料是蓝色三嗪染料。
6.如上述(1)-(5)之一所述的方法,其中,所述对磷酸基团具有亲和性的材料选自下组:羟基磷灰石和氟磷灰石。
7.如上述(6)所述的方法,其中,所述对磷酸基团具有亲和性的材料是羟基磷灰石。
8.如所述(1)-(7)之一所述的方法,其中,所述哺乳动物细胞是转染有表达载体的cho细胞,所述表达载体经设计以在ef-1(α)启动子的调控下表达重组人α-gala。
9.通过上述(1)-(8)之一所述的方法产生的重组人α-gala组合物。
10.一种药物,其包含如上述(9)所述的组合物,其定期地给予患者。
11.如上述(10)所述的药物,其中,所述药物通过注射给予所述患者。
发明效果
本发明允许从包含污染宿主细胞蛋白质的材料纯化rhα-gala。由此纯化的重组人α-gala适合作为药物用于法布瑞氏病的酶替代治疗(ert)。在该治疗中,rhα-gala必须定期地给予患有法布瑞氏病的患者。因此,如果α-gala药物包含宿主细胞蛋白质,则采用该药物的ert可能会具有诱导患者中针对宿主细胞蛋白质的严重抗原-抗体反应(即过敏性反应)的潜在风险。该风险可通过采用根据本发明纯化作为药物的rhα-gala而被最小化。此外,因为已允许以细胞的无血清培养作为起始来产生rhα-gala,本发明提供这样的rhα-gala,其不含任何血清源性的污染物,包括病原体例如病毒或朊病毒。因此,根据本发明获得的rhα-gala可作为安全药物给予人体,其基本不具有接触此类病原体的任何风险。此外,因为已允许以基本避免应用任何有机溶剂的方式纯化rhα-gala,本发明消除了rhα-gala变性的风险,否则,可能因与所用的有机溶剂接触而导致该风险。此外,本发明是环境有益的,因为在根据本发明的纯化方法进行之后剩下的废液不含有机溶剂,并且从经济角度考虑也是如此,因为本发明的方法不需要用于处理(在其它情况下将会包含在废液中的)有机溶剂的设备。
此外,本发明允许对在其寡糖链中有甘露糖-6-磷酸残基的rhα-gala的高度选择性纯化。为了在给予人体之后发挥其酶活,rhα-gala必需被相关细胞通过在其表面上表达的甘露糖-6-磷酸受体摄取。因此,本发明实现的高度选择性纯化将获得这样的rhα-gala产物,其作为药物具有显著增加的功效。
附图的简要说明
[图1]
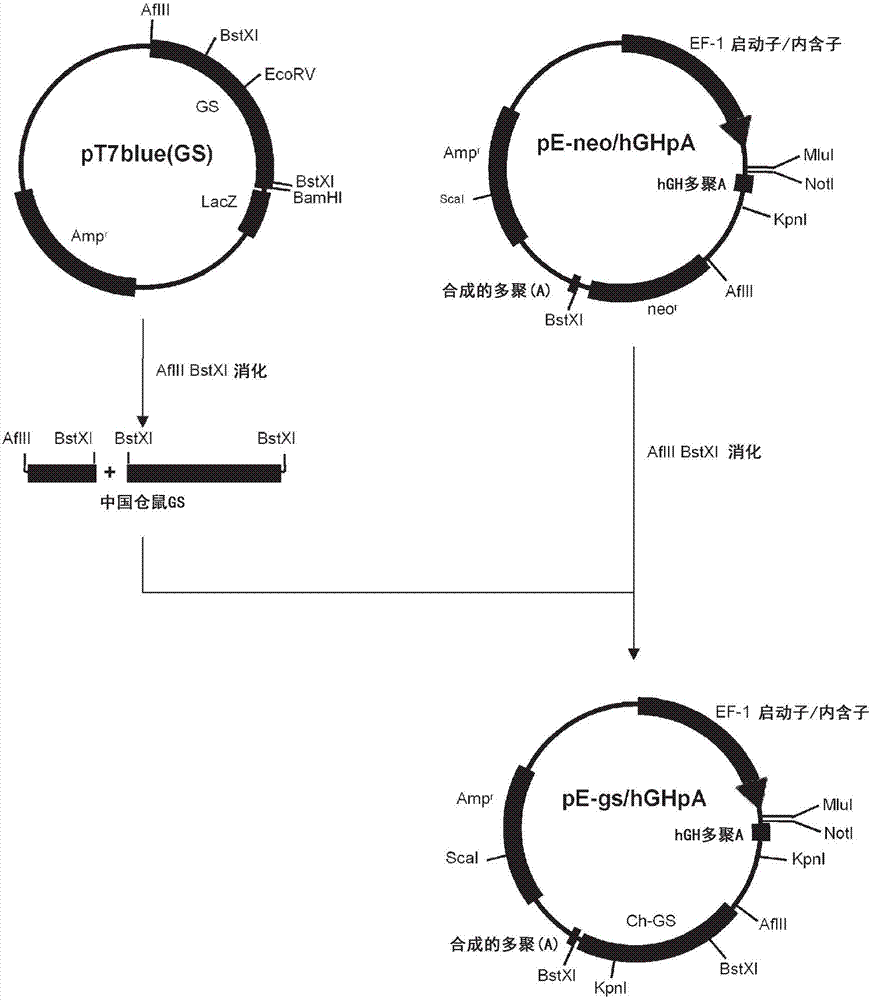
图1显示说明用于构建载体pe-neo/hghpa的方法的示意图。
[图2-1]
图2-1显示说明用于构建载体pe-gs/hghpa(α-gala)的方法的示意图的第一部分。
[图2-2]
图2-2显示说明用于构建载体pe-gs/hghpa(α-gala)的方法的示意图的第二部分。
[图3]
图3显示用于表达rhα-gala的重组细胞的生长曲线,以及rhα-gala在培养基中的浓度。
[图4]
图4显示纯化的rhα-gala的sds-page电泳的结果。泳道1中,施加了5微克的纯化的rhα-gala。
[图5]
图5显示纯化的rhα-gala的se-hplc图表。纵轴和横轴分别显示215nm处的吸光度和保留时间。
具体实施方式
本发明中,尽管重组人α-半乳糖苷酶a(rhα-gala)优选是人野生型α-gala的重组蛋白,但不排除rhα-gala是相比人野生型α-gala的氨基酸序列而言具有一个或多个氨基酸的一处或多处取代、缺失、添加和/或插入的突变型蛋白质。人野生型α-gala的dna序列和其编码的氨基酸序列,包括n-末端信号序列,分别示为seqidno:13和seqidno:14。n-末端信号序列由31个氨基酸组成,并且在翻译后移除。
本发明中,术语"产生重组人α-gala的哺乳动物细胞"或"产生rhα-gala的哺乳动物细胞"表示,已被人工操作以表达或强力表达编码人α-gala的基因的哺乳动物细胞。尽管该待被强力表达的基因是利用其中纳入了该基因的表达载体而引入哺乳动物细胞(转化)的,但其也可以是已经人工改良以被强力表达的固有基因。用于人工改良固有基因以使其本身强力表达的手段的示例包括但不限于,用强力诱导该基因表达的启动子替代该固有基因上游的启动子。此类方法已公开于若干文献(即wo94/12650,wo95/31560)中。尽管对于待采用的哺乳动物细胞的类型没有具体限制,优选是人来源、小鼠来源或中国仓鼠来源的那些,并且其中,特别优选来源于中国仓鼠卵巢细胞的cho细胞。
本发明中,术语"重组人α-半乳糖苷酶a"或"rhα-gala"表示,在培养过程中,通过上述产生重组人α-gala的哺乳动物细胞分泌在培养基中的人α-半乳糖苷酶a。
本发明中,术语"寡糖链"表示,共价结合至α-gala的肽链的寡糖的链,包括天冬酰胺型糖链,其共价结合至α-gala的天冬酰胺残基。
本发明中,其中待培养产生rhα-gala的哺乳动物细胞的优选的无血清培养基的示例有如下培养基:其包含,3-700mg/ml的氨基酸、0.001-50mg/l的维生素、0.3-10g/l的单糖、0.1-10000mg/l的无机盐、0.001-0.1mg/l的微量元素、0.1-50mg/l的核苷、0.001-10mg/l的脂肪酸、0.01-1mg/l的生物素、0.1-20微克/l的氢化可的松、0.1-20mg/l的胰岛素、0.0-10mg/l的维生素b12、0.01-1mg/l的腐胺、10-500mg/l的丙酮酸钠,和水溶性铁化合物。必要时,其还可包括胸苷、次黄嘌呤、常规ph指示剂,和抗生素。
此外,dmem/f12培养基,一种由dmem和f12组成的混合的培养基,也可用作基础无血清培养基。这些培养基均是本领域技术人员熟知的。作为无血清培养基,也可采用dmem(hg)ham改良的(r5)培养基,其包含碳酸氢钠、l-谷氨酰胺、d-葡萄糖、胰岛素、亚硒酸钠、二氨基丁烷、氢化可的松、硫酸亚铁(ii)、天冬酰胺、天冬氨酸、丝氨酸,和聚乙烯醇。此外,市售可得的无血清培养基也可用作基础培养基,例如cdoptichotm、cho-s-sfmii或cdcho(英杰公司(invitrogen))、ischo-vtm或ischo-v-gstm(欧文科技公司(irvinescientific))、ex-celltm325pfcho或ex-celltmcd(西格玛公司(sigma))等。
本发明中,培养产生rhα-gala的哺乳动物细胞至少5天,更优选8-14天,用于在培养基中产生rhα-gala。然后,收集包含rhα-gala的培养物上清液,并使其经历针对rhα-gala的纯化方法。
需要时,用于从包含污染宿主细胞蛋白质的培养物上清液纯化rhα-gala的各色谱操作可在非离子表面活性剂的存在下进行,以防止该蛋白质的非特异性结合。尽管对于待使用的非离子表面活性剂的类型没有具体限制,但优选使用基于聚山梨酯的表面活性剂,更优选聚山梨酯80或聚山梨酯20。此类非离子表面活性剂的浓度优选是0.005%(w/v)-0.05%(w/v),更优选是约0.01%(w/v)。
所述用于纯化rhα-gala的方法可在室温或更低温度进行,但优选更低温度,特别是1-10℃。
在所述纯化方法的第一色谱步骤中,所述培养物上清液的ph优选调节至7.0-8.0,更优选调节至ph7.2-7.8,且更优选至约ph7.5。然后,将培养物上清液施加至阴离子-交换柱,该柱已用补充有盐的磷酸盐缓冲液平衡,以使rhα-gala结合至柱。该磷酸盐缓冲液的ph优选是7.0-8.0,更优选是约7.2-7.8,且更优选是约7.5。尽管对于待添加至磷酸盐缓冲液的盐的类型没有具体限制,优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选在5-100mm范围内,更优选在10-60mm范围内,且更优选是约50mm。
在对结合了rhα-gala的阴离子-交换器柱进行清洗之后,rhα-gala采用具有增加的盐浓度的磷酸盐缓冲液洗脱。尽管对于待使用的盐的类型没有具体限制,但优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选在125-500mm范围内,更优选175-350mm,且更优选是约225mm。
此外,尽管对于待采用的阴离子-交换器树脂的类型没有具体限制,可优选使用强阴离子-交换器树脂。可优选使用市售可得的树脂,例如qsepharosefastflow(ge医疗公司(gehealthcare))。
疏水柱色谱,所述纯化方法的第二步骤,是利用rhα-gala和连接至该树脂的疏水配体的疏水相互作用来去除污染物的步骤。尽管对于待用于该疏水柱色谱中的疏水配体的类型没有具体限制,优选的是包含苯基基团的配体,且更优选的配体包含通过间隔臂(spacerarm)连接至该树脂的苯基基团,例如,由下式代表:r-o-ch2-ch(oh)-ch2-o-c6h5,其中r表示该树脂。用于此目的的特别优选的柱材料是phenylsepharose6fastflow(ge医疗公司),其中苯基基团通过某种间隔臂共价固定至phenylsepharose6fastflow基质。
疏水柱色谱柱用补充有盐的磷酸盐缓冲液平衡。该磷酸盐缓冲液的ph优选是6.5-7.5,更优选是约6.7-7.3,且更优选是约7.0。尽管对于待添加至磷酸盐缓冲液的盐的类型没有具体限制,优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选在500mm-1m范围内,且更优选在700-800mm范围内,且更优选是约750mm。当前,可将tris缓冲液添加至该磷酸盐缓冲液,添加浓度优选是30-70mm,更优选是约50mm。
然后,将第一步骤中获得的洗脱物的包含rhα-gala的分级分离部分施加至柱。在对其上结合了rhα-gala的柱进行清洗之后,洗脱rhα-gala。洗脱可通过未补充盐的磷酸盐缓冲液来进行,其中磷酸盐缓冲液的浓度优选是3-10mm,且更优选是约5mm。当前,可将tris缓冲液添加至该磷酸盐缓冲液,添加浓度优选是30-70mm,更优选是约50mm。或者,洗脱可通过纯水来进行。
采用对磷酸基团具有亲和性的固相的柱色谱,所述纯化的第三步骤,是消除污染蛋白质(例如羧基肽酶)的步骤。尽管对于待使用的、对磷酸基团具有亲和性的固相的类型没有具体限制,可优选使用羟基磷灰石和氟磷灰石,并且特别优选羟基磷灰石。
当使用羟基磷灰石柱时,其用补充有盐的磷酸盐缓冲液平衡。该磷酸盐缓冲液的ph优选是6.5-7.5,更优选是约6.8-7.2,且更优选是约7.0,并且磷酸盐的浓度优选是3.0-20mm,更优选是约3-15mm,且更优选是约10mm。尽管对于待添加至磷酸盐缓冲液的盐的类型没有具体限制,优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选低于800mm,且更优选在10-200mm范围内,且更优选是约50mm。当前,可将tris缓冲液添加至该磷酸盐缓冲液,添加浓度优选是30-70mm,更优选是约50mm。
然后,将第二步骤中获得的洗脱物的包含rhα-gala的分级分离部分施加至柱。在对其上结合了rhα-gala的柱进行清洗之后,洗脱rhα-gala。洗脱可通过包含盐的磷酸盐缓冲液来进行。该磷酸盐缓冲液的ph优选是6.5-7.5,更优选是约6.7-7.3,且更优选是约7.0,并且磷酸盐的浓度优选在30-80mm范围内,更优选在40-60mm范围内,且更优选是约45mm。尽管对于待使用的盐的类型没有具体限制,但优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选低于300mm,且更优选在10-200mm范围内,且更优选是约50mm。
阳离子-交换柱色谱,所述纯化方法的第四步骤,是消除污染蛋白质的步骤。尽管对于待用于该阳离子-交换柱色谱中的阳离子-交换器的类型没有具体限制,优选弱阳离子交换器,且更优选具有基于疏水相互作用和氢键形成的选择性的弱阳离子交换器。例如,可采用具有苯基基团、酰胺键和羧基基团且具有基于疏水相互作用和氢键形成的选择性的弱阳离子交换器,例如captommc(ge医疗公司)等。
在该阳离子-交换柱色谱中,该柱采用补充有盐的乙酸盐缓冲液平衡。该乙酸盐缓冲液的ph优选是4.5-6.5,更优选是约5.0-6.0,且更优选是约5.5。尽管对于待添加至磷酸盐缓冲液的盐的类型没有具体限制,优选氯化钠、氯化钾和氯化钙。在其中采用氯化钠的情况中,其浓度优选在50-250mm范围内,更优选在100-200mm范围内,且更优选是约150mm。
然后,将第三步骤中获得的洗脱物的包含rhα-gala的分级分离部分施加至柱。在对其上结合了rhα-gala的柱进行清洗之后,rhα-gala采用具有增加的ph的磷酸盐缓冲液洗脱,该ph优选在约5.5-7.5的范围内,更优选在约6.0-7.0范围内,且更优选是约6.5。
染料-亲和性色谱,所述纯化的第五步骤,是用于去除污染物,即宿主细胞蛋白质(hcp)的过程。优选使用蓝色三嗪(bluetriazine)染料,但其它三嗪染料也是合适的。特别优选的是bluesepharose6ff,fastflow(ge医疗公司),如下方示意化学式所示,其由sepharose6fastflow基质组成,其上通过共价键连接有染料cibacrontmbluef3ga。
[式1]
染料-亲和性色谱柱用补充有盐的磷酸盐缓冲液平衡处于或接近中性ph,优选ph6.8-7.2,更优选约ph7.0。尽管对于待添加至磷酸盐缓冲液的盐的类型没有具体限制,优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选在50-150mm范围内,更优选在100-150mm范围内,且更优选是约125mm。
然后,将第四步骤中获得的洗脱物的分级分离部分施加至该柱。在对结合了rhα-gala的柱进行清洗之后,rhα-gala采用含有增加的盐浓度的磷酸盐缓冲液洗脱。尽管对于待添加至磷酸盐缓冲液的盐的类型没有具体限制,优选氯化钠和氯化钾。在其中采用氯化钠的情况中,其浓度优选在400-750mm范围内,更优选在400-500mm范围内,且更优选是约450mm。氨基丁三醇(trometamol)(三(羟甲基)氨基甲烷)可以优选40-60mm且更优选是约50mm的浓度同时添加至该缓冲液。
凝胶过滤柱色谱,所述纯化方法的第六步骤,是用于消除低分子量杂质(例如内毒素)以及多聚复合物或rhα-gala的分解产物的步骤。因此,通过所述纯化方法的第六步骤获得基本纯的rhα-gala。
此外,可向包括阴离子-交换色谱、染料-亲和柱色谱、疏水柱色谱、采用对磷酸基团具有亲和性的固相的柱色谱、阳离子-交换柱色谱,和凝胶过滤柱色谱的上述纯化方法再纳入一种柱色谱。所述额外色谱柱优选是染料-亲和柱色谱,其可在必要时于所述纯化方法的任何两个相邻步骤之间使用。
可任选地向本发明的纯化方法添加用于病毒失活的步骤。尽管对于待施用的用于病毒失活的方法类型没有具体限制,但可优选施用溶剂-去污剂方法。为此,将非离子表面活性剂添加至包含rhα-gala的溶液,并且将所得的混合物孵育超过3小时。尽管对于待使用的表面活性剂类型没有具体限制,但可优选以单独或以任何组合的方式使用聚山梨酯20、聚山梨酯80、曲通x-100和三(正丁基)磷酸盐,且可更优选地采用聚山梨酯80和三(正丁基)磷酸盐的组合。
所述用于病毒失活的额外步骤可在所述纯化方法之前或在上述纯化方法的任何两个相邻步骤之间使用。
此外,本发明还提供用于从包含污染宿主细胞蛋白质的材料纯化rhα-gala的方法。该方法包括这样的步骤,其中使包含rhα-gala和用于产生rhα-gala的宿主细胞中的固有蛋白质的溶液经过染料-亲和柱色谱。该步骤的主要目的是消除污染宿主细胞蛋白质。该步骤可以任何顺序与选自下组的至少一个其它纯化步骤组合:阳离子-交换柱色谱、疏水柱色谱、阴离子-交换柱色谱、采用对磷酸基团具有亲和性的固相的柱色谱(即羟基磷灰石柱色谱)和凝胶过滤柱色谱。优选地,该组合是按如下顺序的阴离子-交换柱色谱、疏水柱色谱、采用对磷酸基团具有亲和性的固相的柱色谱、阳离子-交换柱色谱、染料-亲和柱色谱和凝胶过滤柱色谱。
通过本发明方法产生的重组人α-gala组合物适用于制备待定期地给予患者的药物。待给予所述患者的药物优选通过静脉内注射,更优选通过静脉内输注,并且可优选每周一次至每2-4周一次,更优选每两周一次给予所述患者。一次给予患者的rhα-gala的量可优选0.1-2mg/kg体重,更优选0.1-2mg/kg体重。该药物可以预填充注射器的形式供应。
本发明在下文中参考实施例进行进一步详述。然而,这并不意味着本发明限于所述实施例。
[实施例1]
pe-gs/hghpa(α-gala),一种rhα-gala表达载体的构建。
pef/myc/nuc载体(英杰公司)用kpni和ncoi消化以切出包括ef-1(α)启动子及其第一内含子的dna片段,其然后用t4dna聚合酶产生钝端。然后,将因此制备的dna片段插入pc1-neo载体(英杰公司),其已用bglii和ecori消化然后用t4dna聚合酶产生钝端。插入该载体的是上述的包括ef-1(α)启动子及其第一内含子的钝端片段,以获得pe-neo7载体(图1)。
包含人生长激素基因的聚腺苷酸化信号序列的dna片段通过将如下四种合成寡核苷酸退火来合成:(a)hgh-f1(idno:1),(b)hgh-r1(seqidno:2),(c)hgh-f2(seqidno:3),和(d)hgh-r2(seqidno:4)。将因此制备的dna片段插入pe-neo7的mlui和kpni位点之间,以获得pe-neo/hghpa载体(图1)。
中国仓鼠谷氨酰胺合成酶("chgs"或"gs")编码区的5'一半通过pcr扩增,扩增采用引物组、gs-1(seqidno:5)和gs-3(seqidno:6),以及,从提取自cho细胞的rna制备的ssdna作为模板。chgs编码区的3'一半通过pcr扩增,扩增采用引物组、gs-2(seqidno:7)和gs-4(seqidno:8),以及,从提取自cho细胞的rna制备的ssdna作为模板。然后,将扩增的chgs编码区的5'一半连接进入pt7blue-t载体(emd密理博公司(emdmillipore))。因此获得的载体用ecorv和bamhi消化,然后扩增的chgs编码区的3'一半,在用ecorv和bamhi消化之后,插入消化的载体,以获得包含ch-gs的全长cdna的质粒载体。获得的质粒称为pt7blue(gs)(图2-1)。
人α-gala编码区的5'一半通过pcr扩增,扩增采用引物组、gal-mlu(seqidno:9)和gal-sca2(seqidno:10),和人胎盘quick-clonetmcdna(克隆泰克公司(clontech))作为模板。人α-gala编码区的3'一半通过pcr扩增,扩增采用引物组、gal-sca1(seqidno:11)和gal-xba(seqidno:12),和人胎盘quick-clonetmcdna(克隆泰克公司)作为模板。然后,将两个pcr产物连接进入pbluescriptsk(+)载体的ecorv位点。然后,通过用mlui和scai消化,从因此获得的载体切下人α-gala编码区的5'一半,并且通过用scai和noti消化,从该载体切下人α-gala编码区的3'一半。然后,将切下的片段同时插入pe-neo载体的多克隆位点的mlui和noti位点,以获得人α-gala的全长cdna。因此获得的质粒称为pe-neo(α-gala)(图2-2)。
pe-neo/hghpa用afiii和bstxi消化,并且向因此消化的载体插入ch-gscdna,其已通过用afiii和bstxi消化而从pt7blue(gs)切出。获得的质粒称为pe-gs/hghpa(图2-1)。pe-gs/hghpa载体用mlui和noti消化,并向因此消化的载体插入人α-galacdna,其已通过用mlui和noti消化而从pe-neo(α-gala)切出。获得的质粒称为pe-gs/hghpa(α-gala),其用作其它实验中的rhα-gala表达载体(图2-2)。
[实施例2]
用于表达rhα-gala的重组细胞的产生。
cho细胞(cho-k1:购自美国典型培养物保藏中心)用上述表达载体pe-gs/hghpa(α-gala)转染,转染根据如下方法采用lipofectaminetm2000(英杰公司)进行。简言之,转染前两天,将2.5x105cho-k1细胞接种于包含含有5%fcs(d-mem/f12/5%fcs)的3ml的d-mem/f12培养基的3.5-cm培养皿,然后细胞在湿润的5%co2和95%空气的气氛中于37℃培养。培养两天之后,细胞用pbs清洗,并且添加1ml的新鲜无血清d-mem/f12培养基。然后,细胞通过添加200微升的由lipofectaminetm2000溶液(用opti-memtmi培养基(生命技术公司(lifetechnologies))稀释20倍)和pe-gs/hghpa(α-gala)溶液(用opti-memtmi培养基稀释至20微克/ml)组成的1:1混合物溶液来转染,然后在5%co2和95%空气的湿润气氛中37℃孵育5小时。转染之后,培养基用d-mem/f12/5%fcs替代,并另培养24小时。
然后,培养基用补充有1xgs补充物(西格玛公司)、10%透析的fbs和30微摩尔/l蛋氨酸亚砜亚胺(msx)的无谷氨酰胺的gmem-s培养基(西格玛公司)替代,然后在5%co2和95%空气的湿润气氛中37℃进行选择性培养。用于选择性培养的已在该培养基中生长的细胞在该培养基中经历数轮连续亚培养,以获得重组细胞。在选择性培养时程后,一步步地升高该培养基中的msx的浓度,以扩增插入的重组基因。最后,以升高的msx浓度(100和300微摩尔/lmsx)进行两步亚培养之后,获得在具有300微摩尔/lmsx的培养基中稳定生长的细胞群。
然后,根据限制性稀释技术,具有扩增的重组基因的细胞以每孔可能接种不多于一个细胞的方式接种于96孔板上。然后,细胞培养约10天以使其各自形成单克隆集落。分别对其中形成单克隆集落的孔中的培养物上清液取样,然后如下所述检测其人α-gala活性,并且挑选显示表现人α-gala的高活性的细胞系。
为适应无血清悬浮物细胞培养物,所选细胞系各自在市售可得的无血清培养基,补充有10mg/l胰岛素、40mg/l胸苷、100mg/l次黄嘌呤(hypoxantine)和100微摩尔/lmsx的cd-optichotm培养基(英杰公司)中,于5%co2和95%空气的湿润气氛中37℃培养直至细胞稳定生长。然后,细胞悬浮于补充有10mg/l胰岛素、40mg/l胸苷、100mg/l次黄嘌呤(hypoxantine)、100微摩尔/lmsx和10%dmso的cd-optichotm培养基(英杰公司)中,并液氮贮存作为种子细胞。
[实施例3]
用于表达rhα-gala的重组细胞的培养
上述种子细胞经解冻并稀释至4x105细胞/ml的密度,然后用补充有10mg/l胰岛素、40mg/l胸苷、100mg/l次黄嘌呤(hypoxantine)和100微摩尔/lmsx(cd培养基)的cd-optichotm培养基培养3-4天,然后用cd培养基稀释至2x105细胞/ml的密度并培养3-4天。这些细胞用cd培养基再次稀释至2x105细胞/ml的密度并进一步培养3-4天。
对因此培养的细胞数量计数,并且细胞培养物用cd培养基稀释至2x105细胞/ml的密度,然后将1l该稀释培养物中的细胞振荡培养数天。培养规模升级直至培养体积到达200l。
然后,对细胞数量计数,并且细胞用补充有10mg/l胰岛素、40mg/l胸苷、100mg/l次黄嘌呤(hypoxantine)和0.1%hy大豆(英杰公司)的1800l的cd-optichotm培养基稀释至2x105细胞/ml的密度,并培养11天。cd-optichotm培养基中的包含8.84g胰岛素、35.2mmol次黄嘌呤(hypoxantine)、5.6mmol胸苷和1.8kghy大豆的22.4l的种子溶液在第3天、第5天、第7天,和第9天添加。在培养过程中每天取样,并且测量细胞数量、存活率、葡萄糖浓度和表达的rhα-gala的量。在其中葡萄糖浓度变得低于3g/l的情况中,添加30%葡萄糖溶液,从而该浓度到达3.5g/l。在11天的培养过程中,每天监测活细胞密度和rhα-gala浓度。在培养第6-7天,活细胞密度到达约6x106细胞/ml,指示成功实现高密度细胞培养物(图3)。如elisa检测(如下所述),培养基中由细胞分泌的rhα-gala的浓度随时间增加,并且在第6天几乎到达140mg/l(图3)。
在完成上述培养之后,细胞培养物经收集并依次过滤通过millistak+tmhcpodfilter级d0hc(密理博公司(millipore))、millistak+tmhcpodfilter级x0hc(密理博公司),然后是duraporeopticaptmxlt20(0.22微米,密理博公司),以获得培养物上清液。所得的培养物上清液通过配备有ps膜(聚砜膜)的中空纤维模块浓缩至原始体积的1/13。
[实施例4]
病毒失活
将三正丁基磷酸盐(tnbp)和聚山梨酯80添加至约75l的上述浓缩的培养物上清液,从而其终浓度将分别是0.3%(v/v)和1%(w/v),然后,该混合物溶液室温柔和搅拌3-4小时。
[实施例5]
用于纯化rhα-gala的方法
然后,通过添加1mtris-缓冲液(ph8.8),将上述病毒失活的溶液的ph调节至7.5,随后通过添加包含1mnacl的50mm磷酸盐缓冲液(ph7.0),将电导率(conductivity)调节至包含50mmnacl的10mm磷酸盐缓冲液(ph7.5)的电导率。然后,将溶液过滤通过duraporeopticaptmxl10(密理博公司),然后加载至qsepharosefastflow柱(柱体积:约19.2l,床高:约20cm,ge医疗公司)(一种阴离子-交换柱)上,该柱已用包含50mmnacl的10mm磷酸盐缓冲液(ph7.5)以150cm/小时的线性流速平衡以允许rhα-gala被所述柱吸附。然后,柱用以相同流速供给的三倍柱体积的相同缓冲液清洗,然后,吸附的rhα-gala用六倍柱体积的包含225mmnacl的10mm磷酸盐缓冲液(ph7.5)、随后是三倍柱体积的包含1mnacl的50mm磷酸盐缓冲液(ph7.0)洗脱,从而收集包含rhα-gala的分级分离部分。
向在上述qsepharosefastflow柱色谱步骤处收集的该分级分离部分添加四分之一体积的2mnacl,以调节nacl浓度至约500mm,随后添加乙酸以调节ph至7.0。将所得溶液加载至phenylsepharose6fastflow柱(柱体积:19.2l,床高:约20cm,ge医疗公司)(疏水柱),其已采用50mmtris-hcl,包含750mmnacl的5mm磷酸盐缓冲液(ph7.0)以150cm/小时的线性流速平衡,以允许rhα-gala被所述柱吸附。然后,柱用三倍柱体积的以相同流速供给的相同缓冲液清洗,吸附的rhα-gala用九倍柱体积的由50mmtris-hcl和5mm磷酸盐(ph7.0)组成的缓冲液,随后用三倍柱体积的纯水洗脱,从而收集包含rhα-gala的分级分离部分。
将在上述phenylsepharose6fastflow柱色谱步骤处收集的分级分离部分加载至cht-i陶瓷羟基磷灰石柱(柱体积:19.2l,床高:约20cm,伯乐实验室公司(bio-radlaboratories))(羟基磷灰石柱)上,其已用50mmtris-hcl,包含50mmnacl的10mm磷酸盐缓冲液(ph7.0)以150cm/小时的线性流速平衡,以允许rhα-gala被所述柱吸附。然后,柱用五倍柱体积的以相同流速供给的相同缓冲液清洗,然后,吸附的rhα-gala用九倍柱体积的包含50mmtris-hcl、45mm磷酸钠和50mmnacl(ph7.0)的缓冲液,随后用三倍柱体积的200mm磷酸盐缓冲液(ph7.0)洗脱,从而收集包含rhα-gala的分级分离部分。
向在上述cht-i陶瓷羟基磷灰石柱色谱的步骤处收集的分级分离部分添加乙酸,以调节ph至5.5。通过opticaptmshcxl5(0.22微米,密理博公司)过滤来移除由此形成的沉淀物。将所得的溶液加载至captotmmmc柱(柱体积:6.3l,床高:约20cm,ge医疗公司)(具有基于疏水相互作用和氢键形成的选择性的阳离子-交换柱)上,其已用包含150mmnacl的50mm乙酸盐缓冲液(ph5.5)以300cm/小时的线性流速平衡,以允许rhα-gala被所述柱吸附。然后,在柱用四倍柱体积的以相同流速供给的相同缓冲液清洗之后,吸附的rhα-gala用五倍柱体积的50mm磷酸盐缓冲液(ph6.5),随后用三倍柱体积的包含1mnacl的50mm磷酸盐缓冲液(ph7.0)洗脱,从而收集包含rhα-gala的分级分离部分。
向在上述captotmmmc柱色谱步骤处收集的分级分离部分,添加1mtris缓冲液(ph8.8),以调节ph至7.0。将所得溶液的一半加载至bluesepharose6ff柱(柱体积:约19.2l,床高:约20cm,ge医疗公司)上,该柱用以150cm/小时的线性流速提供的包含125mmnacl的20mm磷酸盐缓冲液(ph7.0)平衡,以允许rhα-gala被所述柱吸附。然后,柱用三倍柱体积的以相同流速供给的包含125mmnacl的20mm磷酸盐缓冲液(ph7.0)清洗,然后吸附的rhα-gala用四倍柱体积的以相同流速供给的包含450mmnacl的50mmtris-hcl/5mm磷酸盐缓冲液(ph7.0)洗脱,从而收集包含rhα-gala的分级分离部分。该溶液的另一半通过染料-亲和柱色谱以与如上所述相同的方式相继处理。收集的包含rhα-gala的分级分离部分经合并以供进一步纯化。
在上述染料-亲和柱色谱步骤处收集的分级分离部分采用配备有biomaxtm30膜(密理博公司)的pellicontm3cassettes浓缩,直至总体积变得小于1l。将1/3的浓缩的溶液加载至superdextm200制备级柱(柱体积:约58l,床高:约30cmx2,ge医疗公司)上,该柱已用包含137mmnacl的20mm磷酸盐缓冲液(ph5.8)平衡。然后,以25cm/小时的线性流速供应相同缓冲液,并且收集对应于在吸光度280nm观察到的主峰的分级分离部分,作为包含纯化的rhα-gala的分级分离部分。该色谱进行三次以纯化所有的上述浓缩溶液,并且将通过每次跑动收集的分级分离部分合并。
在上述superdextm200制备级柱色谱的步骤处汇集的分级分离部分通过配备有ps膜的中空纤维模块浓缩,并且向该浓缩的溶液以终浓度0.02%添加聚山梨酯80。所得的溶液过滤通过viresolvetmpromodus1.3(0.07m2尺寸,密理博公司),以避免终产物中任何可能的病毒和微生物污染。
在各纯化步骤中,采用elisa(如下所述)对加载的材料中包含的rhα-gala的量和在收集的分级分离部分中回收的rhα-gala量进行定量。结果见表1。在该表中,"rhα-gala回收率/步骤"表示,该步骤中回收的rhα-gala的量与该步骤中加载的rhα-gala的量之比,而"rhα-gala回收率/总计"表示,该步骤中回收的rhα-gala的量与经历所述纯化方法的rhα-gala的初始量之比。经历所述纯化方法的rhα-gala的初始量是140.6g,其中91.4g最终被回收,因此rhα-gala回收率/总计高达65.0%。这些结果显示,上述纯化方法允许以极高产量和大生产规模纯化rhα-gala。
[表1]
表1.各纯化步骤中rhα-gala的回收率
[实施例6]
人α-gala的elisa分析
向96孔微滴定板(nunc)的各孔添加100微升的小鼠抗人α-gala单克隆抗体(用0.05m碳酸盐-碳酸氢盐缓冲液(ph9.6)稀释至0.25微克/ml),然后该板在不受影响的条件下室温放置至少1小时或2-8℃过夜,以允许抗体被孔吸收。然后,在用包含0.05%吐温20(pbs-t)的磷酸盐缓冲盐水ph7.4(pbs)清洗各孔之后,添加300微升的包含1%bsa的pbs-t,并且该板在不受影响的条件下室温放置至少一小时。然后,在各孔用pbs-t清洗三次之后,向孔添加100微升的测试样品或人α-gala标准品(必要时,其已用包含0.5%bsa和0.05%吐温20的pbs(pbs-bt)稀释),然后该板以不受影响的条件室温放置至少一小时。然后,在各孔用pbs-t清洗三次之后,添加100微升的辣根过氧化物酶标记的兔抗人α-gala多克隆抗体(用pbs-bt稀释),然后该板在不受影响的条件下放置至少一小时。然后,在各孔用pbs-t清洗三次之后,向各孔添加100微升的具有包含0.009%过氧化氢的磷酸盐-柠檬酸盐缓冲液(ph5.0)的0.4mg/ml邻苯二胺,然后该板在不受影响的条件下室温放置10-25分钟。然后向各孔添加0.1ml的1mol/lh2so4以停止反应,并且在96孔板酶标仪上检测各孔的490nm的光学密度。
[实施例7]
rhα-gala活性检测
标准溶液如下制备:在稀释缓冲液(26.7mm柠檬酸盐-44.8mm磷酸盐缓冲液,ph4.6,包含0.1mg/mlbsa)中以0-200微摩尔/l的浓度溶解4-甲基伞形酮。底物溶液如下制备:在稀释缓冲液中以5mm的终浓度溶解4-甲基伞形基-α-d-半乳糖苷(sigma)。将10微升的各个标准品溶液或测试样品(用稀释缓冲液稀释)添加至96孔微滴定板(fluoronunc板,nunc)的各孔。将75微升的底物溶液添加至包含稀释的测试样品或任何标准品溶液的各孔,然后该板在不受影响的条件下37℃避光放置1小时。在该孵育之后,将200微升的停止缓冲液(0.2m甘氨酸-naoh,ph10.6)添加至各孔。然后各孔中溶液的荧光强度通过96孔板酶标仪以335nm波长的发射光和460nm波长的荧光检测。
标准曲线通过用标准品溶液测得的荧光强度绘点,并且在各绘制的数据点之间内插来产生。采用标准曲线,将各样品的荧光强度对应于释放的4-muf的浓度。人α-gala的特定活性计算为单位/mg,其中一单位活性等于37℃每分钟产生的一微摩尔的4-muf。参考公开的美国专利申请(公开号2004-0229250)来进行关于rhα-gala活性的上述检测。通过上述方法纯化的rhα-gala的特定活性显示为约50u/mg(48.3-53.7u/mg)。
[实施例8]
rhα-gala的纯度分析。
五微克的上述纯化的rhα-gala经历还原性、加热(70℃10分钟)条件下的sds-page电泳。凝胶用考马斯亮蓝染色,显示对应于superdextm200pg分级分离部分中的rhα-gala的单一条带(图4)。
此外,上述纯化的rhα-gala通过尺寸消除(size-elimination)hplc(se-hplc)进行分析。hplc采用lc-20a系统,spd-20avuv/vis检测器(shimazu公司)进行。对于se-hplc分析,将包含2mg/ml的上述纯化的rhα-gala的10微升的样品溶液施加至tskgelg3000swxl柱(7.8mmi.d.x30cm,tosoh)上,该柱用25mm磷酸盐缓冲盐水(pbs)以0.5ml/分钟的流速平衡。通过监测215nm处的吸光度产生洗脱概况。
上述纯化的rhα-gala的se-hplc分析仅显示单一峰(图5)。结果显示上述获得的rhα-gala是高度纯化的且不含任何检测得到的污染物。该结果显示上述纯化的rhα-gala具有如此高的纯度以至于可以直接用作医药药物。
[实施例9]
宿主细胞蛋白质(hcp)检测
纯化步骤1-6中各自收集的rhα-gala-活性分级分离部分的汇集物中存在的污染宿主细胞蛋白质(hcp)通过elisa以常规方式定量,并与该汇集物中所含的rhα-gala的量做比较。结果于表1中示为"hcp/rhα-gala(ppm)",其为hcp的与rhα-gala之质量比。如表1中所示,该比例,在最终的纯化步骤之后,低至20ppm,该水平足够低以允许因此纯化的rhα-gala用作通过注射重复给予人的药物。
在所述纯化方法的步骤中,第五,染料-亲和性色谱,最为有效地从被hcp污染的rhα-gala移除hcp。即,该步骤中,几乎97%的hcp被移除,并且hcp/rhα-gala比率从8.6x103ppm降至2.5x102ppm。结果显示染料-亲和性色谱是从rhα-gala制备物移除hcp的显著有效的方式。
工业可行性
本发明用于以大规模产生rhα-半乳糖苷酶a(rhα-gala),其具有作为向患有法布瑞氏综合征的患者给予的药物的足够高的纯度。
序列表自由文本
seqidno:1=hgh-f1,合成序列
seqidno:2=hgh-r1,合成序列
seqidno:3=hgh-f2,合成序列
seqidno:4=hgh-r2,合成序列
seqidno:5=引物gs-1,合成序列
seqidno:6=引物gs-3,合成序列
seqidno:7=引物gs-2,合成序列
seqidno:8=引物gs-4,合成序列
seqidno:9=引物gal-mlu,合成序列
seqidno:10=引物gal-sca2,合成序列
seqidno:11=引物gal-sca1,合成序列
seqidno:12=引物gal-xba,合成序列
序列表
<110>jcr制药股份有限公司(jcrpharmaceuticalsco.,ltd)
福井刚(fukui,tsuyoshi)
川崎敦子(kawasaki,atsuko)
秦野勇吉(hatano,yukichi)
伊藤八重(ito,yae)
三原和敏(mihara,kazutoshi)
杉村厚(sugimura,atsushi)
<120>用于从包含污染物宿主细胞蛋白的材料纯化重组人α-半乳糖苷酶a的方法
<130>gp183-pct
<150>pct/jp2015/000290
<151>2015-01-22
<160>14
<170>patentinversion3.5
<210>1
<211>114
<212>dna
<213>人工序列
<220>
<223>hgh-f1,合成序列
<400>1
cgcgtgaattcgcggccgctctagacccgggtggcatccctgtgacccctccccagtgcc60
tctcctggccctggaagttgccactccagtgcccaccagccttgtcctaataaa114
<210>2
<211>124
<212>dna
<213>人工序列
<220>
<223>hgh-r1,合成序列
<400>2
tgatgcaacttaattttattaggacaaggctggtgggcactggagtggcaacttccaggg60
ccaggagaggcactggggaggggtcacagggatgccacccgggtctagagcggccgcgaa120
ttca124
<210>3
<211>96
<212>dna
<213>人工序列
<220>
<223>hgh-f2,合成序列
<400>3
attaagttgcatcattttgtctgactaggtgtccttctataatagcgcagcaccatggcc60
tgaaataacctctgaaagaggaacttggttaggtac96
<210>4
<211>78
<212>dna
<213>人工序列
<220>
<223>hgh-r2,合成序列
<400>4
ctaaccaagttcctctttcagaggttatttcaggccatggtgctgcgctattatagaagg60
acacctagtcagacaaaa78
<210>5
<211>25
<212>dna
<213>人工序列
<220>
<223>引物gs-1,合成序列
<400>5
cttaagatggccacctcagcaagtt25
<210>6
<211>27
<212>dna
<213>人工序列
<220>
<223>引物gs-3,合成序列
<400>6
acgatatccctgccataggctttgtct27
<210>7
<211>27
<212>dna
<213>人工序列
<220>
<223>引物gs-2,合成序列
<400>7
agacaaagcctatggcagggatatcgt27
<210>8
<211>30
<212>dna
<213>人工序列
<220>
<223>引物gs-4,合成序列
<400>8
ccatcgtgatggttagtttttgtattggaa30
<210>9
<211>26
<212>dna
<213>人工序列
<220>
<223>引物gal-mlu,合成序列
<400>9
ggtacgcgtgacaatgcagctgagga26
<210>10
<211>21
<212>dna
<213>人工序列
<220>
<223>引物gal-sca2,合成序列
<400>10
gtgattgcagtactgtcggat21
<210>11
<211>21
<212>dna
<213>人工序列
<220>
<223>引物gal-sca1,合成序列
<400>11
atccgacagtactgcaatcac21
<210>12
<211>35
<212>dna
<213>人工序列
<220>
<223>引物gal-xba,合成序列
<400>12
gagtctagattttaaagtaagtcttttaatgacat35
<210>13
<211>1290
<212>dna
<213>智人(homosapiens)
<220>
<221>cds
<222>(1)..(1290)
<400>13
atgcagctgaggaacccagaactacatctgggctgcgcgcttgcgctt48
metglnleuargasnprogluleuhisleuglycysalaleualaleu
151015
cgcttcctggccctcgtttcctgggacatccctggggctagagcactg96
argpheleualaleuvalsertrpaspileproglyalaargalaleu
202530
gacaatggattggcaaggacgcctaccatgggctggctgcactgggag144
aspasnglyleualaargthrprothrmetglytrpleuhistrpglu
354045
cgcttcatgtgcaaccttgactgccaggaagagccagattcctgcatc192
argphemetcysasnleuaspcysglnglugluproaspsercysile
505560
agtgagaagctcttcatggagatggcagagctcatggtctcagaaggc240
serglulysleuphemetglumetalagluleumetvalserglugly
65707580
tggaaggatgcaggttatgagtacctctgcattgatgactgttggatg288
trplysaspalaglytyrglutyrleucysileaspaspcystrpmet
859095
gctccccaaagagattcagaaggcagacttcaggcagaccctcagcgc336
alaproglnargaspsergluglyargleuglnalaaspproglnarg
100105110
tttcctcatgggattcgccagctagctaattatgttcacagcaaagga384
pheprohisglyileargglnleualaasntyrvalhisserlysgly
115120125
ctgaagctagggatttatgcagatgttggaaataaaacctgcgcaggc432
leulysleuglyiletyralaaspvalglyasnlysthrcysalagly
130135140
ttccctgggagttttggatactacgacattgatgcccagacctttgct480
pheproglyserpheglytyrtyraspileaspalaglnthrpheala
145150155160
gactggggagtagatctgctaaaatttgatggttgttactgtgacagt528
asptrpglyvalaspleuleulyspheaspglycystyrcysaspser
165170175
ttggaaaatttggcagatggttataagcacatgtccttggccctgaat576
leugluasnleualaaspglytyrlyshismetserleualaleuasn
180185190
aggactggcagaagcattgtgtactcctgtgagtggcctctttatatg624
argthrglyargserilevaltyrsercysglutrpproleutyrmet
195200205
tggccctttcaaaagcccaattatacagaaatccgacagtactgcaat672
trppropheglnlysproasntyrthrgluileargglntyrcysasn
210215220
cactggcgaaattttgctgacattgatgattcctggaaaagtataaag720
histrpargasnphealaaspileaspaspsertrplysserilelys
225230235240
agtatcttggactggacatcttttaaccaggagagaattgttgatgtt768
serileleuasptrpthrserpheasnglngluargilevalaspval
245250255
gctggaccagggggttggaatgacccagatatgttagtgattggcaac816
alaglyproglyglytrpasnaspproaspmetleuvalileglyasn
260265270
tttggcctcagctggaatcagcaagtaactcagatggccctctgggct864
pheglyleusertrpasnglnglnvalthrglnmetalaleutrpala
275280285
atcatggctgctcctttattcatgtctaatgacctccgacacatcagc912
ilemetalaalaproleuphemetserasnaspleuarghisileser
290295300
cctcaagccaaagctctccttcaggataaggacgtaattgccatcaat960
proglnalalysalaleuleuglnasplysaspvalilealaileasn
305310315320
caggaccccttgggcaagcaagggtaccagcttagacagggagacaac1008
glnaspproleuglylysglnglytyrglnleuargglnglyaspasn
325330335
tttgaagtgtgggaacgacctctctcaggcttagcctgggctgtagct1056
phegluvaltrpgluargproleuserglyleualatrpalavalala
340345350
atgataaaccggcaggagattggtggacctcgctcttataccatcgca1104
metileasnargglngluileglyglyproargsertyrthrileala
355360365
gttgcttccctgggtaaaggagtggcctgtaatcctgcctgcttcatc1152
valalaserleuglylysglyvalalacysasnproalacyspheile
370375380
acacagctcctccctgtgaaaaggaagctagggttctatgaatggact1200
thrglnleuleuprovallysarglysleuglyphetyrglutrpthr
385390395400
tcaaggttaagaagtcacataaatcccacaggcactgttttgcttcag1248
serargleuargserhisileasnprothrglythrvalleuleugln
405410415
ctagaaaatacaatgcagatgtcattaaaagacttactttaa1290
leugluasnthrmetglnmetserleulysaspleuleu
420425
<210>14
<211>429
<212>prt
<213>智人(homosapiens)
<400>14
metglnleuargasnprogluleuhisleuglycysalaleualaleu
151015
argpheleualaleuvalsertrpaspileproglyalaargalaleu
202530
aspasnglyleualaargthrprothrmetglytrpleuhistrpglu
354045
argphemetcysasnleuaspcysglnglugluproaspsercysile
505560
serglulysleuphemetglumetalagluleumetvalserglugly
65707580
trplysaspalaglytyrglutyrleucysileaspaspcystrpmet
859095
alaproglnargaspsergluglyargleuglnalaaspproglnarg
100105110
pheprohisglyileargglnleualaasntyrvalhisserlysgly
115120125
leulysleuglyiletyralaaspvalglyasnlysthrcysalagly
130135140
pheproglyserpheglytyrtyraspileaspalaglnthrpheala
145150155160
asptrpglyvalaspleuleulyspheaspglycystyrcysaspser
165170175
leugluasnleualaaspglytyrlyshismetserleualaleuasn
180185190
argthrglyargserilevaltyrsercysglutrpproleutyrmet
195200205
trppropheglnlysproasntyrthrgluileargglntyrcysasn
210215220
histrpargasnphealaaspileaspaspsertrplysserilelys
225230235240
serileleuasptrpthrserpheasnglngluargilevalaspval
245250255
alaglyproglyglytrpasnaspproaspmetleuvalileglyasn
260265270
pheglyleusertrpasnglnglnvalthrglnmetalaleutrpala
275280285
ilemetalaalaproleuphemetserasnaspleuarghisileser
290295300
proglnalalysalaleuleuglnasplysaspvalilealaileasn
305310315320
glnaspproleuglylysglnglytyrglnleuargglnglyaspasn
325330335
phegluvaltrpgluargproleuserglyleualatrpalavalala
340345350
metileasnargglngluileglyglyproargsertyrthrileala
355360365
valalaserleuglylysglyvalalacysasnproalacyspheile
370375380
thrglnleuleuprovallysarglysleuglyphetyrglutrpthr
385390395400
serargleuargserhisileasnprothrglythrvalleuleugln
405410415
leugluasnthrmetglnmetserleulysaspleuleu
420425
- 还没有人留言评论。精彩留言会获得点赞!