阳离子性脂质的制作方法
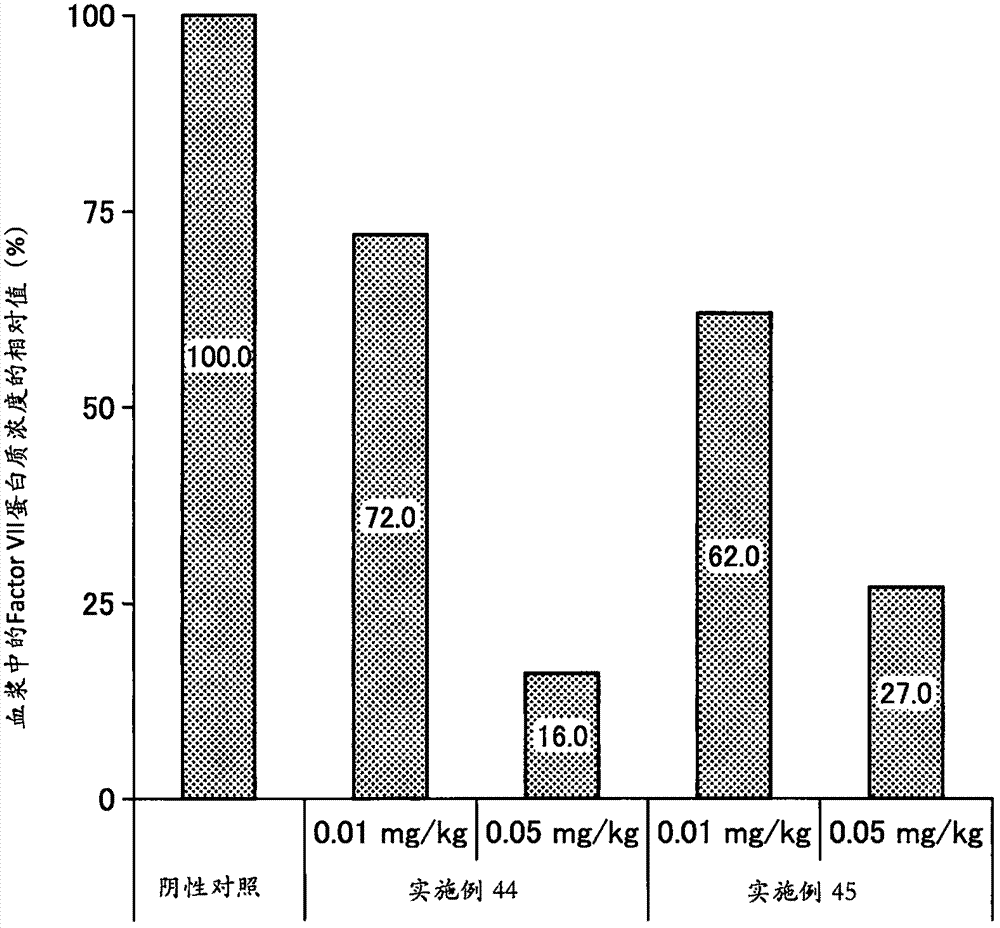
本发明涉及一种新颖阳离子性脂质。本申请是基于2014年12月26日在日本提出申请的日本专利特许2014-266548号而主张优先权,并将其内容引用到本文中。
背景技术:
:sirna(小干扰rna)、mirna(微小rna)、shrna(短发夹rna、或小发夹rna)表达载体、反义寡核苷酸等核酸是在活体内诱导序列特异性基因表达抑制的核酸,其作为核酸医药而为公众所知。在这些核酸医药中,特别是sirna备受瞩目。sirna是包含19~23个碱基对的双链rna,其会诱导称为rna干扰(rnainterference,rnai)的序列特异性基因表达抑制。sirna虽化学性质稳定,但在治疗用途中存在如下问题:容易被血浆中的rnase(核糖核酸酶,ribonuclease)分解、及当单独存在时难以透过细胞膜等(例如,参照专利文献1)。针对所述问题,已知有通过将sirna封入到含有阳离子性脂质的微粒子内,而保护所封入的sirna免于在血浆中发生分解,且可使sirna透过脂溶性细胞膜(例如,参照专利文献1)。另外,专利文献2~4记载了用于传递sirna等核酸医药的阳离子性脂质,其生物降解性得到提高。另外,含有阳离子性脂质的微粒子存在保管期间容易发生凝聚的稳定性问题,已知有使聚乙二醇修饰脂质(peg脂质)包含于该微粒子中而抑制凝聚的方法。此外,专利文献5中记载了如下方法,即,通过将特定peg脂质peg-dpg设为微粒子的构成成分,或制成包含该微粒子与经过脱离子化的溶剂的制剂,而改善凝聚抑制及核酸的传递效率。先前技术文献专利文献专利文献1:日本专利特许2012-530059号公报专利文献2:国际公开第2011/153493号手册专利文献3:国际公开第2013/086354号手册专利文献4:国际公开第2013/158579号手册专利文献5:国际公开第2014/089239号手册技术实现要素:发明所要解决的问题然而,尽管最近有所进展,但业界仍然在寻求可利用于向细胞质传递核酸的阳离子性脂质。解决问题的技术手段本发明涉及以下的[1]至[8]。[1]一种化合物或其药学上所容许的盐,该化合物是选自由下述式(1)~(11)所表示的化合物所组成的族群中。[化1][化2][化3][化4][化5][化6][化7][化8][化9][化10][化11][2]根据[1]所述的化合物或其药学上所容许的盐,该化合物是选自由下述式(1)及(6)~(9)所表示的化合物所组成的族群中。[化12][化13][化14][化15][化16][3]根据[1]或[2]所述的化合物或其药剂学上所容许的盐,该化合物是以下述式(1)表示。[化17]所述式(1)所表示的化合物为阳离子性脂质。[4]根据[1]或[2]所述的化合物或其药剂学上所容许的盐,该化合物是以下述式(6)表示。[化18]所述式(6)所表示的化合物为阳离子性脂质。[5]根据[1]或[2]所述的化合物或其药剂学上所容许的盐,该化合物是以下述式(8)表示。[化19]所述式(8)所表示的化合物为阳离子性脂质。[6]一种脂质复合物,其含有(i)[1]至[5]中任一项所述的化合物或其药学上所容许的盐和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质。[7]一种组合物,其含有(i)[1]至[5]中任一项所述的化合物或其药学上所容许的盐、(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质及(iii)核酸。[8]一种组合物的制造方法,其包括如下步骤:将含有(i)[1]至[5]中任一项所述的化合物或其药学上所容许的盐和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质的含极性有机溶剂的水溶液、与含有(iii)核酸的水溶液进行混合,而获得混合液的步骤;以及,使混合液中的极性有机溶剂的含量减少的步骤。发明效果根据本发明的阳离子性脂质,可向细胞质高效率地释放核酸。因此,本发明的阳离子性脂质具有作为用于向细胞质传递核酸的脂质的可利用性。附图说明图1是表示动物实验(4)的结果的图表。图2是表示动物实验(5)的结果的图表。具体实施方式<阳离子性脂质>在一个实施方式中,本发明为所述式(1)~(11)中的任一个式所表示的化合物或其药剂学上所容许的盐,其可用作阳离子性脂质。阳离子性脂质也可以是所述盐的水合物或所述盐的溶剂合物。在本说明书中,所谓阳离子性脂质是指具有脂质亲和性区域和亲水性区域的两亲分子,该脂质亲和性区域包含一个以上的烃基,该亲水性区域包含在生理ph值下会质子化的极性基。即,本发明的阳离子性脂质能够发生质子化而形成阳离子。作为与所述阳离子成对,且本实施方式的阳离子性脂质可含有的阴离子,只要为药剂学上所容许的阴离子,则没有特别限定,例如可列举:氯化物离子、溴化物离子、硝酸根离子、硫酸根离子、磷酸根离子等无机离子;醋酸根离子、草酸根离子、马来酸根离子、富马酸根离子、柠檬酸根离子、苯甲酸根离子、甲磺酸根离子等有机酸根离子等。<阳离子性脂质的制造方法>对本发明的阳离子性脂质的制造方法进行说明。下述式(12)中表示阳离子性脂质的合成流程的一个实施方式。[化20]所述式(12)中,r3表示碳数4~12的烷撑,r4表示碳数7~12的烷基,r8表示下述式(13)所表示的结构,r9表示下述式(14)所表示的结构。[化21][式(13)中,r1表示可具有由碳链的一部分缩合而形成的1个以上的环丙烷或者环丁烷的碳数4~10的烷基、或碳数4~10的烯基,r2表示氢原子或碳数2~8的烷基,m表示0~5的整数。][化22][式(14)中,r5、r6及r7分别独立表示氢原子或碳数1~10的烷基,n表示0~5的整数;r5及r6也可一并形成单环式杂环,r6及r7也可一并形成单环式杂环。]在本实施方式的合成流程中,阳离子性脂质(1-7)可通过如下方式合成。首先,例如将式(1-1)所表示的二羧酸二烷基酯水解,而获得式(1-2)所表示的单酯体。此处,披露了式(1-1)中二羧酸二烷基酯的烷基为甲基的例子,但二羧酸二烷基酯的烷基并不限于甲基,可选择适当的烷基。接着,将式(1-2)所表示的化合物酰氯化,而获得式(1-3)所表示的化合物。接着,通过使式(1-3)所表示的化合物与格氏试剂进行反应,而获得式(1-4)所表示的化合物。接着,通过酯交换反应而获得式(1-5)所表示的化合物,再将其还原,由此获得式(1-6)所表示的化合物。接着,可通过使式(1-6)所表示的化合物与羧酸进行缩合,而合成阳离子性脂质(1-7)。<脂质复合物>本发明提供一种脂质复合物,其含有(i)所述阳离子性脂质和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质。作为本发明的一个实施方式,脂质复合物含有(i)所述阳离子性脂质、(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质及(iii)核酸。本实施方式的脂质复合物能够实现将核酸高效率地释放到细胞质中。关于本实施方式的脂质复合物,以脂质复合物所含有的全部脂质为基准,所述阳离子性脂质的含量为例如10~100摩尔%、例如20~90摩尔%、例如40~70摩尔%。阳离子性脂质可单独使用1种,或者将2种以上混合使用。作为核酸,可列举:sirna、mirna、shrna表达载体、反义寡核苷酸、核酶等。核酸也可为sirna、mirna。本实施方式的脂质复合物含有例如0.01~50重量%、例如0.1~30重量%、例如1~10重量%的核酸。本实施方式的脂质复合物,作为脂质成分,含有(i)所述阳离子性脂质和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质。作为中性脂质,可列举:二油酰磷脂酰乙醇胺(dope)、棕榈酰油酰磷脂酰胆碱(popc)、卵磷脂酰胆碱(epc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二花生酰磷脂酰胆碱(dapc)、二山嵛酰磷脂酰胆碱(dbpc)、二(二十四酰)磷脂酰胆碱(dlpc)、二油酰磷脂酰胆碱(dopc)、鞘磷脂、神经酰胺、二油酰磷脂酰甘油(dopg)、二棕榈酰磷脂酰甘油(dppg)、磷脂酰乙醇胺(pope)、二油酰-磷脂酰乙醇胺4-(n-马来酰亚胺甲基)-环己烷-1-羧酸酯(dope-mal)等。中性脂质可单独使用1种,或者将2种以上混合使用。本实施方式的脂质复合物中,以脂质复合物所含有的全部脂质为基准,也可含有例如0~50摩尔%、例如0~40摩尔%、例如0~30摩尔%的中性脂质。作为聚乙二醇修饰脂质,可列举:peg2000-dmg(peg2000-二肉豆蔻基甘油、peg2000-dpg(peg2000-二棕榈酰甘油)、peg2000-dsg(peg2000-二硬脂酰甘油)、peg5000-dmg(peg5000-二肉豆蔻基甘油)、peg5000-dpg(peg5000-二棕榈酰甘油)、peg5000-dsg(peg5000-二硬脂酰甘油)、peg-cdma(n-[(甲氧基聚(乙二醇)2000)氨基甲酰基]-1,2-二肉豆蔻基氧基丙基-3-胺)、peg-c-domg(r-3-[(ω-甲氧基-聚(乙二醇)2000)氨基甲酰基)]-1,2-二肉豆蔻基氧基丙基-3-胺)、聚乙二醇(peg)-二酰甘油(dag)、peg-二烷氧基丙基(daa)、peg-磷脂质、peg-神经酰胺(cer)等。作为peg-二烷氧基丙基,可列举:peg-二月桂氧基丙基、peg-二肉豆蔻氧基丙基、peg-二棕榈氧基丙基、peg-二硬脂氧基丙基等。聚乙二醇修饰脂质可单独使用1种,或者将2种以上混合使用。本实施方式的脂质复合物中,以脂质复合物所含有的全部脂质为基准,也可含有例如0~30摩尔%、例如0~20摩尔%、例如0~10摩尔%的聚乙二醇修饰脂质。作为固醇,可列举:胆固醇、二氢胆固醇、羊毛固醇、β-谷固醇、菜油固醇、豆固醇、菜籽固醇、麦角固醇、岩藻固醇、3β-[n-(n′,n′-二甲基氨基乙基)氨基甲酰基]胆固醇(dc-chol)等。固醇可单独使用1种,或者将2种以上混合使用。本实施方式的脂质复合物中,以脂质复合物所含有的全部脂质为基准,也可含有例如0~90摩尔%、例如10~80摩尔%、例如20~50摩尔%的固醇。本实施方式的脂质复合物中的脂质成分的组合没有特别限定,例如可列举:所述的阳离子性脂质、中性脂质及固醇的组合,所述的阳离子性脂质、中性脂质、聚乙二醇修饰脂质及固醇的组合等。<组合物>在一个实施方式中,本发明提供一种组合物,其含有(i)所述阳离子性脂质、(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质及(iii)核酸。本实施方式的组合物能够实现将核酸高效率地释放到细胞质中。本实施方式的组合物也可为包含所述脂质复合物、药学上所容许的介质、及根据需要的其他添加剂的组合物。关于药学上所容许的介质、其他添加剂,在下文进行说明。本实施方式的组合物中,以组合物所含有的全部脂质为基准,含有例如10~100摩尔%、例如20~90摩尔%、例如40~70摩尔%的所述阳离子性脂质。阳离子性脂质可单独使用1种,或者将2种以上混合使用。作为核酸,可列举与所述相同的核酸。本实施方式的组合物含有例如0.01~50重量%、例如0.1~30重量%、例如1~10重量%的核酸。本实施方式的组合物含有(i)所述阳离子性脂质和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质作为脂质成分。作为中性脂质,可列举与所述相同的中性脂质。本实施方式的组合物中,以组合物所含有的全部脂质为基准,也可含有例如0~50摩尔%、例如0~40摩尔%、例如0~30摩尔%的中性脂质。作为聚乙二醇修饰脂质,可列举与所述相同的聚乙二醇修饰脂质。本实施方式的组合物中,以组合物所含有的全部脂质为基准,也可含有例如0~30摩尔%、例如0~20摩尔%、例如0~10摩尔%的聚乙二醇修饰脂质。作为固醇,可列举与所述相同的固醇。本实施方式的组合物中,以组合物所含有的全部脂质为基准,也可含有例如0~90摩尔%、例如10~80摩尔%、例如20~50摩尔%的固醇。本实施方式的组合物中的脂质成分的组合没有特别限定,例如可列举:所述的阳离子性脂质、中性脂质及固醇的组合,所述的阳离子性脂质、中性脂质、聚乙二醇修饰脂质及固醇的组合等。本实施方式的组合物中,除了所述成分以外,作为其他添加剂,也可含有:蔗糖、葡萄糖、山梨糖醇、乳糖等糖;谷氨酰胺、谷氨酸、谷氨酸钠、组氨酸等氨基酸;柠檬酸、磷酸、醋酸、乳酸、碳酸、酒石酸等酸的盐等。本实施方式的组合物也可制剂化为医药组合物。作为医药组合物的剂型,例如可列举注射剂。本实施方式的组合物例如可为通过冷冻干燥等而去除了溶剂的粉末状态,也可为液体状态。在组合物为粉末状态的情况下,可在使用前悬浊或溶解到药学上所容许的介质中制成注射剂而使用。在组合物为液体状态的情况下,可直接使用或者悬浊或溶解到药学上所容许的介质中制成注射剂而使用。作为药学上所容许的介质,可列举:无菌水;生理盐水;含有葡萄糖、d-山梨糖醇、d-甘露糖、d-甘露糖醇、氯化钠等辅助药的等渗液等。本实施方式的组合物还可含有乙醇、丙二醇、聚乙二醇等醇等溶解辅助剂,稳定剂、抗氧化剂、防腐剂等添加剂。对患者投予组合物例如可通过动脉内注射、静脉内注射、皮下注射等而进行。组合物的投予量根据投予对象、对象脏器、症状、投予方法而异。本实施方式的组合物是形成由含有阳离子性脂质的脂质所构成的微粒子内封入了核酸的脂质复合物。脂质复合物的“平均粒径”可通过体积平均、数量平均、z-平均的任一种方法算出。在本实施方式的组合物中,脂质复合物的平均粒径(z-平均)可为例如10~1000nm、例如30~500nm、例如30~200nm。关于本实施方式的组合物,就抑制非特异性吸附或免疫反应的观点而言,例如优选在血液中等ph值约7.4的环境下表面几乎无电荷。另外,就因内吞作用而被吞入到细胞内时提高内吞体膜的融合效率的观点而言,优选在低ph值环境下带正电。<组合物的制造方法>在一个实施方式中,本发明提供一种组合物的制造方法,其包括步骤(a)及步骤(b),步骤(a)是将含有(i)所述阳离子性脂质和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质的含极性有机溶剂的水溶液、与含有(iii)核酸的水溶液加以混合而获得混合液,步骤(b)是使混合液中的极性有机溶剂的含量减少。根据本实施方式的制造方法,可制造能够将核酸高效率地释放到细胞质中的组合物。通过水溶性核酸和所述阳离子性脂质的静电相互作用、及脂质间的疏水相互作用,可形成由脂质构成的微粒子内封入了核酸的脂质复合物。例如,通过改变含有(i)所述阳离子性脂质和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质的脂质成分在含极性有机溶剂的水溶液中的溶解度,可形成脂质复合物。作为极性有机溶剂,可列举乙醇等醇。首先,在步骤(a)中,将溶解了(i)所述阳离子性脂质和(ii)选自由中性脂质、聚乙二醇修饰脂质及固醇所组成的族群中的至少一种脂质的含极性有机溶剂的水溶液、与含有(iii)核酸的水溶液加以混合而获得混合液。含极性有机溶剂的水溶液中的极性有机溶剂的浓度只要在与核酸的水溶液混合后仍然满足溶解脂质分子的条件,则没有特别限定。接着,在步骤(b)中,通过向所述混合液中添加水等,而使极性有机溶剂的含量减少。由此,可形成脂质复合物。为了高效率地形成脂质复合物,优选使极性有机溶剂的含量急剧降低。根据本实施方式的组合物的制造方法,可获得核酸被高效率地封入到微粒子内部的脂质复合物。在封入到组合物中的核酸为核酸医药的情况下,可将组合物作为医药组合物而使用。实施例以下,列举实施例更详细地说明本发明,但本发明并不限定于这些实施例。另外,实施例中的化合物名是使用软件(商品名“chemdrawultraver.12.0”、珀金埃尔默(perkinelmer)公司制造)进行命名。实施例中所使用的简称是本领域技术人员公知的惯用简称。以下披露若干简称。dmf:n,n-二甲基甲酰胺tfa:三氟醋酸wsc:1-乙基-3-(3-二甲基氨基丙基)碳二酰亚胺盐酸盐dmap:n,n-二甲基-4-氨基吡啶thf:四氢呋喃lc-ms:液相色谱法-质谱联用(liquidchromatography-massspectrometry)esi-ms:电喷雾电离质谱法(electrosprayionizationmassspectrometry)质子核磁共振波谱的化学位移是以相对于四甲基硅烷的δ单位(ppm)进行记录。图案的简称如下。s:单峰、d:二重峰、t:三重峰、q:四重峰、dd:双二重峰、ddd:双双二重峰、dt:双三重峰、tt:三重三重峰、m:多重峰。<阳离子性脂质的合成>[实施例1](1-甲基哌啶-4-羧酸1-((2-己基环丙基)甲氧基)-1-氧代十九烷-10-基酯(以下,有时称为“ys-102”)的合成)以下披露ys-102的合成流程。[化23](第1步骤:水解)将在乙醇(868ml)中溶解有癸二酸二甲酯(200g、868.4mmol)的溶液冷却到0℃。向该溶液中滴加氢氧化钾(48.73g、868.4mmol)的乙醇(300ml)溶液,滴加后在0℃下搅拌12小时。反应完毕后,添加醋酸乙酯和水,通过将未反应物萃取到有机层中而去除。利用盐酸使水层成为酸性,添加醋酸乙酯而萃取目标物。利用水、食盐水将有机层洗净,并进行浓缩。对于第1步骤品单酯体(150.3g、652.6mmol、75%),不进行纯化而用于下一步骤。(第2步骤:酰氯化)向第1步骤品单酯体(50.0g、231.2mmol)与催化剂量的dmf(23ml)的悬浊液中滴加亚硫酰氯(41.3g、346.8mmol)。反应完毕后,在减压下将亚硫酰氯蒸馏去除后,进行蒸馏纯化,而获得第2步骤品(25.8g、109.9mmol、48%)。(第3步骤:与格氏试剂的反应)使氯化锌(2.7g、20.1mmol)溶解到thf(61ml)中,并冷却到-78℃。向该溶液中在氮气环境下且在-78℃下滴加1m的溴化壬基镁(40.2ml、40.2mmol)。滴加后,升温到0℃,在0℃下搅拌30分钟后,投入四(三苯基膦)钯(0.58mg、0.5mmol),接着滴加第2步骤品(5.0g、20.1mmol)。在0℃下进一步搅拌1小时后,加入1m盐酸水溶液进行淬灭。从反应溶液中过滤分离析出物,利用醋酸乙酯对滤液进行萃取,利用水、食盐水将有机层洗净后,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第3步骤品(5.0g、14.7mmol、73%)。(第4步骤:酯交换)一边对第3步骤品(2.0g、5.9mmol)、2-壬烯醇(4.2g、29.4mmol)、四丙醇钛(0.2g、0.6mmol)的混合液进行搅拌,一边将外浴升温到110℃。一边去除所产生的馏出液一边继续搅拌,将不再见到馏出的时刻设为反应终点,在冷却后添加水进行淬灭。利用醋酸乙酯对反应液进行萃取,并利用水、食盐水进行洗净后,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第4步骤品(2.6g、5.8mmol、99%)。(第5步骤:环丙烷化)使二乙基锌(8.3ml、8.3mmol)溶解到二氯甲烷(15ml)中,并冷却到0℃。向其中滴加三氟甲磺酸(0.9g、8.3mmol),接着滴加二碘甲烷(2.2g、8.3mmol)后,在0℃下搅拌1小时。向该溶液中滴加第4步骤品(1.2g、2.8mmol)的二氯甲烷(5ml)溶液,并升温到室温。通过tlc(thinlayerchromatography,薄层色谱法)确认反应,将原料消失设为终点,利用水进行淬灭。将所析出的固体过滤分离,利用醋酸乙酯对滤液进行萃取,利用水、食盐水进行洗净后,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第4步骤品(1.2g、2.7mmol、99%)。(第6步骤:还原)向在乙醇(22ml)中溶解了第5步骤品(1.0g、2.2mmol)的溶液中,添加硼氢化钠(0.08g、2.2mmol)使之反应10分钟。反应完毕后,利用1n盐酸进行淬灭。利用醋酸乙酯进行萃取,并利用水、食盐水进行洗净后,将有机层在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第6步骤品(0.3g、0.7mmol、30%)。(第7步骤:缩合)向在二氯甲烷(7ml)中溶解了第6步骤品(0.8g、1.8mmol)的溶液中,添加wsc(0.7g、3.7mmol)、二甲基氨基吡啶(0.04g、0.4mmol)、1-甲基哌啶-4-羧酸(0.5g、3.7mmol)。在室温下搅拌到次日后,添加水,使有机层分液。将有机层利用水洗净5次后,利用1n氢氧化钠水溶液洗净1次,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得下述式(15)所表示的ys-102(0.12g、0.2mmol、12%)。[化24]在以下条件下利用hplc-lc/ms(highperformanceliquidchromatography-liquidchromatography/massspectrometry,高效液相色谱-质谱联用)对所获得的化合物进行确认。色谱柱:ymc-triartc18、150-4.6mm、5μm、洗提液:meoh(均匀溶剂)、流速:1.0ml/分钟、运行时间:15分钟、柱温:45℃、检测:uv(215nm)、电喷雾电离质谱(esi-ms)。hplc-lc/ms、rt6.24分钟、esi-ms(m+h)计算值577.5、测量值578.6、1hnmr(400mhz、cdcl3)δ4.87(1h,q)、2.82(2h,d)、2.27(4h,m)、2.04(1h,m)、1.91(1h,m)、1.82(2h,m)、1.61(2h,m)、1.50(4h,m)、1.36(5h,m)、1.25(24h,m)、0.88(6h,m)[实施例2](1-甲基哌啶-4-羧酸(z)-1-(壬-2-烯-1-基氧基)-1-氧代十九烷-10-基酯(以下,有时称为“ys-101”)的合成)除了不进行第5步骤的方面以外,和实施例1同样地合成下述式(16)所表示的ys-101。[化25]hplc-lc/ms、rt5.51分钟、esi-ms(m+h)计算值563.5、测量值564.5、1hnmr(400mhz、cdcl3)δ5.32(2h,m)、4.87(1h,q)、4.11(1h,dd)、4.05(2h,t)、2.82(2h,d)、2.27(7h,m)、2.04(8h,m)、1.89(2h,m)、1.79(2h,m)、1.61(4h,m)、1.49(4h,m)、1.36(5h,m)、1.25(30h,m)、0.95(3h,m)、0.88(3h,m)[实施例3](1-甲基哌啶-4-羧酸1-氧代-1-(十一烷-5-基氧基)十九烷-10-基酯(以下,有时称为“ys-103”)的合成)在第4步骤中,使用2-丁基辛烷-1-醇代替2-壬烯醇进行反应,且不进行第5步骤,除此以外,和实施例1同样地合成下述式(2)所表示的ys-103。[化26]hplc-lc/ms、rt7.52分钟、esi-ms(m+h)计算值593.5、测量值594.6、1hnmr(400mhz、cdcl3)δ4.86(1h,q)、4.06(2h,t)、2.82(2h,d)、2.27(7h,m)、1.99(2h,m)、1.88(2h,m)、1.79(2h,m)、1.60(4h,m)、1.49(4h,m)、1.38(7h,m)、1.25(30h,m)、0.97(3h,m)、0.88(3h,m)、0.64(2h,m)、0.59(1h,m)、-0.33(1h,dd)[实施例4](1-甲基哌啶-4-羧酸1-((2-丁基辛基)氧基)-1-氧代十九烷-10-基酯(以下,有时称为“ys-119”)的合成)以下披露ys-119的合成流程。[化27](第1步骤到第3步骤)第1步骤到第3步骤是和所述ys-102的合成同样地进行。(第4步骤:酯交换)一边对第3步骤品(4.1g、12.0mmol)、2-丁基辛烷-1-醇(6.73g、36.12mmol)、四丙醇钛(0.34g、1.2mmol)的混合液进行搅拌,一边将外浴升温到110℃。一边去除所产生的馏出液一边继续搅拌,将不再见到馏出的时刻设为反应终点,在冷却后添加水进行淬灭。利用醋酸乙酯对反应液进行萃取,利用水、食盐水进行洗净后,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第4步骤品(4.5g、9.4mmol、78%)。(第5步骤:还原)向在thf(18.7ml)、甲醇(18.7ml)中溶解了第4步骤品(4.5g、9.4mmol)的溶液中,添加硼氢化钠(1.8g、46.8mmol),使之反应一小时。反应完毕后,利用1n盐酸进行淬灭。利用醋酸乙酯进行萃取,利用水、食盐水进行洗净后,将有机层在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第5步骤品(3.1g、6.42mmol、69%)。(第6步骤:缩合)向在二氯甲烷(8.28ml)中溶解了第5步骤品(2.0g、4.14mmol)的溶液中,添加wsc(1.59g、8.28mmol)、二甲基氨基吡啶(0.04g、0.4mmol)、1-甲基哌啶-4-羧酸(1.19g、8.28mmol)。在室温下搅拌到次日后,添加水,使有机层分液。将有机层利用水洗净5次后,利用1n氢氧化钠水溶液洗净1次,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得式(1)所表示的ys-119(1.9g、3.1mmol、74%)。[化28]hplc-lc/ms、rt8.01分钟、esi-ms(m+h)计算值607.6、测量值608.6、1hnmr(400mhz、cdcl3)δ4.87(1h,q)、3.96(2h,d)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.61(4h,m)、1.49(4h,m)、1.20(46h,m)、0.86(9h,m)[实施例5](1-甲基哌啶4-羧酸1-氧代-1-(十一烷-5-基氧基)十五烷-6-基酯(以下,有时称为“ys-111”)的合成)在第1步骤中,使用己二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用十一烷-5-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(17)所表示的ys-111。[化29]hplc-lc/ms、rt5.35分钟、esi-ms(m+h)计算值537.5、测量值538.5、1hnmr(400mhz、cdcl3)δ4.87(2h,q)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.50(10h,m)、1.24(28h,m)、0.87(9h,m)[实施例6](1-甲基哌啶4-羧酸1-氧代-1-(十一烷-5-基氧基)十七烷-8-基酯(以下,有时称为“ys-112”)的合成)在第1步骤中,使用辛二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用十一烷-5-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(4)所表示的ys-112。[化30]hplc-lc/ms、rt6.05分钟、esi-ms(m+h)计算值565.5、测量值566.5、1hnmr(400mhz、cdcl3)δ4.87(2h,q)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.50(10h,m)、1.24(32h,m)、0.87(9h,m)[实施例7](1-甲基哌啶4-羧酸21-氧代-21-(十一烷-5-基氧基)二十一烷-10-基酯(以下,有时称为“ys-113”)的合成)在第1步骤中,使用十二烷二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用十一烷-5-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(5)所表示的ys-113。[化31]hplc-lc/ms、rt8.95分钟、esi-ms(m+h)计算值621.6、测量值622.6、1hnmr(400mhz、cdcl3)δ4.87(2h,q)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.50(10h,m)、1.24(40h,m)、0.87(9h,m)[实施例8](1-甲基哌啶4-羧酸23-氧代-23-(十一烷-5-基氧基)二十三烷-10-基酯(以下,有时称为“ys-114”)的合成)在第1步骤中,使用十四烷二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用十一烷-5-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(18)所表示的ys-114。[化32]hplc-lc/ms、rt11.1分钟、esi-ms(m+h)计算值649.6、测量值650.6、1hnmr(400mhz、cdcl3)δ4.87(2h,q)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.50(10h,m)、1.24(44h,m)、0.87(9h,m)[实施例9](1-甲基哌啶-4-羧酸1-((2-丁基辛基)氧基)-1-氧代十七烷-8-基酯(以下,有时称为“ys-115”)的合成)在第1步骤中,使用辛二酸二甲酯代替癸二酸二甲酯进行反应,除此以外,和实施例4同样地合成下述式(19)所表示的ys-115。[化33]hplc-lc/ms、rt6.72分钟、esi-ms(m+h)计算值579.5、测量值580.7、1hnmr(400mhz、cdcl3)δ4.87(2h,q)、3.96(2h,d)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.50(10h,m)、1.24(32h,m)、0.87(9h,m)[实施例10](1-甲基哌啶-4-羧酸21-((2-丁基辛基)氧基)-21-氧代二十一烷-10-基酯(以下,有时称为“ys-116”)的合成)在第1步骤中,使用辛二酸二甲酯代替癸二酸二甲酯进行进行反应,除此以外,和实施例4同样地合成下述式(20)所表示的ys-116。[化34]hplc-lc/ms、rt10.0分钟、esi-ms(m+h)计算值635.6、测量值636.7、1hnmr(400mhz、cdcl3)δ4.87(2h,q)、3.96(2h,d)、2.81(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.50(10h,m)、1.24(40h,m)、0.87(9h,m)[实施例11](1-甲基哌啶-4-羧酸1-(辛烷-3-基氧基)-1-氧代十七烷-8-基酯(以下,有时称为“ys-117”)的合成)在第1步骤中,使用辛二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用辛烷-3-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(21)所表示的ys-117。[化35]hplc-lc/ms、rt4.71分钟、esi-ms(m+h)计算值523.5、测量值524.6、1hnmr(400mhz、cdcl3)δ4.87(1h,q)、4.80(1h,q)、2.82(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.29(10h,m)、1.24(26h,m)、0.87(9h,m)[实施例12](1-甲基哌啶-4-羧酸1-((s)辛烷-3-基氧基)-1-氧代十七烷-8-基酯(以下,有时称为“ys-117s”)的合成)在第1步骤中,使用辛二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用(s)-辛烷-3-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(22)所表示的ys-117s。[化36]hplc-lc/ms、rt4.70分钟、esi-ms(m+h)计算值523.5、测量值524.6、1hnmr(400mhz、cdcl3)δ4.87(1h,q)、4.80(1h,q)、2.82(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.29(10h,m)、1.24(26h,m)、0.86(9h,m)[实施例13](1-甲基哌啶-4-羧酸21-(辛烷-3-基氧基)-21-氧代二十一烷-10-基酯(以下,有时称为“ys-118”)的合成)在第1步骤中,使用十二烷二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用辛烷-3-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(3)所表示的ys-118。[化37]hplc-lc/ms、rt6.55分钟、esi-ms(m+h)计算值579.5、测量值580.6、1hnmr(400mhz、cdcl3)δ4.87(1h,q)、4.80(1h,q)、2.82(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.29(10h,m)、1.24(30h,m)、0.86(9h,m)[实施例14](1-甲基哌啶-4-羧酸21-((s)-辛烷-3-基氧基)-21-氧代二十一烷-10-基酯(以下,有时称为“ys-118s”)的合成)在第1步骤中,使用十二烷二酸二甲酯代替癸二酸二甲酯进行反应,在第4步骤中,使用(s)-辛烷-3-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例4同样地合成下述式(23)所表示的ys-118s。[化38]hplc-lc/ms、rt6.54分钟、esi-ms(m+h)计算值579.5、测量值580.6、1hnmr(400mhz、cdcl3)δ4.87(1h,q)、4.80(1h,q)、2.82(2h,d)、2.27(6h,m)、1.98(2h,m)、1.91(2h,m)、1.82(2h,m)、1.62-1.29(10h,m)、1.24(30h,m)、0.86(9h,m)[实施例15](1-甲基哌啶-4-羧酸1-((2-丁基辛基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-120”)的合成)在第3步骤中,使用溴化癸基镁代替溴化壬基镁进行反应,除此以外,和实施例4同样地合成下述式(6)所表示的ys-120。[化39]hplc-lc/ms、rt8.70分钟、esi-ms(m+h)计算值621.6、测量值622.7、1hnmr(400mhz,cdcl3)δ4.86(1h,ddd)、3.96(2h,d)、2.81(2h,d)、2.27(6h,m)、2.03(2h,m)、1.98(1h,d)、1.90(1h,m)、1.78(4h,m)、1.61(4h,m)、1.49(4h,m)、1.27-1.21(41h,m)、0.87(9h,m)如下所述,如果利用所述式(6)所表示的化合物形成脂质复合物,则在保管一定时间的情况下的脂质复合物的粒径增大得到抑制,而稳定性高。[实施例16](1-甲基哌啶-4-羧酸1-((2-丁基辛基)氧基)-1-氧代二十烷-10-基酯(“ys-120”)的合成)以下披露ys-120的另一合成流程。[化40](第1步骤到第3步骤)第1步骤到第3步骤是和所述ys-102的合成同样地进行。(第4步骤:酯交换)一边对第3步骤品(150.0g、440.5mmol)、苄醇(142.9g、1321.4mmol)、四丙醇钛(12.5g、44.5mmol)的混合液进行搅拌,一边将外浴升温到130℃。一边去除所产生的馏出液一边继续搅拌,将不再见到馏出的时刻设为反应终点,在冷却后添加水进行淬灭。利用醋酸乙酯对反应液进行萃取,利用水、食盐水进行洗净后,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第4步骤品(146.2g、350.9mmol)。(第5步骤:还原)向在thf(480.0ml)、甲醇(480.0ml)中溶解了第4步骤品(100.0g、240.0mmol)的溶液中,添加硼氢化钠(10.9g、288.0mmol),使之反应10分钟。反应完毕后,利用1n盐酸进行淬灭。利用醋酸乙酯进行萃取,利用水、食盐水进行洗净后,将有机层在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第5步骤品(70.0g、167.2mmol)。(第6步骤:缩合)向在thf(480.0ml)中溶解了第5步骤品(50.0g、119.4mmol)的溶液中,添加wsc(45.8g、238.9mmol)、二甲基氨基吡啶(2.92g、23.9mmol)、1-甲基哌啶-4-羧酸(34.2g、238.9mmol)。在室温下搅拌到次日后,添加水,使有机层分液。将有机层利用水洗净5次后,利用1n氢氧化钠水溶液洗净1次,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得第6步骤品(37.2g、68.4mmol)。(第7步骤:接触还原)使第6步骤品(37.2g、68.4mmol)、钯/碳(4.9ml)悬浊在醋酸乙酯(136.8ml)中,并在氢气环境下搅拌一晚。将反应液过滤分离,去除钯/碳进行浓缩。通过硅胶色谱法进行纯化,而获得第7步骤品(26.8g、59.1mmol)。(第8步骤:缩合)向在二氯甲烷(220.0ml)中溶解了第7步骤品(20.0g、44.1mmol)的溶液中,添加wsc(8.9g、46.3mmol)、二甲基氨基吡啶(1.08g、0.4mmol)、2-丁基辛烷-1-醇(16.4g、88.2mmol)。在室温下搅拌到次日后,添加水,使有机层分液。将有机层利用水洗净5次后,利用无水硫酸镁进行干燥。通过过滤而去除干燥剂,将滤液在减压下加以浓缩。通过硅胶柱色谱法进行纯化,而获得式(6)所表示的ys-120(22.0g、35.4mmol)。[实施例17](1-甲基哌啶-4-羧酸1-((2z,5z)-癸-2,5-二烯-1-基氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-121”)的合成)在第8步骤中,使用(2z,5z)-癸-2,5-二烯-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(24)所表示的ys-121。[化41]esi-ms(m+h)计算值589.5、测量值590.7、1hnmr(400mhz,cdcl3)δ5.60(1h,m)、5.36(1h,m)、4.87(1h,tt)、4.64(1h,d)、2.86(2h,m)、2.36(3h,s)2.32(2h,t)、2.22(1h,m)、2.02(2h,m)、1.97(2h,m)、1.61(2h,m)、1.50(3h,m)、1.27(40h,m)、0.88(6h,m)[实施例18](1-甲基哌啶-4-羧酸(z)-1-((2-丁基壬-3-烯-1-基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-122”)的合成)在第8步骤中,使用(z)-2-丁基壬-3-烯-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(25)所表示的ys-122。[化42]esi-ms(m+h)计算值633.6、测量值634.7、1hnmr(400mhz,cdcl3)δ5.60(1h,m)、5.36(1h,m)、4.87(1h,tt)、4.64(1h,d)、2.86(2h,m)、2.36(3h,s)、2.32(2h,t)、2.22(1h,m)、2.02(2h,m)、1.97(2h,m)、1.61(2h,m)、1.50(3h,m)、1.27(48h,m)、0.88(6h,m)如下所述,如果利用所述式(25)所表示的化合物形成脂质复合物,则在保管一定时间的情况下的脂质复合物的粒径增大得到抑制,而稳定性高。[实施例19](1-甲基哌啶-4-羧酸(z)-1-氧代-1-((5-丙基壬-2-烯-1-基)氧基)二十烷-10-基酯(以下,有时称为“ys-123”)的合成)在第8步骤中,使用(z)-5-丙基壬-2-烯-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(26)所表示的ys-123。[化43]esi-ms(m+h)计算值619.6、测量值620.7、1hnmr(400mhz,cdcl3)δ5.60(2h,m)、4.87(1h,tt)、4.61(2h,d)、2.93(2h,d)、2.42(3h,s)、2.31(2h,t)、2.29(2h,t)、2.05(4h,t)、1.93(2h,m)、1.61(2h,m)、1.50(4h,m)、1.27(43h,m)、0.88(6h,m)如下所述,如果利用所述式(26)所表示的化合物形成脂质复合物,则在保管一定时间的情况下的脂质复合物的粒径增大得到抑制,而稳定性高。[实施例20](1-甲基哌啶-4-羧酸1-氧代-1-((3-戊基辛基)氧基)二十烷-10-基酯(以下,有时称为“ys-124”)的合成)在第8步骤中,使用3-戊基辛烷-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(27)所表示的ys-124。[化44]esi-ms(m+h)计算值635.6、测量值636.7、1hnmr(400mhz,cdcl3)δ4.87(1h,tt)、4.06(2h,m)、2.81(2h,d)、2.27(6h,m)、2.02(2h,m)、1.97(2h,m)、1.77(4h,m)、1.61(2h,m)、1.50(3h,m)、1.43(1h,m)、1.27(43h,m)、0.88(9h,m)如下所述,如果利用所述式(27)所表示的化合物形成脂质复合物,则在保管一定时间的情况下的脂质复合物的粒径增大得到抑制,而稳定性高。[实施例21](1-甲基哌啶-4-羧酸1-((2,4-二丙基庚基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-125”)的合成)在第8步骤中,使用2,4-二丙基庚烷-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(28)所表示的ys-125。[化45]esi-ms(m+h)计算值635.6、测量值636.7、1hnmr(400mhz,cdcl3)δ4.87(1h,tt)、3.95(1h,d)、3.55(2h,t)、2.96(2h,m)、2.45(3h,s)、2.32(2h,t)、2.22(1h,m)、2.02(2h,m)、1.97(2h,m)、1.61(2h,m)、1.50(3h,m)、1.27(49h,m)、0.88(12h,m)如下所述,如果利用所述式(28)所表示的化合物形成脂质复合物,则在保管一定时间的情况下的脂质复合物的粒径增大得到抑制,而稳定性高。[实施例22](1-甲基哌啶-4-羧酸1-((3,4-二丙基庚基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-126”)的合成)在第8步骤中,使用3,4-二丙基庚烷-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(29)所表示的ys-126。[化46]esi-ms(m+h)计算值635.6、测量值636.7、1hnmr(400mhz,cdcl3)δ4.87(1h,tt)、4.06(2h,m)、3.00(2h,m)、2.45(5h,m)、2.27(2h,t)、2.02(2h,m)、1.97(2h,m)、1.61(2h,m)、1.50(3h,m)、1.43(2h,m)、1.27(42h,m)、0.88(12h,m)如下所述,如果利用所述式(29)所表示的化合物形成脂质复合物,则在保管一定时间的情况下的脂质复合物的粒径增大得到抑制,而稳定性高。[实施例23](1-甲基哌啶-4-羧酸1-(4-(己基双硫基)-3-((己基双硫基)甲基)丁氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-127”)的合成)在第8步骤中,使用4-(己基双硫基)-3-((己基双硫基)甲基)丁烷-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(30)所表示的ys-127。[化47]esi-ms(m+h)计算值819.5、测量值820.6、1hnmr(400mhz,cdcl3)δ4.86(1h,tt)、4.13(2h,t)、2.81(6h,d)、2.67(2h,t)、2.29(3h,t)、2.27(3h,s)、1.99(2h,m)、1.90(2h,dd)、1.79(2h,dt)、1.68(12h,m)、1.50(6h,m)、1.42(6h,m)、1.24(29h,m)、0.88(9h,m)[实施例24](1-甲基哌啶-4-羧酸1-((6-(丁基双硫基)-3-(3-(丁基双硫基)丙基)己基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-128”)的合成)在第8步骤中,使用6-(丁基双硫基)-3-(3-(丁基双硫基)丙基)己烷-1-醇代替2-丁基辛烷-1-醇进行反应,除此以外,和实施例16同样地合成下述式(31)所表示的ys-128。[化48]esi-ms(m+h)计算值819.5、测量值821.0、1hnmr(400mhz,cdcl3)δ4.86(1h,tt)、4.08(2h,t)、2.81(2h,d)、2.67(8h,dd)、2.29(3h,t)、2.27(3h,s)、1.99(2h,m)、1.90(2h,dd)、1.79(2h,dt)、1.68(12h,m)、1.50(6h,m)、1.42(6h,m)、1.24(37h,m)、0.92-0.88(9h,m)[实施例25](1-甲基吡咯烷-3-羧酸1-((2-丁基辛基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-129”)的合成)在第6步骤中,使用1-甲基吡咯烷-3-羧酸代替1-甲基哌啶-4-羧酸进行反应,除此以外,和实施例16同样地合成下述式(32)所表示的ys-129。[化49]esi-ms(m+h)计算值607.6、测量值608.8、1hnmr(400mhz,cdcl3)δ4.86(1h,tt)、3.98(2h,d)、3.05(1h,tt)、2.86(1h,tt)、2.67(2h,m)、2.49(1h,tt)、2.35(3h,s)、2.29(2h,t)、2.17(2h,m)、1.72(2h,s)、1.60(3h,m)、1.50(4h,m)、1.24(44h,m)、0.92-0.88(9h,m)[实施例26](1-甲基吖丁啶-3-羧酸1-((2-丁基辛基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-131”)的合成)在第6步骤中,使用1-甲基吖丁啶-3-羧酸代替1-甲基哌啶-4-羧酸进行反应,除此以外,和实施例16同样地合成下述式(33)所表示的ys-131。[化50]esi-ms(m+h)计算值593.4、测量值594.7、1hnmr(400mhz,cdcl3)δ4.87(1h,tt)、3.96(2h,d)、3.57(2h,d)、3.25(2h,d)、3.23(1h,tt)、2.32(3h,s)、2.29(2h,t)、2.03(2h,m)、1.61(4h,m)、1.49(4h,m)、1.27-1.21(41h,m)、0.87(9h,m)[实施例27](1-乙基哌啶-4-羧酸1-((2-丁基辛基)氧基)-1-氧代二十烷-10-基酯(以下,有时称为“ys-132”)的合成)在第6步骤中,使用1-乙基哌啶-4-羧酸代替1-甲基哌啶-4-羧酸进行反应,除此以外,和实施例16同样地合成下述式(34)所表示的ys-132。[化51]esi-ms(m+h)计算值636.0、测量值636.7、1hnmr(400mhz,cdcl3)δ4.87(1h,ddd)、3.96(2h,d)、2.91(2h,d)、2.40(2h,dd)、2.29(4h,m)、2.03-1.93(4h,m)、1.80(2h,m)、1.61(4h,m)、1.49(4h,m)、1.27-1.21(41h,m)、1.08(4h,t)、0.87(9h,m)[实施例28](10-((4-(二甲基氨基)丁酰基)氧基)二十烷酸2-丁基辛酯(以下,有时称为“ys-133”)的合成)在第6步骤中,使用4-(二甲基氨基)丁酸代替1-甲基哌啶-4-羧酸进行反应,除此以外,和实施例16同样地合成下述式(35)所表示的ys-133。[化52]esi-ms(m+h)计算值609.6、测量值610.7、1hnmr(400mhz,cdcl3)δ4.86(1h,tt)、3.96(2h,d)、2.33-2.26(6h,m)、2.21(6h,s)、2.03(2h,m)、1.80(2h,m)、1.61(4h,m)、1.49(4h,m)、1.27-1.21(41h,m)、0.87(9h,m)<组合物的制备(1)>[实施例29](ys-102)使用实施例1的阳离子性脂质(ys-102)而制备组合物。作为核酸,使用包含有义链5′-ggafufcafufcfufcaagfufcfufuafct*t-3′(序列编号1、t:dna、fu,fc=2′-氟代rna、*=硫代磷酸酯连结子)、反义链5′-gfuaagafcfufugagafugafufcfct*t-3′(序列编号2、t:dna、fu,fc=2′-氟代rna、*=硫代磷酸酯连结子)的碱基序列的抑制factorvii(凝血因子7)基因的表达的sirna,且该sirna经过退火(genedesign股份有限公司、以下有时称为“factorviisirna”)。将factorviisirna在25mm醋酸钠(ph值4.0)中溶解为216μg/ml,而制成sirna稀释液。另外,将阳离子性脂质(ys-102)、dspc(日本精化股份有限公司)、胆固醇(日本精化股份有限公司)、mpeg2000-dmg(日油股份有限公司)以60/8.5/30/1.5(摩尔比)的比例且以总脂质浓度为15mm的方式溶解到乙醇中,而制成脂质溶液。将sirna稀释液与脂质溶液分别以2.4ml/分钟、1.29ml/分钟的流速进行混合,进而将25mm醋酸钠(ph值4.0)以9.25ml/分钟的流速进行混合,由此获得脂质复合物水溶液。将所获得的脂质复合物水溶液供于使用透析膜(商品名“float-a-lyzerg2”、美国斯百全(spectrum)公司、50kmwco)的透析,将外液换成磷酸缓冲液(pbs、ph值7.5)。透析后,进行浓缩及过滤灭菌,而获得实施例29的组合物。[实施例30](ys-101)使用实施例2的阳离子性脂质(ys-101)代替ys-102作为阳离子性脂质,除此以外,和实施例29同样地获得实施例30的组合物。[实施例31](ys-103)使用实施例3的阳离子性脂质(ys-103)代替ys-102作为阳离子性脂质,除此以外,和实施例29同样地获得实施例31的组合物。[参考例1](ys-021)使用下述式(36)所表示的1-甲基哌啶-4-羧酸1-(2-辛基环丙基)十七烷-8-基酯(以下,有时称为“ys-021”)代替ys-102作为阳离子性脂质,除此以外,和实施例29同样地获得参考例1的组合物。[化53]<组合物的分析(1)>针对实施例29~31及参考例1的组合物,测定sirna向脂质复合物中的封入率。具体而言,利用无rna酶水(rnasefreewater)稀释组合物,使用quant-itribogreenrna试剂(美国英杰(invitrogen)公司)进行测定,将所测得的sirna浓度(a)设为脂质复合物外液中所存在的sirna。另外,将组合物利用1%tritonx-100进行稀释并测定,将所测得的sirna浓度(b)设为组合物中的总sirna浓度。接着,根据下式(f1)算出核酸的封入率。封入率(%)=100-(a/b)×100(f1)另外,利用粒径测定装置(商品名“zetasizernanozs”、英国马尔文(malvern)公司制造)测定脂质复合物的平均粒径。表1中表示sirna的封入率及脂质复合物的平均粒径(z-平均)。[表1]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例29ys-1029874实施例30ys-101>9979实施例31ys-1039868参考例1ys-021>9965<组合物的制备(2)>[实施例32](ys-111)使用实施例5的阳离子性脂质(ys-111)而制备组合物。作为核酸,使用和实施例29的组合物所使用者相同的factorviisirna。将factorviisirna利用25mm醋酸钠(ph值4.0)溶解为181μg/ml,而制成sirna稀释液。另外,将阳离子性脂质(ys-111)、dspc(日本精化股份有限公司)、胆固醇(日本精化股份有限公司)、mpeg2000-dmg(日油股份有限公司)以60/8.5/30/1.5(摩尔比)的比例且以总脂质浓度为10mm的方式溶解到乙醇中,而制成脂质溶液。将sirna稀释液与脂质溶液分别以2.4ml/分钟、1.29ml/分钟的流速进行混合,进而将25mm醋酸钠(ph值4.0)以5.0ml/分钟的流速进行混合,由此获得脂质复合物水溶液。将所获得的脂质复合物水溶液供于使用透析膜(商品名“float-a-lyzerg2”、美国斯百全(spectrum)公司、50kmwco)的透析,将外液换成磷酸缓冲液(pbs、ph值7.5)。透析后,进行浓缩及过滤灭菌,而获得实施例32的组合物。[实施例33](ys-112)使用实施例6的阳离子性脂质(ys-112)代替ys-111作为阳离子性脂质,除此以外,和实施例32同样地获得实施例33的组合物。[实施例34](ys-113)使用实施例7的阳离子性脂质(ys-113)代替ys-111作为阳离子性脂质,除此以外,和实施例32同样地获得实施例34的组合物。[实施例35](ys-114)使用实施例8的阳离子性脂质(ys-114)代替ys-111作为阳离子性脂质,除此以外,和实施例32同样地获得实施例35的组合物。[实施例36](ys-115)使用实施例9的阳离子性脂质(ys-115)代替ys-111作为阳离子性脂质,除此以外,和实施例32同样地获得实施例36的组合物。[实施例37](ys-116)使用实施例10的阳离子性脂质(ys-116)代替ys-111作为阳离子性脂质,除此以外,和实施例32同样地获得实施例36的组合物。[比较例1](aln-319)使用专利文献1中记载的下述式(32)所表示的9-((4-(二甲基氨基)丁酰基)氧基)十七烷二酸二((z)-壬-2-烯-1-基)酯(以下,有时称为“aln-319”)代替ys-111作为阳离子性脂质,依据专利文献1中记载的方法进行合成并使用,除此以外,和实施例32同样地获得比较例1的组合物。[化54]<组合物的分析(2)>和实施例29的组合物同样地,针对实施例32~37及比较例1的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径。表2中表示sirna的封入率及脂质复合物的平均粒径(z-平均)。[表2]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例32ys-1119578实施例33ys-1129471实施例34ys-1138870实施例35ys-1148673实施例36ys-1159568实施例37ys-1169172比较例1aln-3199677<组合物的制备(3)>[实施例38](ys-117)使用实施例11的阳离子性脂质(ys-117)而制备组合物。作为核酸,使用和实施例29的组合物所使用者相同的factorviisirna。将factorviisirna利用25mm醋酸钠(ph值4.0)溶解为108μg/ml,而制成sirna稀释液。另外,将阳离子性脂质(ys-111)、dspc(日本精化股份有限公司)、胆固醇(日本精化股份有限公司)、mpeg2000-dmg(日油股份有限公司)以60/8.5/30/1.5(摩尔比)的比例且以总脂质浓度为6mm的方式溶解到乙醇中,而制成脂质溶液。将sirna稀释液与脂质溶液分别以2.4ml/分钟、1.29ml/分钟的流速进行混合,进而将25mm醋酸钠(ph值4.0)以9.25ml/分钟的流速进行混合,由此获得脂质复合物水溶液。将所获得的脂质复合物水溶液供于使用透析膜(商品名“float-a-lyzerg2”、美国斯百全(spectrum)公司、50kmwco)的透析,将外液换成磷酸缓冲液(pbs、ph值7.5)。透析后,进行浓缩及过滤灭菌,而获得实施例38的组合物。[实施例39](ys-117s)使用实施例12的阳离子性脂质(ys-117s)代替ys-117作为阳离子性脂质,除此以外,和实施例38同样地获得实施例39的组合物。[实施例40](ys-118)使用实施例13的阳离子性脂质(ys-118)代替ys-117作为阳离子性脂质,除此以外,和实施例38同样地获得实施例40的组合物。[实施例41](ys-118s)使用实施例14的阳离子性脂质(ys-118s)代替ys-117作为阳离子性脂质,除此以外,和实施例38同样地获得实施例41的组合物。[实施例42](ys-119)使用实施例4的阳离子性脂质(ys-119)代替ys-117作为阳离子性脂质,除此以外,和实施例38同样地获得实施例42的组合物。<组合物的分析(3)>和实施例29的组合物同样地,针对实施例38~42的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径。表3中表示sirna的封入率及脂质复合物的平均粒径(z-平均)。[表3]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例38ys-11758110实施例39ys-117s65126实施例40ys-1187474实施例41ys-118s7371实施例42ys-1197772<组合物的制备(4)>[实施例43](ys-119)使用实施例4的阳离子性脂质(ys-119)而制备组合物。作为核酸,使用和实施例29的组合物所使用者相同的factorviisirna。将factorviisirna利用25mm醋酸钠(ph值4.0)溶解为108μg/ml,而制成sirna稀释液。另外,将阳离子性脂质(ys-119)、dspc(日本精化股份有限公司)、胆固醇(日本精化股份有限公司)、mpeg2000-dmg(日油股份有限公司)以60/8.5/30/1.5(摩尔比)的比例且以总脂质浓度为6mm的方式溶解到乙醇中,而制成脂质溶液。将sirna稀释液与脂质溶液分别以1.80ml/分钟、0.97ml/分钟的流速进行混合,进而将25mm醋酸钠(ph值4.0)以6.94ml/分钟的流速进行混合,由此获得脂质复合物水溶液。将所获得的脂质复合物水溶液供于使用透析膜(商品名“float-a-lyzerg2”、美国斯百全(spectrum)公司、50kmwco)的透析,将外液换成磷酸缓冲液(pbs、ph值7.5)。透析后,进行浓缩及过滤灭菌,而获得实施例43的组合物。[比较例2](aln-319)使用所述aln-319代替ys-119作为阳离子性脂质,除此以外,和实施例43同样地获得比较例2的组合物。<组合物的分析(4)>和实施例29的组合物同样地,针对实施例43及比较例2的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径(z-平均)。表4中表示sirna的封入率及脂质复合物的平均粒径。[表4]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例43ys-1198894比较例2aln-3197595<组合物的制备(5)>[实施例44](ys-119)使用实施例4的阳离子性脂质(ys-119)而制备组合物。作为核酸,使用和实施例29的组合物所使用者相同的factorviisirna。将factorviisirna利用25mm醋酸钠(ph值4.0)溶解为216μg/ml,而制成sirna稀释液。另外,将阳离子性脂质(ys-119)、胆固醇(日本精化股份有限公司)、mpeg2000-dpg(日油股份有限公司)以60/38.5/1.5(摩尔比)的比例且以总脂质浓度为6mm的方式溶解到乙醇中,而制成脂质溶液。将sirna稀释液与脂质溶液分别以3.36ml/分钟、1.81ml/分钟的流速进行混合,进而将25mm醋酸钠(ph值4.0)以12.95ml/分钟的流速进行混合,由此获得脂质复合物水溶液。将所获得的脂质复合物水溶液供于使用透析膜(商品名“float-a-lyzerg2”、美国斯百全(spectrum)公司、50kmwco)的透析,将外液换成磷酸缓冲液(pbs、ph值7.5)。透析后,进行浓缩及过滤灭菌,而获得实施例44的组合物。[实施例45](ys-120)使用实施例15的阳离子性脂质(ys-120)代替ys-119作为阳离子性脂质,除此以外,和实施例44同样地获得实施例45的组合物。<组合物的分析(5)>和实施例29的组合物同样地,针对实施例44及45的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径(z-平均)。表5中表示sirna的封入率及脂质复合物的平均粒径。[表5]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例44ys-1199680实施例45ys-1209479<组合物的制备(6)>[实施例46](ys-120)使用实施例16的阳离子性脂质(ys-120)而制备组合物。作为核酸,使用和实施例29的组合物所使用者相同的factorviisirna。将factorviisirna利用25mm醋酸钠(ph值4.0)溶解为450μg/ml,而制成sirna稀释液。另外,将阳离子性脂质(ys-120)、dspc(日本精化股份有限公司)、胆固醇(日本精化股份有限公司)、mpeg2000-dmg(日油股份有限公司)以60/8.5/30/1.5(摩尔比)的比例且以总脂质浓度为40mm的方式溶解到乙醇中,而制成脂质溶液。将脂质相对于sirna的比设为质量比0.06,将sirna稀释液与脂质溶液分别以4.0ml/分钟、1.3ml/分钟的流速进行混合,由此获得脂质复合物水溶液。将所获得的脂质复合物水溶液供于使用透析膜(商品名“float-a-lyzerg2”、美国斯百全(spectrum)公司、50kmwco)的透析,将外液换成磷酸缓冲液(pbs、ph7.4)。透析后,进行浓缩及过滤灭菌,而获得实施例46的组合物。[实施例47](ys-121)使用实施例17的阳离子性脂质(ys-121)代替ys-120作为阳离子性脂质,除此以外,和实施例46同样地获得实施例47的组合物。[实施例48](ys-122)使用实施例18的阳离子性脂质(ys-122)代替ys-120作为阳离子性脂质,除此以外,和实施例46同样地获得实施例48的组合物。[实施例49](ys-123)使用实施例19的阳离子性脂质(ys-123)代替ys-120作为阳离子性脂质,除此以外,和实施例46同样地获得实施例49的组合物。[实施例50](ys-124)使用实施例20的阳离子性脂质(ys-124)代替ys-120作为阳离子性脂质,除此以外,和实施例46同样地获得实施例50的组合物。[实施例51](ys-125)使用实施例21的阳离子性脂质(ys-125)代替ys-120作为阳离子性脂质,除此以外,和实施例46同样地获得实施例51的组合物。[实施例52](ys-126)使用实施例22的阳离子性脂质(ys-126)代替ys-120作为阳离子性脂质,除此以外,和实施例46同样地获得实施例52的组合物。<组合物的分析(6)>和实施例29的组合物同样地,针对实施例46~52的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径(z-平均)。表6中表示sirna的封入率及脂质复合物的平均粒径。[表6]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例46ys-1209964实施例47ys-1218474实施例48ys-1229866实施例49ys-1239961实施例50ys-1249964实施例51ys-1249663实施例52ys-1259963<组合物的分析(7)>将实施例46~52的组合物在密闭的玻璃小瓶中在4℃下保管,和实施例29的组合物同样地测定保管前、保管后第3个月及第6个月的粒径(z-平均及多分散指数)。表7中表示实施例46~52的组合物的平均粒径的随时间经过而产生的变化及保管后第6个月和保管前的粒径变化(d)。包含ys-121以外的阳离子性脂质的组合物在保管期间显示出脂质复合物的粒径的增大得到抑制。[表7]<组合物的制备(7)>[实施例53](ys-120)和“组合物的制备(6)”同样地使用实施例16的阳离子性脂质(ys-120)而制备组合物。[实施例54](ys-124)使用实施例23的阳离子性脂质(ys-127)代替ys-120作为阳离子性脂质,除此以外,和实施例53同样地获得实施例54的组合物。[比较例3](aln-319)使用所述aln-319代替ys-120作为阳离子性脂质,除此以外,和实施例53同样地获得比较例3的组合物。<组合物的分析(8)>和实施例29的组合物同样地,针对实施例53、54及比较例3的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径(z-平均)。表8中表示sirna的封入率及脂质复合物的平均粒径。[表8]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例53ys-1209766实施例54ys-1249667比较例3aln-3199895<组合物的分析(9)>针对实施例53、54及比较例3的组合物,在各组合物的制备中通过sirna稀释液和脂质溶液的混合而产生脂质复合物后,立即将该脂质复合物在pbs中进行透析后,在密闭的玻璃小瓶中在4℃下保管后,利用粒径测定装置(商品名“zetasizernanozs”、英国马尔文(malvern)公司制造)测定第2个月及第6个月的粒径(z-平均及多分散指数)。表9中表示实施例53、54及比较例3的组合物的平均粒径的随时间经过而产生的变化及保管后第6个月和刚混合后的粒径变化(d)。包含ys-120或ys-124的阳离子性脂质的组合物和比较例3的组合物相比,在保管期间中显示出脂质复合物的粒径的增大得到抑制。[表9]<组合物的制备(8)>[实施例55](ys-120)和“组合物的制备(6)”同样地使用实施例16的阳离子性脂质(ys-120)而制备组合物。[实施例56](ys-127)使用实施例23的阳离子性脂质(ys-127)代替ys-120作为阳离子性脂质,除此以外,和实施例55同样地获得实施例56的组合物。[实施例57](ys-128)使用实施例24的阳离子性脂质(ys-128)代替ys-120作为阳离子性脂质,除此以外,和实施例55同样地获得实施例57的组合物。[实施例58](ys-129)使用实施例25的阳离子性脂质(ys-129)代替ys-120作为阳离子性脂质,除此以外,和实施例55同样地获得实施例58的组合物。<组合物的分析(10)>和实施例29的组合物同样地,针对实施例55~58的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径(z-平均)。表10中表示sirna的封入率及脂质复合物的平均粒径。[表10]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例55ys-1208763实施例56ys-1277280实施例57ys-1288465实施例58ys-1297661<组合物的制备(9)>[实施例59](ys-101)和“组合物的制备(6)”同样地使用实施例2的阳离子性脂质(ys-101)而制备组合物。[实施例60](ys-131)使用实施例26的阳离子性脂质(ys-131)代替ys-101作为阳离子性脂质,除此以外,和实施例59同样地获得实施例60的组合物。[实施例61](ys-132)使用实施例27的阳离子性脂质(ys-132)代替ys-101作为阳离子性脂质,除此以外,和实施例59同样地获得实施例61的组合物。[实施例62](ys-133)使用实施例28的阳离子性脂质(ys-133)代替ys-101作为阳离子性脂质,除此以外,和实施例59同样地获得实施例62的组合物。[实施例63](ys-120)使用实施例16的阳离子性脂质(ys-120)代替ys-101作为阳离子性脂质,除此以外,和实施例59同样地获得实施例63的组合物。[比较例4](aln-319)使用所述aln-319代替ys-101作为阳离子性脂质,除此以外,和实施例59同样地获得比较例4的组合物。<组合物的分析(11)>和实施例29的组合物同样地,针对实施例59~63及比较例4的组合物,测定sirna向脂质复合物中的封入率及脂质复合物的平均粒径(z-平均)。表11中表示sirna的封入率及脂质复合物的平均粒径。[表11]组合物阳离子性脂质封入率(%)平均粒径(nm)实施例59ys-1019670实施例60ys-1319275实施例61ys-1329574实施例62ys-1339871实施例63ys-1209770比较例4aln-3199776<动物实验(1)>将实施例29~31及参考例1的组合物以封入到脂质复合物中的factorviisirna浓度为10μg/ml的方式利用pbs进行稀释。将各组合物以10ml/kg的投予容量对c57/bl6小鼠(5周龄、雄性)进行尾静脉内投予,从投予起24小时后在麻醉下实施采血及肝脏的采集。通过离心将血浆从血液分离,利用市售的试剂盒(商品名“biophenfvii”、hyphenbiomed公司)对血浆中的factorvii蛋白质浓度进行定量。作为阴性对照,对投予了pbs的组群进行相同处理。将pbs投予组的factorvii蛋白质浓度设为100%,以相对值算出组合物投予组的factorvii蛋白质浓度。另外,将肝脏均质化,利用甲醇萃取构成组合物的脂质后,通过lc-ms对阳离子性脂质进行定量。将所投予的阳离子性脂质的量设为100%,以相对值算出肝脏中残存的阳离子性脂质的量。将结果示于表12。[表12]<动物实验(2)>将实施例32~37及比较例1的组合物与“动物实验(1)”同样地进行稀释,并对c57/bl6小鼠(5周龄、雄性)进行投予,算出投予24小时后的血浆中的factorvii蛋白质浓度的相对值及肝脏中残存的阳离子性脂质量的相对值。将结果示于表13。[表13]<动物实验(3)>将实施例38~42的组合物和“动物实验(1)”同样地进行稀释,并对c57/bl6小鼠(5周龄、雄性)进行投予,算出投予24小时后的血浆中的factorvii蛋白质浓度的相对值及肝脏中残存的阳离子性脂质量的相对值。将结果示于表14。[表14]<动物实验(4)>将实施例43及比较例2的组合物以封入到脂质复合物中的factorviisirna浓度为1μg/ml或5μg/ml的方式利用pbs进行稀释。将各组合物以10ml/kg的投予容量对c57/bl6小鼠(5周龄、雄性)进行尾静脉内投予,从投予起24小时后在麻醉下实施采血及肝脏的采集。通过离心将血浆从血液分离,利用市售的试剂盒(商品名“biophenfvii”、hyphenbiomed公司)对血浆中的factorvii蛋白质浓度进行定量。作为阴性对照,对投予了pbs的组群进行相同处理。将pbs投予组的factorvii蛋白质浓度设为100%,以相对值算出组合物投予组的factorvii蛋白质浓度。将结果示于表15及图1。实施例43的组合物显示出高于比较例2的组合物的factorvii蛋白质的表达抑制效果。[表15]<动物实验(5)>将实施例44及45的组合物以封入到脂质复合物中的factorviisirna浓度为1μg/ml或5μg/ml的方式利用pbs进行稀释。将各组合物以10ml/kg的投予容量对c57/bl6小鼠(5周龄、雄性)进行尾静脉内投予,从投予起24小时后在麻醉下实施采血及肝脏的采集。通过离心将血浆从血液分离,利用市售的试剂盒(商品名“biophenfvii”、hyphenbiomed公司)对血浆中的factorvii蛋白质浓度进行定量。作为阴性对照,对投予了pbs的组群进行相同处理。将pbs投予组的factorvii蛋白质浓度设为100%,以相对值算出组合物投予组的factorvii蛋白质浓度。将结果示于表16及图2。实施例44及45的组合物均显示出较高的factorvii蛋白质的表达抑制效果。[表16]<动物实验(6)>将实施例46~52的组合物和“动物实验(5)”同样地进行稀释,并对c57/bl6小鼠(5周龄、雄性)进行投予,算出投予24小时后的血浆中的factorvii蛋白质浓度的相对值。将结果示于表17。[表17]<动物实验(7)>将实施例53、54及比较例3的组合物以封入到脂质复合物中的factorviisirna浓度为2μg/ml或10μg/ml的方式利用pbs进行稀释。将各组合物以10ml/kg的投予容量对icr小鼠(6周龄、雌性)进行尾静脉内投予,从投予起24小时后在麻醉下实施采血及肝脏的采集。通过离心将血浆从血液分离,利用市售的试剂盒(商品名“biophenfvii”、hyphenbiomed公司)对血浆中的factorvii蛋白质浓度进行定量。作为阴性对照,对投予了pbs的组群进行相同处理。将pbs投予组的factorvii蛋白质浓度设为100%,以相对值算出组合物投予组的factorvii蛋白质浓度。将结果示于表18。实施例53及54的组合物显示出高于比较例3的组合物的factorvii蛋白质的表达抑制效果。[表18]<动物实验(8)>将实施例55~58的组合物和“动物实验(7)”同样地进行稀释,并对icr小鼠(6周龄、雌性)进行投予,算出投予24小时后的血浆中的factorvii蛋白质浓度的相对值。将结果示于表19。[表19]<动物实验(9)>将实施例59~63及比较例4的组合物和“动物实验(7)”同样地进行稀释,并对icr小鼠(5周龄、雌性)进行投予,算出投予24小时后的血浆中的factorvii蛋白质浓度的相对值。将结果示于表20。[表20][产业上的利用可能性]根据本发明,可提供能够将核酸高效率地释放到细胞质中的阳离子性脂质。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1