一种制备心脏祖细胞的方法与流程
本发明属于生物医药研究领域,具体涉及一种制备心脏祖细胞的方法。
背景技术:
心血管疾病是我国重要的公共卫生问题,其高发病率、发病年轻化、高致残率趋势日益严峻。尽管有实验表明人的心脏细胞具有一定的再生能力,但这种自身再生能力不足以修复缺血等病理因素导致的大量心脏细胞丢失。因此,受损心脏组织的再生和修复是心血管转化医学研究中亟待解决的难题。
心脏祖细胞(Cardiac Progenitor Cells,CPCs)是心脏发育起源细胞,能自我更新以及定向分化为心肌细胞、平滑肌细胞、内皮细胞,是实现心脏再生的潜在种子细胞来源,但体内固有干细胞的数量极少,体外分离培养、扩增CPCs非常繁琐耗时,限制了临床大规模应用。重编程技术的出现与迅猛发展,推进了外源性心脏细胞的获取。
近十年来,科学家们做了许多努力。当前,多能性重编程、直接重编程技术主要包括外源性遗传物质导入法、小分子诱导和蛋白质诱导。即使基因导入法历经了从整合型病毒(逆转录病毒、慢病毒)到非整合型病毒(转座子技术)、无病毒转染,仍然不能完全排除外源性遗传物质残存所致的一系列安全隐患,加上非整合型病毒载体操作复杂,耗时长,效率较低,还不能突破临床应用的瓶颈。小分子化合物诱导法虽然摆脱了重编程对外源基因的过分依赖,但由于小分子依赖于信号通路刺激细胞转变,其细胞状态、细胞微环境直接决定了小分子诱导的效率。重编程的关键在于进行核内重编程,擦除体细胞的记忆,激活干细胞基因的表达。对于基因导入法和小分子而言,仅有少部分基因、小部分化合物到达核内发挥作用。
相比之下,蛋白质是基因功能的执行体,机体生命活动的基础。这意味着药物样蛋白质在重编程中具有巨大的潜力。蛋白质诱导法不借助病毒、外源性基因,更为安全,适用于未来临床转化。蛋白质诱导的最大挑战在于大分子量、结构复杂的重编程蛋白如何跨越细胞膜这道“防火墙”进入细胞核发挥作用。
经过人们的不懈努力,借助优良的新型纳米试剂,精准递送蛋白质已经变得轻而易举。相对而言,高效重编程因子的选择一直困扰着全世界。
因此,获得一种针对细胞种类创新地提供了“个性化”、安全、高效的蛋白诱导生成心脏祖细胞的方法,非常重要。
技术实现要素:
为了克服现有技术中所存在的问题,本发明的目的在于提供一种制备心脏祖细胞的方法。
为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
本发明的第一方面提供一种制备心脏祖细胞的方法,包括步骤:将重编程因子转导至起始重编程对象细胞内,所述重编程因子选自心脏转录因子、表观遗传调控因子。
优选地,所述方法还包括步骤:将重编程因子转导至起始重编程对象细胞内后在合适的条件下培养或扩增转导后的起始重编程对象细胞。
优选地,所述重编程因子选自Gata4、Tbx5、Nkx2.5、AF9、Hand2、Mef2C、Mesp1、Baf60c、UTX中任一种或多种的组合。
Gata4在NCBI的ID:NP_001295022.1。
Tbx5在NCBI的ID:NP_852259.1。
Nkx2.5在NCBI的ID:NP_004378.1。
AF9在NCBI的ID:NP_001180279.1。
Hand2在NCBI的ID:NP_068808.1。
Mef2C在NCBI的ID:NP_001180279.1。
Mesp1在NCBI的ID:NP_061140.1。
Baf60c在NCBI的ID:NP_001003802.1。
UTX在NCBI的ID:NP_001278344.1.。
本领域技术人员在获知了Gata4、Tbx5、Nkx2.5、AF9、Hand2、Mef2C、Mesp1、Baf60c、UTX各自的氨基酸序列后,能够根据现有技术制备获得这些重编程因子。可采用的制备方法并不限制于实施例中所例举的制备方法,只要能够成功获得这些重编程因子即可。
优选地,将重编程因子转导至起始重编程对象细胞的细胞核内。
优选地,所述起始重编程对象为成体干细胞。
进一步优选地,所述起始重编程对象选自骨髓间充质干细胞或脐带间充质干细胞。所述起始重编程对象可以是人类骨髓间充质干细胞或人类脐带间充质干细胞。
进一步地,所述方法为在体外制备心脏祖细胞的方法。
优选地,所述方法包括步骤:将重编程因子与起始重编程对象细胞混合,进而将重编程因子转导至起始重编程对象细胞内。
优选地,所述重编程因子为下之任一:(1)重编程因子GMT由Gata4、Mef2C、Tbx5组成;(2)重编程因子GMTB由Gata4、Mef2C、Tbx5、Baf60c组成;(3)重编程因子GHMT由Gata4、Hand2、Mef2C、Tbx5组成;(4)重编程因子GNT由Gata4、Nkx2.5、Tbx5组成;(5)重编程因子GNTB由Gata4、Nkx2.5、Tbx5、Baf60c组成;(6)重编程因子GNMT由Gata4、Nkx2.5、Mef2C、Tbx5组成;(7)重编程因子GM1T由Gata4、Mef2C、Mesp1、Tbx5组成;(8)重编程因子GNM1T由Gata4、Nkx2.5、Mef2C、Mesp1、Tbx5组成;(9)重编程因子GMM1T由Gata4、Mef2C、Mef2C、Mesp1、Tbx5组成;(10)重编程因子GTB由Gata4、Tbx5、Baf60c组成;(11)重编程因子GM1TB由Gata4、Mef2C、Mesp1、Tbx5、Baf60c组成;(12)重编程因子GNTA由Gata4、Nkx2.5、Tbx5、AF9组成;(13)重编程因子GNTU由Gata4、Tbx5、Nkx2.5、UTX组成;(14)重编程因子GNTAU由Gata4、Nkx2.5、Tbx5、AF9、UTX组成。
优选地,将重编程因子与起始重编程对象细胞混合后,Gata4的终浓度是0.2~0.4μg/ml,Tbx5的终浓度是0.2~0.4μg/ml,Nkx2.5的终浓度是0.1~0.2μg/ml,Hand2的终浓度是0.1~0.2μg/ml,Mef2C的终浓度是0.2~0.4μg/ml,Mesp1的终浓度是0.3~0.6μg/m,Baf60c的终浓度是0.4~0.8μg/ml,UTX的终浓度是0.5~1.0μg/ml,AF9的终浓度是0.5~1.0μg/ml。
优选地,所述方法进一步包括步骤:将重编程因子先与转导载体复合后形成重编程因子-转导载体复合物,然后将所述重编程因子-转导载体复合物与起始重编程对象细胞混合,进而通过转导载体将重编程因子转导至起始重编程对象细胞内。优选地,将重编程因子转导至起始重编程对象细胞的细胞核内。
本发明的一些实施方式中列举了采用壳聚糖或壳聚糖衍生物作为转导载体,但是并不限于此。所述转导载体可以是本领域任意能够将重编程因子有效转导至起始重编程对象细胞内(优选转导至细胞核内)的转导载体。一般情况下,所述转导载体的转导效率在90%以上即可。
本发明的第二方面,提供一种用于制备心脏祖细胞的重编程因子,所述重编程因子选自Gata4、Tbx5、Nkx2.5、AF9、Hand2、Mef2C、Mesp1、Baf60c、UTX中任一种或多种的组合。
优选地,所述重编程因子为下之任一:(1)重编程因子GMT由Gata4、Mef2C、Tbx5组成;(2)重编程因子GMTB由Gata4、Mef2C、Tbx5、Baf60c组成;(3)重编程因子GHMT由Gata4、Hand2、Mef2C、Tbx5组成;(4)重编程因子GNT由Gata4、Nkx2.5、Tbx5组成;(5)重编程因子GNTB由Gata4、Nkx2.5、Tbx5、Baf60c组成;(6)重编程因子GNMT由Gata4、Nkx2.5、Mef2C、Tbx5组成;(7)重编程因子GM1T由Gata4、Mef2C、Mesp1、Tbx5组成;(8)重编程因子GNM1T由Gata4、Nkx2.5、Mef2C、Mesp1、Tbx5组成;(9)重编程因子GMM1T由Gata4、Mef2C、Mef2C、Mesp1、Tbx5组成;(10)重编程因子GTB由Gata4、Tbx5、Baf60c组成;(11)重编程因子GM1TB由Gata4、Mef2C、Mesp1、Tbx5、Baf60c组成;(12)重编程因子GNTA由Gata4、Nkx2.5、Tbx5、AF9组成;(13)重编程因子GNTU由Gata4、Tbx5、Nkx2.5、UTX组成;(14)重编程因子GNTAU由Gata4、Nkx2.5、Tbx5、AF9、UTX组成。
本发明的第三方面,提供一种用于制备心脏祖细胞的药物组合物,包括上述重编程因子以及转导载体,所述转导载体将重编程因子转导至起始重编程对象细胞内。
优选地,所述转导载体将重编程因子转导至起始重编程对象细胞的细胞核内。
本发明的一些实施方式中列举了采用壳聚糖或壳聚糖衍生物作为转导载体,但是并不限于此。所述转导载体可以是本领域任意能够将重编程因子有效转导至起始重编程对象细胞内(优选转导至细胞核内)的转导载体。一般情况下,所述转导载体的转导效率在90%以上即可。
与现有技术相比,本发明具有如下有益效果:
采用本发明的方法制备心脏祖细胞,在8~10天左右即可成功获得心脏祖细胞,且获得的心脏祖细胞均是isl+/Tbx5+双阳性细胞,阳性率高且免疫原性低。
附图说明
图1:重编程因子Nkx2.5修饰前后转导12h后,人骨髓间充质干细胞的免疫荧光图形,显示Nkx2.5核定位转导效率,其中,第一行unmodified为未修饰组,第二行modified为转导载体修饰组,荧光颜色如下:DAPI(蓝色)、Nkx2.5(绿色),两种颜色混合见于“Merge(合并)”图中。
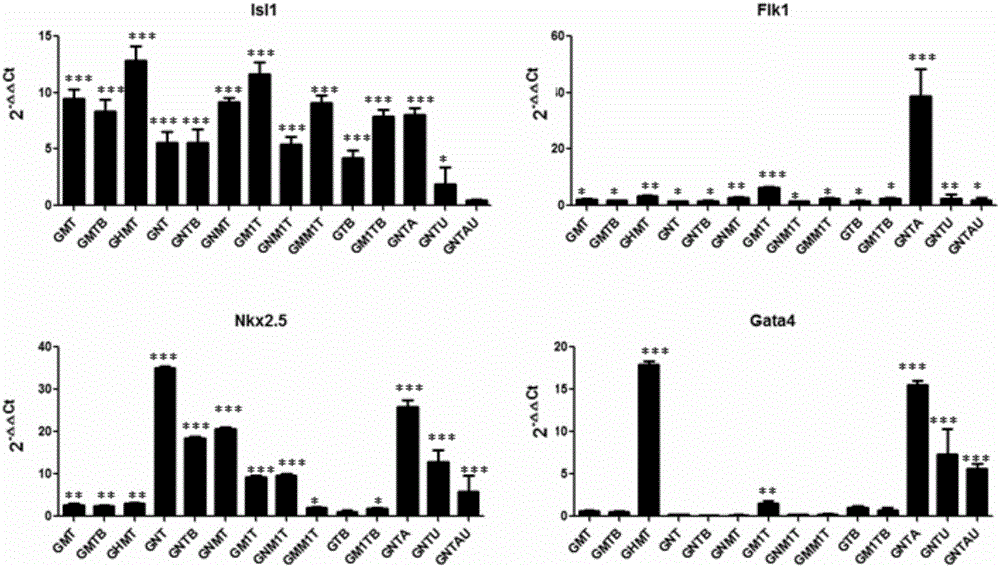
图2是BM-MSCs运用不同重编程因子重编程,qPCR分析d8心脏祖细胞基因mRNA表达水平。
图3:BM-MSCs向piCPCs重编程过程中“玫瑰花环”集落形成图。
图4:BM-MSCs经GNTA重编程后d8心脏祖细胞基因mRNA水平。
图5:是piCPCs免疫荧光图像。
图6是piCPCs流式分析结果。
图7是piCPCs心脏谱系分化潜能鉴定图。
图8是UC-MSCs运用不同重编程因子重编程,qPCR分析d8心脏祖细胞基因mRNA表达水平。
图9是UC-MSCs经重编程因子GMM1T诱导后的免疫荧光图像。
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODS IN MOLECULAR BIOLOGY,Vol.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
实施例1本发明所需溶液的制备
(1)Ni柱洗涤缓冲液:20mM Tris-HCl,0.15M NaCl,20mM咪唑,pH8.0;
(2)Ni柱洗脱缓冲液:20mM Tris-HCl,0.15M NaCl,200mM咪唑,pH8.0;
(3)重组蛋白质溶解缓冲液:50mM Tris,150mM NaCl,10%甘油(v/v),pH8.0;
(4)间充质干细胞培养基:45ml MSC基础培养基(Cyagen),5ml FBS,添加终浓度为0.1mM非必需氨基酸,2mM L-谷氨酰胺,50nMβ-巯基乙醇;可用于人骨髓间充质干细胞或人脐带间充质干细胞的培养;
(5)心脏祖细胞重编程培养基(CRM培养基):在5%(v/v)胎牛血清的人骨髓间充质干细胞培养基基础上,主要添加有终浓度为10ng/ml bFGF、3ng/ml Activin A、6nM Chir99021、0.5%(g/L)BSA;
(6)心脏祖细胞维持培养基(CMM培养基):在DMEM基础培养基中(Invitrogen),主要添加10%(v/v)胎牛血清的KSR血清(HyClone)、终浓度为0.1mM非必需氨基酸、2mM L-谷氨酰胺、50nMβ-巯基乙醇、5ng/ml bFGF、3nM Chir99021、ITS(Insulin-Transferin-Serium,Invitrogen)、5ng/ml VEGF等;
(7)含2%(w/v)BSA的PBST:称量1g BSA粉末,用PBS溶解并定容至50ml,再添加100ul 100%的吐温20,即含有0.2%(v/v)的吐温20;
(8)心肌细胞分化培养基:在DMEM基础培养基中(Invitrogen),主要添加10%(v/v)胎牛血清KSR血清(Hyclone),5nM IWR-1,5ng/ml bFGF等。
(9)内皮细胞分化培养基:在2%(v/v)胎牛血清EGM-2培养基中(Lonza),主要添加10ng/ml EGF。
(10)血管平滑肌细胞分化培养基:在10%(v/v)胎牛血清DMEM基础培养基中(Invitrogen),主要添加10ng/ml VEGF、3ng/mlTGFβ1。
实施例2各重编程因子的原核表达
本实施例的主要目的在于获得以下各个重编程因子:Gata4、Tbx5、Nkx2.5、AF9、Hand2、Mef2C、Mesp1、Baf60c、UTX。
各重编程因子的原核表达方法包括步骤:
(1)将各重编程因子的编码基因序列插入到表达载体pSmart-I(天地人和公司,中国)中,获得重组表达载体;
具体地,Gata4的编码基因的核苷酸序列同NCBI的Gene ID 2626所示;
Tbx5的编码基因的核苷酸序列同NCBI的Gene ID 6910所示;
Nkx2.5的编码基因的核苷酸序列同NCBI的Gene ID 1482所示;
AF9的编码基因的核苷酸序列同NCBI的Gene ID 4300所示;
Hand2的编码基因的核苷酸序列同NCBI的Gene ID 9464所示;
Mef2C的编码基因的核苷酸序列同NCBI的Gene ID 4208所示;
Mesp1的编码基因的核苷酸序列同NCBI的Gene ID 55897所示;
Baf60c的编码基因的核苷酸序列同NCBI的Gene ID 6604所示;
UTX的编码基因的核苷酸序列同NCBI的Gene ID 7403所示;
(2)将步骤(1)所获得的重组载体分别转化到DH5α克隆菌和BL21(DE3)表达菌中,利用IPTG诱导表达目的蛋白。然后通过Akta蛋白纯化仪Ni柱亲和纯化层析、咪唑洗脱,经鉴定各目的蛋白的大小与预期相符,且各目的蛋白的纯度均在95%以上。
将洗脱下来的目的蛋白经N/C末端序列分析,结果表明所表达的重组蛋白样品均读框无误,与理论N/C末端氨基酸序列一致。
具体地,所得Gata4的氨基酸序列同在NCBI的ID:NP_001295022.1所示;
Tbx5的氨基酸序列同在NCBI的ID:NP_852259.1所示;
Nkx2.5的氨基酸序列同在NCBI的ID:NP_004378.1所示;
AF9的氨基酸序列同NCBI的ID:NP_001180279.1所示;
Hand2的氨基酸序列同NCBI的ID:NP_068808.1所示;
Mef2C的氨基酸序列同NCBI的ID:NP_001180279.1所示;
Mesp1的氨基酸序列同NCBI的ID:NP_061140.1所示;
Baf60c的氨基酸序列同在NCBI的ID:NP_001003802.1所示;
UTX的氨基酸序列同NCBI的ID:NP_001278344.1.所示;
将洗脱下来的目的蛋白加入透析袋透析,真空冷冻干燥,分别获得各重编程因子的冻干粉末。
实施例3各重编程因子的转导及转导效率监测
本实施例的主要目的在于将实施例2获得的各重编程因子转导至靶细胞(起始重编程对象)内。
本实施例中例举使用低分子壳聚糖及各低分子壳聚糖衍生物组合作为转导载体,具体地,所述低分子壳聚糖为分子量为5000的壳聚糖,所述低分子壳聚糖衍生物为N-羧基丁基壳聚糖,前者与后者的质量比为1:1。使用时,可将所述转导载体配置成pH7.4的转导载体水溶液。
将实施例2获得的各重编程因子的冻干粉末溶解于缓冲液(50mM Tris,150mM NaCl,10%v/v甘油,PH8.0)中,获得各重编程因子缓冲液。
使用时,将各重编程因子缓冲液分别与转导载体水溶液混合,超声分散,在冷室中混合过夜,使得各重编程因子分别与转导载体以合理的摩尔比例混合,获得稳定的重组编程因子-转导载体复合物。
先以重编程因子Nkx2.5为例,重编程因子Nkx2.5与所述转导载体1:1的摩尔比例混合,超声共振5s,4℃翻转混匀过夜,获得Nkx2.5-转导载体复合物。
将未与转导载体复合的Nkx2.5缓冲液作为未修饰的未修饰的Nkx2.5蛋白质溶液,将Nkx2.5-转导载体复合物作为修饰的Nkx2.5蛋白质溶液。然后将未修饰的Nkx2.5蛋白质溶液、修饰的Nkx2.5蛋白质溶液分别与是实例1中的人骨髓间充质干细胞培养基(Cyagen)混合,使得Nkx2.5的终浓度为0.2μg/ml。以未修饰组为对照,分别与人骨髓间充质干细胞孵育12小时。12小时后,洗净培养基,利用anti-nkx2.5抗体(abcam)进行的免疫荧光观察细胞核内荧光信号。结果如图1所示,所述转导载体对Nkx2.5的转导效率约为96%。同样地,经试验发现,所述转导载体对重编程因子Gata4、Tbx5、AF9、Hand2、Mef2C、Mesp1、Baf60c、UTX的转导效率也分别均在96%以上。
实施例4心脏祖细胞的制备程序
本实施例的目的在于以成体干细胞作为起始重编程对象,采用重编程因子(Gata4、Tbx5、Nkx2.5、AF9、Hand2、Mef2C、Mesp1、Baf60c、UTX中任一种或多种的组合)对成体干细胞进行重编程,获得心脏祖细胞。首先,将成体干细胞传代至6孔板,每孔约8~10×104个细胞。
(一)以人类骨髓间充质干细胞为起始重编程对象为例,采用不同重编程因子GMT/GMTB/GHMT/GNT/GNTB/GNMT/GM1T/GBM1T/GMM1T/GTB/GM1TB/GNTA/GNTU/GNTAU进行重编程,制备心脏祖细胞
重编程因子GMT由Gata4、Mef2C、Tbx5组成。
重编程因子GMTB由Gata4、Mef2C、Tbx5、Baf60c组成。
重编程因子GHMT由Gata4、Hand2、Mef2C、Tbx5组成。
重编程因子GNT由Gata4、Nkx2.5、Tbx5组成。
重编程因子GNTB由Gata4、Nkx2.5、Tbx5、Baf60c组成。
重编程因子GNMT由Gata4、Nkx2.5、Mef2C、Tbx5组成。
重编程因子GM1T由Gata4、Mef2C、Mesp1、Tbx5组成。
重编程因子GNM1T由Gata4、Nkx2.5、Mef2C、Mesp1、Tbx5组成。
重编程因子GMM1T由Gata4、Mef2C、Mef2C、Mesp1、Tbx5组成。
重编程因子GTB由Gata4、Tbx5、Baf60c组成。
重编程因子GM1TB由Gata4、Mef2C、Mesp1、Tbx5、Baf60c组成。
重编程因子GNTA由Gata4、Nkx2.5、Tbx5、AF9组成。
重编程因子GNTU由Gata4、Tbx5、Nkx2.5、UTX组成。
重编程因子GNTAU由Gata4、Nkx2.5、Tbx5、AF9、UTX组成。
重编程全程大致分为3个阶段:
(1)第一阶段为预重编程阶段:将上述不同重编程因子
GMT/GMTB/GHMT/GNT/GNTB/GNMT/GM1T/GNM1T/GMM1T/GTB/GM1TB/GNTA/GNTU/GNTAU分别与实施例3中的转导载体混合,分别获得
GMT/GMTB/GHMT/GNT/GNTB/GNMT/GM1T/GBM1T/GMM1T/GTB/GM1TB/GNTA/GNTU/GNTAU-转导载体复合物,然后将所述复合物分别与实施例1中的间充质干细胞培养基(Cyagen)混合,混合后Gata4的终浓度是0.2~0.4μg/ml,Tbx5的终浓度是0.2~0.4μg/ml,Nkx2.5的终浓度是0.1~0.2μg/ml,Hand2的终浓度是0.1~0.2μg/ml,Mef2C的终浓度是0.2~0.4μg/ml,Mesp1的终浓度是0.3~0.6μg/m,Baf60c的终浓度是0.4~0.8μg/ml,UTX的终浓度是0.5~1.0μg/ml,AF9的终浓度是0.5~1.0μg/ml;将人骨髓间充质干细胞与含有重编程因子的培养基孵育12小时后,更换到常规不含有重编程因子的培养基培养,隔天后,再次更换为含有重编程因子的培养基培养,大约2~3个到循环后,细胞逐渐聚集,然后进去第二阶段;
(2)第二阶段为重编程阶段:
分别将
GMT/GMTB/GHMT/GNT/GNTB/GNMT/GM1T/GNM1T/GMM1T/GTB/GM1TB/GNTA/GNTU/GNTAU-转导载体复合物与实施例1中的心脏祖细胞重编程培养基混合,使得各重编程因子的终浓度较之于第一阶段减半,获得含有重编程因子的心脏祖细胞重编程培养基,每个循环包括将聚集后的细胞(重编程对象)与所述含有重编程因子的心脏祖细胞重编程培养基孵育24小时后更换为不含编程因子的心脏祖细胞重编程培养基培养24小时,如此2~3循环后,即整个重编程的第8~10天,观察到编程对象的形态学发生明显的变化,有“玫瑰花环样”集落出现;
(3)第三阶段:为维持阶段,在铺有Matrigel的培养皿下,使用实施例1中的心脏祖细胞维持培养基维持、扩增心脏祖细胞。
通过接下来研究获得的心脏祖细胞的特征:重编程细胞荧光定量qPCR分析,蛋白重编第8天,根据制造商的说明书,使用细胞总RNA提取试剂盒(TianGen),从起始重编程对象人骨髓间充质干细胞BM-MSCs和重编程后获得的心脏祖细胞piCPCs中分别分离总RNA。使用cDNA逆转录试剂盒(Takara),将250ng RNA逆转录合成cDNA。使用SYBR Mix(Takara)进行PCR反应,使用管家基因β-tubllin作为内参标准化。如图2所示结果,显示了BM-MSCs经诱导后心脏祖细胞标志物基因Isl1、Flk1、Nkx2.5、Gata4mRNA表达水平(n=3)。说明运用上述不同重编程因子对人骨髓间充质干细胞进行重编程,均能够成功获得心脏祖细胞,然而不同组合的重编程效率有差异,其中GHMT组合获得的ISL1或GATA4阳性的细胞数最多,而GNT组合获得的Nkx2.5阳性细胞数最多。
表1.用于人心脏祖细胞研究的引物
细胞免疫荧光测定:将piCPCs和BM-MSCs分别种植到铺有Matrigel的8孔培养室中,用4%多聚甲醛固定,随后用PBS清洗3次。用0.2%triton X-100通透15min,接着用具有2%BSA的PBST封闭2小时。然后将细胞与一抗在4℃孵育过夜:ISL1(abcam,鼠单抗,1:300)、Nkx2.5(CST,鼠单抗,1:100)、Gata4(abcam,兔单抗,1:500)、Tbx5(abcam,兔多抗,1:500)。在1%BSA/PBS中洗涤3~5次,共15~25min。使用荧光二抗(在2%BSA/PBS中1:500)室温孵育2h:Alexa Fluro 488驴抗鼠IgG(Invitrogen)、Alexa Fluro 555羊抗兔IgG(Invitrogen)。使用含有DAPI的Vector作为封片剂。封片后,使用尼康荧光显微镜拍照获得荧光图像。结果发现,运用上述不同重编程因子对人骨髓间充质干细胞进行重编程获得的心脏祖细胞均能够强表达心脏中胚层祖细胞标志物蛋白Isl1、Gata4、Tbx5、Nkx2.5。
接下来分析流式细胞术分析重编程效率:用胰酶将汇合形成的piCPCs集落消化成单个细胞,用PBS清洗并将细胞分成每份5×106个细胞。随后用破膜液(eBioscience)将细胞膜、核膜破裂,用IC buffer(eBioscience)清洗干净。用100ul PBS重悬细胞,加入10ul血清封闭5min。随后按照说明书比例孵育ISL1(abcam,鼠单抗,1:200)和Tbx5(abcam,兔多抗,1:200)室温孵育20min,然后用PBS洗涤,1000rpm离心5min,弃去上清。然后,加入anti-mouse-FITC(1:500)、anti-rabbit-PE(1:500)流式二抗室温孵育15min。用PBS洗涤2遍,1000rpm离心5min,弃去上清,加入200ul PBS重悬并通过BD流式细胞仪进行测定。
结果发现,运用上述不同重编程因子对人骨髓间充质干细胞进行重编程获得的心脏祖细胞心脏相关基因荧光强度具有统计学差异,其中GHMT组合ISL1或GATA4荧光强度最强,而GNT组合Nkx2.5荧光强度最强。每个组合的isl+/Tbx5+双阳性细胞比例代表了其重编程效率,分别是GMT(45%),GMTB(40%),GHMT(80%),GNT(27%),GNTB(28%),GNMT(69%),GM1T(52%),GNM1T(33%),GMM1T(45%),GTB(21%),GM1TB(69%),GNTA(87%),GNTU(41%)和GNTAU(18%)。
此外,还发现:piCPCs体外向心脏三个谱系分化:将运用上述不同重编程因子对人骨髓间充质干细胞进行重编程获得的心血管祖细胞分别使用实施例1中的心肌细胞特定分化培养基、内皮细胞分化培养基、血管平滑肌分化培养基分化。隔天换夜。待观察到出现三角状或棍棒状的心肌细胞、铺路石样内皮细胞以及平滑肌样细胞形态,通过免疫荧光和流式细胞鉴定分析,表明所得piCPCs均具有向心肌细胞、血管平滑肌细胞和内皮细胞分化的潜能。
此外,对于重编程因子GNTA,在编程的第一阶段,GNTA-转导载体复合物与实施例1中的10%人骨髓间充质干细胞培养基(Cyagen)混合后,还采用如下终浓度:Gata4的终浓度为0.4μg/ml,Tbx5的终浓度是0.4μg/ml,Nkx2.5的终浓度是0.2μg/ml,AF9的终浓度是1μg/ml;将人骨髓间充质干细胞与含有重编程因子的培养基孵育12小时后,更换到常规不含有重编程因子的培养基培养,隔天后,再次更换为含有重编程因子的培养基培养,大约2~3个到循环后,细胞逐渐聚集,然后进去第二阶段;第二阶段为重编程阶段:将GNTA-转导载体复合物与实施例1中的心脏祖细胞重编程培养基混合,使得Gata4、Tbx5、Nkx2.5、AF9的终浓度较之于第一阶段减半;每获得含有重编程因子的心脏祖细胞重编程培养基,每个循环包括将聚集后的细胞(重编程对象)与所述含有重编程因子的心脏祖细胞重编程培养基孵育24小时后更换为不含编程因子的心脏祖细胞重编程培养基培养24小时,如此2~3循环后,即整个重编程的第8~10天,观察到形态学发生明显的变化,有“玫瑰花环样”集落出现(如图3所示);第三阶段为维持阶段,在铺有Matrigel的培养皿下,使用实施例1中的心脏祖细胞维持培养基维持、扩增心脏祖细胞。
接下来按照前述方法研究获得的心脏祖细胞的特征,如图4的结果显示了起始重编程对象人骨髓间充质干细胞经重编程因子GNTA重编程诱导后心脏祖细胞标志物基因Isl1、Gata4、Tbx5、Nkx2.5、MYH6mRNA表达情况(n=3),与图2中所示结果一致。说明,重组编程因子Gata4的终浓度是0.2~0.4μg/ml、Tbx5的终浓度是0.2~0.4μg/ml、Nkx2.5的终浓度是0.1~0.2μg/ml、AF9的终浓度是0.5~1μg/ml时,均能够成功重编程获得心脏祖细胞。
接下来按照前述方法进行细胞免疫荧光测定:图5可见了重编程后的piCPCs表达心脏中胚层祖细胞标志物蛋白Isl1、Gata4、Tbx5、Nkx2.5强表达。
接下来按照前述分析流式细胞术分析重编程效率:图6显示了本方法获得的心脏祖细胞是isl+/Tbx5+双阳性细胞,阳性率为87%左右。
此外,还发现:piCPCs体外向心脏三个谱系分化:将诱导获得的心血管祖细胞分别使用实施例1中的心肌细胞特定分化培养基、内皮细胞分化培养基、血管平滑肌分化培养基分化。隔天换夜。待观察到出现三角状或棍棒状的心肌细胞、铺路石样内皮细胞以及平滑肌样细胞形态,通过免疫荧光和流式细胞鉴定分析,图7显示了piCPCs能有效地表达心脏收缩蛋白(MHC和肌钙蛋白I)、血管平滑肌细胞收缩蛋白SMMHC、以及CD31,表明piCPCs具有向心肌细胞、血管平滑肌细胞和内皮细胞分化的潜能。
综上所述,在对人间充质骨髓干细胞进行编程时,重组编程因子Gata4的终浓度是0.2~0.4μg/ml、Tbx5的终浓度是0.2~0.4μg/ml、Nkx2.5的终浓度是0.1~0.2μg/ml、AF9的终浓度是0.5~1μg/ml时,均能够使获得的心脏祖细胞是isl+/Tbx5+双阳性细胞,阳性率为87%左右;且所获得的心脏祖细胞具有向心肌细胞、血管平滑肌细胞和内皮细胞分化的潜能。
(二)以人类脐带间充质干细胞UC-MSCs为起始重编程对象为例,采用不同重编程因子GMT/GMTB/GHMT/GNT/GNTB/GNMT/GM1T/GNM1T/GMM1T/GTB/GM1TB/GNTA/GNTU/GNTAU进行重编程,制备心脏祖细胞
参照(一)中所述重编程方法,按照BM-MSCs诱导piCPCs的方案,采用与其相同的重编程因子,对人类脐带间充质干细胞进行重编程,待观察到UC-MSCs聚集形成piCPCs克隆团,经诱导8天后根据试制造商说明书通过反转录和荧光定量qPCR测定,图8显示了UC-MSCs经不同重编程因子重编程后心脏祖细胞标志物基因Isl1、Flk1、Nkx2.5、Gata4转录水平。说明采用不同重编程因子
GMT/GMTB/GHMT/GNT/GNTB/GNMT/GM1T/GNM1T/GMM1T/GTB/GM1TB/GNTA/GNTU/GNTAU对UC-MSCs进行重编程,均能够诱导获得心脏祖细胞。然而不同组合的重编程效率有差异,其中GMM1T组合获得的ISL阳性的细胞数最多,GNT组合获得的Nkx2.5阳性细胞数最多,而GHMT组合获得阳性的细胞数最多。每个组合的isl+/Tbx5+双阳性细胞比例代表了其重编程效率,分别是GMT(14%),GMTB(26%),GHMT(27%),GNT(15%),GNTB(29%),GNMT(57%),GM1T(17%),GNM1T(38%),GMM1T(85%),GTB(41%),GM1TB(73%),GNTA(34%),GNTU(29%)和GNTAU(30%)。
先以GMM1T诱导UC-MSCs为示例,待UC-MSCs形成piCPCs后,用免疫荧光测定,具体染色如下:Flk1(CST,兔单抗,1:500)ISL1(abcam,鼠单抗,1:300)、Nkx2.5(abcam,兔单抗,1:200)、MHC(abcam,鼠单抗,1:300)、SMMHC(abcam,兔单抗,1:500)、CD31(abcam,鼠单抗,1:400)为一抗,以Alexa Fluro 488驴抗兔IgG(Invitrogen)、Alexa Fluro 555羊抗鼠IgG(Invitrogen)为荧光二抗,用Hoechst3342(1:2000)染细胞核,图9显示GMM1T有效地将UC-MSCs转变为具有标志物Flk1、Isl1、Nkx2.5的心脏祖细胞,而且分化后心脏谱系细胞基因MHC、SMMHC、CD31强表达。采用同样的实验方法,发现其他的13组编程因子也能够有效地将UC-MSCs转变为具有标志物Flk1、Isl1、Nkx2.5的心脏祖细胞,而且分化后心脏谱系细胞基因MHC、SMMHC、CD31强表达。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
SEQUENCE LISTING
<110> 余, 细勇
李, 晓红
吴, 岳恒
杨, 翔宇
<120> 一种制备心脏祖细胞的方法
<130> 171002
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Islet-1 Forward primer
<400> 1
ggatttggaa tggcatgcgg 20
<210> 2
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Islet-1 Reverse primer
<400> 2
catttgatcc cgtacaacct ga 22
<210> 3
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Nkx2.5 Forward primer
<400> 3
caagtgtgcg tctgcctttc 20
<210> 4
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Nkx2.5 Reverse primer
<400> 4
cgcacagctc tttcttttcg g 21
<210> 5
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Gata4 Forward primer
<400> 5
cgacacccca atctcgatat gtt 23
<210> 6
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Tbx5 Forward primer
<400> 6
aaagtcttca cctgagccct g 21
<210> 7
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Tbx5 Reverse primer
<400> 7
gcaaggttct gctctccaac t 21
<210> 8
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> MYH6 Forward primer
<400> 8
cggcccagat tcttcaggat t 21
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> MYH6 Reverse primer
<400> 9
acgctccttc tctgacttgc 20
- 还没有人留言评论。精彩留言会获得点赞!