一种人二倍体细胞微载体培养有效传代的方法与流程
本发明涉及生物
技术领域:
,特别是用于人二倍体细胞在生物反应器微载体放大培养过程中的一种有效传代的方法。
背景技术:
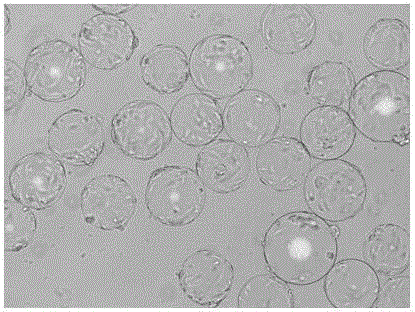
:MRC-5,KMB17,WI-38等人二倍体细胞是来源于人体正常组织的体外培养细胞,无潜在致癌性,无外源因子污染,而且具有广泛的病毒敏感谱,目前被认为是最安全的、最适宜的细胞基质,已被广泛应用于疫苗的生产。动物细胞的大规模培养技术被广泛地应用于生物制品的生产。20世纪80年代以来,集生物反应器和微载体为一体的培养技术已逐步建立,此技术兼具单层贴壁培养和悬浮培养的优势,微载体的比表面积大,可实现高密度培养;同时生物反应器容易测量与监控工艺参数,重现性好,生产效率高,可实现规模化生产。使用生物反应器微载体培养动物细胞进行生物制品的生产是生物制药行业的必然趋势。放大培养是生物反应器微载体培养技术中的重点和难点。微载体培养放大到下一级反应器的基本转移模式有胰酶消化转移和球转球转移。球转球转移是指在直接将上一级培养物(长满细胞的微载体)作为种子接入到下一级生物反应器中,通过细胞在旧球和新球之间的重新分配而实现放大培养,这种放大方法的优点在于操作步骤少,污染机会小,微载体利用率高。但是对于平板效率比较低的细胞而言,细胞的转移效率低,空球率高,而且新旧载体上的细胞生长状态不同步,代次不一,因此球转球的放大方式不能满足大规模药品生产的要求。胰酶消化转移是贴壁依赖型细胞最常用的消化模式,利用胰酶将细胞从微载体上消化下来,然后将细胞悬液加入到下一级生物反应器,粘附到新的微载体上进行培养。人二倍体细胞的生物反应器的放大培养一直是疫苗规模化生产中的难点。人二倍体细胞培养难度大,平板效率低,除了对培养基和牛血清等营养成分的要求比较高外,对pH、渗透压、胰酶作用、剪切力等环境刺激也非常敏感。在物反应器微载体放大培养过程中,尤其消化过程中,消化超出一定时限后胰酶引起的损伤,搅拌和通气造成的剪切力,微载体沉淀时对细胞的机械挤压,更换清洗液、消化液和培养液时pH、渗透压的变化,都容易使细胞遭到损伤,造成细胞活力降低,粘附效率下降、传代后细胞生长缓慢,从而对放大培养造成了限制,阻碍了生产效率的提高。因此摸索合适的胰酶消化方法和作用时间、微载体与细胞的分离方法、放大培养过程中有效传代后合适的起始培养条件,提高细胞活力、细胞收获率和细胞粘附率是人二倍体细胞微载体放大培养的关键,目前尚未有文献报道。技术实现要素:本发明的目的是为了解决现有生物反应器和微载体培养人二倍体细胞的消化传代方法中细胞活力、收获率和粘附率低,以及粘附不均匀的不足,提供一种人二倍体细胞在生物反应器和微载体放大培养过程中有效传代的方法,该方法能提高传代过程中细胞的活力、粘附率和粘附均匀度,使传代效率得到提高,广泛用于疫苗规模化生产。本发明用微载体培养人二倍体细胞种子,在种子培养体系中预平衡空白微载体,用含柠檬酸钠的胰酶消化液消化微载体上的种子细胞,在种子反应器中温和地间歇搅拌培养3-6小时,再转移至扩增反应器中扩增培养,得到人二倍体细胞微载体放大培养过程中有效的传代。本发明人二倍体细胞微载体培养有效传代的方法,该方法人二倍体细胞为MRC-5或KMB17细胞,微载体为cytodex1,用微载体培养人二倍体细胞种子,当种子反应器中微载体上培养的人二倍体细胞长至汇合度80%以上时,将预处理好的空白微载体加入到种子反应器中与细胞种子培养物共同培养6小时以上或过夜,用含柠檬酸钠的胰酶消化液消化微载体上的种子细胞,加入完全培养基中和后在种子反应器中温和地间歇搅拌,起始培养3-6小时,再将起始培养物从种子反应器转移至扩增反应器中进行扩增培养,得到人二倍体细胞微载体放大培养过程中有效的传代。本发明微载体的浓度为1-10克/升,空白微载体的预处理是指干的cytodex1微载体经磷酸盐缓冲液(PBS)水化过夜、洗涤3-5次、121℃高压灭菌处理后,用预热至37℃的基础培养基润洗置换1-2次;空白微载体和种子反应器中原有的微载体的比例为2:1-5:1。本发明所述的消化微载体上的种子细胞,包括以下步骤:①停止种子生物反应器的搅拌,使反应器内细胞种子培养物和新加入的微载体自然沉降,排去上清培养液,用预热至37℃洗涤液搅拌洗涤微载体及细胞1-3次。所述的洗涤液为含0.01%EDTA-2Na的D-Hanks,洗涤液和微载体的比例为100-200毫升/克cytodex1,搅拌速度为30-50rpm,洗涤时间为5-10分钟。②用预热至37℃的消化液间歇搅拌消化细胞,取样镜检观察细胞消化状态、检测脱落细胞浓度和活率从而控制消化时间。消化液的组成成份为:0.8%氯化钠、0.02%氯化钾、0.005%二水磷酸氢二钠、0.1%葡萄糖、0.1%碳酸氢钠、0.3%二水柠檬酸钠、0.25%胰酶、0.002%酚红;消化液和微载体的比例为:20-30毫升/克cytodex1;消化pH值:7.4-8.0;消化搅拌转速:50-150rpm,每5分钟搅拌1分钟间歇搅拌;消化温度:36-38℃;消化总时间:5-20分钟;每5分钟取样观察消化程度,90%以上的细胞从微载体上脱落后,加入完全培养基中和,50-100rpm搅拌1-3分钟混匀载体和细胞。本发明起始培养在种子反应器中进行,按照每15-45分钟搅拌1-3分钟的频率进行温和地间歇搅拌,搅拌速度为20-50rpm,采取能搅起全部微载体的最小速度和最短时间。培养参数为温度35-37℃,pH值7.2-7.4,溶氧(DO)30%-50%。起始培养时间为3-6小时,期间每3小时取样观察细胞粘附情况;再将起始培养物从种子反应器转移至扩增反应器中进行放大有效传代培养。本发明具体技术方案如下:1.人二倍体细胞在生物反应器微载体放大培养过程中有效传代的方法,包括下列步骤:⑴在种子反应器中用微载体培养人二倍体细胞;⑵在种子培养体系中预平衡微载体;⑶洗涤、消化种子细胞;⑷在种子反应器中起始培养;⑸在扩增反应器中扩增培养。本发明所述步骤⑴中人二倍体细胞为MRC-5或KMB17细胞,该种子培养物中微载体为cytodex1,微载体的浓度为1-10克/升,所述细胞在微载体上的汇合度不小于80%。本发明技术方案所述步骤⑵的预平衡是指空白的微载体经磷酸盐缓冲液(PBS)水化过夜、洗涤3-5次和121℃高压灭菌处理后,用预热至37℃的基础培养基润洗置换1-2次,当种子反应器的细胞在微载体上生长至汇合度为80%以上时,将空白微载体加入到种子反应器中与细胞种子培养物共同培养6小时以上或过夜。新加入的空白微载体和种子反应器中原有的微载体的比例为2:1-5:1。本发明技术方案所述步骤⑶中洗涤消化细胞,包括以下步骤:①停止种子生物反应器的搅拌,使反应器内细胞种子培养物和新加入的微载体自然沉降,排去上清培养液,用预热至37℃洗涤液洗涤微载体及细胞1-3次,洗涤液为含0.01%EDTA-2Na的D-Hanks,微载体和洗涤液的比例为100-200毫升/克cytodex1,搅拌速度为30-50rpm,洗涤时间为5-10分钟。②用预热至37℃的消化液消化细胞,消化液的组成成份为:含0.8%氯化钠、0.02%氯化钾、0.005%二水磷酸氢二钠、0.1%葡萄糖、0.1%碳酸氢钠、0.3%二水柠檬酸钠、0.25%胰酶(1:250)、0.002%酚红(pH7.5-8.0);消化液和微载体的比例为:20-30毫升/克cytodex1;消化pH值:7.4-8.0;消化搅拌转速:50-150rpm,每隔4分钟搅拌1分钟间歇搅拌;消化温度:36-38℃;消化总时间:5-20分钟;每5分钟取样观察消化程度,90%以上的细胞从微载体上脱落后,加入完全培养基中和,50-100rpm搅拌1-3分钟混匀载体和细胞;取样镜检观察细胞消化状态、检测细胞浓度及活率。本发明技术方案所述步骤⑷中在种子反应器中起始培养:加入完全培养基至种子反应器的培养体积,按照每15-45分钟搅拌1-3分钟的频率进行温和地的间歇搅拌,搅拌速度为20-50rpm,采取能搅起全部微载体的最小速度和最短时间;其它培养参数为温度35-37℃,pH值7.2-7.4,溶氧(DO)30%-50%;起始培养时间为3-6小时,期间每3小时取样观察细胞粘附情况。本发明技术方案所述步骤⑸中扩增培养:扩增反应器事先加入完全培养基按照培养参数(37℃,pH7.2-7.4,DO50-70%,30-70rpm)进行预热。种子经起始培养3-6小时,细胞95%以上粘附至微载体后,将起始培养物从种子反应器转移至扩增反应器中进行放大培养,定期检测细胞生长及代谢情况,根据检测结果进行培养基补给。本发明的有益效果体现在如下几个方面:1、本发明中新微载体用培养基进行润洗和加入到种子培养物中预平衡,使新载体在合适的pH、渗透压及含有粘附分子、细胞生长因子的培养液中平衡到最适于细胞粘附和生长的微环境,有利于粘附效率的提高和缩短接种后的延滞期。同时,新加入的空白微载体与原有的微载体在同一环境中培养,使其趋于一致,也有利于提高粘附的均匀度。2、本消化液成分以及柠檬酸钠和氯化钾代替EDTA,有利于提高消化效率,增加细胞分散度,缩短消化时间,减少对细胞的损害,提高细胞活力。3、预平衡、洗涤、消化和传代后的起始培养都在种子反应器中进行,避免了载体和细胞在不同容器中的多次转移,减少了细胞的损失,降低了污染的风险;种子反应器中原有的微载体在放大培养后继续使用,提高了载体的利用率。4、起始培养在种子反应器中进行,缩小了培养体积,提高了细胞和微载体的浓度,从而增加了细胞和微载体接触粘附的机会;对于贴壁效率低的人二倍体细胞,在早期阶段,间歇温和地搅拌,提供一定时间的静止培养,细胞的粘附速率和粘附比例将会增加。5、本发明具有提高传代过程中细胞的活力、粘附率和粘附均匀度,使传代效率得到提高,解决了人二倍体细胞在生物反应器和微载体上放大培养困难的问题,能广泛用于疫苗规模化生产。附图说明图1是本发明KMB17细胞在5升生物反应器中起始培养3小时后的粘附结果示意图;图2是本发明KMB17细胞在5升生物反应器中起始培养6小时后的粘附结果示意图。具体实施方案为了更清楚的理解本发明,以下用实施例进一步阐述本发明。实施例仅用于进一步具体说明本发明,而不以任何方式限制本发明。实施1MRC-5细胞的微载体有效传代培养⑴在1.5升生物反应器中微载体培养MRC-5细胞种子:将干的2.0克cytodex1微载体加入到合适的硅化过的玻璃瓶中,加入200毫升无Ca2+、Mg2+的PBS混匀后在室温下水化过夜,用上述PBS洗涤3次,121℃、30分钟高压湿热灭菌后备用。静置使无菌的微载体沉降,倾去上清,用温热的MEM培养基润洗置换2次。将微载体转移到1.5升生物反应器中,加入500毫升MEM完全培养基,设置好培养参数:温度37℃,pH7.2,DO50%,转速30rpm平衡过夜。将7个T225细胞瓶的MRC-5细胞消化后,将细胞悬液加入到生物反应器中,根据细胞悬液的量调整生物反应器内预留培养基的体积,至总体积1000毫升。设置好培养参数:温度37℃,pH7.2,DO50%,转速30rpm进行培养,每天两次检测细胞生长及代谢情况,当乳酸浓度大于1.5克/升时,更换一半体积的培养基。(2)空白微载体的预平衡:将干的10克cytodex1微载体加入到合适的硅化过的玻璃瓶中,加入800毫升无Ca2+、Mg2+的PBS混匀后在室温下水化过夜,用上述PBS洗涤3次,121℃、30分钟高压湿热灭菌后备用。静置使无菌的微载体沉降,倾去上清,用温热的MEM培养基润洗置换3次。在种子反应器的细胞在微载体上生长至汇合度80%以上时,将新载体加入到种子反应器中在培养体系中按照种子培养参数平衡过夜。(3)洗涤、消化种子细胞:①停止种子生物反应器的搅拌,使反应器内的粘附细胞的微载体和新加入的微载体自然沉降,排去上清培养液,用1200毫升预热至37℃洗涤液洗涤微载体及细胞,洗涤液为含0.01%EDTA-2Na的D-Hanks,30rpm搅拌重悬微载体及细胞,搅拌时间为10分钟,停止搅拌静置沉淀后去上清,洗涤3次。②用250毫升预热至37℃的消化液(含0.8%氯化钠、0.02%氯化钾、0.005%二水磷酸氢二钠、0.1%葡萄糖、0.1%碳酸氢钠、0.3%二水柠檬酸钠、0.25%胰酶(1:250)、0.002%酚红)消化细胞,100rpm每5分钟搅拌1分钟,37℃消化10-20分钟。每5分钟取样观察消化程度,10分钟后,90%以上的细胞从微载体上脱落,加入300毫升的MEM完全培养基中和,60rpm搅拌1分钟混匀载体和细胞。取样检测细胞浓度及活率。(4)在种子反应器中起始培养:加入预热至37℃的MEM完全培养基至1000毫升,按照每30分钟搅拌2分钟的频率进行温和的间歇搅拌,搅拌速度为30rpm。其它培养参数为37℃,pH7.2,DO50%,三通气模式,压缩空气、氧气、二氧化碳(CO2),期间每3小时取样观察细胞粘附情况。(5)5升生物反应器中的扩增培养:5升生物反应器提前5天加入MEM基础培养基按照培养参数(37℃,pH7.2,DO50%)进行无菌试验。无菌试验通过后,加入3升完全MEM培养基37℃,pH7.2,DO50%进行预培养,种子罐中的培养物起始培养6小时后,绝大部分细胞已经均匀地粘附到微载体上,将起始培养物转移到5升生物反应器中,60rpm搅拌1分钟搅拌均匀后,37℃,pH7.2,DO50%,三通气模式,压缩空气、氧气、二氧化碳(CO2),30-50rpm搅拌培养,每天取样检测pH值、葡萄糖和乳酸浓度,显微镜观察细胞在微载体上的生长情况及形态,低渗破细胞后计数细胞核。根据细胞的生长及代谢情况,调整培养参数、灌注新鲜培养基补给营养。实施例2KMB17细胞的微载体有效传代培养(1)在5.0升生物反应器中微载体培养KMB17细胞种子:将干的10.0克cytodex1微载体加入到合适的硅化过的玻璃瓶中,加入1000毫升无Ca2+、Mg2+的PBS混匀后在室温下水化过夜,用上述PBS洗涤5次,121℃、30分钟高压湿热灭菌后备用。静置使无菌的微载体沉降,倾去上清,用温热的M199培养基润洗置换2次。将微载体转移到1.5升生物反应器中,加入500毫升M199完全培养基,设置好培养参数:温度37℃,pH7.2,DO50%,转速30rpm平衡过夜。5.0升生物反应器提前5天加入M199基础培养基按照培养参数(37℃,pH7.2,DO50%)进行无菌试验。无菌试验通过后,加入3.0升M199完全培养基37℃,pH7.2,DO50%进行预培养。将一个10层细胞工厂的KMB17细胞消化后,将细胞悬液加入到生物反应器中,根据细胞悬液的量调整生物反应器内预留培养基的体积,至总体积3.5升。设置好培养参数(37℃,pH7.2,DO50%,转速30rpm)进行培养,每天两次检测细胞生长及代谢情况,2天后开始灌流培养,灌流的速度以能维持乳酸浓度低于1.5克/升为准。(2)空白微载体的预平衡:将干的20.0克cytodex1微载体加入到合适的硅化过的玻璃瓶中,加入2000毫升无Ca2+、Mg2+的PBS混匀后在室温下水化过夜,用上述PBS洗涤5次,121℃、30min高压湿热灭菌后备用。静置使无菌的微载体沉降,倾去上清,用温热的M199培养基润洗置换3次。在种子反应器的细胞在微载体上生长至汇合度80%以上时,将新载体加入到种子反应器中在培养体系中按照种子培养参数平衡过夜。(3)洗涤、消化种子细胞:①停止种子生物反应器的搅拌,使反应器内的粘附细胞的微载体和新加入的微载体自然沉降,排去上清培养液,用3.0升预热至37℃洗涤液洗涤微载体及细胞,洗涤液为含0.01%EDTA-2Na的D-Hanks,30rpm搅拌重悬微载体及细胞,停止搅拌静置沉淀后去上清,洗涤3次。②用600毫升37℃预热的消化液(含0.8%氯化钠、0.02%氯化钾、0.005%二水磷酸氢二钠、0.1%葡萄糖、0.1%碳酸氢钠、0.3%二水柠檬酸钠、0.25%胰酶(1:250)、0.002%酚红)消化细胞,100rpm每5分钟搅拌1分钟,37℃消化10-20分钟。每5分钟取样观察消化程度,15分钟后,90%以上的细胞从微载体上脱落,加入2.5升的M199完全培养基中和,100rpm搅拌2分钟混匀载体和细胞;取样镜检观察细胞消化状态、检测细胞浓度及活率。(4)在种子反应器中起始培养:按照每15分钟搅拌2分钟的频率进行温和的间歇搅拌,搅拌速度为30rpm。其它培养参数为37℃,pH7.2,DO50%,三通气模式(压缩空气、O2、CO2),期间每3小时取样观察细胞粘附情况。(5)14.0升生物反应器中的扩增培养:14.0升生物反应器提前5天加入10.0升M199基础培养基按照培养参数:温度37℃,pH值7.2,溶氧(DO)50%进行无菌试验。无菌试验通过后,置换为6.5升M199完全培养基37℃,pH7.2,DO50%进行预培养。种子罐中的培养物起始培养6小时后,绝大部分细胞已经均匀地粘附到微载体上,将起始培养物转移到14.0升生物反应器中,60rpm搅拌2分钟搅拌均匀后,37℃,pH7.2,DO50%,三通气模式(压缩空气、氧气、二氧化碳),30-60rpm搅拌培养,每天取样检测pH值、葡萄糖和乳酸浓度,显微镜观察细胞在微载体上的生长情况及形态;根据细胞的生长及代谢情况,调整培养参数、灌注新鲜培养基补给营养。实施例3传代过程中细胞活力,细胞脱落百分率、细胞粘附率和细胞回收率的测定及计算(1)在细胞消化步骤前,取1毫升均匀悬浮的培养物,1000rpm离心5分钟使载体细胞沉降,小心移除上清,加入含0.1%结晶紫的0.1摩尔/升的柠檬酸溶液重悬沉淀,37℃孵育10分钟后在漩涡混合仪上振荡5分钟,然后取样在血球计数板上计数被染色的释放的细胞核,测得细胞核浓度乘以培养体积即为消化前细胞总数;(2)在消化的每5分钟一次的取样时,吸取上清,加入含血清完全培养基中和胰酶后,取样1:1加入台盼蓝染色液,作用5分钟后在TC20自动细胞计数仪上检测细胞活力;(3)起始培养6小时后,取2毫升均匀悬浮的培养物,其中1毫升1000rpm离心5分钟使载体细胞沉降,同方法⑴计数细胞核浓度,乘以培养体积即为传代后细胞总数;另外1毫升静置5分钟左右使载体沉降,小心移除上清,同方法⑴计数细胞核浓度,乘以培养体积即为传代后粘附到微载体上的细胞数。细胞活率:TC20自动细胞计数仪直接显示检测结果;细胞粘附率:传代后粘附到微载体上的细胞数/传代后细胞总数×100%;细胞回收率:传代后细胞总数/消化前细胞总数×100%。表1传代效果评价结果实施例1实施例2细胞MRC-5KMB17微载体Cytodex1Cytodex1种子反应器体积/培养体积(升)1.5/1.05.0/3.5种子反应器微载体浓度(克/升)2.02.9扩增反应器体积/培养体积(升)5.0/3.514.0/10.0扩增反应器微载体浓度(克/升)3.43.0细胞活力(%)9896起始培养6小时细胞粘附率(%)10097细胞回收率(%)9591由表1和图1、图2的结果可以看出,传代后细胞活力在95%以上,起始培养3小时,细胞绝大部分均匀粘附到微载体上,上清中仅观察到极少量的游离细胞,起始培养6小时,粘附到微载体的细胞已经伸展开来,细胞粘附率达到97%以上,传代过程的细胞总回收率在90%以上。本发明针对人二倍体细胞的平板效率低和对环境敏感的特性,通过改变或优化消化前空白微载体预平衡的方法、消化液配方和起始培养条件,提高了细胞在微载体上的粘附效率,减少了传代过程中对细胞造成的损伤,实现了人二倍体细胞在生物反应器微载体培养过程中的有效传代,为人二倍体细胞高密度培养的产业化放大打下了坚实的基础。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1