一种无血清肝细胞培养基及其制备方法与流程
本发明涉及细胞培养用培养基,具体涉及一种用于肝细胞培养的无血清培养基及其制备方法。
背景技术:
肝脏作为人体中最重要的器官之一,承担着合成、分泌、代谢、解毒等多种复杂的功能。一旦由各种原因造成肝细胞的大量坏死,将会出现肝衰竭,导致机体代谢紊乱和毒性物质的堆积,而这反过来又加重了肝细胞的损伤,影响肝细胞的再生,进而形成肝衰竭的恶性循环。急性肝功能衰竭是一种严重的肝脏疾病,死亡率高达60~90%。目前,对此最有效的治疗方法为肝脏移植。然而,由于供体器官缺乏、费用高昂、需长期使用免疫抑制剂等原因,往往在等待供体过程中,病人由于病情进展而迅速死亡,极大地限制了肝移植手术的广泛开展。因此,以培养肝细胞为基础的生物型人工肝技术成为终末期肝病患者向原位肝移植顺利过渡、以及给急性肝功能衰竭患者受损肝脏提供得以再生和修复时机的重要手段。
随着肝细胞分离、培养技术的发展,体外培养的肝细胞能维持数小时的代谢活力,执行许多肝脏的代谢和解毒功能。由于肝移植供肝的严重短缺,利用体外培养的肝细胞进行细胞移植和构建生物人工肝(bioartificial liver systems,BAL)来治疗急性或慢性肝功能衰竭患者的方法正日益受到关注。
目前在肝细胞体外培养中通常使用添加10%(v/v)胎牛血清(FBS)的William’s-E培养基。然而,血清中的成分十分复杂,其中存在的未知物质和可变因素往往影响研究结果和治疗效果的准确性和重复性。另外,FBS等动物血清或血清蛋白等动物源成分进入人体后会引发多种不良反应及疾病,为细胞移植和BAL治疗的临床应用埋下了隐患。美国FDA即将停止受理用含血清细胞培养工艺的医疗技术以及制备的生物技术新药的申报。无血清培养已经成为生物技术制药生产和生物医学工程临床治疗的总趋势。
中国专利申请(CN105087465A)公布了一种肝细胞无血清培养基,其包括以下组分:基础培养基500mL;丝胶蛋白0.05~0.5%;地塞米松0.1~1000nmol/mL;肝细胞生长因子5~20ng/mL;表皮生长因子10~50ng/mL;青链霉素100U/mL,此专利申请主要结合了丝胶蛋白的优势。
技术实现要素:
为解决上述问题,本发明提供了一种无血清肝细胞培养基,其能够促进细胞的生长,并且能够大量促进白蛋白的合成,能够长时间维持细胞活力。本发明还提供了一种无血清肝细胞培养基的制备方法。
本发明通过以下技术方案实现:
一种无血清肝细胞培养基,包含基础培养基和添加组分,添加组分由以下成分及其浓度组成:胰岛素1-15mg/mL,转铁蛋白1-10mg/L,亚硒酸钠6-12μg/L,表皮生长因子10-100μg/L,肝细胞生长因子15-100ng/mL,层粘连蛋白0.5-0.85μg/mL,地塞米松1-10mmol/L,非酯化脂肪酸0.1-0.5mmol/L,碳酸氢钠1-3g/L,丹参酮ⅡA 10-50μg/L和隐丹参酮1-10μg/L。
优选地,所述非酯化脂肪酸由油酸,硬脂酸和棕榈油酸的组合物,各成分所占重量比为油酸35%,硬脂酸35%,棕榈油酸30%。
优选地,所述非酯化脂肪酸为亚油酸,油酸、软脂酸和硬脂酸的组合物,各成分所占比例为亚油酸20%,油酸45%,软脂酸25%和硬脂酸10%。
优选地,所述基础培养基为DMEM/F12,DEME或RPMI1640培养基。
一种无血清肝细胞培养基制备方法,其特征在于,包括以下步骤:
(1)准确称取基础培养基,胰岛素,转铁蛋白,亚硒酸钠,表皮生长因子,肝细胞生长因子和层粘连蛋白溶于灭菌后的超纯水中,搅拌均匀,得溶液I;
(2)准确称取地塞米松溶于10mL无水乙醇中,然后用超纯水稀释100倍,得溶液II;
(3)按比例准确称取非酯化脂肪酸后,溶于10mL无水乙醇中,搅拌均匀,得溶液III;
(4)将溶液II和溶液III加入溶液I中,并加入碳酸氢钠,搅拌均匀,得溶液IV;
(5)将溶液IV用0.22μM无菌滤膜过滤,即得。
本发明培养基所添加的各组分是通过大量科学实验筛选得到的。其中,胰岛素主要作用是增加细胞内的cAMP水平,促进葡萄糖、氨基酸利用,同时促进肝细胞内的RNA、蛋白质和脂肪酸的合成,抑制细胞凋亡,从而增强肝细胞的活力与功能。转铁蛋白通常和胰岛素、硒元素共同添加,简称ITS添加物,是大部分无血清培养基所必需的补充因子。转铁蛋白的主要作用为调节体内铁元素的代谢,通过细胞表面的转铁蛋白受体将铁元素转移到细胞内。亚硒酸钠作为人体的必需微量元素硒的存在形式,起到保护细胞免受氧化应激的作用。表皮生长因子和肝细胞生长因子的主要作用为促进肝细胞的增殖,以及调节肝细胞的功能。层粘连蛋白的主要作用为促进肝细胞的粘附,及其贴壁生长。地塞米松是体内重要的激素,参与肝细胞的糖代谢、脂类代谢等,能调节肝细胞的增殖与功能表达。
本发明培养基中添加有非酯化脂肪酸,已有研究证明非酯化脂肪酸对肝细胞具有调控作用。在本发明培养中,筛选出的油酸,硬脂酸和棕榈油酸组合物或亚油酸,油酸、软脂酸和硬脂酸的组合物添加到培养基中均能够显著地促进干细胞的生长。
丹参酮ⅡA是丹参的一种醇溶性成分,是天然的抗氧化剂。丹参酮ⅡA作为一种有效的细胞内脂质过氧化物与DNA相互作用的抑制剂,能消除线粒体脂质过氧化过程中产生的脂质自由基,从而能消除线粒体的吸收功能。与此同时,有研究证明丹参酮ⅡA能够改善TNF-α和H2O2所致体外培养肝细胞株的损伤。本发明意外地发现,当在培养基中加入10-50μg/L浓度范围内的丹参酮ⅡA和1-10μg/L浓度范围内的隐丹参酮不仅能够有效地抑制培养基内微生物地生长和病毒地感染,并且能够明显促进白蛋白的合成。
本发无血清肝细胞培养基与现有培养基相比,具有能够促进细胞的生长,并能够大量促进白蛋白的合成,能够长时间维持细胞活力的优势。
附图说明
图1不同培养基中肝细胞活力测定:培养基为实施例1-2及对比例1-3制备得到的培养基。
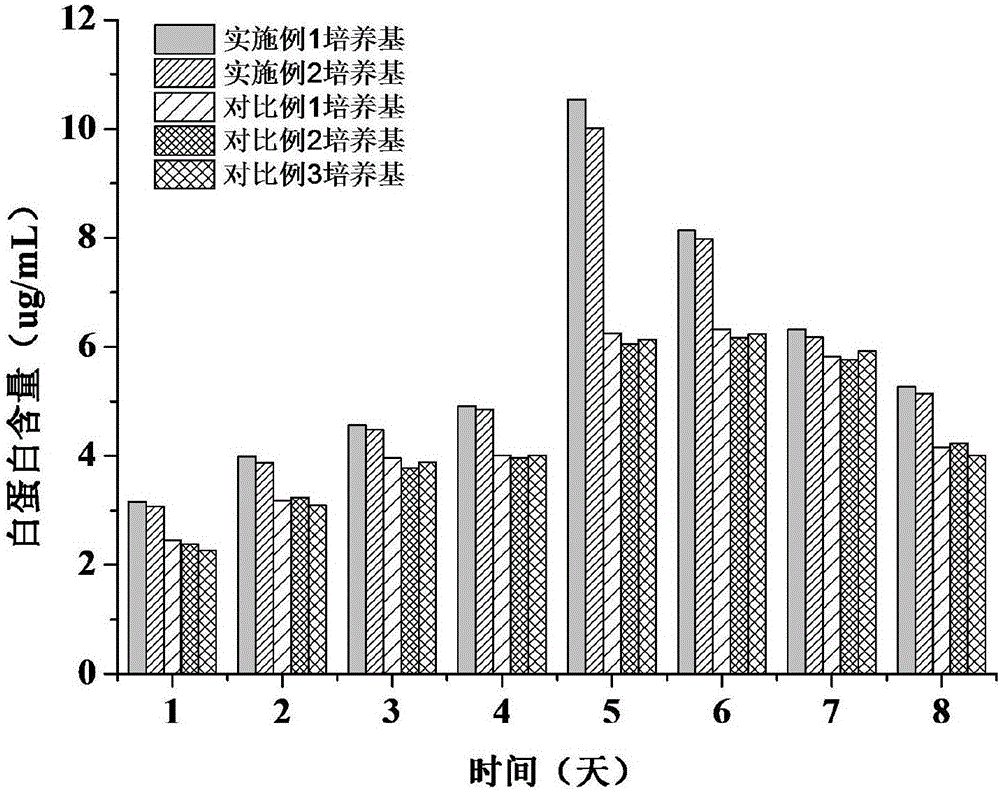
图2不同培养基中白蛋白(ALB)含量:培养基为实施例1-2及对比例1-3制备得到的培养基。
图3不同培养基中ALT(丙氨酸转氨酶)含量:培养基为实施例1-2及对比例1-3制备得到的培养基。
具体实施方式
下面结合附图和实施例对本发明做进一步详细说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
本发明所需药品为常规药品,丹参酮ⅡA、隐丹参酮购于南京景竹医药科技有限公司。
实施例1一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1235g/L,胰岛素8.65mg/mL,转铁蛋白5.74mg/L,亚硒酸钠8.2μg/L,表皮生长因子69μg/L,肝细胞生长因子78ng/mL,层粘连蛋白0.71μg/mL,地塞米松7.9mmol/L,油酸0.112mmol/L,硬脂酸0.112mmol/L,棕榈油酸0.096mmol/L,碳酸氢钠1.5g/L,丹参酮ⅡA45μg/L和隐丹参酮4.3μg/L。
本发明无血清肝细胞培养基制备方法,分为以下步骤:
(1)准确称取基础培养基,胰岛素,转铁蛋白,亚硒酸钠,表皮生长因子,肝细胞生长因子和层粘连蛋白溶于灭菌后的超纯水中,搅拌均匀,得溶液I;
(2)准确称取地塞米松溶于10mL无水乙醇中,然后用超纯水稀释100倍,得溶液II;
(3)按比例准确称取非酯化脂肪酸后,溶于10mL无水乙醇中,搅拌均匀,得溶液III;
(4)将溶液II和溶液III加入溶液I中,并加入碳酸氢钠,搅拌均匀,得溶液IV;
(5)将溶液IV用0.22μM无菌滤膜过滤,即得。
实施例2一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1235g/L,胰岛素8.65mg/mL,转铁蛋白5.74mg/L,亚硒酸钠8.2μg/L,表皮生长因子69μg/L,肝细胞生长因子78ng/mL,层粘连蛋白0.71μg/mL,地塞米松7.9mmol/L,亚油酸0.064mmol/L,油酸0.144mmol/L,软脂酸0.08mmol/L,硬脂酸0.032mmol/L,碳酸氢钠1.5g/L,丹参酮ⅡA45μg/L和隐丹参酮4.3μg/L。
所述培养基制备方法与实施例1类似。
实施例3一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1242g/L,胰岛素1mg/mL,转铁蛋白1mg/L,亚硒酸钠6μg/L,表皮生长因子10μg/L,肝细胞生长因子15ng/mL,层粘连蛋白0.5μg/mL,地塞米松1mmol/L,油酸0.035mmol/L,硬脂酸0.035mmol/L,棕榈油酸0.03mmol/L,碳酸氢钠1g/L,丹参酮ⅡA 10μg/L和隐丹参酮1μg/L。
所述培养基制备方法同实施例1类似。
实施例4一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1225g/L,胰岛素15mg/mL,转铁蛋白10mg/L,亚硒酸钠12μg/L,表皮生长因子100μg/L,肝细胞生长因子100ng/mL,层粘连蛋白0.85μg/mL,地塞米松10mmol/L,亚油酸0.1mmol/L,油酸0.225mmol/L,软脂酸0.125mmol/L,硬脂酸0.05mmol/L,碳酸氢钠3g/L,丹参酮ⅡA 50μg/L,隐丹参酮10μg/L。
所述培养基制备方法与实施例1类似。
对比例1一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1235g/L,胰岛素8.65mg/mL,转铁蛋白5.74mg/L,亚硒酸钠8.2μg/L,表皮生长因子69μg/L,肝细胞生长因子78ng/mL,层粘连蛋白0.71μg/mL,地塞米松7.9mmol/L,油酸0.112mmol/L,硬脂酸0.112mmol/L,棕榈油酸0.096mmol/L,碳酸氢钠1.5g/L,隐丹参酮49.3μg/L。
所述培养基制备方法与实施例1类似。
与实施例1区别在于,未加入丹参酮ⅡA,并且加入隐丹参酮的量为实施例中丹参酮ⅡA和隐丹参酮的总量。
对比例2一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1235g/L,胰岛素8.65mg/mL,转铁蛋白5.74mg/L,亚硒酸钠8.2μg/L,表皮生长因子69μg/L,肝细胞生长因子78ng/mL,层粘连蛋白0.71μg/mL,地塞米松7.9mmol/L,油酸0.224mmol/L,棕榈油酸0.096mmol/L,碳酸氢钠1.5g/L,丹参酮ⅡA45μg/L,隐丹参酮4.3μg/L。
所述培养基制备方法与实施例1类似。
与实施例1区别在于,未加入硬脂酸,并且油酸的加入量为实施例1中硬脂酸和油酸的总量。
对比例3一种无血清肝细胞培养基
一种无血清肝细胞培养基,由以下成分及其浓度组成:DMEM/F1235g/L,胰岛素8.65mg/mL,转铁蛋白5.74mg/L,亚硒酸钠8.2μg/L,表皮生长因子69μg/L,肝细胞生长因子78ng/mL,层粘连蛋白0.71μg/mL,地塞米松7.9mmol/L,亚油酸0.064mmol/L,油酸0.144mmol/L,软脂酸0.08mmol/L,花生四烯酸0.032mmol/L,碳酸氢钠1.5g/L,丹参酮ⅡA45μg/L,隐丹参酮4.3μg/L。
所述培养基制备方法与实施例1类似。
与实施例2区别在于,将硬脂酸替换为花生四烯酸。
试验例1培养基质量测试
测试培养基:实施例1-4制备得到的培养基以及对比例1-2制备得到的培养基。
测试内容:
(1)无菌检测
使用平板法检测,取羊血琼脂平板1块和沙保弱琼脂平板1块,平衡至室温。取上述测试培养基为样品经4000rpm离心15min后从样品管底部吸取样品,每块平板100μL,用接种针划线。将平板放入37℃培养箱中,培养48h后观察结果为阴性,样品合格。
(2)内毒素检测
使用凝胶法检测,取上述测试培养基为样品经稀释后,同阴性对照、阳性对照、供试品阳性对照分别加入经无菌检查用水复融后的鲎试剂中,每种平行两管。结果为阴性对照管为阴性,阳性对照管为阳性,供试品阳性对照管为阳性且样品管为阴性,样品合格。
(3)支原体检测为PCR法检测
将上述测试培养基为样品进行沸水浴10min后经12000rpm离心3min后使用,采用25μL体系对待测样品、阳性对照、阴性对照进行PCR扩增;扩增产物进行琼脂糖凝胶电泳,在凝胶成像仪上观察检测结果。检测结果为阴性,样品合格。
试验例2不同培养基中肝细胞生长及细胞生物功能检测
试验对培养基:实施例1-4及对比例1-3制备得到的培养基
试验内容:
细胞培养:将107个/mL的C3A细胞接种至25cm2培养瓶中,首先采用5mL的含血清培养基(每500mL的DMEM高糖培养基中添加55mL的胎牛血清、5mmol的HEPES、10000U的青霉素和10000U的链霉素)培养,两天换一次液。待C3A细胞生长稳定后,采取逐步降低血清的方法,以适应培养基的突然改变及无血清培养基的培养。首先,采用2.5mL的含血清培养基加入2.5mL的试验培养基共同培养C3A细胞,即血清浓度为5%,两天换一次液。待C3A细胞传5代并稳定后,进一步降低血清的浓度,采用1.25mL的含血清培养基加入3.75mL的试验培养基培养基共同培养,即血清浓度为2.5%,两天换一次液。待C3A细胞传5代并稳定后,过渡到100%的试验培养基中培养基分别单独培养,不含任何血清成分,即采用5mL的无血清培养基长期传代培养。将稳定后的C3A细胞接种于6孔板和96孔板,继续培养8天。
细胞计数:对培养细胞不同时间内取样采用台盘蓝计数法进行细胞计数,试验结果如表1所示。
台盘蓝计数法:胰蛋白酶消化细胞后离心,制备单细胞悬液,并作适当稀释(106细胞/mL),取1mL细胞悬液移入EP中,加0.1mL0.4%台盼蓝溶液,混匀,加入血细胞计数板,观察计数。如果细胞膜完整,细胞不为台盘蓝染色,则为正常细胞;如果细胞膜不完整、破裂,台盘蓝染料进入细胞,细胞变蓝,即为坏死。
表1各培养基中不同时间段细胞计数情况
试验例3采用MTT染色法细胞活力检测
收集实施例1、实施例2,对比例1,对比例2和对比例3培养基中对数期的C3A细胞,调整C3A细胞悬液浓度,每个孔加入100μL的检测液,使待测C3A细胞密度为1000-10000个/孔,并在5%CO2,37℃的环境中孵育。然后每孔加入20uL浓度为5mg/mL的MTT溶液,继续培养4h。然后终止培养,吸去孔内培养液,再在每孔加入150uL的二甲基亚砜(DMSO),置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD490nm处测量各孔的吸光值,记录结果,以时间为横坐标,吸光值为纵坐标绘制曲线,如图1所示。
由图1可知,实施例培养基中肝细胞生长速度明显快于对比例,并且实施例培养基中细胞稳定期长,细胞凋亡速度慢,由此可以说明本发明培养基能够促进肝细胞的生长。
试验例4不同培养基中肝细胞生物功能检测
将不同培养基中的C3A细胞分别接种于6孔板中,分别用3mL的各组的培养基各自培养,每天更换培养基同时收集留取上清样品,采用放射免疫分析法测定白蛋白(ALB)含量,同时采用全自动生化分析仪检测上清ALT(丙氨酸转氨酶),试验结果如图2、图3所示。
由图2可知,在不同培养时间内实施例培养基培养得到的肝细胞培养液中白蛋白含量始终高于对比例,并且在培养5时,实施例1、2培养液中白蛋白含量达到最大,分别为10.54μg/mL和10.02μg/mL。由此可知,本发明培养基有利于肝细胞自身生长有利蛋白的分泌表达。
由图3可知,在不同培养时间内实施例培养得到的肝细胞培养液中ALT含量明显低于对比例,从而能够促进肝细胞生长。
- 还没有人留言评论。精彩留言会获得点赞!