亚磷酸三(1‑烷氧基‑4‑羟基‑2,2,6,6‑四甲基哌啶醇)酯及其制备方法与流程
本发明涉及的是一类新的n-烷氧基受阻胺化合物及其制备方法,具体地说是亚磷酸三(1-烷氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯及其制备方法,该化合物可作为多功能光稳定剂,属于化工及高分子材料助剂领域。
背景技术:
受阻胺(hals)光稳定剂因具有高效、耐抽出、耐高温、低毒或无毒且不易着色等优异性能而广泛应用于聚烯烃农用薄膜、高分子涂料、人造地毯及皮革、工程塑料等领域[王仰东,刘涛,孙德江,等.聚烯烃用抗氧剂及光稳定剂的研究进展.中国塑料,2008,22(6):5-11]。
受阻胺主要是指哌啶衍生物,该类化合物包含一个含氮的六元杂环,且具有较强的空间位阻效应,化学结构通式如下:
式中x=h,r或or,r为烷基或环烷基,a为连接哌啶基的辅助基团。x为or的受阻胺称为n-烷氧基受阻胺(或称为1-烷氧基受阻胺,简称nors)。
受阻胺根据x的不同而显现出不同的碱性。传统的受阻胺大多是x为h的四甲基哌啶的衍生物,由于其具有很强的碱性,在应用于农用塑料薄膜和阻燃塑料时常常受到限制。因为农药和化肥中存在着大量的硫化物和卤化物,该类化合物在分解过程中会产生酸性物质,与具有强碱性的hals发生反应使哌啶基团失去活性,进而降低了hals的光稳定作用[sinturelc,lemairej,gardettejl.photooxidationoffireretardedpolypropylene:iii.mechanismofhalsinactivation.europpolymj,2000,36(7):1431-1443]。同样,阻燃塑料中的阻燃剂在使用过程中产生的酸性物质(如hbr)会与hals发生反应,产生类似nh4+br-的铵盐而使hals失去活性[antosk,sedlarj.influenceofbrominatedflameretardantthermaldecompositionproductsonhals.polymdegrstab,2005,90(1):188-194;sinturelc,lemairej,gardettejl.photooxidationoffireretardedpolypropylene:iii.mechanismofhalsinactivation.europpolymj,2000,36(7):1431-1443]。
nors碱性最弱,不易与高分子材料中的酸性组分发生反应,保持了材料的稳定性,且将烷氧基引入受阻胺中,不仅降低了nors中的活性氮原子周围的电子云密度,而且其正好参与在捕捉自由基的循环中,提高了氮氧自由基(no·)捕捉活性基团的能力。正是由于该原因,nors逐渐受到科研工作者的重视,并且获得了快速发展。
近些年的研究发现,nors不仅具有良好的光稳定性,而且对聚烯烃薄制品具有良好的阻燃效果。如瑞士汽巴精化公司开发的flamestabnor116(fn116)多功能阻燃剂具有下列优点[谢鸽成.聚烯烃阻燃体系的革命性进展-n-烷氧基受阻胺阻燃剂flamestabnor116.塑料助剂,2000,(5):24-26;曹堃,吴水良,李彦,等.n-取代烷氧基受阻胺类阻燃剂及其在聚烯烃中的应用.化学进展,2011,23(6):1189-1195]:
1)对聚烯烃薄制品如纤维、薄膜等具有较高的阻燃效率,用量仅千分之几就能达到良好的阻燃效果;
2)与卤系阻燃剂的相互作用较小,因而与卤系阻燃剂复配使用时不会影响其光稳定作用;
3)热稳定性和抗紫外光性能均优于传统的受阻胺光稳定剂;
4)与高分子材料的相容性好,不会迁移至材料表面而降低其效果和影响其美观;
5)对材料的机械和加工性能影响较小,抗抽提性能优异;
6)不含卤素,不会对人体的安全和环境造成危害。
flamestabnor116是一种具有较高分子量的nors[galbojp,gracehc,horseydw,etal.n,n',n"-tris{2,4-bis[(hydro-carbyloxy-2,2,6,6-tetramethylpiperdin-4-yl)alkylamino]-s-triazin-6-yl}-3,3'-ethylenediiminodipropylamines,theirisomersandbridgedderivatives,preparationthereof,andorganiccompositionsstabilizedtherewith.us:5844026,1998],其化学结构式如下所示:
flamestabnor116的结构非常复杂,合成工艺非常繁琐[galbojp,detlefsenre.hydrogenperoxidecatalyzedprocessforthepreparationofstericallyhinderedn-hydrocarbyloxyamines.wo:2005005388,2005-1-20;basbasai,alvisid,cordovar,etal.processforthepreparationofstericallyhinderednitroxylethers.wo2008003605,2008-01-10]。汽巴精化公司还开发出一种较新的nors(tinuvinnor371)。它具有优异的耐酸性能,特别适用于农用塑料大棚,对农药具有优良的耐受性[王仰东,刘涛,孙德江,等.聚烯烃用抗氧剂及光稳定剂的研究进展.中国塑料,2008,22(6):5-11]。tinuvinnor371的化学结构如下:
tinuvinnor371的结构与flamestabnor116的相似,其结构和合成工艺也非常复杂。
tinuvin152是一种结构相对简单的nors,化学名为2,4-双-[n-正丁基-n-(1-环己氧基-2,2,6,6-四甲基-4-哌啶基)氨基]-6-(2-羟乙氨基)-1,3,5-三嗪,化学结构如下:
tinuvin152具有很低的挥发性,耐抽提性和耐迁移性良好,光稳定性和抗紫外性能均优于传统的hals,但没有文献报道其是否有阻燃作用[唐蓉萍,陈立功,覃韦通,等.受阻胺光稳定剂tinuvin152的合成工艺研究.现代化工,2008,28(10):51-53]。tinuvin152的结构和合成工艺与flamestabnor116的相似,合成工艺也很复杂。
总之,目前报道的nors品种很少,现有品种的结构和合成工艺非常复杂,影响了nors的推广使用。
技术实现要素:
为了克服现有nors的以上缺点和增加nors的品种,本发明的发明者设计和合成了一类新型的n-烷氧基受阻胺化合物-亚磷酸三(1-烷氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯(简称norps),化学结构如下:
式中r为cnh2n+1-,n=1,2,3……
norps可采用如下路线合成:
本发明的亚磷酸三(1-烷氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的制备步骤如下:
(1)合成:将1-烷氧基-4-羟基-2,2,6,6-四甲基哌啶醇、缚酸剂和溶剂加入到带有机械搅拌的反应釜中,用冰浴将物料温度降至15℃以下,再缓慢加入pcl3,随后将物料温度逐步升温至25~70℃,并于该温度下反应6~18h。
(2)提纯:反应结束后用去离子水洗涤3次,油相蒸出溶剂得粗品。粗品用无水乙醇常温下结晶,过滤,滤饼用无水乙醇洗涤3次,再于80℃左右干燥至恒重得产品。
进一步地,所述的pcl3和1-烷氧基-4-羟基-2,2,6,6-四甲基哌啶醇的摩尔比为1:2.5~3.5,优选为1:2.8~3.2。
所述的溶剂为二氯甲烷、氯仿、二氯乙烷、四氢呋喃、乙腈等,优选为氯仿。
所述的pcl3和溶剂的质量比为1:2.5~7.5,优选为1:4.0~5.5。
所述的缚酸剂为吡啶、三乙胺、碳酸钠等,优选为三乙胺。
所述的缚酸剂和pcl3的摩尔比为4.0~12.0:1,优选为7.0~9.0:1。
所述的结晶用无水乙醇和pcl3的质量比为20~40:1,优选为25~35:1。
进一步地,所述的反应温度优选为40~60℃,反应时间优选为9~12h。
本发明的亚磷酸三(1-烷氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的优点在于:其碱性很弱,因而它具有优异的耐酸性能,特别适用于农用塑料大棚和阻燃塑料,并且和现有同类产品相比,结构简单,易于合成。
附图说明
图1为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的红外光谱图;
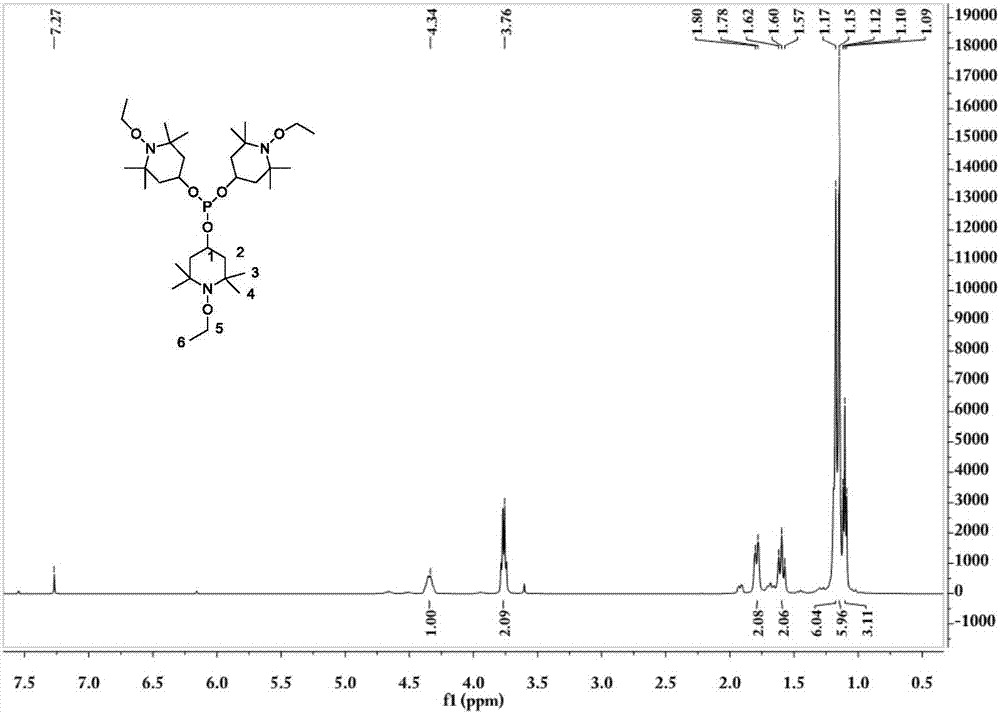
图2为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振氢谱图;
图3为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振碳谱图;
图4为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振磷谱图;
图5为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的红外光谱图;
图6为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振氢谱图;
图7为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振碳谱图;
图8为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振磷谱图。
具体实施方式
以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
除非另有说明,本发明中所采用的百分数均为质量百分数。
产品的熔点采用xt4b型显微熔点测定仪测定。
产品的核磁共振氢谱、碳谱和磷谱采用德国布鲁克公司的avance-500型核磁共振仪测定,均以氘代氯仿为溶剂,测磷谱时以密装在毛细管中的85%的磷酸为外标。产品的摩尔含量根据磷谱结果按面积归一法计算。
红外光谱采用德国布鲁克公司的tensor-27红外光谱仪测定,采用溴化钾压片法。
中间体的含量采用美国瓦里安公司的cp-3800气相色谱仪测定,色谱柱为db-5,250mm×4.6mm,含量采用面积归一法计算。
质谱采用美国安捷伦科技有限公司的agilent19091s-433型气质联用仪测定。
磷含量采用喹钼柠酮重量法分析,具体过程参考gb/t23843-2009。测定步骤如下:称取0.5g样品(精确至0.1mg),加入250ml带回流冷凝管的碘量瓶中,并加少量蒸馏水和10ml质量分数为50%的hno3,加热回流约1-2h,待溶液澄清后停止加热,冷却后定容于100ml容量瓶。用移液管从100ml容量瓶中移取10ml溶液置于250ml烧杯中。加入10ml硝酸溶液、30ml蒸馏水,盖上表面皿,加热至沸。取下烧杯,加入40ml喹钼柠酮溶液(过量)并不断搅拌至没有黄色沉淀继续析出。静置冷却后,用在180℃下干燥至恒重的玻璃砂坩埚过滤,再用蒸馏水洗涤1-2次。将玻璃砂坩埚连同沉淀于180℃干燥约40min,取出待其冷却后,称量。同时做空白试验。磷的含量按下列公式计算:
式中:w-磷的质量分数,%;
m1-过滤后干燥至恒重的玻璃砂坩埚的质量,g;
m2-干燥至恒重的玻璃砂坩埚的质量,g;
m-取样品的质量,g。
实施例1
亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的制备工艺,包括如下步骤:
(1)1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇的合成
将0.036mol(6.2g)4-羟基-2,2,6,6-4甲基哌啶氮氧自由基、0.432mol(31.2g)丁酮、20ml30%h2o2加入到带搅拌的100ml三口烧瓶中,于5~13℃下加入0.21gcucl,搅拌20min,调节ph至3.5左右,升温至30℃,反应18h;反应结束后加入60ml乙酸乙酯萃取,有机相用40ml×3的去离子水洗涤3次,蒸出乙酸乙酯和未反应的丁酮,釜残加入50ml去离子水搅拌5min,过滤,滤饼用50ml×3的去离子水洗涤3次,再于80℃左右干燥至恒重得粗品;粗品用15ml乙醇/水(质量比=3:7)混合溶剂于60℃结晶,过滤,滤饼用10ml×395%乙醇洗涤3次,再于80℃左右干燥至恒重得近白色粉末状产品4.73g,产率为65.31%,产品含量为98.91%(气相色谱分析),熔点为84~86℃。
(2)三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)亚磷酸酯的合成
将0.03mol(6g)1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇、0.09mol(9.1g)三乙胺和50ml氯仿加入到带有机械搅拌的干燥过的100ml三口烧瓶中,用冰浴将物料温度降至15℃以下,之后缓慢加入0.01mol(1.37g)pcl3,再用水浴将物料温度加热至50℃,并于该温度下反应12h;反应结束后用100ml×3的去离子水洗涤3次,油相蒸出氯仿得粗品,再加入50ml无水乙醇搅拌5min,过滤,滤饼用30ml×2的无水乙醇洗涤两次,并于80℃左右干燥至恒重得4.49g(理论产量6.31g)白色粉末状产品,产率为71.20%,熔点138~140℃,磷含量为4.88%(理论磷含量为4.91%),摩尔含量为99.01%(磷谱分析,面积归一)。
本发明还通过红外光谱和核磁共振谱测定对本实施例得到的产物结构进行了表征。图1为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的红外光谱图(σ,cm-1);图2为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振氢谱图(1h-nmr,500mhz,cdcl3);图3为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振碳谱图(13c-nmr,500mhz,cdcl3);图4为本发明实施例1得到的亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振磷谱图(31p-nmr,500mhz,cdcl3)。
图1中,2972cm-1是-ch3的c-h的反对称伸缩振动吸收峰;2932cm-1是-ch2-的c-h的反对称伸缩振动吸收峰;2881cm-1是-ch3的c-h的对称伸缩振动吸收峰;1467cm-1是-ch3的c-h的反对称变形振动吸收峰;1375cm-1为-ch3的c-h的对称变形振动吸收峰;1248cm-1为c-n的伸缩振动吸收峰;1217cm-1为n-o的伸缩振动吸收峰;1197cm-1和1172cm-1为p-o的伸缩振动吸收峰;1002cm-1为c-o的伸缩振动吸收峰;773cm-1为乙基中的-ch2-的面内摇摆振动吸收峰。以上红外特征与目标产物的吻合。
图2中,δ=1.09ppm、1.10ppm和1.12ppm处的峰为6号位甲基的氢质子峰,δ=1.15ppm处的峰为4号位甲基的氢质子峰,δ=1.17ppm处的峰为3号位甲基的氢质子峰,δ=1.57ppm和1.80ppm处的峰为2号位亚甲基的的氢质子峰,δ=3.76ppm处的峰为5号位亚甲基的氢质子峰,δ=4.34ppm处的峰为1号位叔碳上的氢质子峰,δ=7.27ppm处的峰为溶剂cdcl3中未被取代的氢的质子峰。以上氢谱特征与目标产物的吻合。
图3中,δ=13.56ppm处的峰为7号位甲基的碳原子峰,δ=20.98ppm处的峰为4号位甲基的碳原子峰,δ=33.08ppm处的峰为5号位甲基的碳原子峰,δ=47.09ppm处的峰为2号位亚甲基的碳原子峰,δ=59.89ppm处的峰为3号位季碳的碳原子峰,δ=65.06ppm处的峰为1号位叔碳的碳原子峰,δ=72.34ppm处的峰为6号位亚甲基的碳原子峰,δ=76.75ppm、77.00ppm、77.26ppm处的峰为溶剂cdcl3中的碳原子的三重峰。以上碳谱特征与目标产物的吻合。
图4中,δ=139.43ppm处的峰为目标产物中的磷原子峰,δ=5.50ppm处的峰为亚磷酸二(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的磷原子峰。以上磷谱特征与目标产物的吻合。按峰面积计算,亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的摩尔含量为99.01%。
图1~4的结果证明本发明得到的产物为亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯。
实施例2
亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的制备工艺,包括如下步骤:
将0.03mol(6.4g)1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇(参考实施例1中的方法合成,用正丁醛代替丁酮,含量98.6%)、0.09mol(9.1g)三乙胺和50ml氯仿加入到带有机械搅拌的干燥过的100ml三口烧瓶中,用冰浴将物料温度降至15℃以下,之后缓慢加入0.01mol(1.37g)pcl3,再用水浴将物料温度加热至50℃,并于该温度下反应12h;反应结束后用100ml×3的去离子水洗涤3次,油相蒸出氯仿得粗品,再加入50ml无水乙醇搅拌5min,过滤,滤饼用30ml×2的无水乙醇洗涤两次,并于80℃左右干燥至恒重得5.03g(理论产量6.73g)白色粉末状产品,产率为74.74%,熔点95~98℃,磷含量为4.57%(理论磷含量为4.61%),摩尔含量为98.04%。
本发明也通过红外光谱及核磁共振谱测定对本实施例得到的产物结构进行了表征。图5为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的红外光谱图(σ,cm-1);图6为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振氢谱图(1h-nmr,500mhz,cdcl3);图7为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振碳谱图(13c-nmr,500mhz,cdcl3);图8为本发明实施例2得到的亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的核磁共振磷谱图(31p-nmr,500mhz,cdcl3)。
图5中,2977cm-1是-ch3的c-h的反对称伸缩振动吸收峰;2939cm-1为-ch2-的c-h的反对称伸缩振动吸收峰;2877cm-1是-ch3的c-h的对称伸缩振动吸收峰;1468cm-1是-ch3的c-h的反对称变形振动吸收峰;1373cm-1和1359cm-1为-ch3的c-h的对称变形振动吸收峰;1247cm-1为c-n的伸缩振动吸收峰;1217cm-1为n-o的伸缩振动吸收峰;1196cm-1和1172cm-1为p-o的伸缩振动吸收峰;1006cm-1为c-o的伸缩振动吸收峰;786cm-1为乙基中的-ch2-的面内摇摆振动吸收峰。以上红外特征与目标产物的吻合。
图6中,δ=0.92ppm、0.93ppm和0.95ppm处的峰为7号位甲基的氢质子峰,δ=1.15ppm处的峰为4号位甲基的氢质子峰,δ=1.18ppm处的峰为3号位甲基的氢质子峰,δ=1.54ppm和1.80ppm处的峰为2号位亚甲基的氢质子峰,δ=1.78ppm和1.80ppm处的峰为6号位亚甲基的氢质子峰,δ=3.69ppm处的峰为5号位亚甲基的氢质子峰,δ=4.35ppm处的峰为1号位叔碳上的氢质子峰,δ=7.27ppm处的峰为溶剂cdcl3中未被取代的氢原子的质子峰。以上氢谱特征与目标产物的吻合。
图7中,δ=10.87ppm处的峰为8号位甲基的碳原子峰,δ=21.02ppm处的峰为4号位甲基的碳原子峰,δ=21.95ppm处的峰为7号位的碳原子峰,δ=33.14ppm处的峰为5号位甲基的碳原子峰,δ=44.17ppm处的峰为2号位亚甲基的碳原子峰,δ=60.07ppm处的峰为3号位季碳的碳原子峰,δ=65.01ppm处的峰为1号位叔碳的碳原子峰,δ=78.45ppm处的峰为6号位亚甲基的碳原子峰,δ=76.75ppm、77.01ppm、77.26ppm处的峰为溶剂cdcl3中碳原子的三重峰。以上碳谱特征与目标产物的吻合。
图8中,δ=139.62ppm处的峰为目标产物中的磷原子峰,δ=5.69ppm处的峰为亚磷酸二(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的的磷原子峰。以上磷谱特征与目标产物的吻合。按峰面积计算,亚磷酸三(1-乙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯的摩尔含量为98.04%。
图5~8的结果证明本发明得到的产物为亚磷酸三(1-丙氧基-4-羟基-2,2,6,6-四甲基哌啶醇)酯。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!