重组ΔfHbp‑NadA融合蛋白载体及其制备方法和应用与流程
本发明属于生物技术领域,特别是涉及一种用于多价脑膜炎球菌和肺炎球菌缀合疫苗的重组δfhbp-nada蛋白载体及其制备方法和应用。
背景技术:
一、病原微生物与疫苗
能引起人体或动物体发生传染病的微生物,称为病原微生物或致病微生物。传染是指病原微生物侵入机体后,在一定的部位生长、繁殖,并引起一系列病理生理的过程。当病原微生物侵入机体后,病原微生物与机体互相作用,互相改变对方的活性与功能,因此能否引起传染病,一方面取决于病原微生物的致病能力即致病性或毒力,另方面还取决于机体的抵抗力即免疫力。病原性细菌引起传染的能力大小,就是细菌的毒力或致病性。细菌毒力的有无和毒力的强弱主要取决于它的侵袭力、产毒素性和引起超敏反应的能力。
细菌产生的毒素可分为外毒素和内毒素两大类。外毒素是病原菌在生长繁殖期间分泌到周围环境种的一种代谢产物,主要由革兰氏阳性菌产生,少数革兰氏阴性菌也能产生。其化学组成是蛋白质,抗原性强,毒性也强,但极不稳定,对热和某些化学物质敏感,容易受到破坏。常见的如:白喉棒杆菌产生的白喉外毒素、破伤风梭菌产生的破伤风毒素、霍乱弧菌产生的肠毒素、肉毒梭菌产生的肉毒毒素等。大多数革兰氏阴性细菌能产生内毒素,实际上它存在于细菌细胞壁的外层,属于细胞壁的组成部分,一般情况下并不分泌到环境中,只有当细菌溶解后才释放出来,因而称为内毒素,其毒性比外毒素要低,抗原性也弱。
同种生物的不同个体,当它们与病原菌接触后,有的患病,有的则安然无恙,原因在于不同个体的免疫力不同。免疫就是指机体识别和排除抗原异物(如病原微生物等)的一种保护性反应。一般来讲,它对机体是有利的,在异常条件下,也可能损害机体。人体的免疫分为非特异性免疫和特异性免疫。其中特异性免疫是指机体针对某一种或某一类微生物或产物所产生的特异抵抗力。而疫苗即是科学家研制出来使机体产生特异性免疫抵抗病原微生物对人体侵害的生物制品,通常由病原微生物本身加以制备而成的。细菌、病毒和立克次氏体等病原微生物制成疫苗,注射机体后,使机体产生特异性或致敏性淋巴细胞,分泌抗体,达到特异性免疫效果。
而疫苗又分为治疗性和预防性两种,通过治疗性疫苗治疗疾病,并通过预防性疫苗保护人体不受致病性微生物的侵害。经过多年的努力,医学界已经开发出各种不同的疫苗用以预防,诸如细菌、病毒和真菌等,感染造成的各种疾病,极大地提高了人类的健康水平。生物技术的不断发展,促进了疫苗品种的多样化。用以预防病毒导致的传染病有灭活病毒技术开发出来的疫苗,如乙脑疫苗、脊髓灰质炎疫苗、流感疫苗等;减毒病毒技术开发出来的减毒活疫苗,如轮状病毒疫苗、口服脊髓灰质炎病毒疫苗、麻疹病毒疫苗、腮腺炎病毒疫苗、风疹病毒疫苗和水痘疫苗等。用以预防细菌性传染病的有用蛋白和多糖等生物大分子纯化技术开发出来的细菌类疫苗,如破伤风类毒素、白喉类毒素、百日咳类毒素及其亚细胞组分、流行性脑膜炎球菌多糖和23价肺炎球菌多糖等。更先进的有用半化学结合技术开发出来的预防脑膜炎和肺炎的细菌疫苗,如流行性嗜血杆菌b型多糖-蛋白缀合疫苗、7价或10价肺炎球菌多糖-蛋白缀合疫苗以及4价脑膜炎球菌多糖-蛋白缀合疫苗。通过对生物技术的不断改进,能够开发出更多的新型疫苗产品来应付不同的病原微生物对人类健康的挑战。
二、多糖-蛋白缀合疫苗及其蛋白载体
多糖是病原菌中的一种重要免疫有效成分,有菌体多糖(ops)和荚膜多糖(cps)之分。当病原体侵入机体后,它们作为免疫原,能刺激机体产生保护性免疫应答。而目前许多能引起危害严重的疾病的病原体如流感嗜血杆菌b型(haemophilusinfluenzaetypeb,hib),肺炎链球菌(streptococcuspneumoniae,spn)和脑膜炎奈瑟菌(neisseriameningitidis,nm)其表面都具有多糖,这些多糖能够赋予病原体对补体介导的杀伤和吞噬作用产生抗性,从而促进它们发病期间在血液中的存活。第一代针对hib,spn和nm的疫苗即以多糖为抗原。但不幸的是,这些多糖疫苗在幼儿中不是免疫原性的,并且不能产生免疫记忆。这是因为多糖分子属于t细胞不依赖性抗原(ti-ag),免疫原性较弱,接种婴幼儿后免疫效果尤其不理想。为了提高多糖疫苗的免疫原性,在20世纪20年代和30年代由landsteiner,avery和goebel通过与蛋白质偶联来增强。1980年,johnrobbins和rachelschneerson描述了hib多糖与白喉和破伤风类毒素蛋白的缀合物,极大的增强了动物模型中的抗体反应。最终hib多糖-蛋白质缀合物,在人类婴儿中引发记忆型抗体应答。新一代的多糖-蛋白质缀合疫苗,在疫苗学中创造了复兴。这类缀合物将过去的t细胞非依赖性多糖疫苗转化为在儿童中具有更强免疫原性的t细胞依赖性疫苗,显示具有产生具有高亲合力的抗体的能力,建立免疫记忆,并产生群免疫效应。此外,它们改善了年轻婴儿的未成熟免疫系统和老年人的衰老免疫系统的保护性应答,从而达到最佳的免疫效果。
迄今为止,5种载体蛋白已用于许可上市的缀合疫苗中:白喉毒素无毒变异体(crm197),破伤风类毒素(tt),脑膜炎球菌外膜蛋白复合物(omp),白喉类毒素(dt)和流感嗜血杆菌蛋白d(hid)。临床试验已经证明这些缀合疫苗在预防感染性疾病和改变hib,spn和nm的药物中的功效。所有5种载体蛋白质在增加疫苗免疫原性方面都是有效的,但是它们引起的抗体的量和亲合力不同,在同一产品中携带多种多糖的能力以及与其它疫苗同时作用的能力也不同。
crm197是从白喉棒杆菌c7(β197)培养物中分离的白喉毒素的无毒变体。crm197与野生型白喉毒素的不同之处在于,在氨基酸位置52处的点突变用谷氨酸代替甘氨酸,这消除了其酶活性和毒性。crm197与白喉毒素在抗原上是不可区分的,但是具有作为缀合蛋白的优点:无毒的,并且具有更多的赖氨酰侧链可用于缀合。用作缀合物的crm的另一种形式是纯化的天然白喉毒素,其随后用甲醛解毒,称为白喉类毒素(dt),不应与crm197混淆。tt是破伤风梭菌培养物产生的破伤风毒素用甲醛解毒来制备得来。omp为nm菌血清型b群外膜蛋白复合物。dt是白喉杆菌培养物产生的白喉毒素,通过甲醛解毒制备得来。hid是最初用超声处理流感嗜血杆菌中,通过sds-page步骤纯化分离流感嗜血杆菌表面蛋白,但是目前的疫苗都是通过基因工程获得重组蛋白。
tt、dt等类毒素早已工业化生产,较易获得,而且与多糖偶联后确实可大大增强多糖的免疫原性。但为获得类毒素,需对细菌毒素进行化学脱毒。而在这一过程中会产生点对点突变或不必要的修饰,致毒素的理化性质改变,破坏了重要的t细胞抗原表位,影响其免疫原性。如采用无毒的变异毒素crm197就可避免上述问题。然而体内存在的类毒素抗体(tt和dt已大量使用)可能会导致超敏反应或引起抑制抗糖反应(免疫抑制)等问题。采用相同种属细菌的多糖与载体蛋白就可避免这些潜在问题。例如开发nm疫苗,以b群的蛋白或omp蛋白为载体制备a、c、y、w135群多糖-蛋白缀合疫苗不失为一个良好策略,理论上其可预防几乎所有致病性nm,但前提是该b群蛋白载体是“广谱”的或是具有很大交叉反应性的。因此,开发新型的,能够赋予疫苗以真正的保护性免疫原性的蛋白载体迫在眉睫。
三、脑膜炎奈瑟氏菌(nm)及其流行病学
流行性脑脊髓膜炎(epidemiccerebrospinalmeningitis)是由脑膜炎奈瑟氏菌,通过呼吸道传播引起的急性化脓性脑膜炎,在世界各地均有不同程度的流行。脑膜炎奈瑟菌也称为脑膜炎球菌,是一类革兰染色阴性双球菌,通常定植在人的鼻咽部。人类是其唯一宿主,因而nm表现出对人类鼻咽部高度的适应性,10%-40%的健康人群都是nm的无临床症状携带者,在脑膜炎爆发性流行时期,无症状携带者比例更可高达70%。少数情况下,nm可经血侵入脑脊髓膜,引起化脓性炎症,出现脑膜刺激症和化脓性脑膜炎的脑脊液变化。疫苗预防是防治脑膜炎球菌病的重要手段,因为即使采用抗生素干涉,这种疾病仍有高发病率和死亡率。
具有致病性的nm菌株一般都具有荚膜结构,健康人群正常携带的菌株往往会缺失荚膜,成为不能分群的菌株。根据nm荚膜多糖的化学组成可将其分成a、b、c、d、h、i、k、l、x、y、z、29e和w13513个血清群(serogroup),而根据其外膜蛋白(omp)、porb(2或3类omp)和pora(1类omp)的抗原性差异,又可分成不同的血清型和血清亚型。全球每年约发生120万的nm感染病例,多数病例是由a、b、c、w135、y群菌株引起。而在发达国家中由b群nm引起的流行性脑脊髓膜炎病例更是高达总病例的80%。在我国的流行主要以a群为主,近年来由于疫苗的广泛接种,a群引起的感染得到有效控制,而由b群引起的病例也相对增多。单一血清群、血清型和血清亚型的流脑菌苗在整体上很难预防流行性脑脊髓膜炎的发生。随着对nm表面抗原结构更加深入的研究,流脑菌苗正朝着多元化方向发展。
流脑多糖-蛋白缀合菌苗已有研制,chiron和wyem使用脱毒白喉类毒素(crm197)作为蛋白载体,baxter用破伤风类毒素作为载体,开发了a/c群脑膜炎球菌缀合疫苗,于1999年11月引入了英国。此后sanofi-pasteur开发了a/c/y/w135群多糖共价结合白喉类毒素(mcv4)的四价缀合疫苗,我国已有几种a、c群脑膜炎球菌荚膜多糖与载体蛋白tt的缀合疫苗批准上市。由于脑膜炎球菌多糖及缀合疫苗应用,有效的预防了a、c、y和w135群脑膜炎球菌的感染。与a、c、w135、y群菌株荚膜多糖不同,b群nm菌株的荚膜多糖免疫原性较低,并且menb荚膜多糖的结构与正在发育的神经组织及少数成熟组织中的神经细胞黏附分子同源,免疫接种易产生自身免疫。因此,b群nm的荚膜多糖不能用作疫苗的抗原成份。b群疫苗的研究目前主要集中在非荚膜抗原,如蛋白、脂多糖(1ipopolysaccharide,los)等。筛选非荚膜表面抗原的主要挑战是其安全性、抗原保守性及能引发广泛有效的杀菌力反应。能作为候选疫苗的具有免疫原性的蛋白质需具备以下特点:在大多数菌株中都表达且结构保守;可诱生杀菌抗体或保护性抗体。目前在蛋白质疫苗的研究方面取得了一定进展,诺华公司应用反向疫苗学研制的4cmenb疫苗已通过ⅲ期临床实验。在研热点候选抗原有pora,nhha、gna2132、nada和fhbp等,其中fhbp是最有前途的候选蛋白质之一。
fhbp为因子h结合蛋白(factorh-bindingprotein,fhbp),又称为脂蛋白2086,几乎表达于所有脑膜炎奈瑟菌表面,由255个氨基酸残基组成,分子量29000。因子h是补体替代途径的关键调节子,它在因子i介导的c3b裂解为灭活片段ic3b过程中发挥辅助因子作用。也促进替代途径c3转化酶c3bbb的衰变。fhbp和因子h结合可下调替代途径,从而有利于脑膜炎奈瑟菌生存。fhbp对于脑膜炎球菌在人类的血液、血清和抗菌性多肽存在的情况下的生存是极为重要的。其氨基酸序列较保守,变种内91.6%-100%氨基酸相同。重组fhbp抗体可引起针对同一类变种的补体介导的杀菌作用和诱导感染乳鼠模型的被动保护。由完整fhbp获得的抗体不仅滴度高,且对顺序变异不敏感,即使有少量氨基酸改变,只要决定空间构象的关键氨基酸不变,抗体杀菌活性变化不大。所有这些特点使fhbp成为脑膜炎奈瑟菌最有效的抗原之一和最有希望的候选通用疫苗。根据整个蛋白的抗原交叉反应性和序列相似性,脑膜炎球菌fhbp可以被分为3个抗原变体组。通常,针对变体v1的fhbp(也被称为亚家族b)制备的抗体对来自变体v1表达fhbp的菌株具有杀菌活性,但不针对变体v2和v3(也称为亚族a)中表达fhbp的菌株,反之亦然。在每个变体组中也存在fhbp的亚变体。最近,fhbp的分子结构已显示为“模块化”,fhbp变体含有五个可变结构域的不同组合(va~ve),每个可变区段衍生自亚族a和亚族b。因此,通过基因工程手段自由组合五个结构域可以得到覆盖a、b两个亚族三种变体的抗原的重组δfhbp蛋白,成为广谱的疫苗抗原及蛋白载体。
但是,单独使用fhbp蛋白也有一定的缺陷,因为在有些menb菌株中fhbp蛋白表达水平较低,只有fhbp的抗原的疫苗不可能足以用于广泛的免疫脑膜炎球菌的感染,融合表达多种抗原不失为一个良好的选择。在研的一种纯蛋白疫苗(lp2086)中含有三种组分,其中两个组分是融合蛋白(gna2091与fhbp融合,gna2132与gna1030融合),第三个组分是重组nada。5种抗原负染应用可以引起小鼠中的大多数血清杀菌应答,起到良好的保护。其中,gna2091、gna2132和gna1030均为未知功能蛋白组分,而nada为奈瑟氏菌粘附素a,在体外结合上皮细胞的粘附素/侵袭素。该抗原在menb菌株中是非常保守的(>96%氨基酸同一性),但是不存在于某些遗传谱系的菌株中,仅有50%的menb致病菌株表达nada蛋白,但这50%都是高致病菌。融合表达δfhbp蛋白和nada蛋白,无疑能提高其抗原性,并以此抗原为蛋白载体,结合a、c、y和w135群脑膜炎球菌的荚膜多糖,理论上该多价缀合疫苗可预防a、b、c、y和w135五个亚群致病菌的感染,从而预防绝大部分nm感染导致的流行性脑脊髓膜炎。
四、肺炎球菌的危害及其流行病学研究
由肺炎球菌所引起的感染是全世界肺炎发病率和死亡率的主要起因,已成为全球一个重要的公共卫生问题。肺炎球菌已成为全球儿童的头号杀手。我国肺炎的病死率为16.4%,其中50岁以上中老年人及1岁以下婴幼儿分别高达28.6%和22.0%。根据荚膜多糖免疫原性的不同,spn可分为93种血清型,但多数血清型很少引起疾病,世界范围内至少70%-75%的侵袭性肺炎是由13种常见的血清型引起的,而我国的统计资料显示肺炎球菌感染菌株前几个血清型依次为:5、6、19、23、14、2、4型,spn疫苗是预防其感染的重要手段。中国生物技术集团成都生物制品研究所生产的23价肺炎球菌疫苗是选取了23种最常见的致病菌(1,2,3,4,5,6b,7f,8,9n,9v,10a,11a,12f,14,15b,17f,18c,19a,19f,20,22f,23f,33f),分别发酵培养并分离提纯肺炎球菌荚膜上的各型多糖,按等比例混合制成疫苗。临床使用证明,荚膜多糖制作的疫苗明确有效,并在多个国家广泛使用。但是这类多糖疫苗存在产生的抗体亲和力低、对侵入型肺炎球菌保护率只有50%-70%、只产生短暂免疫,不具备免疫记忆、对2岁以下婴幼儿无保护作用等诸多问题。最主要的原因是单纯的多糖抗原不能激活t细胞,无法诱导免疫记忆效应,刺激机体产生的抗体主要是igm和igg2,不能够有效地激活补体系统。
因此,肺炎球菌的多糖-蛋白质缀合疫苗应运而生。通过多年的技术发展,2000年,美国惠氏(wyeth)公司成功开发并上市了7价肺炎球菌多糖-crm197缀合疫苗,是由7个不同的肺炎球菌血清型多糖分别共价键连接到crm197蛋白载体上,混合配制而成的一种多价疫苗,用以预防小儿肺炎,所述7个血清型肺炎球菌涵盖了北美和欧洲90%以上流行的肺炎球菌不同血清型菌株。同年,美国辉瑞公司第一个7(4、6b、9v、14、18c、19f和23f)价肺炎球菌蛋白缀合疫苗上市,目前,辉瑞公司正在中国注册13价缀合疫苗,增加了6个血清型(1,3,5,7f,6a,19a)。但是我国的流行病学显示肺炎球菌感染菌株血清型依次为:5、6、1、19、23、14、2、4型,辉瑞7价肺炎球菌缀合疫苗对我国常见致病菌型覆盖率只有50%左右,而13价缀合疫苗的覆盖率也仅有70%。国外研发的缀合疫苗不太适合我国大范围的儿童肺炎预防。
还有一个不容忽视的问题是,随着不同血清型的增加和同种载体蛋白的重复使用,使得载体蛋白用量增多,其免疫原性反而降低。临床试验表明,当多价肺炎缀合疫苗与其他含有与蛋白载体相同组分的单价疫苗或多联疫苗同时接种时,比如hib-tt、百白破-hib多糖缀合疫苗-ipv(灭活脊髓灰质炎疫苗)-乙肝疫苗(简称6联疫苗),多价肺炎球菌缀合疫苗中的大部分血清型多糖的免疫原性会受到抑制,特别是对用破伤风类毒素作为载体的血清型多糖免疫原性影响尤其明显。原因是多价肺炎球菌缀合疫苗中作为载体的破伤风类毒素和白喉类毒素总浓度过高,在同时接种含有百白破组分的联合疫苗时,会造成载体受体竞争性抑制效应,降低了缀合疫苗多糖部分的免疫原性。在现有上市的五种载体蛋白(crm197、tt、omp、dt和hid)大量使用的情况下,开发新的载体蛋白迫在眉睫。在此基础上开发适合中国流行病学的23价多糖-蛋白缀合疫苗,具有重大的意义和社会价值,保护我国婴幼儿免受spn侵染引起的肺炎。
技术实现要素:
有鉴于此,本发明提供了一种重组δfhbp-nada融合蛋白,该融合蛋白具有更强的menb菌群免疫原性,能诱导体内产生强大的血清杀菌应答。同时,以δfhbp-nada为蛋白载体,提供了一种能覆盖a、b、c、y和w135五种菌群的强免疫原性缀合疫苗。
本发明第一方面提供了一种重组δfhbp-nada融合蛋白载体,包括重组δfhbp、柔性连接肽段和nada,所述重组δfhbp包含fhbp可变体v1的va、vb结构域以及fhbp可变体v3的vc、vd、ve结构域。
所述重组δfhbp的氨基酸序列如序列表seqidno:1所示,其核苷酸编码序列如序列表seqidno:2所示。
所述柔性连接肽段的核苷酸编码序列如序列表seqidno:3所示。
所述重组δfhbp-nada融合蛋白载体的氨基酸序列如序列表seqidno:4所示,其核苷酸编码序列如序列表seqidno:5所示。
本发明第二方面提供了上述重组δfhbp-nada融合蛋白载体的制备方法,步骤包括:
s1、设计引物分别扩增得到fhbpv1基因片段、fhbpv3基因片段,再以这两段基因片段为模板进行搭桥pcr扩增得到重组的δfhbp全长片段,回收δfhbp基因片段和pet载体,制备重组质粒pet-δfhbp;
s2、设计引物扩增得到nada蛋白的全长cds序列,回收nada基因片段和重组质粒pet-δfhbp,制备重组质粒pet-δfhbp-nada;
s3、将重组质粒pet-δfhbp-nada转化表达菌株,得到重组δfhbp-nada融合蛋白载体。
本发明第三方面提供了上述重组δfhbp-nada融合蛋白载体在制备多糖-蛋白缀合疫苗中的应用。
本发明第四方面提供了一种多价脑膜炎球菌缀合疫苗,该缀合疫苗中,a群、c群、y群和w135群脑膜炎球菌荚膜多糖与重组δfhbp-nada融合蛋白载体缀合。
本发明第五方面提供了一种多价肺炎球菌缀合疫苗,该缀合疫苗中,肺炎球菌荚膜多糖与重组δfhbp-nada融合蛋白载体缀合。
本发明的有益效果是:1、针对b群脑膜炎球菌荚膜多糖成份不适合用作疫苗,利用反向遗传学的技术,表达b群脑膜炎球菌人h因子结合蛋白重组蛋白与奈瑟氏菌粘附素a蛋白的融合产物δfhbp-nada。该融合蛋白的δfhbp含有fhbpa亚族和fhbpb亚族(v1~v3三种变体)的保守结构域,能够覆盖所有表达fhbp蛋白的nmb群菌株,并且,δfhbp包含fhbp完整的va~ve五个结构域,其结构、功能和抗原位点保持了完整性;同时,该融合蛋白的nada在50%的nmb群菌株中表达,且这些菌株基本为高致病菌。因此即使不表达fhbp但表达nada的菌株也能被δfhbp-nada蛋白覆盖,以此重组蛋白为抗原制成的蛋白疫苗能广谱保护几乎所有nmb群致病菌的感染。
2、重组δfhbp-nada是一种全新的可用于缀合疫苗的载体蛋白,不同于现有缀合疫苗工艺中常用蛋白载体(crm197、tt、omp、dt、hid),因而不会因同种蛋白载体接种过多导致缀合疫苗的免疫原性下降。
3、δfhbp-nada中的δfhbp和nada组分虽然是nm生存和致病的重要因子,但其本身无毒性,从而在工业生产中不需要对该活性蛋白进行脱毒处理,不会改变其结构和抗原活性位点,从而获得更佳的免疫效果。
4、δfhbp-nada通过设计软性连接肽链将两个活性蛋白融合表达,再保持各自的活性的同时让两者成为单一的蛋白质,因而在工业生产及免疫接种是更具有可控性,风险大大降低,又能提供更多的多糖-蛋白结合位点。
5、本发明提供的以重组δfhbp-nada为蛋白载体的新型多价脑膜炎球菌缀合疫苗具有广谱的免疫效果,其免疫小鼠血清能与a、b、c、y和w135五个群的模式菌株产生交联反应,同时能够覆盖b群中表达fhbp(3中变体)以及不表达fhbp但表达nada的高致病菌,并在杀菌检测中表现出广谱且极强的杀菌效果。
6、本发明提供的以重组δfhbp-nada为蛋白载体的新型23价肺炎球菌缀合疫苗具有广谱的免疫效果,其免疫小鼠血清能与1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f、33f血清型spn菌株多糖抗原产生交联反应,同时能够覆盖中国流行的血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、23f、33f菌株,并在杀菌检测中表现出广谱且极强的杀菌效果,此类多糖-蛋白缀合疫苗更适合我国人群使用。
7、本发明提供的以重组δfhbp-nada为蛋白载体的新型缀合疫苗具有多糖-蛋白缀合疫苗的通用优势:免疫后能激活t细胞效应,产生免疫记忆,从而真正保护2岁以下的婴儿。
8、本发明应用cdap活化多糖后衍化结合的工艺制备多价荚膜多糖-δfhbp-nada蛋白缀合疫苗。不仅消除了常规方法中溴化氰的毒性,且活化效能明显提高。
附图说明
图1为fhbpv1~v3可变体结构域及重组δfhbp结构域。
图2为δfhbp扩增电泳图谱与pet-δfhbp鉴定电泳图谱。
图3为nada扩增电泳图谱与pet-δfhbp-nada鉴定电泳图谱。
图4为iptg诱导重组菌表达δfhbp和δfhbp-nada蛋白。
图5为western-blot鉴定δfhbp和δfhbp-nada重组蛋白。
图6为sds-page鉴定纯化后的δfhbp和δfhbp-nada重组蛋白。
图7为sds-page鉴定大规模纯化后的δfhbp-nada重组蛋白。
具体实施方式
下面将结合具体实施例对本发明提供的一种δfhbp-nada蛋白载体及基于δfhbp-nada蛋白载体的多价脑膜炎球菌和肺炎球菌缀合疫苗予以进一步说明。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料如无特殊说明,均为市场购买得到。
一、δfhbp和δfhbp-nada重组蛋白的克隆和原核表达
1、pet-δfhbp和pet-δfhbp-nada重组质粒的构建
fhbp是一种膜表面脂蛋白,许多脑膜炎球菌的菌株都带有其基因,也发现不携带该基因的菌株。根据整个蛋白的抗原交叉反应性和序列相似性,脑膜炎球菌fhbp可以被分为3个抗原变体组v1~v3。通常,针对变体v1的fhbp(也被称为亚家族b)制备的抗体对来自变体v1表达fhbp的菌株具有杀菌活性,但不针对变体v2和v3(也称为亚族a)中表达fhbp的菌株,反之亦然。fhbp的蛋白分子含有五个可变结构域的不同组合(va~ve),每个可变区段衍生自亚族a和亚族b。我们根据其结构域特点,设计了δfhbp的结构(如图1所示),其包含v1的a、b结构域(b结构域上含有v1的抗原表位),以及v3的c、d、e结构域(c、d、e结构域含有v2和v3的抗原表位,且其174-216位氨基酸高度保守,只有个别氨基酸的差异),理论上,重组的δfhbp能覆盖所有野生型fhbp3个变体的抗原位点,具有广谱抗菌的潜力。
根据genebank登录的fhbpv1和fhbpv3全长cds序列,我们设计如下2对引物:引物在p1和p4位置分别引入bamhⅰ和hindⅲ酶切位点。
p1:ggattcatgaaccgaactgccttctgctgcc
p2:gccgggcagttggttgaaggcggta
p3:acggcattcggttcagacgatgcca
p4:aagcttttactgcttggcggcaagaccgata
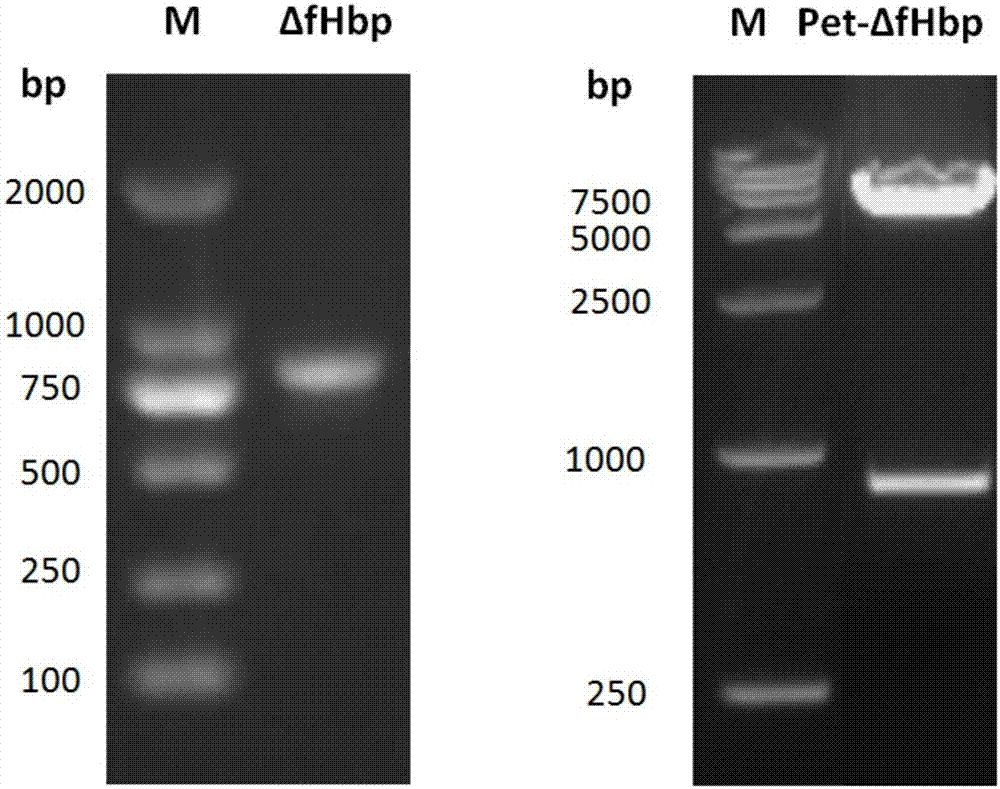
分别以表达fhbpv1和v3的两株menb群菌为模板(购自美国atcc),进行pcr扩增。其中p1,p2可扩增fhbpv1的a、b结构域基因片段,p3和p4可扩增v3的c、d、e结构域基因片段。再以这两段基因片段为模板,p1,p4为引物,进行搭桥pcr,可扩增得到重组的δfhbp全长片段。用bamhi和hindⅲ双酶切目的基因(pcr产物)和原核表达载体pet32a(+),凝胶回收盒回收δfhbp基因片段和线性pet32a载体。胶回收后,用dna连接酶,16℃连接过夜,转化大肠杆菌dh5a菌株,单克隆扩增,小提质粒后,bamhi和hindⅲ双酶切鉴定的约800bp条带,在卡那霉素抗性下筛选阳性克隆,获得重组质粒pet-δfhbp,pcr扩增电泳图谱与鉴定正确电泳图谱如图2所示。将鉴定正确的重组质粒以15%甘油菌形式-70℃保存,并测序鉴定正确,其δfhbp的氨基酸序列如序列表seqidno:1所示,其核苷酸编码序列如序列表seqidno:2(826bp)所示。
seqidno:2(826bp):
atgaaccgaactgccttctgctgccttttcctgaccaccgccctgattctgaccgcctgcagcagcggaggcggcggaagcggaagcggcggtgtcgccgccgacatcggcacggggcttgccgatgcactaactacgccgctcgaccataaagacaaaggtttgaaatctctgacattggaagactccattccccaaaacggaacactaaccctgtcggcacaaggtgcggaaaaaactttcaaagccggcgacaaagacaacagcctcaacacgggcaaactgaagaacgacaaaatcagccgcttcgacttcgtgcaaaaaatcgaagtggacggacaaaccatcacgctggcaagcggcgaatttcaaatatacaaacaggaccactccgccgtcgttgccctacagattgaaaaaatcaacaaccccgacaaaatcgacagcctgataaaccaacgctccttccttgtcagcggtttgggcggagaacataccgccttcaaccaactgcccggcacggcattcggttcagacgatgccagtggaaaactgacctacaccatagatttcgccgccaagcagggacacggcaaaatcgaacatttgaaatcgccagaactcaatgttgacctggccgcctccgatatcaagccggataaaaaacgccatgccgtcatcagcggttccgtcctttacaaccaagccgagaaaggcagttactctctaggcatctttggcgggcaagcccaggaagttgccggcagcgcagaagtggaaaccgcaaacggcatacgccatatcggtcttgccgccaagcagtaa
其氨基酸序列为seqidno:1:
mnrtafcclflttaliltacssggggsgsggvaadigtgladalttpldhkdkglksltledsipqngtltlsaqgaektfkagdkdnslntgklkndkisrfdfvqkievdgqtitlasgefqiykqdhsavvalqiekinnpdkidslinqrsflvsglggehtafnqlpgtafgsddasgkltytidfaakqghgkiehlkspelnvdlaasdikpdkkrhavisgsvlynqaekgsyslgifggqaqevagsaevetangirhiglaakq
但单独使用δfhbp蛋白也有一定的缺陷,因为在有些menb菌株中fhbp蛋白表达水平较低,只有δfhbp抗原的疫苗不可能足以用于广泛的免疫脑膜炎球菌的感染。奈瑟氏菌粘附素a(nada),在体外结合上皮细胞的粘附素/侵袭素。该抗原在menb菌株中是非常保守的(>96%氨基酸同一性),不存在于某些遗传谱系的菌株中,仅有50%的menb致病菌株表达nada蛋白,但这50%都是高致病菌。融合表达δfhbp蛋白和nada蛋白,无疑能提高其抗原性,但两个蛋白之间要加上柔性的链接肽段,最为经典的即为huston设计合成的(ggggs)3序列,有利于两个蛋白能够正确折叠,从而不影响其各自的免疫原型。根据genebank登录的nada全长cds序列,设计引物:引物p5和p6分别引入hindⅲ和xhoⅰ酶切位点,同时p5的酶切位点后设计表达(ggggs)3连接蛋白的序列。
p5:aagcttggcggcggcggcagtggcggcggcggcagtggcggcggcggcagtatgaaacactttccatccaaagtac(seqidno:3)
p6:ctcgagttaccactcgtaattgacgccgaca
以表达nada的menb群菌为模板(购自美国atcc),p5,p6为引物,扩增得到nada蛋白的全长cds序列,用hindⅲ和xhoⅰ双酶切目的基因(nada产物)和重组质粒pet-δfhbp,凝胶回收盒回收nada基因片段和线性pet-δfhbp载体。胶回收后,用dna连接酶,16℃连接过夜,转化大肠杆菌dh5a菌株,单克隆扩增,小提质粒后,bamhi和xhoⅰ双酶切鉴定的约1900bp条带,在卡那霉素抗性下筛选阳性克隆,获得重组质粒pet-δfhbp-nada,pcr扩增电泳图谱与鉴定正确电泳图谱如图3所示。将鉴定正确的重组质粒以15%甘油菌形式-70℃保存,并测序鉴定正确,重组δfhbp-nada融合蛋白载体的氨基酸序列如序列表seqidno:4所示,其核苷酸编码序列如序列表seqidno:5(1089bp)所示。
seqidno:5(1089bp):
atgaaccgaactgccttctgctgccttttcctgaccaccgccctgattctgaccgcctgcagcagcggaggcggcggaagcggaagcggcggtgtcgccgccgacatcggcacggggcttgccgatgcactaactacgccgctcgaccataaagacaaaggtttgaaatctctgacattggaagactccattccccaaaacggaacactaaccctgtcggcacaaggtgcggaaaaaactttcaaagccggcgacaaagacaacagcctcaacacgggcaaactgaagaacgacaaaatcagccgcttcgacttcgtgcaaaaaatcgaagtggacggacaaaccatcacgctggcaagcggcgaatttcaaatatacaaacaggaccactccgccgtcgttgccctacagattgaaaaaatcaacaaccccgacaaaatcgacagcctgataaaccaacgctccttccttgtcagcggtttgggcggagaacataccgccttcaaccaactgcccggcacggcattcggttcagacgatgccagtggaaaactgacctacaccatagatttcgccgccaagcagggacacggcaaaatcgaacatttgaaatcgccagaactcaatgttgacctggccgcctccgatatcaagccggataaaaaacgccatgccgtcatcagcggttccgtcctttacaaccaagccgagaaaggcagttactctctaggcatctttggcgggcaagcccaggaagttgccggcagcgcagaagtggaaaccgcaaacggcatacgccatatcggtcttgccgccaagcagtaaggcggcggcggcagtggcggcggcggcagtggcggcggcggcagtatgaaacactttccatccaaagtactgaccacagccatccttgccactttctgtagcggcgcactggcagccacaagcgacgacgatgttaaaaaagctgccactgtggccattgttgctgcctacaacaatggccaagaaatcaacggtttcaaagctggagagaccatctacgacattggtgaagacggcacaattacccaaaaagacgcaactgcagccgatgttgaagccgacgactttaaaggtctgggtctgaaaaaagtcgtgactaacctgaccaaaaccgtcaatgaaaacaaacaaaacgtcgatgccaaagtaaaagctgcagaatctgaaatagaaaagttaacaaccaagttagcagacactgatgccgctttagcagatactgatgccgctctggatgaaaccaccaacgccttgaataaattgggagaaaatataacgacatttgctgaagagactaagacaaatatcgtaaaaattgatgaaaaattagaagccgtggctgataccgtcgacaagcatgccgaagcattcaacgatatcgccgattcattggatgaaaccaacactaaggcagacgaagccgtcaaaaccgccaatgaagccaaacagacggccgaagaaaccaaacaaaacgtcgatgccaaagtaaaagctgcagaaactgcagcaggcaaagccgaagctgccgctggcacagctaatactgcagccgacaaggccgaagctgtcgctgcaaaagttaccgacatcaaagctgatatcgctacgaacaaagctgatattgctaaaaactcagcacgcatcgacagcttggacaaaaacgtagctaatctgcgcaaagaaacccgccaaggccttgcagaacaagccgcgctctccggcctgttccaaccttacaacgtgggtcggttcaatgtaacggctgcagtcggcggctacaaatccgaatcggcagtcgccatcggtaccggcttccgctttaccgaaaactttgccgccaaagcaggcgtggcagtcggcacttcgtccggttcttccgcagcctaccatgtcggcgtcaattacgagtggtaa
其氨基酸序列为seqidno:4:
mnrtafcclflttaliltacssggggsgsggvaadigtgladalttpldhkdkglksltledsipqngtltlsaqgaektfkagdkdnslntgklkndkisrfdfvqkievdgqtitlasgefqiykqdhsavvalqiekinnpdkidslinqrsflvsglggehtafnqlpgtafgsddasgkltytidfaakqghgkiehlkspelnvdlaasdikpdkkrhavisgsvlynqaekgsyslgifggqaqevagsaevetangirhiglaakqggggsggggsggggsmkhfpskvlttailatfcsgalaatsdddvkkaatvaivaaynngqeingfkagetiydigedgtitqkdataadveaddfkglglkkvvtnltktvnenkqnvdakvkaaeseieklttkladtdaaladtdaaldettnalnklgenittfaeetktnivkidekleavadtvdkhaeafndiadsldetntkadeavktaneakqtaeetkqnvdakvkaaetaagkaeaaagtantaadkaeavaakvtdikadiatnkadiaknsaridsldknvanlrketrqglaeqaalsglfqpynvgrfnvtaavggyksesavaigtgfrftenfaakagvavgtssgssaayhvgvnyew
2、δfhbp和δfhbp-nada重组蛋白的原核表达及鉴定
将重组质粒pet-δfhbp和pet-δfhbp-nada转化e.colibl21(de3),37℃过夜培养(含50μg/ml卡纳青霉素),得到δfhbp/bl21(de3)和δfhbp-nada/bl21(de3)表达菌,挑取单克隆,37℃振荡培养至菌密度达od600约0.5~1.0,加入终浓度0.5mm的异丙基-β-d-硫代半乳糖苷(iptg),37℃振荡诱导培养2-6小时,经sds-page鉴定,结果如图4显示,δfhbp/bl21(de3)和δfhbp-nada/bl21(de3)诱导后有明显的表达条带,分子量分别为30kd和72kd。经western-blot鉴定为δfhbp和δfhbp-nada重组蛋白,如图5所示:1,3泳道为δfhbp/bl21(de3)诱导表达物,2,4泳道为δfhbp-nada/bl21(de3)诱导表达物,1,2用fhbp单抗检测,分别有30kd和72kd的预期条带,3,4用nada单抗检测,只有4泳道有72kd条带,结果符合预期。最后两个重组蛋白经质谱鉴定,确定为δfhbp和δfhbp-nada重组蛋白。
二、δfhbp和δfhbp-nada重组蛋白的小规模纯化及其免疫效果评价
将δfhbp/bl21(de3)和δfhbp-nada/bl21(de3)接种lb(含50μg/ml卡纳霉素)液体培养基,37℃、200rpm培养12小时,以1%接种比例扩大培养,37℃、200rpm培养3-6小时后,od600至16~20,iptg(0.5mm)诱导4小时。离心机离心收集菌体。超声破菌,之前的sds-page显示,重组蛋白表达以包涵体的形式(图3)。先后用te+300mmnacl,te+1%triton-100洗涤包涵体后,8000rpm离心20min获得包涵体,洗涤后,溶解于3mol/lurea,20mmol/ltris-cl,1mmol/ledta,ph4.0溶液中,经cm柱离子交换层析纯化,可得到与目标蛋白大小相符的两个目的蛋白。最后待重组蛋白稀释复性至24h后,超滤器低温快速浓缩至原体积的1.2倍,过阴离子交换柱qsepharosef.f,收集目的蛋白峰,检测方法同图4与图5,凝胶检测蛋白含量达到95.3%以上,纯化效果如图6所示,wb检测确为目的蛋白。用pbs(ph7.4)透析除盐后,bca法测蛋白浓度含量约0.5mg/ml。
小鼠免疫:分别用纯化后的δfhbp和δfhbp-nada重组蛋白皮下免疫6周龄spf级nih小鼠10只,免疫剂量为每次纯化后的δfhbp或δfhbp-nada重组蛋白50ug/只(溶解于0.2ml生理盐水中),免疫程序为0,2,4周,免疫结束后2周采血,离心收集血清;另设10只小鼠对照,相同方法注射生理盐水。收集好的血清elisa法测血清抗体的滴度,具体方法如下:采用纯化后的δfhbp或δfhbp-nada重组蛋白,分别以适宜剂量包被酶标板,37℃孵育过夜,洗板后加入系列稀释的待测小鼠血清,37℃孵育后洗板,加入辣根过氧化物酶标记羊抗鼠igg二抗显色,酶标仪测定,读取492nm(630nm为参比波长)吸光度值(a值)。阴性对照组血清a均值+3倍的标准偏差为cutoff值,待测血清a值大于cutoff值判为阳性,以a值大于cutoff值的最大稀释度计算各型别小鼠的几何平均滴度,即为小鼠血清igg抗体效价(表1)。两种重组蛋白免疫小鼠后均产生了高低度的血清抗体。
表1.各组抗原三次免疫小鼠后血清抗体的滴度测定(几何平均值)
两种重组蛋白免疫效果的评价,采取两种方法,一为全菌体包被测定全细胞elisa,另一为流行株的杀菌力实验。全菌体包被选择menb群菌株mc58(高表达fhbpv1可变体)、8047(高表达fhbpv2可变体)、m1239高表达fhbpv3可变体),961-5945(中量表达fhbp蛋白)和67/00(低量表达fhbp蛋白),将这些菌株扩大培养增殖后,刮取细菌菌苔,以生理盐水溶解,甲醛杀菌后,稀释为2×108个/ml,以此浓度包被96孔酶标板,100ul/孔,4℃包被过夜,洗板后,进行检测,结果见表2。同样,培养menb群菌株mc58(高表达fhbpv1可变体)、8047(高表达fhbpv2可变体)、m1239高表达fhbpv3可变体),961-5945(中量表达fhbp蛋白)和67/00(低量表达fhbp蛋白)后用相应血清抗体进行杀菌检测,测定并计算杀菌抗体滴度(与补体阴性对照孔相比,50%以上杀菌率的血清最高稀释度为血清抗体杀菌滴度),结果见表3。
表2.各menb菌株全细胞elisa
表3.各menb菌株杀菌力实验:bc50titer(1:)
备注:杀菌力实验以大于1:8为具有保护性。
由表2和表3的结果综合分析可得,δfhbp蛋白疫苗能够有效免疫所有表达fhbp(v1、v3和v2变体)的menb菌株的侵染,但对低表达甚至不表达fhbp的menb菌株失去保护能力;而δfhbp-nada蛋白疫苗在免疫所有表达fhbp(v1、v3和v2变体)的menb菌株的侵染的基础上,同时能对低表达甚至不表达fhbp的menb菌株依然具有保护作用。同时,δfhbp-nada蛋白疫苗能够产生更高的抗体效价并具有更强的杀菌能力,说明两种特异性蛋白的融合表达能够起到协同促进免疫反应的作用,并能提供更为广谱的疫苗保护功能。因此,我们的后续工艺选择δfhbp-nada重组蛋白作为新型多价脑膜炎球菌及肺炎球菌缀合疫苗的蛋白载体。
三、工程菌的发酵培养、诱导表达及大规模抗原蛋白浓缩纯化
将上述鉴定正确的δfhbp-nada/bl21(de3)重组菌株按照药典的要求制成原始种子库和工作种子库。工艺流程如下:
1.取工程菌株工作种子库菌种,划种lb琼脂培养基(含卡纳霉素),37℃培养过夜,挑取单个菌落接种至lb液体培养基(含50μg/ml卡纳霉素)中,并以1-2%的接种比例逐步扩大至发酵罐发酵培养,待od600达到16-20时,采用异丙基-β-d-硫代半乳糖苷(iptg)诱导培养4-8小时,停止培养,大容量离心机离心收集菌体。
2.取菌体加入破菌缓冲液(50mmpb,2mmedta,ph7.5),高压(800-1000bar)均质破菌二遍后,离心(10000rpm,60min,8℃)取上清。采用30-60%硫酸铵分级沉淀,50mmpbph7.5溶解,50kd超滤5次,并浓缩至原体积的1/5-1/3。
3.采用sepharoseqff层析,平衡液:50mmpbph7.2,洗脱液:50mmpb+1mnaclph7.2。洗脱方法:0-100%梯度洗脱,收集10%的洗脱液。
4.取10%梯度洗脱液经50kd超滤膜包超滤浓缩,采用sepharose4ff凝胶过滤层析,收集v0处蛋白峰,以0.15mol/l氯化钠、10kd超滤5次以上,并浓缩至蛋白含量为1-2mg/ml,0.22μm除菌过滤。经无菌检查、蛋白含量检查、分子量和纯度检查、蛋白特异性检查、细菌内毒素检查即为δfhbp-nada蛋白原液。
技术要求为得到纯度大于95%的重组δfhbp-nada蛋白原液。细菌内毒素不高于20eu/ml,本发明应不高于10eu/ml,最佳不高于5eu/ml。分子量和纯度检查见图7,纯度为96.3%。蛋白特异性检测如图5所示,wb检测为目标蛋白。
四、多价nm多糖-δfhbp-nada蛋白缀合疫苗的制备和免疫效果评价
1.a群、c群、y群和w135群nm菌荚膜多糖的制备
a群脑膜炎球菌采用29201菌株,c群脑膜炎球菌采用29205菌株,y群脑膜炎球菌采用29028菌株,w135群脑膜炎球菌采用29037菌株,脑膜炎球菌经发酵培养后,采用沙培离心机、碟片式离心机或其他大容量离心机分离培养液,收集离心上清;将离心上清以100kd膜包超滤浓缩,采用25-80%的乙醇进行分级沉淀,收集沉淀并用无水乙醇及丙酮分别洗涤,得到粗制多糖;灭菌注射用水溶解多糖并经脱氧胆酸钠处理后,采用ge填料captoadhere和captodeae或其他厂家相同功能性质的离子交换填料,以串联层析或分步层析的方法进行粗糖精制,收集流穿峰,采用gesephadexg25coarse对流穿峰进行脱盐,乙醇沉淀或冻干回收多糖,置于-20℃保存备用。
2.a/c/y/w135群多糖-δfhbp-nada蛋白缀合疫苗的制备
本行业常用的方法有两种,即胺还原法或溴化氰活化法制备多糖蛋白结合物。胺还原法为将a/c/y/w135群多糖经高碘酸钠避光氧化,再加己二酰肼(adh)和硼氰化钠制备多糖衍生物,采用超滤方法将adh和硼氰化钠等去除,然后加入制备好的δfhbp-nada载体蛋白,在碳二亚胺(edac)作用下,形成多糖蛋白结合物。溴化氰活化法为将a/c/y/w135群脑膜炎球菌多糖经溴化氰(cnbr)活化,在活化的糖链上连接上己二酰肼,采用超滤的方法将溴化氰、游离的己二酰肼去除,然后加入制备好的δfhbp-nada载体蛋白,在碳二亚胺的连接作用下,多糖蛋白结合形成多糖蛋白复合物。
其中,溴化氰具有较强的活化多糖羟基的作用,目前国内上市的a群和a、c群脑膜炎球菌多糖缀合疫苗均采用溴化氰活化多糖的方法制备。但由于使用剧毒化学试剂溴化氰,制备过程对人员和环境均具有较大的潜在风险,结合物产率不高。随着化学合成技术的发展,已成功研制了一种新型水溶性氰化物,即1-氰基-4-二甲基氨基吡啶-四氟化硼(1-cyano-4-dimethylamin-opyridiniumtetrafluoroborate,cdap)。应用该试剂不仅消除了溴化氰的毒性,且活化效能明显提高。有研究者将溴化氰与cdap两种方法进行比较,cdap法的多糖收率可达35%-40%,而溴化氰仅有5%-20%,且结合物仍具有良好的免疫原性。
因此,本发明应用cdap活化多糖后衍化结合的工艺制备多价荚膜多糖-δfhbp-nada蛋白缀合疫苗。具体方法为:将a/c/y/w135群脑膜炎球菌多糖溶解至5-15mg/ml,调节ph值至10.8左右,在多糖溶液中加入1/10(g/g)的cdap,室温、维持ph值10.8的碱性环境下活化多糖8min。按1:1(与活化多糖的体积比)的比例加入0.5mol/l的已二酰肼,室温反应50-70min。50kd膜包超滤去除溴化氰及已二酰肼,得到多糖衍生物。将多糖衍生物与载体蛋白δfhbp-nada以1:1(g/g)的比例混合并搅拌,按碳二亚胺:多糖=1:10的比例加入碳二亚胺,室温、酸性环境(ph5.6)下反应60min。经100kd超滤膜包超滤去除杂质,并浓缩。最后采用gesepharose4ff进行凝胶层析纯化,收集v0附近的洗脱液。用0.22μm滤膜除菌过滤,得到a/c/y/w135群脑膜炎球菌多糖-δfhbp-nada蛋白缀合疫苗原液。
将此原液采用磷酸铝佐剂搅拌吸附,以0.15mol/l氯化钠稀释配制,至多价多糖蛋白结合物以多糖含量计终浓度分别为20μg/ml,铝含量终浓度为0.45-0.6mg/ml,搅拌均匀,以预填充注射器分装,0.5ml/支,制成a/c/y/w135群脑膜炎球菌多糖-δfhbp-nada蛋白缀合疫苗制剂,2-8℃保存。也可在疫苗原液中加入80mg/ml蔗糖作为赋形剂,每支多糖含量20μg/ml冻干后制成蛋白疫苗制剂,2-8℃保存。
3.a/c/y/w135群多糖-δfhbp-nada蛋白缀合疫苗效果评价
小鼠免疫:分别用a/c/y/w135群多糖-δfhbp-nada蛋白缀合疫苗蛋白原液、冻干制剂和佐剂吸附制剂皮下免疫6周龄spf级nih小鼠10只,免疫剂量为每次0.2ml/只,免疫程序为0,2,4周,免疫结束后2周采血,离心收集血清;另设10只小鼠对照,相同方法注射生理盐水。收集好的血清elisa法测血清抗体的滴度,具体方法如下:采用纯化后的δfhbp-nada重组蛋白,分别以适宜剂量包被酶标板,37℃孵育过夜,洗板后加入系列稀释的待测小鼠血清,37℃孵育后洗板,加入辣根过氧化物酶标记羊抗鼠igg二抗显色,酶标仪测定,读取492nm(630nm为参比波长)吸光度值(a值)。阴性对照组血清a均值+3倍的标准偏差为cutoff值,待测血清a值大于cutoff值判为阳性,以a值大于cutoff值的最大稀释度计算各型别小鼠的几何平均滴度,即为小鼠血清igg抗体效价(表4)。缀合疫苗原液和两种剂型免疫小鼠后均产生了高低度的血清抗体。
表4.各组抗原三次免疫小鼠后血清抗体的滴度测定(几何平均值)
缀合疫苗各剂型免疫效果的评价,同样采取两种方法,全菌体包被测定全细胞elisa和流行株的杀菌力实验。全菌体包被选择a群脑膜炎球菌29201菌株,b群脑膜炎球菌mc58和67/00菌株,c群脑膜炎球菌29205菌株,y群脑膜炎球菌29028菌株,w135群脑膜炎球菌29037菌株,将这些菌株扩大培养增殖后,刮取细菌菌苔,以生理盐水溶解,甲醛杀菌后,稀释为2×108个/ml,以此浓度包被96孔酶标板,100ul/孔,4℃包被过夜,洗板后,用相应疫苗血清抗体进行elisa检测,结果见表5。
表5.各群脑膜炎球菌菌株全细胞elisa
同样,a群脑膜炎球菌29201菌株,b群脑膜炎球菌mc58和67/00菌株,c群脑膜炎球菌29205菌株,y群脑膜炎球菌29028菌株,w135群脑膜炎球菌29037菌株后用相应疫苗血清抗体进行杀菌检测,测定并计算杀菌抗体滴度(与补体阴性对照孔相比,50%以上杀菌率的血清最高稀释度为血清抗体杀菌滴度),结果见表6。
表6.各群脑膜炎球菌菌株杀菌力实验:bc50titer(1:)
备注:杀菌力实验以大于1:8为具有保护性。
由以上结果综合分析可得,以重组δfhbp-nada为蛋白载体的新型多价脑膜炎球菌缀合疫苗具有广谱的免疫效果,其免疫小鼠血清能与a、b、c、y和w135五个群的模式菌株产生交联反应,同时能够覆盖b群中表达fhbp(3种变体)以及不表达fhbp但表达nada的高致病菌,并在杀菌检测中表现出广谱且极强的杀菌效果,从而保护人们(尤其是婴幼儿及年老体弱者)免受绝大部分nm致病菌侵害导致的脊髓脑膜炎危害。
五、多价肺炎球菌-δfhbp-nada缀合疫苗的制备和免疫效果评价
重组δfhbp-nada是由生物工程技术制备得来,是一种全新的可用于缀合疫苗的载体蛋白,不同于现有缀合疫苗工艺中常用蛋白载体(crm197、tt、omp、dt、hid),因而不会因同种蛋白载体接种过多导致缀合疫苗的免疫原性下降。同时,δfhbp和nada虽然是nm生存和致病的重要因子,但其本身无毒性,从而在工业生产中不需要对该活性蛋白进行脱毒处理,不会改变其结构和抗原活性位点,从而获得更佳的免疫效果。再次,δfhbp-nada通过柔性连接肽链将两个活性蛋白融合表达,再保持各自的活性的同时让两者成为单一的蛋白质,因而在工业生产及免疫接种时更具有可控性,风险大大降低,又能提供更多的多糖-蛋白结合位点。因而,δfhbp-nada可作为新型优质的载体蛋白用于其他致病菌(如hib和spn)缀合疫苗的开发,就像nm的膜蛋白omp,hib的菌表面蛋白hid,完全可作为常规载体蛋白应用。本发明以δfhbp-nada重组蛋白为载体,提供一种能覆盖23种血清型的强免疫原性肺炎球菌缀合疫苗。δfhbp-nada重组蛋白原液制备如前所述,后续具体制备方案如下:
1.23种血清型spn菌荚膜多糖的制备
选取23种血清型(1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f、33f)的肺炎球菌发酵培养后,采用沙培离心机、碟片式离心机或其他大容量离心机分离培养液,收集离心上清;将离心上清以100kd膜包超滤浓缩,采用25-80%的乙醇进行分级沉淀,收集沉淀并用无水乙醇及丙酮分别洗涤,得到粗制多糖;灭菌注射用水溶解多糖并经脱氧胆酸钠处理后,采用ge填料captoadhere和captodeae或其他厂家相同功能性质的离子交换填料,以串联层析或分步层析的方法进行粗糖精制,收集流穿峰,采gesephadexg25coarse对流穿峰进行脱盐,乙醇沉淀或冻干回收多糖,置于-20℃保存备用。
2.23价spn菌多糖-δfhbp-nada蛋白缀合疫苗的制备
同样应用cdap活化多糖后衍化结合的工艺制备多价荚膜多糖-δfhbp-nada蛋白缀合疫苗。具体方法为:将23种血清型spn菌多糖溶解至5-15mg/ml,调节ph值至10.8左右,在多糖溶液中加入1/10(g/g)的cdap,室温、维持ph值10.8的碱性环境下活化多糖8min。按1:1(与活化多糖的体积比)的比例加入0.5mol/l的已二酰肼,室温反应50-70min。50kd膜包超滤去除溴化氰及已二酰肼,得到多糖衍生物。将多糖衍生物与载体蛋白δfhbp-nada以1:1(g/g)的比例混合并搅拌,按碳二亚胺:多糖=1:10的比例加入碳二亚胺,室温、酸性环境(ph5.6)下反应60min。经100kd超滤膜包超滤去除杂质,并浓缩。最后采用gesepharose4ff进行凝胶层析纯化,收集v0附近的洗脱液。用0.22μm滤膜除菌过滤,得到23价spn菌多糖-δfhbp-nada蛋白缀合疫苗原液。
可将此原液采用磷酸铝佐剂搅拌吸附,以0.15mol/l氯化钠稀释配制,至多价多糖蛋白结合物以多糖含量计终浓度分别为20μg/ml,铝含量终浓度为0.45-0.6mg/ml,搅拌均匀,以预填充注射器分装,0.5ml/支,制成23价spn菌多糖-δfhbp-nada蛋白缀合疫苗制剂,2-8℃保存。也可在疫苗原液中加入80mg/ml蔗糖作为赋形剂,每支多糖含量20μg/ml冻干后制成蛋白疫苗制剂,2-8℃保存。
3.23价spn菌多糖-δfhbp-nada蛋白缀合疫苗效果评价
小鼠免疫:23价spn菌多糖-δfhbp-nada蛋白缀合疫苗蛋白原液、市售23价阳性对照疫苗制剂皮下免疫6周龄spf级nih小鼠10只,免疫剂量为每次0.2ml/只,免疫程序为0,2,4周,免疫结束后2周采血,离心收集血清;另设10只小鼠对照,相同方法注射生理盐水。收集好的血清elisa法测血清抗体的滴度,具体方法如下:采用纯化后23种各血清型多糖,分别以适宜剂量包被酶标板,37℃孵育过夜,洗板后加入系列稀释的待测小鼠血清,37℃孵育后洗板,加入辣根过氧化物酶标记羊抗鼠igg二抗显色,酶标仪测定,读取492nm(630nm为参比波长)吸光度值(a值)。阴性对照组血清a均值+3倍的标准偏差为cutoff值,待测血清a值大于cutoff值判为阳性,以a值大于cutoff值的最大稀释度计算各型别小鼠的几何平均滴度,即为小鼠血清igg抗体效价(表7)。缀合疫苗蛋白原液和市售23价阳性对照多糖疫苗免疫小鼠后均产生了高低度的血清抗体,且缀合疫苗蛋白原液产生的滴度更高,说明蛋白抗原具有协同促进免疫的功能。
表7.疫苗三次免疫小鼠后各种血清型抗体的滴度测定(几何平均值)
缀合疫苗与市售多糖疫苗免疫效果的评价,同样采取两种方法,全菌体包被测定全细胞elisa和流行株的杀菌力实验。全菌体包被选择中国流行的高致病spn菌株血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、23f、33f,将这些菌株扩大培养增殖后,刮取细菌菌苔,以生理盐水溶解,甲醛杀菌后,稀释为2×108个/ml,以此浓度包被96孔酶标板,100ul/孔,4℃包被过夜,洗板后,用相应疫苗血清抗体进行elisa检测,结果见表8。
表8.各血清型肺炎球菌菌株全细胞elisa
同样,高致病spn菌株血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、23f、33f培养后用相应疫苗血清抗体进行杀菌检测,测定并计算杀菌抗体滴度(与补体阴性对照孔相比,50%以上杀菌率的血清最高稀释度为血清抗体杀菌滴度),结果见表9。
表9.各血清型肺炎球菌菌株杀菌力实验:bc50titer(1:)
备注:杀菌力实验以大于1:8为具有保护性。
由以上结果综合分析可得,以重组δfhbp-nada为蛋白载体的新型23价肺炎球菌缀合疫苗具有广谱的免疫效果,其免疫小鼠血清能与1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f、33f血清型spn菌株多糖抗原产生交联反应,同时能够覆盖中国流行的血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、23f、33f菌株,并在杀菌检测中表现出广谱且极强的杀菌效果,从而保护人们(尤其是婴幼儿及年老体弱者)免受绝大部分肺炎球菌致病菌侵害导致肺炎,此类多糖-蛋白缀合疫苗更适合我国人群使用。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>武汉博沃生物科技有限公司
<120>重组δfhbp-nada融合蛋白载体及其制备方法和应用
<130>2017
<160>5
<170>patentinversion3.3
<210>1
<211>274
<212>prt
<213>人工合成
<400>1
metasnargthralaphecyscysleupheleuthrthralaleuile
151015
leuthralacysserserglyglyglyglyserglyserglyglyval
202530
alaalaaspileglythrglyleualaaspalaleuthrthrproleu
354045
asphislysasplysglyleulysserleuthrleugluaspserile
505560
proglnasnglythrleuthrleuseralaglnglyalaglulysthr
65707580
phelysalaglyasplysaspasnserleuasnthrglylysleulys
859095
asnasplysileserargpheaspphevalglnlysilegluvalasp
100105110
glyglnthrilethrleualaserglyglupheglniletyrlysgln
115120125
asphisseralavalvalalaleuglnileglulysileasnasnpro
130135140
asplysileaspserleuileasnglnargserpheleuvalsergly
145150155160
leuglyglygluhisthralapheasnglnleuproglythralaphe
165170175
glyseraspaspalaserglylysleuthrtyrthrileasppheala
180185190
alalysglnglyhisglylysilegluhisleulysserprogluleu
195200205
asnvalaspleualaalaseraspilelysproasplyslysarghis
210215220
alavalileserglyservalleutyrasnglnalaglulysglyser
225230235240
tyrserleuglyilepheglyglyglnalaglngluvalalaglyser
245250255
alagluvalgluthralaasnglyilearghisileglyleualaala
260265270
lysgln
<210>2
<211>825
<212>dna
<213>人工合成
<400>2
atgaaccgaactgccttctgctgccttttcctgaccaccgccctgattctgaccgcctgc60
agcagcggaggcggcggaagcggaagcggcggtgtcgccgccgacatcggcacggggctt120
gccgatgcactaactacgccgctcgaccataaagacaaaggtttgaaatctctgacattg180
gaagactccattccccaaaacggaacactaaccctgtcggcacaaggtgcggaaaaaact240
ttcaaagccggcgacaaagacaacagcctcaacacgggcaaactgaagaacgacaaaatc300
agccgcttcgacttcgtgcaaaaaatcgaagtggacggacaaaccatcacgctggcaagc360
ggcgaatttcaaatatacaaacaggaccactccgccgtcgttgccctacagattgaaaaa420
atcaacaaccccgacaaaatcgacagcctgataaaccaacgctccttccttgtcagcggt480
ttgggcggagaacataccgccttcaaccaactgcccggcacggcattcggttcagacgat540
gccagtggaaaactgacctacaccatagatttcgccgccaagcagggacacggcaaaatc600
gaacatttgaaatcgccagaactcaatgttgacctggccgcctccgatatcaagccggat660
aaaaaacgccatgccgtcatcagcggttccgtcctttacaaccaagccgagaaaggcagt720
tactctctaggcatctttggcgggcaagcccaggaagttgccggcagcgcagaagtggaa780
accgcaaacggcatacgccatatcggtcttgccgccaagcagtaa825
<210>3
<211>76
<212>dna
<213>人工合成
<400>3
aagcttggcggcggcggcagtggcggcggcggcagtggcggcggcggcagtatgaaacac60
tttccatccaaagtac76
<210>4
<211>651
<212>prt
<213>人工合成
<400>4
metasnargthralaphecyscysleupheleuthrthralaleuile
151015
leuthralacysserserglyglyglyglyserglyserglyglyval
202530
alaalaaspileglythrglyleualaaspalaleuthrthrproleu
354045
asphislysasplysglyleulysserleuthrleugluaspserile
505560
proglnasnglythrleuthrleuseralaglnglyalaglulysthr
65707580
phelysalaglyasplysaspasnserleuasnthrglylysleulys
859095
asnasplysileserargpheaspphevalglnlysilegluvalasp
100105110
glyglnthrilethrleualaserglyglupheglniletyrlysgln
115120125
asphisseralavalvalalaleuglnileglulysileasnasnpro
130135140
asplysileaspserleuileasnglnargserpheleuvalsergly
145150155160
leuglyglygluhisthralapheasnglnleuproglythralaphe
165170175
glyseraspaspalaserglylysleuthrtyrthrileasppheala
180185190
alalysglnglyhisglylysilegluhisleulysserprogluleu
195200205
asnvalaspleualaalaseraspilelysproasplyslysarghis
210215220
alavalileserglyservalleutyrasnglnalaglulysglyser
225230235240
tyrserleuglyilepheglyglyglnalaglngluvalalaglyser
245250255
alagluvalgluthralaasnglyilearghisileglyleualaala
260265270
lysglnglyglyglyglyserglyglyglyglyserglyglyglygly
275280285
sermetlyshispheproserlysvalleuthrthralaileleuala
290295300
thrphecysserglyalaleualaalathrseraspaspaspvallys
305310315320
lysalaalathrvalalailevalalaalatyrasnasnglyglnglu
325330335
ileasnglyphelysalaglygluthriletyraspileglygluasp
340345350
glythrilethrglnlysaspalathralaalaaspvalglualaasp
355360365
aspphelysglyleuglyleulyslysvalvalthrasnleuthrlys
370375380
thrvalasngluasnlysglnasnvalaspalalysvallysalaala
385390395400
glusergluileglulysleuthrthrlysleualaaspthraspala
405410415
alaleualaaspthraspalaalaleuaspgluthrthrasnalaleu
420425430
asnlysleuglygluasnilethrthrphealaglugluthrlysthr
435440445
asnilevallysileaspglulysleuglualavalalaaspthrval
450455460
asplyshisalaglualapheasnaspilealaaspserleuaspglu
465470475480
thrasnthrlysalaaspglualavallysthralaasnglualalys
485490495
glnthralaglugluthrlysglnasnvalaspalalysvallysala
500505510
alagluthralaalaglylysalaglualaalaalaglythralaasn
515520525
thralaalaasplysalaglualavalalaalalysvalthraspile
530535540
lysalaaspilealathrasnlysalaaspilealalysasnserala
545550555560
argileaspserleuasplysasnvalalaasnleuarglysgluthr
565570575
argglnglyleualagluglnalaalaleuserglyleupheglnpro
580585590
tyrasnvalglyargpheasnvalthralaalavalglyglytyrlys
595600605
sergluseralavalalaileglythrglypheargphethrgluasn
610615620
phealaalalysalaglyvalalavalglythrserserglyserser
625630635640
alaalatyrhisvalglyvalasntyrglutrp
645650
<210>5
<211>1959
<212>dna
<213>人工合成
<400>5
atgaaccgaactgccttctgctgccttttcctgaccaccgccctgattctgaccgcctgc60
agcagcggaggcggcggaagcggaagcggcggtgtcgccgccgacatcggcacggggctt120
gccgatgcactaactacgccgctcgaccataaagacaaaggtttgaaatctctgacattg180
gaagactccattccccaaaacggaacactaaccctgtcggcacaaggtgcggaaaaaact240
ttcaaagccggcgacaaagacaacagcctcaacacgggcaaactgaagaacgacaaaatc300
agccgcttcgacttcgtgcaaaaaatcgaagtggacggacaaaccatcacgctggcaagc360
ggcgaatttcaaatatacaaacaggaccactccgccgtcgttgccctacagattgaaaaa420
atcaacaaccccgacaaaatcgacagcctgataaaccaacgctccttccttgtcagcggt480
ttgggcggagaacataccgccttcaaccaactgcccggcacggcattcggttcagacgat540
gccagtggaaaactgacctacaccatagatttcgccgccaagcagggacacggcaaaatc600
gaacatttgaaatcgccagaactcaatgttgacctggccgcctccgatatcaagccggat660
aaaaaacgccatgccgtcatcagcggttccgtcctttacaaccaagccgagaaaggcagt720
tactctctaggcatctttggcgggcaagcccaggaagttgccggcagcgcagaagtggaa780
accgcaaacggcatacgccatatcggtcttgccgccaagcagtaaggcggcggcggcagt840
ggcggcggcggcagtggcggcggcggcagtatgaaacactttccatccaaagtactgacc900
acagccatccttgccactttctgtagcggcgcactggcagccacaagcgacgacgatgtt960
aaaaaagctgccactgtggccattgttgctgcctacaacaatggccaagaaatcaacggt1020
ttcaaagctggagagaccatctacgacattggtgaagacggcacaattacccaaaaagac1080
gcaactgcagccgatgttgaagccgacgactttaaaggtctgggtctgaaaaaagtcgtg1140
actaacctgaccaaaaccgtcaatgaaaacaaacaaaacgtcgatgccaaagtaaaagct1200
gcagaatctgaaatagaaaagttaacaaccaagttagcagacactgatgccgctttagca1260
gatactgatgccgctctggatgaaaccaccaacgccttgaataaattgggagaaaatata1320
acgacatttgctgaagagactaagacaaatatcgtaaaaattgatgaaaaattagaagcc1380
gtggctgataccgtcgacaagcatgccgaagcattcaacgatatcgccgattcattggat1440
gaaaccaacactaaggcagacgaagccgtcaaaaccgccaatgaagccaaacagacggcc1500
gaagaaaccaaacaaaacgtcgatgccaaagtaaaagctgcagaaactgcagcaggcaaa1560
gccgaagctgccgctggcacagctaatactgcagccgacaaggccgaagctgtcgctgca1620
aaagttaccgacatcaaagctgatatcgctacgaacaaagctgatattgctaaaaactca1680
gcacgcatcgacagcttggacaaaaacgtagctaatctgcgcaaagaaacccgccaaggc1740
cttgcagaacaagccgcgctctccggcctgttccaaccttacaacgtgggtcggttcaat1800
gtaacggctgcagtcggcggctacaaatccgaatcggcagtcgccatcggtaccggcttc1860
cgctttaccgaaaactttgccgccaaagcaggcgtggcagtcggcacttcgtccggttct1920
tccgcagcctaccatgtcggcgtcaattacgagtggtaa1959
- 还没有人留言评论。精彩留言会获得点赞!