新型双特异性抗体及其用途的制作方法
本申请大体涉及抗体药物领域,具体而言,本申请提供了新型双特异性抗体及其医学和生物学用途。
背景技术:
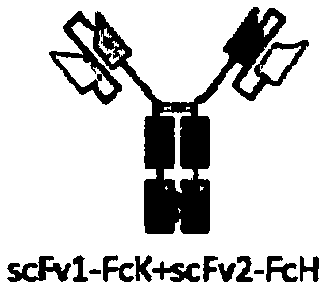
:双特异性抗体(bispecificantibody,BsAb)是一类人工抗体,其包含两个不同的抗原结合位点。双特异性抗体在生物医药领域,尤其是肿瘤免疫治疗方面应用广泛。双特异性抗体从作用机制上可分为双重信号阻断型和介导细胞功能型。通常,介导细胞功能型双特异性抗体指介导T细胞杀伤的抗CD3双特异性抗体。1985年,利用T细胞杀死肿瘤细胞的概念就已被提出(Stearzatal.Nature1985,314:628-631)。通常认为有效激活T细胞需要双重信号,第一信号来自抗原呈递细胞上MHC-抗原复合物与T细胞受体TCR-CD3的结合,第二信号为T细胞与抗原呈递细胞表达的共刺激分子相互作用后产生的非抗原特异性共刺激信号。由于多数癌细胞表面MHC的表达下调甚至缺失,从而使癌细胞逃逸免疫杀伤。靶向CD3的双特异性抗体则能够分别结合T细胞表面CD3分子和癌细胞表面抗原,从而拉近细胞毒性T细胞(cytotoxicTcell,Tc或CTL)与癌细胞的距离,引导T细胞直接杀伤癌细胞,而不再依赖于T细胞的双重激活信号。双特异性抗体可以是三功能抗体,即一条臂靶向肿瘤细胞上的抗原,另一条臂靶向T细胞的CD3分子,Fc段结合Fc受体。这种抗体使得T细胞、肿瘤细胞和结合抗体Fc结构域的效应细胞形成复合体(MullerandKontermann,BioDrugs2010;24:89-98)。CD3分子有δ、ε、γ、ζ共4个亚基,分子量分别为18.9kDa、23.1kDa、20.5kDa、18.7kDa,各包括171个、207个、182个和164个氨基酸残基。四种亚基组成的6条多肽链与T细胞受体(Tcellreceptor,TCR)紧密结合,形成包含8条多肽链的TCR-CD3复合物,该复合物传导T细胞激活信号,稳定TCR结构。CD3的胞内部分含有免疫受体酪氨酸激活基序(immunoreceptortyrosine-basedactivationmotif,ITAM),TCR识别和结合MHC分子呈递的抗原肽,使得T细胞内的酪氨酸蛋白激酶p561ck磷酸化CD3分子中ITAM的酪氨酸残基,之后募集含有SH2(Scrhomology2)结构域的酪氨酸蛋白激酶(如ZAP-70)。ITAM磷酸化和结合ZAP-70是T细胞激活早期信号传导过程的重要生化反应之一。因此,CD3分子有传导TCR识别抗原产生的激活信号的功能。抗CD3E抗体能结合T细胞表面TCR受体复合物中的CD3E亚基,能够提供T细胞激活的第一信号(类似于抗原递呈细胞上的MHC-肽复合物结合到TCR),有利于T细胞的激活。而且包含针对CD3E的的抗原结合部的双特异性抗体,可以实现T细胞在肿瘤细胞周边的富集,提高T细胞对肿瘤细胞的杀伤效率。由于早期在免疫原性、结构稳定性以及抗体质量控制等方面的不足,限制了双特异性抗体的进一步发展。近年来,上游基因工程抗体和下游生产工艺技术的改进,克服了传统双特异性抗体的缺陷,从而推动了多类新型双特异性抗体进入临床开发阶段。为了解决将两个不同的半抗体进行正确装配的问题,设计开发了多种结构的双特异性抗体。一类双特异性抗体不含Fc区。这类结构抗体的优点是分子量小,可以在原核细胞中表达,不需要考虑正确装配的问题;缺点是由于没有抗体Fc段,不能介导相应的生物学功能,而且半衰期短,因而临床应用受到一定限制。目前已有报道的此类双特异性抗体包括BiTE、DART、TrandAbs、bi-Nanobody等。德国Micromet公司开发的BiTE(bispecificT-cellengager)系列产品是将抗CD3scfv与不同抗肿瘤细胞表面抗原scfv通过肽段进行连接获得的,可同时结合CD3+T细胞和肿瘤细胞。此类抗体克服了稳定性差、表达量低、溶解性低等生产问题,其中Blinatumomab已成功上市。另一类是保留抗体Fc结构域的抗体。此类抗体形成IgG样结构,具有Fc介导的生物学功能。此类双特异性抗体主要有Triomabs、kihIgG、Cross-mab、orthoFabIgG、DVDIgG、IgGscFv、scFv2-Fc等。这些包含Fc段的双特异性抗体,都具有体内半衰期长,能够介导ADCC和CDC等优点。HER2基因位于人17q21染色体,编码分子量185kD的跨膜蛋白,该蛋白有酪氨酸激酶活性,正常状态下以无活性形式存在,参与调节细胞正常分化,通常只在婴儿期表达,成人只在少数组织中低水平表达。HER2基因在正常细胞中是双拷贝基因,通过基因突变激活,其扩增导致转录上调,蛋白表达增加。HER2是人表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)家族的第二个成员,属于I型受体酪氨酸激酶家族,在许多正常和异常表皮细胞的生长、分化和代谢过程中起重要的调节作用,多种肿瘤的发生、发展和疾病状态都与HER2相关。该家族共有4种受体,分别命名为HER1、HER2、HER3和HER4,这些受体相互作用形成同源或异源二聚体,尤以HER2异二聚体为主,在细胞的信号传导过程中发挥重要作用。HER2激活抑制肿瘤细胞凋亡,促进肿瘤细胞增殖;上调VEGF/VPF,加速肿瘤血管生成,促进肿瘤细胞转移,破坏组织抗侵袭功能(ArtufelMV,ValeroAC,LladoRR,etal.ClinTranslOncol,2005,7.(11):504-511)。HER2蛋白过表达对诱导细胞分化、增殖和转化以及促进肿瘤转移、侵袭和粘附具有重要作用(HynesNE,StemDF.BiochemBiophysAcTa,1994,1198(2-3):165-184.)。由于在20%的乳腺癌病例中过表达,而且与不良预后相关,因此HER2在乳腺癌中的作用格外受到关注(Reeseetal.,StemCells1997;15:1-8;Andrecheketal.,ProcNatlAcadSciUSA2000;97:3444-3449.Slamonetal.,Science1987;235:177-182)。因而,靶向CD3和/或HER2的双特异性抗体会在肿瘤治疗中有良好的应用前景。技术实现要素:第一方面,本申请提供双特异性人IgG1抗体,其包含针对人CD3E的抗原结合部,所述针对人CD3E的抗原结合部包含:如SEQIDNO:3所示的HCDR1,如SEQIDNO:4所示的HCDR2,如SEQIDNO:5所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;其中HCDR和LCDR根据Kabat定义。第二方面,本申请提供双特异性人IgG1抗体,其包含针对HER2的抗原结合部,所述针对HER2的抗原结合部包含:如SEQIDNO:9所示的HCDR1,如SEQIDNO:10所示的HCDR2,如SEQIDNO:11所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;其中HCDR和LCDR根据Kabat定义。第三方面,本申请提供双特异性人IgG1抗体,其包含针对人CD3E的抗原结合部和针对HER2的抗原结合部,所述针对人CD3E的抗原结合部包含:如SEQIDNO:3所示的HCDR1,如SEQIDNO:4所示的HCDR2,如SEQIDNO:5所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;并且所述针对HER2的抗原结合部包含:如SEQIDNO:9所示的HCDR1,如SEQIDNO:10所示的HCDR2,如SEQIDNO:11所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;其中HCDR和LCDR根据Kabat定义。在第一和第三方面的一些实施方案中,针对人CD3E的抗原结合部包含如SEQIDNO:12所示的重链可变区和如SEQIDNO:13所示的轻链可变区。在第二和第三方面的一些实施方案中,针对HER2的抗原结合部包含SEQIDNO:14所示的重链可变区和如SEQIDNO:13所示的轻链可变区。在上述任一方面的一些实施方案中,针对HER2的抗原结合部为单链抗体(scfv)或Fab片段。在上述任一方面的一些实施方案中,针对人CD3E的抗原结合部为单链抗体(scfv)或Fab片段。在上述任一方面的一些实施方案中,双特异性人IgG1抗体具有第一臂和第二臂,其中第一臂和第二臂具有选自以下的结构:(1)第一臂包含单链抗体(scfv)形式的针对HER2的抗原结合部,第二臂包含单链抗体(scfv)形式的针对人CD3E的抗原结合部,其中第一臂包含如SEQIDNO:15所示的氨基酸序列并且第二臂包含如SEQIDNO:16所示的氨基酸序列,或者第一臂包含如SEQIDNO:21所示的氨基酸序列并且第二臂包含如SEQIDNO:22所示的氨基酸序列;(2)第一臂包含Fab片段形式的针对HER2的抗原结合部,第二臂包含单链抗体(scfv)形式的针对人CD3E的抗原结合部,其中第一臂包含如SEQIDNO:17的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,并且第二臂包含如SEQIDNO:16所示的氨基酸序列,或者第一臂包含如SEQIDNO:20的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,并且第二臂包含如SEQIDNO:16所示的氨基酸序列,或者第一臂包含如SEQIDNO:23的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,并且第二臂包含如SEQIDNO:22所示的氨基酸序列,或者第一臂包含如SEQIDNO:25的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,并且第二臂包含如SEQIDNO:22所示的氨基酸序列;(3)第一臂包含单链抗体(scfv)形式的针对HER2的抗原结合部,第二臂包含Fab片段形式的针对人CD3E的抗原结合部,其中第一臂包含如SEQIDNO:15所示的氨基酸序列并且第二臂包含如SEQIDNO:19的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,或者第一臂包含如SEQIDNO:21所示的氨基酸序列并且第二臂包含如SEQIDNO:24的氨基酸序列和如SEQIDNO:18所示的氨基酸序列;(4)第一臂包含Fab片段形式的针对HER2的抗原结合部,第二臂包含Fab片段形式的针对人CD3E的抗原结合部,其中第一臂包含如SEQIDNO:17的氨基酸序列和如SEQIDNO:18所示的的氨基酸序列并且第二臂包含如SEQIDNO:19的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,或第一臂包含如SEQIDNO:20的氨基酸序列和如SEQIDNO:18所示的的氨基酸序列并且第二臂包含如SEQIDNO:19的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,或第一臂包含如SEQIDNO:23的氨基酸序列和如SEQIDNO:18所示的的氨基酸序列并且第二臂包含如SEQIDNO:24的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,或第一臂包含如SEQIDNO:25的氨基酸序列和如SEQIDNO:18所示的的氨基酸序列并且第二臂包含如SEQIDNO:24的氨基酸序列和如SEQIDNO:18所示的氨基酸序列,或第一臂包含如SEQIDNO:26的氨基酸序列和如SEQIDNO:18所示的的氨基酸序列并且第二臂包含如SEQIDNO:27的氨基酸序列和如SEQIDNO:18所示的氨基酸序列。在上述任一方面的一些实施方案中,双特异性人IgG1抗体包含两种具有相同铰链区的Fc片段,所述铰链区的氨基酸序列如SEQIDNO:29、SEQIDNO:1或SEQIDNO:28所示,当所述铰链区的氨基酸序列如SEQIDNO:1或SEQIDNO:28所示时,其替换天然人IgG1抗体恒定区的第216-230位序列,抗体恒定区氨基酸位置按照EUnumbering确定。第四方面,本申请提供药物组合物,其包含第一至第三方面中任一方面所述的双特异性人IgG1抗体。第五方面,本申请提供第一至第三方面中任一方面所述的双特异性人IgG1抗体或者第四方面所述的药物组合物在制备用于预防或治疗肿瘤的药物中的用途。第六方面,本申请提供了预防或治疗肿瘤的方法,包括向有需要的个体给予第一至第三方面中任一方面所述的双特异性人IgG1抗体或者第四方面所述的药物组合物。附图说明图1a-图1d为本申请设计的四种不同结构双特异性抗体的结构示意图。图2显示了采用ELISA方法检测各种双特异性抗体同时结合CD3E和HER2两种抗原的结果。图3显示了利用流式细胞术分析各种双特异性抗体与MDA-MB-453人乳腺癌细胞表面HER2结合的结果。图4显示了利用流式细胞术分析各种双特异性抗体与PBMC表面CD3结合的结果。图5a-5g显示了不同双特异性抗体对肿瘤细胞的杀伤作用结果,其中图5a显示了双特异性抗体对HER2阳性细胞的杀伤结果;图5b显示了双特异性抗体对HER2阴性细胞的杀伤结果;图5c-图5e显示了双特异性抗体的不同铰链区结构对杀伤活性的影响;图5f和图5g为双特异性抗体的不同抗原结合部设计对杀伤活性的影响。图6a-6c显示了不同双特异性抗体介导HER2阳性靶细胞(MDA-MB-453人乳腺癌细胞)对T细胞的激活,其中图6a和图6b显示了不同双特异性抗体激活T细胞表达早期活化标志分子CD69的结果;图6c显示了不同双特异性抗体诱导T细胞产生细胞因子IL-2的结果。序列说明SEQIDNO:1为本申请的示例性双特异性抗体包含的铰链区的氨基酸序列,其为天然的人IgG2抗体的铰链区。SEQIDNO:2为天然的人IgG1抗体恒定区CH1片段的氨基酸序列。SEQIDNO:3为本申请的示例性抗人CD3E单克隆抗体的HCDR1的氨基酸序列。SEQIDNO:4为本申请的示例性抗人CD3E单克隆抗体的HCDR2的氨基酸序列。SEQIDNO:5为本申请的示例性抗人CD3E单克隆抗体的HCDR3的氨基酸序列。SEQIDNO:6为本申请的示例性抗人CD3E单克隆抗体和抗HER2单克隆抗体的LCDR1的氨基酸序列。SEQIDNO:7为本申请的示例性抗人CD3E单克隆抗体和抗HER2单克隆抗体的LCDR2的氨基酸序列。SEQIDNO:8为本申请的示例性抗人CD3E单克隆抗体和抗HER2单克隆抗体的LCDR3的氨基酸序列。SEQIDNO:9为本申请的示例性抗HER2单克隆抗体的HCDR1的氨基酸序列。SEQIDNO:10为本申请的示例性抗HER2单克隆抗体的HCDR2的氨基酸序列。SEQIDNO:11为本申请的示例性抗HER2单克隆抗体的HCDR3的氨基酸序列。SEQIDNO:12为本申请的示例性抗人CD3E单克隆抗体的重链可变区的氨基酸序列。SEQIDNO:13为本申请的示例性抗人CD3E单克隆抗体和抗HER2单克隆抗体的轻链可变区的氨基酸序列。SEQIDNO:14为本申请的示例性抗HER2单克隆抗体的重链可变区的氨基酸序列。SEQIDNO:15为本申请的示例性双特异性抗体的含抗HER2scfv的臂(抗HER2scfv-Fc融合蛋白)的氨基酸序列。SEQIDNO:16为本申请的示例性双特异性抗体的含抗人CD3Escfv的臂(抗人CD3Escfv-Fc融合蛋白)的氨基酸序列。SEQIDNO:17为本申请的示例性双特异性抗体的含抗HER2Fab的臂的重链部分的氨基酸序列。SEQIDNO:18为本申请的示例性双特异性抗体的含抗HER2Fab或含抗人CD3EFab的臂的轻链部分的氨基酸序列。SEQIDNO:19为本申请的示例性双特异性抗体的含抗人CD3EFab的臂的重链部分的氨基酸序列。SEQIDNO:20为本申请的示例性双特异性抗体的含抗HER2Fab的臂的重链部分的氨基酸序列。SEQIDNO:21为本申请的示例性双特异性抗体的含抗HER2scfv的臂(抗HER2scfv-Fc融合蛋白)的氨基酸序列。SEQIDNO:22为本申请的示例性双特异性抗体的含抗人CD3Escfv的臂(抗人CD3Escfv-Fc融合蛋白)的氨基酸序列。SEQIDNO:23为本申请的示例性双特异性抗体的含抗HER2Fab的臂的重链部分的氨基酸序列。SEQIDNO:24为本申请的示例性双特异性抗体的含抗人CD3EFab的臂的重链部分的氨基酸序列。SEQIDNO:25为本申请的示例性双特异性抗体的含抗HER2Fab的臂的重链部分的氨基酸序列。SEQIDNO:26为本申请的示例性双特异性抗体的含抗HER2Fab的臂的重链部分的氨基酸序列。SEQIDNO:27为本申请的示例性双特异性抗体的含抗人CD3EFab的臂的重链部分的氨基酸序列。SEQIDNO:28为本申请的示例性双特异性抗体包含的铰链区的氨基酸序列,其为天然的人IgG2抗体的铰链区的变体。SEQIDNO:29为本申请的示例性双特异性抗体包含的铰链区的氨基酸序列,其为天然的人IgG1抗体的铰链区。SEQIDNO:30为本申请的示例性双特异性抗体包含的Fab片段中的CH1片段的氨基酸序列。SEQIDNO:31为本申请的示例性双特异性抗体包含的Fc片段中的CH2片段的氨基酸序列。SEQIDNO:32为人CD3E胞外区(CD3E)的氨基酸序列。SEQIDNO:33为人CD3D胞外区(CD3D)的氨基酸序列。SEQIDNO:34为猴CD3E胞外区(mfCD3E)的氨基酸序列。SEQIDNO:35为猴CD3D胞外区(mfCD3D)的氨基酸序列。SEQIDNO:36为小鼠CD3E胞外区(mCD3E)的氨基酸序列。SEQIDNO:37为小鼠CD3D胞外区(mCD3D)的氨基酸序列。SEQIDNO:38为HER2胞外区D1D2D3部分(HER2)的氨基酸序列。SEQIDNO:39为His标签的氨基酸序列。SEQIDNO:40为鼠抗体IgG2a的Fc片段(mFc)的氨基酸序列。SEQIDNO:41为人IgG1抗体的Fc片段变体(FcK)的氨基酸序列。SEQIDNO:42为人IgG1抗体的Fc片段变体(FcH)的氨基酸序列。SEQIDNO:43为天然的人IgG1抗体重链恒定区的氨基酸序列。SEQIDNO:44为人IgG1抗体重链恒定区的变体(IgG1Hn)的氨基酸序列。SEQIDNO:45为人IgG1抗体重链恒定区的变体(IgG1Kn)的氨基酸序列。SEQIDNO:46为人IgG1抗体重链恒定区的变体(IgG1Hn-m3)的氨基酸序列。SEQIDNO:47为人IgG1抗体重链恒定区的变体(IgG1kn-m3)的氨基酸序列。SEQIDNO:48为人IgG1抗体重链恒定区的变体(IgG1H3n-m3)的氨基酸序列。SEQIDNO:49为人IgG1抗体重链恒定区的变体(IgG1kn1-m3)的氨基酸序列。SEQIDNO:50为人IgG1抗体重链恒定区的变体(IgG1H3n1-m3)的氨基酸序列。SEQIDNO:51为人IgG1抗体κ亚型轻链恒定区的氨基酸序列。发明详述定义除非另外指明,本申请中所用的术语具有本领域技术人员通常所理解的含义。在本文描述抗体结构时,涉及氨基酸位置编号的描述参照人IgG1抗体的EUnumbering定义,这是本领域技术人员公知且容易查询到的。此外,在本文结合EUnumbering位置描述突变时,是指相对于天然抗体序列产生的突变。本文所用术语“Fc片段”、“Fc结构域”、“Fc部分”或类似的术语是指抗体重链恒定区的一部分,包括铰链区(hinge)、恒定区的CH2片段和CH3片段。参照人IgG1抗体的EUnumbering定义,Fc片段是抗体恒定区中第216-447位的氨基酸序列。本文所用术语“Fab(fragmentantigenbinding)片段”、“Fab部分”或类似的术语是指完整的抗体用木瓜蛋白酶处理后产生的能够与抗原结合的抗体片段,包括完整的轻链(VL-CL)、重链可变区和CH1片段(VH-CH1)。本文所用术语“单链抗体(scfv,singlechainfragmentvariable)”是指一般利用基因工程技术构建的单链结构的抗体,包含重链可变区(VH)和轻链可变区(VL)的一条多肽链。在重链可变区和轻链可变区之间通常会设计一段柔性的连接肽(linker)以便重链可变区和轻链可变区可以折叠成为能够结合抗原的正确构象。本文所用术语“抗原结合部”指抗体结构中决定抗原结合能力的部分。本领域技术人员能够理解,抗体结构中决定抗原结合能力的主要部分是CDR,因此CDR也是抗原结合部的核心组成部分。在双特异性抗体构建中,“抗原结合部”包括但不限于Fab片段的形式或单链抗体的形式。本文所用术语“双特异性抗体”是具有结合两种不同抗原能力的抗体,其可以由两个Fc片段以及分别与其融合的两个抗原结合部组成。本文所用术语“双特异性人IgG1抗体”是指基于人IgG1抗体的双特异性抗体,并且除了本文说明的改变结构之外,其具备人IgG1抗体的基本特征和功能。本领域技术人员公知,互补决定区(CDR,通常有CDR1、CDR2及CDR3)是可变区中对抗体的亲和力和特异性影响最大的区域。VH或VL的CDR序列有两种常见的定义方式,即kabat定义和Chothia定义。(参阅例如Kabat,“SequencesofProteinsofImmunologicalInterest”,NationalInstitutesofHealth,Bethesda,Md.(1991);A1-Lazikanietal.,J.Mol.Biol.273:927-948(1997);以及Martinetal.,Proc.Natl.Acad.Sci.USA86:9268-9272(1989))。对于给定抗体的可变区序列,可以根据Kabat定义或者Chothia定义来确定VH和VL序列中CDR区序列。在本申请的实施方案中,利用Kabat定义CDR序列。对于给定抗体的可变区序列,可以通过多种方式分析可变区序列中CDR区序列,例如可以利用在线软件Abysis确定(http://www.abysis.org/)。如本文所用术语“特异性结合”,是指两个分子之间的非随机结合反应,例如抗体至抗原表位的结合。第一方面,本申请提供双特异性人IgG1抗体,其包含针对人CD3E的抗原结合部,所述针对人CD3E的抗原结合部包含:如SEQIDNO:3所示的HCDR1,如SEQIDNO:4所示的HCDR2,如SEQIDNO:5所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;其中HCDR和LCDR根据Kabat定义。第二方面,本申请提供双特异性人IgG1抗体,其包含针对HER2的抗原结合部,所述针对HER2的抗原结合部包含:如SEQIDNO:9所示的HCDR1,如SEQIDNO:10所示的HCDR2,如SEQIDNO:11所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;其中HCDR和LCDR根据Kabat定义。第三方面,本申请提供双特异性人IgG1抗体,其包含针对人CD3E的抗原结合部和针对HER2的抗原结合部,所述针对人CD3E的抗原结合部包含:如SEQIDNO:3所示的HCDR1,如SEQIDNO:4所示的HCDR2,如SEQIDNO:5所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;并且所述针对HER2的抗原结合部包含:如SEQIDNO:9所示的HCDR1,如SEQIDNO:10所示的HCDR2,如SEQIDNO:11所示的HCDR3,如SEQIDNO:6所示的LCDR1,如SEQIDNO:7所示的LCDR2,和如SEQIDNO:8所示的LCDR3;其中HCDR和LCDR根据Kabat定义。在第一和第三方面的一些实施方案中,针对人CD3E的抗原结合部包含如SEQIDNO:12(包含如SEQIDNO:3所示的HCDR1、如SEQIDNO:4所示的HCDR2和如SEQIDNO:5所示的HCDR3)所示的重链可变区和如SEQIDNO:13所示的轻链可变区(包含如SEQIDNO:6所示的LCDR1、如SEQIDNO:7所示的LCDR2和如SEQIDNO:8所示的LCDR3)。在第二和第三方面的一些实施方案中,针对HER2的抗原结合部包含SEQIDNO:14(包含如SEQIDNO:9所示的HCDR1、如SEQIDNO:10所示的HCDR2和如SEQIDNO:11所示的HCDR3)所示的重链可变区和如SEQIDNO:13所示的轻链可变区(包含如SEQIDNO:6所示的LCDR1、如SEQIDNO:7所示的LCDR2和如SEQIDNO:8所示的LCDR3)。在上述任一方面的一些实施方案中,针对HER2的抗原结合部为单链抗体(scfv)或Fab片段。在上述任一方面的一些实施方案中,针对人CD3E的抗原结合部为单链抗体(scfv)或Fab片段。由于双特异性抗体具有针对两种不同抗原的两个不同抗原结合部,而抗原结合部可以为单链抗体(scfv)或Fab片段两种形式,那么针对给定的两种抗原时,双特异性抗体的抗原结合部配置具有四种组合方式(例如,可参见图1a-图1d)。在本文中,还将双特异性抗体描述为具有两个“臂”,例如,在图1a-图1d所示的四种结构中,以中间为界,可以将双特异性抗体分为两个臂。双特异性抗体的臂可以由Fc片段和抗原结合部(Fab片段或单链抗体)组成。对于由Fc片段和Fab片段组成的臂,其结构类似于通常的抗体,含有完整的重链和轻链,因此这样的臂的结构可以表示为Fc+Fab,也可以表示为重链(Fc+Fab中的重链可变区和CH1片段)+轻链(Fab中的轻链部分)。当两个臂都含有Fab片段形式的抗原结合部时,由此形成的双特异性抗体的结构接近于天然抗体,是优选的一种实施方案。在上述任一方面的一些实施方案中,双特异性人IgG1抗体包含两种具有相同铰链区的Fc片段,所述铰链区的氨基酸序列如SEQIDNO:29、SEQIDNO:1或SEQIDNO:28所示,当所述铰链区的氨基酸序列如SEQIDNO:1或SEQIDNO:28所示时,其替换天然人IgG1抗体恒定区的第216-230位序列,抗体恒定区氨基酸位置按照EUnumbering确定。SEQIDNO:29为天然的人IgG1抗体的铰链区。SEQIDNO:1为天然的人IgG2抗体的铰链区,SEQIDNO:28为天然的人IgG2抗体的铰链区的变体。本申请的发明人发现,在双特异性人IgG1抗体中引入人IgG2抗体的铰链区能够改进双特异性抗体的一些功能和性质。当构建保留抗体Fc结构域的双特异性抗体时,可以从以下两个角度优化双特异性抗体的结构:一是重链异聚化,二是轻链和重链的正确装配。在一些实施方案中,两种Fc片段包含能够确保重链异聚化的突变。KIH技术(knob-in-hole,KIH)是解决重链异聚化的一种策略。通常,KIH技术是指通过改造CH3区的氨基酸序列,形成有利于异种半抗体相互配对的结构,可以在构成双特异性抗体的同时又尽可能地保持正常抗体的结构。在一些实施方案中,所利用的KIH技术包括,使一个Fc片段包含点突变S354C和T366W,另一个Fc片段包含点突变Y349C、T366S、L368A和Y407V。关于KIH技术的指导,例如可参见“AnefficientroutetohumanbispecificIgG”,A.MargaretMerchantetal.,NatureBiotechnology,Volume16,1998,通过引用的方式将该文献全文并入本文。在一些实施方案中,识别不同抗原表位的Fab片段包含相同的轻链。该实施方案有利于轻链和重链的正确装配,也是优选的一种实施方案。在一些实施方案中,一种Fab片段包含天然的人IgG1抗体恒定区CH1片段,另一种Fab片段包含突变的人IgG1抗体恒定区CH1片段,突变的人IgG1抗体恒定区CH1片段包含点突变G137E、N203D和R214T中的任意1个、2个或3个,其中CH1片段的氨基酸序列为抗体恒定区第118-215位的氨基酸序列。在一些实施方案中,天然的人IgG1抗体恒定区CH1片段的氨基酸序列为SEQIDNO:2。在一些实施方案中,突变的人IgG1抗体恒定区CH1片段的氨基酸序列为SEQIDNO:30。不被任何理论所束缚,在一种Fab片段中引入上述突变能在不改变抗体恒定区结构/功能以及免疫原性的前提下,改变含有该突变的重链的电荷特性(等电点,pI),进而有利于双特异性抗体的后期纯化。137、203和214这三个位点位于CH1结构域的亲水区(结构域的表面),对其进行突变不会改变CH1的构象,所涉及的突变是将碱性氨基酸改为中性氨基酸(如R214T),或者将中性氨基酸改为酸性氨基酸(如G137E、N203D),这样的突变能导致含有突变的这条重链的等电点(pI)下降,低于未突变的另一条重链的等电点,这有利于后期纯化过程中利用等电点不同将目的双特异性抗体与例如KIH技术可能产生的同聚体进行有效的分离。而且,上述突变也天然存在于其它亚型的抗体(如IgG2、IgG4),预期不会导致明显的免疫原性问题。在一些实施方案中,两种Fc片段的CH2片段中均包含点突变L234F、L235E和P331S,其中CH2片段的氨基酸序列为抗体恒定区第231-340位的氨基酸序列。在一些实施方案中,两种Fc片段的CH2片段的氨基酸序列均为SEQIDNO:31。在CH2片段中引入上述突变能够降低抗体Fc段介导的抗体依赖性细胞毒作用(ADCC),从而可能减少双特异性抗体在体内导致的副作用。关于上述突变的指导,例如可参见“ThebindingaffinityofhumanIgGforitshighaffinityFcreceptorisdeterminedbymultipleaminoacidsintheCH2domainandismodulatedbythehingeregion”,StephenM.Canfieldetal.,J.Exp.Med.Volume173,1991,通过引用的方式将该文献全文并入本文。本申请的双特异性人IgG1抗体可以具有第一臂和第二臂,根据每个臂所含的抗原结合部是单链抗体(scfv)形式还是Fab片段形式,第一臂和第二臂可以具有选自以下的结构:(1)第一臂包含单链抗体(scfv)形式的针对HER2的抗原结合部和Fc片段,第二臂包含单链抗体(scfv)形式的针对人CD3E的抗原结合部和Fc片段;(2)第一臂包含Fab片段形式的针对HER2的抗原结合部和Fc片段,第二臂包含单链抗体(scfv)形式的针对人CD3E的抗原结合部和Fc片段;(3)第一臂包含单链抗体(scfv)形式的针对HER2的抗原结合部和Fc片段,第二臂包含Fab片段形式的针对人CD3E的抗原结合部和Fc片段;(4)第一臂包含Fab片段形式的针对HER2的抗原结合部和Fc片段,第二臂包含Fab片段形式的针对人CD3E的抗原结合部和Fc片段。在一些具体的实施方案中,第一臂和第二臂的序列结构可以如下表所示:因此,本申请公开了上表所示的任一类型的HER2相关臂与任一类型的人CD3E相关臂的全部可能组合方式。第四方面,本申请提供药物组合物,其包含第一至第三方面中任一方面所述的双特异性人IgG1抗体。在一些实施方案中,药物组合物还包含药学可接受的载体、赋形剂、稀释剂等。在一些实施方案中,药物组合物用于治疗肿瘤,例如表达双特异性人IgG1抗体所针对的肿瘤表面抗原的肿瘤。在一些实施方案中,药物组合物还可包含润滑剂,如滑石粉、硬脂酸镁和矿物油;润湿剂;乳化剂;悬浮剂;防腐剂,如苯甲酸、山梨酸和丙酸钙;增甜剂和/或调味剂等。在一些实施方案中,可将本申请中的药物组合物配制为片剂、丸剂、粉剂、锭剂、酏剂、悬液、乳剂、溶液、糖浆、栓剂或胶囊等形式。在一些实施方案中,可以利用任何生理上可接受的给药方式递送本申请的药物组合物,这些给药方式包括但不限于:口服给药、肠胃外给药、经鼻给药、直肠给药、腹膜内给药、血管内注射、皮下给药、经皮给药、吸入给药等。在一些实施方案中,可以通过混合具有所需纯度的试剂与视情况的药学上可接受的载体、赋形剂等,以冻干制剂或水溶液的形式配制用于治疗用途的药物组合物用于存储。第五方面,本申请提供第一至第三方面中任一方面所述的双特异性人IgG1抗体或者第四方面所述的药物组合物在制备用于预防或治疗肿瘤的药物中的用途。第六方面,本申请提供了预防或治疗肿瘤的方法,包括向有需要的个体给予第一至第三方面中任一方面所述的双特异性人IgG1抗体或者第四方面所述的药物组合物。在第四、第五或第六方面的一些实施方案中,肿瘤表达HER2。在第四、第五或第六方面的一些实施方案中,肿瘤选自乳腺癌、胃癌、结直肠癌、前列腺癌、胰腺癌、白血病、多发性骨髓瘤以及恶性淋巴瘤。应当理解,以上详细描述仅为了使本领域技术人员更清楚地了解本申请的内容,而并非意图在任何方面加以限制。本领域技术人员能够对所述实施方案进行各种改动和变化。以下实施例仅用于说明而非限制本申请范围的目的。实施例实施例1单克隆抗体的制备和确认作为展示本申请的双特异性人IgG1抗体的一个实例,制备了靶向于人CD3E和HER2的双特异性人IgG1抗体。作为制备该双特异性人IgG1抗体的基础,本申请的发明人首先制备了针对人CD3E和HER2的两种单克隆抗体,该过程需要利用多种不同的重组蛋白,包括重组人CD3E的胞外区(CD3E,SEQIDNO:32),人CD3D-胞外区(CD3D,SEQIDNO:33),猴CD3E胞外区(mfCD3E,SEQIDNO:34),猴CD3D胞外区(mfCD3D,SEQIDNO:35),小鼠CD3E胞外区(mCD3E,SEQIDNO:36),小鼠CD3D胞外区(mCD3D,SEQIDNO:37),重组HER2胞外区D1D2D3部分(HER2,SEQIDNO:38)。在自然环境中,CD3E与CD3D形成异源二聚体,因此为了制备有天然构象的CD3E抗原,我们将CD3E和CD3D同时表达,并利用FcK+FcH异源二聚体方法将CD3D和CD3E形成异源二聚体,用作本研究中的抗原。这些重组蛋白都有大量的翻译后修饰(如:糖基化或二硫键等),因而利用哺乳动物细胞表达系统将更有利于保持重组蛋白的结构和功能。此外,为了方便纯化,非抗体类的重组蛋白在C端添加了His-tag(SEQIDNO:39),或者鼠抗体IgG2a的Fc段(mFc,SEQIDNO:40)。重组抗体制备时,抗体重链恒定区可以来自人IgG1抗体(SEQIDNO:43),或者为IgG1恒定区的各种突变体,如:IgG1Hn(SEQIDNO:44),IgG1Kn(SEQIDNO:45),IgG1Hn-m3(SEQIDNO:46),IgG1kn-m3(SEQIDNO:47),IgG1H3n-m3(SEQIDNO:48),IgG1kn1-m3(SEQIDNO:49),IgG1H3n1-m3(SEQIDNO:50),轻链恒定区是kappa亚型(SEQIDNO:51)。根据Uniprot数据库的各种目的重组蛋白的氨基酸序列,设计并合成上述各种重组蛋白的基因(包含His-tag、mFc或者Fc编码基因)。利用常规的分子生物学技术将合成的各种重组蛋白基因克隆至合适的真核表达载体(如invitrogen公司的pcDNA3.1等),然后利用脂质体(如invitrogen公司的293fectin等)或其它转染试剂(如PEI等)将制备的重组蛋白表达质粒转染入HEK293细胞(如invitrogen公司的HEK293F),在无血清悬浮培养条件下培养3-5天。然后通过离心等方式收获培养上清。His-tag融合表达的重组蛋白利用金属螯合亲和层析柱(如GE公司的HisTrapFF等)对培养上清中的重组蛋白进行一步纯化。而mFc融合表达的重组蛋白和重组抗体用ProteinA/G亲和层析柱(如GE公司的MabselectSURE等)进行一步纯化。然后利用脱盐柱(如GE公司的Hitrapdesaulting等)将重组蛋白保存缓冲液置换为PBS(pH7.0)或者其它合适的缓冲液。必要时,可以对抗体样品进行过滤除菌,然后分装保存于-20℃。利用重组抗体技术得到靶向于肿瘤抗原HER2的单克隆抗体(指定为C6G9+L1A7)和靶向于人CD3E的单克隆抗体(指定为H10B7+L1A7)。C6G9+L1A7的重链可变区序列为SEQIDNO:14,轻链可变区序列为SEQIDNO:13。H10B7+L1A7的重链可变区序列为SEQIDNO:12,轻链可变区序列为SEQIDNO:13。C6G9+L1A7和H10B7+L1A7具有相同的轻链。此外,C6G9+L1A7和H10B7+L1A7各自的抗体功能和性质经过实验确认。实施例2不同结构双特异性抗体的设计和制备基于实施例1制备和验证的两种单克隆抗体,设计了一系列针对人CD3E和HER2的双特异性抗体。由于双特异性抗体的每个臂可以包含Fab片段或scfv,因此根据不同的组合方式设计了四种结构的双特异性抗体(参见图1a-图1d)。此外,为了促进形成异源二聚体,使用了基于KIH(Knob-Into-Hole)技术的人IgG1抗体的Fc片段突变体(FcK,SEQIDNO:41或者FcH,SEQIDNO:42),即,将针对人CD3E(源自H10B7+L1A7)的抗原结合区融合在含有Knob突变的Fc(FcK)的N端,将针对HER2(源自C6G9+L1A7)的抗原结合区融合在含有Hole突变的Fc(FcH)的N端。按照与实施例1类似的重组抗体技术,制备了表1中所示的双特异性抗体(BsAb)和作为对照的单克隆抗体(Mab)。表1.不同结构的人CD3E+HER2双特异性抗体和对照单克隆抗体的结构实施例3各种双特异性抗体的亲和力分析用GE的BiacoreX100plus进行抗体亲和力测定。胺基偶联试剂(Aminecouplingkit)、人抗体捕获试剂(humanantibodycapturekit)、His捕获试剂(hiscapturekit)以及CM5芯片和pH7.4的10×HBS-EP等相关试剂和耗材均购自GEHealthcare公司。采用捕获法测定不同双特异性抗体的亲和力。在测定实施例2中制备的单克隆抗体或者双特异性抗体对CD3E的亲和力时,将抗His的抗体偶联至CM5芯片表面,将带有His标签的CD3E抗原(CD3E-FcK-His/CD3D-FcH)捕获到CM5芯片表面作为固定相,采用单循环的方法将各种抗CD3E抗体蛋白设置一系列的浓度梯度流经固定相表面,测定各抗体蛋白的亲和力。在测定实施例2中制备的单克隆抗体或者双特异性抗体对HER2抗原的亲和力时,将抗Fc的抗体偶联至CM5芯片表面,稀释各种抗HER2抗体蛋白至合适浓度,分别捕获到CM5芯片表面作为固定相,采用单循环的方法将重组的HER2-His设置一系列的浓度梯度流经固定相表面,测定不同抗体蛋白的亲和力。本实施例中使用的人CD3E和HER2抗原的制备见实施例1的描述。如表2和表3的结果所示,各种双特异性抗体均能够分别有效结合CD3E和HER2两种抗原。表2.对照单克隆抗体和双特异性抗体结合CD3E的亲和力常数抗体KaKdKDMAb11.615E+74.871E-33.016E-10BsAb13.161E+62.275E-27.189E-9BsAb28.260E+51.118E-21.353E-8BsAb34.346E+54.122E-29.486E-8BsAb43.221E+61.198E-23.718E-9BsAb51.276E+61.228E-29.622E-9BsAb62.2E+68.701E-33.954E-9BsAb76.573E+58.677E-31.320E-8BsAb83.111E+61.843E-25.924E-9表3.对照单克隆抗体和双特异性抗体结合HER2的亲和力常数抗体KaKdKDMAb21.194E+56.676E+-45.313E-9BsAb19.659E+46.846E+-47.088E-9BsAb27.427E+49.622E+-41.296E-8BsAb31.32E+59.474E+-47.175E-9BsAb48.231E+47.118E+-48.648E-9BsAb56.666E+-47.172E+-41.076E-8BsAb68.252E+46.984E+-48.463E-9BsAb79.533E+46.473E+-46.79E-9BsAb85.236E+45.071E-49.686E-9实施例4各种双特异性抗体同时识别CD3E和HER2两种抗原的能力鉴定利用常规ELISA方法检测实施例2中制备的双特异性抗体对CD3E和HER2两种抗原的同时结合,ELISA流程如下:首先用CD3E-FcK/CD3D-FcH抗原包被ELISA板,4℃冰箱过夜;然后用含有1%BSA的封闭液37℃封闭1小时;洗涤后加入双特异性抗体37℃孵育1小时;洗涤后加HER2-His抗原,37℃孵育1小时;洗涤后加入HRP-抗HisIgG,37℃孵育1小时;洗涤后加入HRP底物液进行显色分析。结果如图2所示:构建的各种双特异性抗体均能够同时识别CD3E和HER2两种抗原。实施例5各种双特异性抗体识别细胞表面的CD3E和HER2的能力鉴定通过流式细胞术分析实施例2中制备的双特异性抗体与MDA-MB-453人乳腺癌细胞上表达的人HER2或人PBMC上表达的人CD3的结合能力。MDA-MB-453细胞购自中国医学科学院基础医学研究所基础医学细胞中心,并培养于RPMI1640培养基中。PBMC利用Ficon密度梯度离心法从志愿者全血中分离,并培养于RPMI1640培养基中。采集正常志愿者的血液(各50mL),其中所采集的血液由发明人及其同事作为志愿者提供,所有志愿者均已签署知情同意书。志愿者的纳入标准为:1.年龄大于18周岁;2.无HIV、HBV感染;3.血常规检测正常;4.非孕妇或哺乳期妇女。收集培养的细胞,并使用台盼蓝染色评估细胞活力。然后将活细胞在含有0.1%BSA的PBS缓冲液中调整至3×106个细胞/ml,向圆底96孔板中每孔加入90μl的细胞悬浮液。向含细胞的孔中加入10μl的双特异性抗体或相应的两种单克隆抗体(MAb1和MAb2)以获17.8nM(MDA-MB-453结合研究)或者53.3nM(PBMC结合研究)的终浓度。于4℃下孵育30分钟后,将细胞离心(5分钟,350g),利用150μl/孔含BSA的PBS染色缓冲液洗涤,重悬浮并与100μl/孔荧光染料缀合的羊抗人IgG抗体于4℃下孵育额外的30分钟。然后通过加入150μl/孔PBS染色缓冲液并在350g下离心5分钟来洗涤细胞。利用150μl/孔PBS染色缓冲液进行第二个洗涤步骤。将样品重悬浮在100μl/孔PBS染色缓冲液中,使用流式细胞仪(BDBiosciences)获得并分析所述样品。结果如图3和图4中所示:实施例2中制备的双特异性抗体均能够分别识别MDA-MB-453人乳腺癌细胞上表达的人HER2和PBMC上表达的人CD3。实施例6各种双特异性抗体介导T细胞对HER2阳性肿瘤细胞的杀伤收集MDA-MB-453人乳腺癌细胞(HER2阳性细胞)或MDA-MB-468人乳腺癌细胞(HER2阴性细胞,购自中国医学科学院基础医学研究所),计数,并使用台盼蓝评估细胞活力。调整细胞密度为2×105/ml,每孔100μl接种于96孔细胞培养板,然后加入起始浓度为3.3nM,10倍梯度稀释的实施例2中制备的CD3+HER2双特异性抗体。为了方便比较,将不同的CD3+HER2双特异性抗体或者对照单克隆抗体(MAb1和MAb2)调整至相同的摩尔浓度。最后向孔中加入人PBMC细胞(效应物)以获得5∶1的最终E∶T比例。同时设置单独靶细胞(MDA-MB-453人乳腺癌细胞或MDA-MB-468人乳腺癌细胞)对照、单独PBMC细胞(效应细胞)对照、单独培养基做空白对照。孵育20小时后,取上清,参照非放射性细胞毒性检测试剂盒说明书(Non-RadioactiveCytotoxicityAssay,promega,G1780)检测和分析双特异性抗体介导的T细胞对靶细胞MDA-MB-453人乳腺癌细胞的杀伤率。检测结果如图5a-图5g和表4所示:本申请构建的各种双特异性抗体(BsAb)均能有效介导T细胞对HER2阳性靶细胞的杀伤,不能介导T细胞对HER2阴性靶细胞的杀伤,双特异性抗体中抗原结合部的形式或铰链区的序列的不同选择带来的双特异性抗体的活性存在一定差异。当采用SEQIDNO:1或者SEQIDNO:28所示的铰链区时,双特异性抗体能够介导T细胞对肿瘤细胞实现更强的杀伤能力。表4.不同双特异性抗体介导T细胞对靶细胞MDA-MB-453杀伤的EC50实施例7各种双特异性抗体介导的T细胞激活收集表达HER2的MDA-MB-453人乳腺癌细胞,计数并使用台盼蓝评估细胞活力。调整MDA-MB-453人乳腺癌细胞的细胞密度为2×105/ml,每孔100μl接种于96孔细胞培养板,然后加入系列稀释的实施例2制备的各种CD3+HER2双特异性抗体。为了方便比较,将不同的CD3+HER2双特异性抗体或者对照单克隆抗体(MAb1和MAb2)调整至相同的摩尔浓度。最后向孔中加入人PBMC(效应物)以获得5∶1的最终E∶T比例。同时设置单独靶细胞(MDA-MB-453人乳腺癌细胞)对照。孵育20小时后,通过离心(5分钟,350g)沉淀细胞并利用150μl/孔PBS缓冲液洗涤两次。加入抗人CD3和人CD69的抗体(eBioscience,11-0037-42,12-0699-42),于4℃下避光孵育30分钟。然后利用150μl/孔PBS缓冲液洗涤细胞两次,重悬浮于100μl/孔PBS缓冲液中,并使用流式细胞仪(BDBiosciencesC6)对细胞样品进行分析并比较不同样品处理后CD3阳性细胞群中激活标志物CD69的表达差异。或者在孵育20小时后,取培养上请,利用ELISA分析上清中IL2水平(人IL-2ELISA试剂,DAKEWE,DKW12-1020-096)。结果如图6a-图6c所示:本申请构建的多种双特异性抗体均能够实现HER2阳性靶细胞对T细胞的特异性激活。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺