一种用于猪Delta冠状病毒检测的试剂盒及检测方法与流程
本发明属于基因工程技术领域,特别涉及一种用于猪delta冠状病毒(pdcov)检测的试剂盒及检测方法。
背景技术:
猪delta冠状病毒(porcinedeltacoronavirus,pdcov)属于冠状病毒科(coronaviridae)冠状病毒亚科(coronavirinae)丁型冠状病毒属,最先由香港大学的woo等于2012年从死亡鸟类、鸡、哺乳动物得到的7140个样本中检测到50多个冠状病毒阳性样本,其中七种为新发现的丁型冠状病毒(woo,patrickc.y.etal.“discoveryofsevennovelmammalianandaviancoronavirusesinthegenusdeltacoronavirussupportsbatcoronavirusesasthegenesourceofalphacoronavirusandbetacoronavirusandaviancoronavirusesasthegenesourceofgammacoronavirusanddeltacoronavirus.”journalofvirology86.7(2012):3995–4008.pmc.web.10apr.2017.)。pdcov是唯一一种感染非禽类的丁型冠状病毒。此后,美国、韩国、中国大陆等许多国家相继发现了pdcov。pdcov能够引起猪的肠道疾病,导致腹泻、呕吐和脱水,发病率和死亡率可高达50%~100%,尤以哺乳阶段仔猪发病最为严重。
尽管woo等人在2012年就从临床样品中检测到pdcov,但并没有分离到病毒,也没有对该病毒进行大规模的流行病学调查。2014年1-2月,在美国爆发仔猪腹泻期间,研究人员从俄亥俄州、爱荷华州、伊利诺斯州发生腹泻的猪场检测到pdcov,而且这些猪场的猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒等几种常见的引起腹泻的病毒均为阴性,提示pdcov具有较强的致病性。全基因组序列分析发现,与2012年香港检测到的两株pdcov(huk15-44和huk15-155)同源性高达99%。随后,在美国的明尼苏达、南达科他等9个州均检测到pdcov感染。目前,美国有近19个州发生pdcov感染,表明pdcov在美国主要养猪地区普遍流行。
2014年4月,在韩国、加拿大发生腹泻的仔猪粪便中也检测到pdcov,与美国分离株同源性达99.7%以上(lees,leec.completegenomecharacterizationofkoreanporcinedeltacoronavirusstrainkor/knu14-04/2014.genomeannouncements.2014,2.)。华中农业大学肖少波课题组对2013-2014年间采自湖北、江苏、广东、河南、安徽等省市规模化猪场的258份粪便样品进行检测,共检测到21份阳性样品,阳性率为14.3%,首次证实pdcov在我国猪场中存在。对检测的部分阳性样品进行全基因组分析,发现我国大陆猪场中的pdcov同样与2012年香港检测到的pdcovhuk15-155株具有较高的同源性(dongn,fangl,zengs,etal.porcinedeltacoronavirusinmainlandchina[j].emerginginfectiousdiseases,2015,21(12):2254-5.)。最近,国内学者song等采用建立的巢式rt-pcr检测了2012-2015年间从江西省采集的356份临床样品,pdcov的阳性率高达33.71%(songd,zhoux,pengq,etal.newlyemergedporcinedeltacoronavirusassociatedwithdiarrhoeainswineinchina:identification,prevalenceandfull-lengthgenomesequenceanalysis.[j].transboundaryandemergingdiseases,2015,62(6):575.)。迄今为止,genbank中共收录了25条来源于美国、中国、韩国的pdcov全基因组序列,进化系统树分析显示这些毒株的同源性很高。
由于pdcov与pedv、tgev等其它猪肠道冠状病毒感染引起的临床症状非常相似并且存在混合感染,对该病毒的诊断主要依靠实验室诊断。pdcov是近几年才发现的病毒,到目前为止的研究报道较少,目前已经建立的pdcov普通rt-pcr、巢式rt-pcr等,其灵敏度相对较低。逄凤娇等(逄凤娇,张柏猛,何孔旺,等.猪δ冠状病毒m基因rt-pcr检测方法的建立及应用[j].畜牧与兽医,2016,48(9):50-53.)针对pdcovm蛋白基因片段设计特异性引物建立的rt-pcr方法,最低可检出量为6.33×104拷贝/μl。国内尚未有荧光rt-pcr应用于pdcov检测的报道。虽然各研究小组已建立了不同的pdcov实验室检测方法,也成功得到了部分国家地区的pdcov流行情况数据,但到目前为止并没有稳定的商品化检测试剂盒可供使用,大范围的临床检测仍有困难,且除中国、美国、韩国外,其他国家pdcov的流行情况依然未知。基于此,需要建立一种快速、灵敏、特异性强的荧光定量pcr检测方法,并使其成为掌握pdcov流行病学资料的一个重要手段显得尤其必要。
技术实现要素:
本发明所要解决的技术问题是为了克服目前对pdcov的检测基本都采用普通rt-pcr、巢式rt-pcr方法所具有的灵敏度低、反应时间长的缺陷,而提供一种检测猪delta冠状病毒的试剂盒、引物对以及检测方法。该方法采用taqman探针法,在闭管状态下进行扩增反应及产物检测,避免了扩增产物污染而致的假阳性;探针杂交特异性更强、灵敏度更高;pcr后无需后续处理,操作更简单快速,安全无污染;对样品中含微量pdcov基因组的检测效果良好,可用于pdcov的实验室检测和分子流行病学调查。
荧光taqman技术的基本原理是利用taq酶的5’外切酶活性,合成一个能与pcr产物杂交的探针,该探针的5’端标记荧光报告基团(r),3’端标记荧光淬灭基团。探针在无特异性pcr发生时,3’端荧光淬灭基团能够吸收或抑制5’端荧光报告基团(r)发出的荧光,荧光信号不改变;当有特异性pcr发生时,探针会在pcr过程中被taq酶的5’—>3’的外切酶活性作用切断(切口平移效应),淬灭基团的抑制作用消失,从而引起报告基团荧光信号的增长。切出的荧光报告基团与pcr产物的数目是一对一的,随着扩增循环数的增加,释放出来的荧光基团不断积累。利用荧光信号积累实时监测整个pcr进程,最后通过标准曲线对未知模板进行定量分析的方法。一般来说,实时荧光定量pcr法的灵敏度比普通rt-pcr高100倍。本发明中,发明人创造性地设计了特异性极强的引物和探针,结合rt-pcr的优势,将检测病毒的灵敏度较现有技术中灵敏度大大提高。
本发明提供的技术方案之一是:一种用于检测猪delta冠状病毒(pdcov)的试剂盒,其包括rt-pcr反应体系,所述rt-pcr反应体系包括引物探针混合液,所述引物探针混合液包括一引物对和一探针,所述引物对的核苷酸序列如seqidno.1和seqidno.2所示,所述探针的核苷酸序列如seqidno.3所示。
所述引物的浓度较佳地为200~400nm,更佳地为200nm。所述探针的浓度较佳地为200~400nm,更佳地为400nm。
较佳地,所述rt-pcr反应体系还包括rt-pcr反应液和酶混合液,所述rt-pcr反应液包括mg2+、dntp以及pcr反应缓冲液,所述酶混合液由逆转录酶(rt酶)、热启动taq酶以及rna酶抑制剂(rnasin)组成;
其中,所述mg2+的浓度优选为1~2.5mmol/l,更优选为2.0mmol/l;所述dntp的浓度优选为0.1~0.25mmol/l,更优选为0.2mmol/l;所述pcr缓冲液优选为2×一步法rt-pcr缓冲液(onesteprt-pcrbuffer)(无mg2+);所述逆转录酶的用量优选为0.5~2u/反应,所述热启动taq酶的用量优选为0.1~0.5u/反应,所述rna酶抑制剂的用量优选为1~3u/反应。
更佳地,所述试剂盒还包括阳性对照和阴性对照,所述阳性对照优选为含有pdcovm基因序列的重组质粒,质粒由上下游引物扩增的pcr产物通过市售的载体克隆构建而成,所使用的上下游引物序列seqidno.1和seqidno.2,所述阳性对照的浓度优选为2.6×106拷贝/μl;所述阴性对照优选为去离子水,更优选为depc-h2o。
本发明所述的试剂盒优选为实时荧光定量pcr(fq-pcr)试剂盒。
本发明提供的技术方案之二是:一种用于检测猪delta冠状病毒的引物对,所述引物对的一条是如seqidno.1所示序列的核酸,另一条是如seqidno.2所示序列的核酸。
本发明提供的技术方案之三是:一种检测猪delta冠状病毒的探针,所述探针的核苷酸序列如seqidno.3所示。
较佳地,上述探针为适用实时荧光定量pcr的荧光探针,其上述序列的两端连接的均为常规的荧光报告基团和淬灭基团。其中,荧光报告基团优选为fam,淬灭基团优选为tamra。
本发明提供的技术方案之四是:所述的引物或者所述的探针在制备检测猪delta冠状病毒的试剂盒中的应用。较佳地,所述试剂盒为实时荧光定量pcr试剂盒。
本发明提供的技术方案之五是:一种非诊断目的的检测猪delta冠状病毒的方法,其包括如下步骤:
(1)使用rna提取试剂提取待检样品中的总rna;
(2)以步骤(1)提取的总rna为模板,利用权利要求1~4任一项所述试剂盒中的rt-pcr反应体系进行rt-pcr反应。
(3)分析检测结果。
其中,所述的rna提取试剂可以是本领域常规的提取动物病毒总rna的试剂,较佳地,所述的rna提取试剂包括样品裂解液、氯仿、depc-乙醇、异丙醇和depc-h2o中的一种或多种;所述的样品裂解液优选trizol,所述的depc-乙醇优选质量百分数为75%的depc-乙醇。
较佳地,步骤(2)中所述rt-pcr反应的反应条件为:
①42~50℃逆转录10~15min;②94~95℃10~15min;③94~95℃10~15s;④55~60℃35~60s;③-④循环40~45次;
步骤(2)所述的荧光rt-pcr反应的反应过程为:分别取引物探针混合液1~3μl、rt-pcr反应液14~16μl、酶混合液(enzymemix)2~4μl配制成17~22μl反应体系,再加入2~8μl步骤(1)所得的rna。将pdcov阳性质粒作为阳性对照样品,depc-h2o作为阴性对照样品,与待检样品rna同时进行荧光rt-pcr反应;
步骤(3)所述的分析检测结果的操作过程为本领域常规,较佳地,所述的分析检测结果的操作过程如下:反应结束后,当阳性对照呈典型的s型扩增曲线,阴性对照无扩增曲线时,判定检测反应成立;若检测样品也出现s型扩增曲线或扩增曲线有明显指数增长期,则判定为检测阳性,否则判定为阴性。
本发明的一较佳实例为:一种用于检测pdcov的试剂盒,其包括:
(1)rna提取试剂,包括:
样品裂解液管:trizol750μl;氯仿管:氯仿200μl;75%乙醇管:75%depc-乙醇800μl;异丙醇管:异丙醇600μl;depc-h2o管:11μl;以上为适合提取1个样本的总rna的试剂用量;所述的rna提取试剂需要4℃保存;
(2)rt-pcr反应体系,包括:
引物探针混合液管:10μm上、下游引物各0.5μl,10μm探针1μl,合计2μl;
rt-pcr反应液管:2×一步法rt-pcr缓冲液(onesteprt-pcrbuffer)(无mg2+)10μl,25mmmgcl22μl,10mmdntp1μl,depc-h2o2μl,合计15μl;
酶混合液(enzymemix)管:40u/μlrnasin1μl,25u/μlrt酶1μl,5u/μltaq酶1μl,合计3μl;
以上为单次反应的试剂用量,所述的反应体系需要-20℃保存;
(3)阳性对照管:浓度为2.6×106拷贝/μl的pdcov阳性质粒5μl;
(4)阴性对照管:depc-h2o5μl。
上述较佳实例中,所述的2×一步法rt-pcr缓冲液(onesteprt-pcrbuffer)(无mg2+)、25mmmgcl2、2.5mmdntp混合物和taq酶也可以使用本领域常规的试剂盒产品,如可以使用一步法荧光rt-pcr试剂盒(onesteprealtimert-pcrkit)替代上述几种试剂,优选takara公司产品一步法荧光rt-pcr试剂盒(onestepprimescripttmrt-pcrkit(perfectrealtime))。
本发明的一较佳实例为:一种非诊断目的的用于检测pdcov的方法,其是一种采用荧光定量rt-pcr检测pdcov的方法,其包括如下步骤:
(1)样品总rna的提取;
(2)pcr反应与结果分析:分别取引物探针混合液2μl、rt-pcr反应液15μl、酶混合液(enzymemix)3μl配制成反应体系。
取阴性对照、标本和阳性对照的核酸各5μl,分别加入反应体系中使用市售的荧光定量pcr仪(如abi7500)进行pcr扩增。pcr反应条件为:①42℃逆转录10min;②94℃15min;③95℃15s;④60℃45s,③-④循环40次(收集荧光信号)。
反应结束后保存检测数据文件。根据pcr扩增结果所得到的曲线,分析实验结果。如扩增曲线有明显指数增长期,则判定为阳性,否则为阴性。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明提供的检测pdcov的方法采用taqman探针法,在闭管状态下进行扩增反应以及产物检测,避免了扩增产物污染而致的假阳性,探针杂交特异性更强、灵敏度更高,最低检测限约为1.3×101拷贝/μl,其灵敏度是现有技术(可检出量为6.33×104拷贝/μl)的4869倍,对样品中含微量pdcov基因组的检测效果良好;同时其操作简单、成本低且结果易于判定,可用于pdcov的实验室检测和大规模的分子流行病学调查研究。因此,本发明的试剂盒、引物对以及检测方法具有很好的应用前景。
附图说明
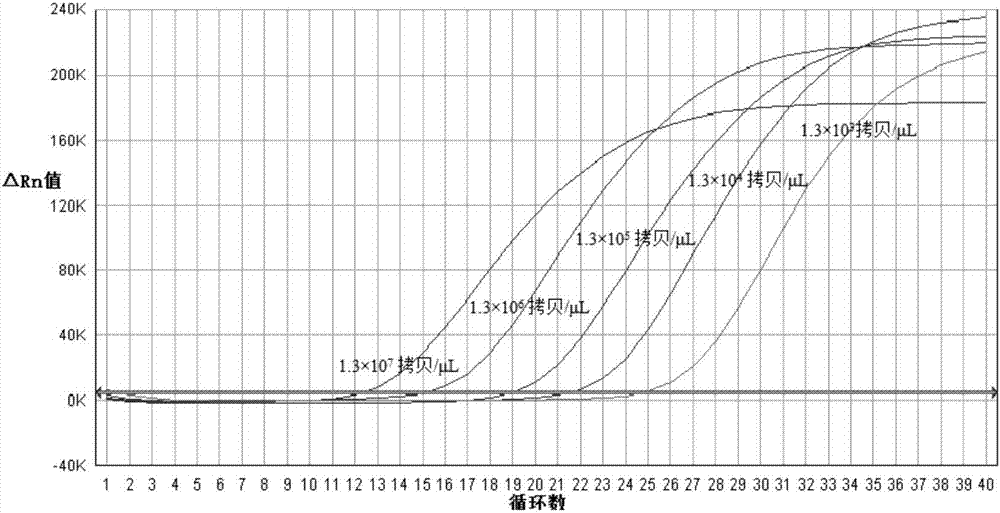
图1为以引物(f1和r1)和探针p1组合的组合1的荧光rt-pcr的扩增曲线结果,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl进行扩增后出现典型的s型扩增曲线,指数区较明显。
图2为以引物(f1和r1)和探针p1组合的组合1的荧光rt-pcr的标准曲线结果,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl进行扩增,3个重复,标准品起始模板浓度与ct值呈现良好的线性关系,斜率接近-3.04,相关系数r2为0.994。
图3为以引物(f2和r2)和探针p2组合的组合2的荧光rt-pcr的扩增曲线结果,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl进行扩增后出现典型的s型扩增曲线,指数区较明显。
图4为以引物(f2和r2)和探针p2组合的组合2的荧光rt-pcr的标准曲线结果,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl进行扩增,3个重复,标准品起始模板浓度与ct值呈现较好的线性关系,斜率接近-2.95,相关系数r2为0.983。
图5为以引物(f3和r3)和探针p3组合的组合3的荧光rt-pcr的扩增曲线结果,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl进行扩增后出现典型的s型扩增曲线,指数区较明显。
图6为以引物(f3和r3)和探针p3组合的组合3的荧光rt-pcr的标准曲线结果,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl进行扩增,3个重复,标准品起始模板浓度与ct值呈现良好的线性关系,斜率接近-2.96,相关系数r2为0.985。
图7为本发明组合1荧光rt-pcr的特异性试验结果,7份特异性参考品中,仅pdcov阳性质粒的扩增曲线为s型扩增曲线,其他6份特异性参考品的扩增曲线为平直或斜向下且与基线无交叉,没有ct值,可明确判定为阴性;6份特异性参考品分别为pedv疫苗株、tgev疫苗株、轮状病毒疫苗株、捷申病毒、kobu病毒阳性样品、大肠杆菌(标准菌株atcc25922)等其他猪易造成腹泻的病原体。
图8为本发明组合2荧光rt-pcr的特异性试验结果,4份特异性参考品(轮状病毒疫苗株、捷申病毒、kobu病毒阳性样品、大肠杆菌标准菌株atcc25922)的扩增曲线平直或斜向下且与基线无交叉,没有ct值,可明确判定为阴性;其中有3份特异性参考品分别为pdcov阳性质粒、pedv疫苗株和tgev疫苗株出现扩增曲线且与基线交叉,有ct值,可判为阳性。
图9为本发明组合3荧光rt-pcr的特异性试验结果,5份特异性参考品(tgev疫苗株、轮状病毒疫苗株、捷申病毒、kobu病毒阳性样品、大肠杆菌标准菌株atcc25922)的扩增曲线平直或斜向下且与基线无交叉,没有ct值,可明确判定为阴性;其中有2份特异性参考品为pdcov阳性质粒、pedv疫苗株出现扩增曲线且与基线交叉,有ct值,可判为阳性。
图10为本发明组合1荧光rt-pcr的敏感性试验结果,8份灵敏度参考品中浓度为1.3×100拷贝/μl的样本扩增曲线平直或斜向下且与基线无交叉,没有ct值,可明确判定为阴性。浓度为1.3×101拷贝/μl的样本扩增曲线的30≤ct≤35,判为可疑,复检后ct值仍为30≤ct≤35,判为阳性;其余样本均可明确判定为阳性。
图11为本发明组合2荧光rt-pcr的敏感性试验结果,8份灵敏度参考品中浓度为1.3×101拷贝/μl和1.3×100拷贝/μl的样本扩增曲线平直或斜向下且与基线无交叉,没有ct值,可明确判定为阴性;其余样本均可明确判定为阳性。
图12为本发明组合3荧光rt-pcr的敏感性试验结果,8份灵敏度参考品中浓度为1.3×101拷贝/μl和1.3×100拷贝/μl的样本扩增曲线平直且ct值>35,可判定为阴性;其余样本均可明确判定为阳性。
图13为某猪场pdcov荧光rt-pcr检测图,其中,p为阳性对照;n为阴性对照;s1~s3为3份猪肠道样品。
图14为某猪场pdcov普通rt-pcr电泳图,其中,m为dl2000marker;p为阳性对照;n为阴性对照;s1~s3为3份猪肠道样品。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
下述实施例中所用引物由英潍捷基(上海)贸易有限公司合成。
部分试剂和仪器来源如下:
2×一步法rt-pcr缓冲液(onesteprt-pcrbuffer)(无mg2+)、25mmmgcl2、10mmdntp混合物、40u/μlrna酶抑制剂(rnasin)、5u/μltaq酶、25u/μlrt酶、primescripttmonesteprt-pcrkitver2.0(dyeplus)、以及一步法荧光rt-pcr试剂盒(onestepprimescripttmrt-pcrkit(perfectrealtime))均购自宝生物工程(大连)有限公司;
abi7500为美国应用生物系统公司产品;
pedv疫苗株、tgev疫苗株、轮状病毒疫苗株均购自中牧实业股份有限公司。
实施例1特异性引物和探针的设计
针对genbank中pdcov的保守序列设计1对特异性引物和探针,如下表1所示,按照以下序列,合成特异性荧光rt-pcr引物和探针。以depc-h2o稀释引物至10μm,-20℃保存备用。
表1引物和探针组合
其中f1的核苷酸序列如序列表中seqidno.1所示,r1的核苷酸序列如序列表中seqidno.2所示,p1的核苷酸序列如序列表中seqidno.3所示。
实施例2反应体系的建立和优化
1、样品的准备:构建1个含有目的扩增区域的质粒作为pdcov检测的阳性对照;以pedv疫苗株、tgev疫苗株、轮状病毒疫苗株、捷申病毒、kobu病毒阳性样品、大肠杆菌(标准菌株atcc25922)(取自上海市动物疫病预防控制中心上海兽医疾病诊断中心实验室)作为特异性参考品;以去离子水作为阴性对照,分别用trizol提取上述阳性对照与特异性参考品的rna,阴性对照待用。
2、引物探针的筛选:以实施例1中设计的引物对探针分别检测上述的阳性对照与阴性对照的rna,经反复试验,筛选出特异性、灵敏度和重复性好的最佳引物探针组合(如seqidno.1~seqidno.3所示)。
3、引物探针浓度的优化:在反应体系中其他组分不变的情况下,分别使用从100nm/反应至400nm/反应梯度的引物和探针进行pcr反应,经多次重复试验发现引物和探针浓度在200~400nm/反应之间均可,其中最佳的引物浓度为200nm/反应、探针浓度为400nm/反应。
4、镁离子浓度的优化:在反应体系中其他组分不变的情况下,分别使用从1mmol/l至2.5mmol/l浓度梯度的镁离子进行pcr反应,经多次重复试验,最终确定最佳的镁离子浓度为2.0mmol/l。
5、dntp浓度的优化:在反应体系中其他组分不变的情况下,分别使用从0.1mmol/l至0.25mmol/l浓度梯度的dntps进行pcr反应,经多次重复试验,最终确定最佳的dntp浓度为0.2mmol/l。
6、热启动taq酶用量的优化:在25μl反应体系中其他组分不变的情况下,分别使用从1u(酶单位)至8u浓度梯度的酶用量/反应进行pcr反应,经多次重复试验,最终确定最佳的热启动taq酶用量为0.1~0.5u/反应。
7、rt酶用量的优化:在25μl反应体系中其他组分不变的情况下,分别使用从1u(酶单位)至8u浓度梯度的酶用量/反应进行pcr反应,经多次重复试验,最终确定最佳的rt酶用量为0.5~2u/反应。
8、rnasin用量的优化:在25μl反应体系中其他组分不变的情况下,分别使用从5u(酶单位)至40u浓度梯度的酶用量/反应进行pcr反应,经多次重复试验,最终确定最佳的rnasin用量为1~3u/反应。
9、反应温度的优化:根据酶的活性和靶多核苷酸的长度,主要对退火温度和延伸时间进行了优化,经多次重复试验,最终确定pcr反应条件为:(1)50℃逆转录10min;(2)94℃15min;(3)95℃15s;(4)55~60℃45s,(3)-(4)循环45次(收集荧光信号)。
实施例3标准曲线的建立
将pdcov阳性质粒dna用分光光度计测定浓度后,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×107、1.3×106、1.3×105、1.3×104、1.3×103拷贝/μl,设置3个重复,进行扩增,反应结束后,利用abi7500荧光定量pcr分析软件自动得到标准曲线。结果显示:
以引物(f1和r1)和探针p1组合的组合1建立的荧光rt-pcr方法,出现典型的s型扩增曲线,指数区较明显,标准品起始模板浓度与ct值呈现具有良好的线性范围,斜率接近-3.04,相关系数r2为0.994(见图1、2)。
根据ct值和标准曲线即可对样品进行准确定量。
实施例4特异性和敏感性试验
(1)特异性试验
采用实施例2中所述优化的体系及扩增条件,取7份特异性参考品分别为pedv疫苗株、tgev疫苗株、轮状病毒疫苗株、pdcov阳性质粒、捷申病毒、猪kobu病毒(pkv)阳性样品、大肠杆菌(标准菌株atcc25922)阳性样品等7个样本,提取rna,采用荧光rt-pcr进行试剂盒的特异性试验。
其中,样品总rna提取的步骤如下:①于750μltrizol裂解液中加入待测样品200μl,混匀,15~25℃静置5min;②加入200μl氯仿,振荡混匀,于4℃、12000r/min离心15min;③取水相上清,加入600μl于-20℃预冷的异丙醇,混匀后,12000r/min离心10min;④弃上清,加入800μl75%depc-乙醇,12000r/min离心10min;⑤弃上清并于15~25℃干燥后加入11μldepc-h2o溶解,得样品rna,备用。
荧光rt-pcr反应体系:引物探针混合液2μl、rt-pcr反应液15μl以及酶混合液(enzymemix)3μl。
荧光rt-pcr的反应条件如下:
(1)42℃逆转录10min;(2)94℃15min;(3)95℃15s;(4)60℃45s;(3)-(4)循环40次(收集荧光信号)。
结果显示:
组合1的荧光rt-pcr结果表明仅pdcov阳性质粒扩增曲线为s型扩增曲线。而pedv疫苗株、tgev疫苗株、轮状病毒疫苗株、捷申病毒、猪kobu病毒(pkv)阳性样品、大肠杆菌(标准菌株atcc25922)阳性样品均没有出现特异性扩增曲线(见图7),说明本组合的特异性很高。
(2)敏感性试验
分别将3个pdcov阳性质粒dna用分光光度计测定浓度后,用depc-h2o对质粒标准品做10倍系列稀释,使每5μl检测用量中的拷贝数分别为1.3×106、1.3×105、1.3×104、1.3×103、1.3×102、1.3×101、1.3×100拷贝/μl进行荧光rt-pcr扩增。荧光rt-pcr反应体系以及反应条件同(1)特异性试验中所示。
结果表明:
组合1的荧光rt-pcr方法的最低检测限约为1.3×101拷贝/μl(见图10)。而逄凤娇(逄凤娇,张柏猛,何孔旺,等.猪δ冠状病毒m基因rt-pcr检测方法的建立及应用[j].畜牧与兽医,2016,48(9):50-53.)等针对pdcovm蛋白基因片段设计特异性引物建立的rt-pcr方法,最低可检出量为6.33×104拷贝/μl。而组合1的敏感性是现有技术(可检出量为6.33×104拷贝/μl)的4869倍。本发明同样针对pdcovm蛋白基因片段设计一对更特异的引物和探针,经过优化组合,大大提高了实验的敏感性。由此可见,本发明的敏感性远远高于普通rt-pcr。
实施例5试剂盒的组装
按照总rna提取和荧光rt-pcr两个部分完成试剂盒组分的配制,以下提供的数据及试剂组成为单次套式rt-pcr检测所需试剂:
(1)总rna提取(4℃保存)
样品裂解液管:trizol750μl;
氯仿管:氯仿200μl;
75%乙醇管:75%depc-乙醇800μl;
异丙醇管:异丙醇600μl;
depc-h2o管:11μl;
(2)荧光rt-pcr(-20℃保存)
引物探针混合液管:10μm上、下游引物各0.5μl,10μm探针1μl,合计2μl;
rt-pcr反应液管:
2×一步法rt-pcr缓冲液(onesteprt-pcrbuffer)(无mg2+)10μl;25mmmgcl22μl;10mmdntp1μl;depc-h2o2μl;合计15μl;
酶混合液(enzymemix)管:40u/μlrnasin1μl,25u/μlrt酶1μl,5u/μltaq酶1μl;
阳性对照管:浓度为2.6×106拷贝/μl的pdcov阳性质粒5μl;
其中,pdcov阳性质粒的制备方法为:阳性质粒由上海佑隆生物科技有限公司构建,具体为合成含有上下游引物序列(即为上述引物f1、r1,如seqidno.1~2所示)的pdcovm基因,并克隆至载体puc57-amp,经转化、筛选、鉴定,获得pdcov阳性质粒。
阴性对照管:depc-h2o5μl。
按照48份检测剂量为一个包装,将上述配制好的试剂分别装入10个无rnase酶的瓶或管中,并按照相应的储存温度保存运送。
实施例6试剂盒的应用
采用本发明的pdcov荧光定量rt-pcr检测试剂盒对上海某猪场送检的3份腹泻仔猪的肠道样品(标本s1、s2和s3)进行检测。
(1)样品的预处理
用无菌的剪刀和镊子剪取待检样品1.0g于研钵中充分研磨,再加1mlpbs混匀,然后将组织悬液转入1.5ml无菌离心管中,3000r/min离心10min,取上清转入另一无菌离心管中,编号备用。
(2)rna的提取
①于750μltrizol裂解液中加入待测样品200μl,混匀,室温静置5min;②加入200μl氯仿,振荡混匀,于4℃12000r/min离心15min;③取水相上清,加入600μl异丙醇(-20℃预冷),混匀后,12000r/min离心10min;④弃上清,加入800μl75%depc-乙醇,12000r/min离心10min;⑤弃上清并于室温干燥后加入11μldepc-h2o溶解,得标本rna,备用。
(3)荧光rt-pcr反应与结果分析
分别取引物探针混合液2μl、rt-pcr反应液15μl、酶混合液(enzymemix)3μl配制成反应体系。
取阴性对照(n)、标本(s1、s2、s3)和阳性对照(p)的核酸各5μl,分别加入反应体系中使用市售的荧光定量pcr仪(如abi7500)进行pcr扩增。pcr反应条件:(1)42℃逆转录10min;(2)94℃15min;(3)95℃15s;(4)60℃45s;(3)-(4)循环40次(收集荧光信号),整个反应共需85min。
反应结束后保存检测数据文件。根据pcr扩增结果所得到的曲线,分析实验结果,结果如图13所示。检测结果表明,设定的对照全部成立,s1、s2、s3份样品的ct值分别为14.86、18.12、21.53,均小于30,且出现典型的s型扩增曲线,表明检测样品中有3份存在阳性扩增。
(4)与普通rt-pcr检测方法比较
参照文献(wangl,byrumb,zhangy.detectionandgeneticcharacterizationofdeltacoronavirusinpigs,ohio,usa,2014.emerginfectdis2014,20:1227–1230)合成pdcovn基因的引物,上游引物41f(5’-tttcaggtgctcaaagctca-3’)和下游引物735r(5’-gcgaaaagcatttcctgaac-3’)。
反应体系:
2×primescripttmonestepbuffer(dyeplus)25μl,primescripttmenzymemix2μl,上下游引物各1μl,用depc-h2o补足至50μl。
pcr反应条件:(1)50℃逆转录30min;(2)95℃15min;(3)95℃15s;(4)55℃45s;(5)72℃1min;(3)-(5)循环40次;(6)72℃7min。
取5μl扩增产物,用1.2%琼脂糖凝胶在110v30min条件下进行电泳检测,紫外灯下观察扩增结果,pcr扩增反应以及电泳检测共需要132min。
结果如图14所示。检测结果表明,设定的对照全部成立,检测样品中有3份存在阳性扩增,即s1、s2和s3。与荧光rt-pcr检测结果一致。
由此可见,采用荧光rt-pcr大大节约了时间,节省劳力,操作更简单,安全无污染,适用于pdcov感染的快速诊断和大规模的流行病学调查研究,有非常好的应用前景。
对比例
(1)特异性引物和探针的设计
针对genbank中pdcov的保守序列设计2对不同于上述实施例的特异性引物和探针,如下表2所示,按照以下序列,合成特异性荧光rt-pcr引物和探针。以depc-h2o稀释引物至10μm,-20℃保存备用。
表2引物和探针组合
上述f2~p3的核苷酸序列如序列表中seqidno:4~9所示。
(2)标准曲线的建立
使用实施例2建立和优化的体系进行标准曲线的建立,建立方法同实施例3。结果显示:
以引物(f2和r2)和探针p2组合的组合2建立的荧光rt-pcr方法,出现典型的s型扩增曲线,指数区较明显,标准品起始模板浓度与ct值呈现具有较好的线性范围,斜率接近-2.95,相关系数r2为0.983(见图3、4)。
以引物(f3和r3)和探针p3组合的组合3建立的荧光rt-pcr方法,出现典型的s型扩增曲线,指数区较明显,标准品起始模板浓度与ct值呈现具有较好的线性范围,斜率接近-2.96,相关系数r2为0.985(见图5、6)。
根据ct值和标准曲线即可对样品进行准确定量。
(3)特异性和敏感性试验
①特异性试验
具体操作步骤同实施例4,结果显示:
组合2的荧光rt-pcrpdcov阳性质粒扩增曲线为s型扩增曲线,pedv疫苗株和tgev疫苗株也均有扩增曲线,出现非特异性扩增;而轮状病毒疫苗株、捷申病毒、猪kobu病毒(pkv)阳性样品、大肠杆菌(标准菌株atcc25922)阳性样品均没有出现特异性扩增曲线(见图8),说明本组合的特异性不好。
组合3的荧光rt-pcr结果表明pdcov阳性质粒扩增曲线为s型扩增曲线,pedv疫苗株有扩增曲线,出现非特异性扩增。而tgev疫苗株、轮状病毒疫苗株、捷申病毒、猪kobu病毒(pkv)阳性样品、大肠杆菌(标准菌株atcc25922)阳性样品均没有出现特异性扩增曲线(见图9),说明本组合的特异性不好。
由此可见,组合2和组合3的荧光rt-pcr特异性均差于组合1的荧光rt-pcr特异性。
②敏感性试验
具体操作步骤同实施例4,结果显示:
组合2的荧光rt-pcr方法的最低检测限约为1.3×102拷贝/μl(见图11),组合3的荧光rt-pcr方法的最低检测限约为1.3×102拷贝/μl(见图12);由此可见,组合2和组合3的荧光rt-pcr方法的检测限远高于组合1。
sequencelisting
<110>上海市动物疫病预防控制中心
<120>一种用于猪delta冠状病毒检测的试剂盒及检测方法
<130>p1710073c
<160>9
<170>patentinversion3.5
<210>1
<211>26
<212>dna
<213>artificialsequence
<220>
<223>引物f1
<400>1
gagagtagactccttgcagggattat26
<210>2
<211>21
<212>dna
<213>artificialsequence
<220>
<223>引物r1
<400>2
gcttgccatgcttaacgactg21
<210>3
<211>18
<212>dna
<213>artificialsequence
<220>
<223>探针p1
<400>3
aatgcacctccatgtacc18
<210>4
<211>19
<212>dna
<213>artificialsequence
<220>
<223>引物f2
<400>4
cgaccacatggctccaatt19
<210>5
<211>19
<212>dna
<213>artificialsequence
<220>
<223>引物r2
<400>5
cagctcttgcccatgtagc19
<210>6
<211>23
<212>dna
<213>artificialsequence
<220>
<223>探针p2
<400>6
cacaccagtcgttaagcatggca23
<210>7
<211>21
<212>dna
<213>artificialsequence
<220>
<223>引物f3
<400>7
tgagagtagactccttgcagg21
<210>8
<211>19
<212>dna
<213>artificialsequence
<220>
<223>引物r3
<400>8
gagaattggagccatgtgg19
<210>9
<211>20
<212>dna
<213>artificialsequence
<220>
<223>探针p3
<400>9
tgtacccattggatccataa20
- 还没有人留言评论。精彩留言会获得点赞!