检测致泻性大肠埃希氏菌的核酸组合及其检测试剂盒与应用的制作方法
本发明涉及检验检疫技术领域,具体而言,涉及检测致泻性大肠埃希氏菌的核酸组合及其检测试剂盒与应用。
背景技术:
核酸检测技术作为分子生物学检测技术的核心,在致泻性大肠埃希氏菌检测中发挥着巨大作用。目前市面上致泻性大肠埃希氏菌检测试剂盒及其检测分型方法主要为常规定性PCR,实时荧光PCR及基因芯片技术等。常规定性PCR操作简单,但过程繁琐,需通过琼脂糖凝胶电泳检测结果,检测灵敏度低,且检测过程中使用高致癌染料(EB),对环境及人体危害非常大;实时荧光PCR检测灵敏度高,但其设备昂贵、对操作人员专业素质、引物及模板质量要求高,且不同品牌间产品重复性及重现性不佳;使用常规定性PCR及实时荧光PCR法单次反应只能筛检一种或几种指标,而且价格较高;无法满足单次反应针对五种致泻性大肠埃希氏菌进行筛检的需求。新型的基因芯片法利用核酸杂交原理,将待测样品特异性探针固定于固相/液相芯片上,可同时检测多种致泻性细菌指标,但其配套设备昂贵,通常用于科研工作中。针对致泻性大肠埃希氏菌检测试剂盒及其检测分型方法,目前还没有较全面的应用到基因芯片法。
因此研发一种操作简单、方便、灵敏、快捷、成本低、通量高且肉眼可视的检测方法和试剂盒成为了一个迫切的需要。
技术实现要素:
本发明的第一目的在于提供一种检测致泻性大肠埃希氏菌的核酸组合,该核酸组合能快速高效的检测区分出不同类型的大肠杆菌,结果准确可靠。
本发明的第二目的在于提供上述的核酸组合在制备致泻性大肠埃希氏菌的检测试剂盒中的应用。
本发明的第三目的在于提供一种致泻性大肠埃希氏菌的检测试剂盒,该检测试剂盒能方便使用于大肠杆菌的分型检测。
本发明的第四目的在于提供上述的检测试剂盒在致泻性大肠埃希氏菌分型中的应用。
为了实现本发明的上述目的,采用以下技术方案:
一种检测致泻性大肠埃希氏菌的核酸组合,核酸组合包括检测引物组合;检测引物组合包括第1-14引物对,第1-14引物对的碱基序列分别如SEQ ID No.1-28所示。
进一步地,上述的核酸组合,还包括检测探针,该检测探针包括第1-14检测探针、阳性对照探针和阴性对照探针,第1-14检测探针的碱基序列分别如SEQ ID No.29-42所示,阳性对照探针的碱基序列如SEQ ID No.43所示,阴性对照探针的碱基序列如SEQ ID No.44所示;检测探针的5’端带有作为吸附剂的amino linker C6。
上述的核酸组合在制备致泻性大肠埃希氏菌的检测试剂盒中的应用。
一种致泻性大肠埃希氏菌的检测试剂盒,该检测试剂盒包括上述的核酸组合;检测引物组合的各引物对中的正向引物的5’端或反向引物的5’端带有生物素标记。
上述的检测试剂盒在致泻性大肠埃希氏菌检测分型中的应用。
与现有技术相比,本发明的有益效果为:本发明提供的检测致泻性大肠埃希氏菌的核酸组合,能够高效、准确的鉴定出各型大肠埃希氏菌,能避免误检的发生;将上述核酸组合应用于制备致泻性大肠埃希氏菌的检测试剂盒,能方便检测致泻性大肠埃希氏菌,该检测试剂盒操作简单、方便、灵敏、快捷、成本低、通量高且肉眼可视的检测方法具有非常广的应用市场及非常好的应用价值。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例1提供的膜芯片示意图;
图2为本发明实验例2提供的EPEC膜芯片模式图;
图3为本发明实验例2提供的EIEC膜芯片模式图;
图4为本发明实验例2提供的ETEC膜芯片模式图;
图5为本发明实验例2提供的EHEC膜芯片模式图;
图6为本发明实验例2提供的EAEC膜芯片模式图;
图7为本发明实验例2提供的混合大肠杆菌膜芯片模式图;
图8为本发明实验例3提供的混合大肠杆菌膜芯片检测结果图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的检测致泻性大肠埃希氏菌的核酸组合及其检测试剂盒与应用进行具体说明。
大肠埃希氏菌(Escherichia coli)通常被称为大肠杆菌,是Escherich在1885年发现的,属于革兰氏阴性细菌(G-);在相当长的一段时间内,一直被当作正常肠道菌群的组成部分,认为是非致病菌。直到20世纪中叶,才认识到一些特殊血清型的大肠杆菌对人和动物有病原性,尤其对婴儿和幼畜(禽),常引起严重腹泻和败血症,它是一种普通的原核生物,根据不同的生物学特性将致病性大肠杆菌分为6类:肠致病性大肠杆菌(EPEC)、肠产毒性大肠杆菌(ETEC)、肠侵袭性大肠杆菌(EIEC)、肠出血性大肠杆菌(EHEC)、肠黏附性大肠杆菌(EAEC)和弥散粘附性大肠杆菌(DAEC)。通常将肠致病性大肠杆菌(EPEC)、肠产毒性大肠杆菌(ETEC)、肠侵袭性大肠杆菌(EIEC)、肠出血性大肠杆菌(EHEC)、肠黏附性大肠杆菌(EAEC)应用于分型检测中。
一种检测致泻性大肠埃希氏菌的核酸组合,核酸组合包括检测引物组合;检测引物组合包括第1-14引物对,第1-14引物对的碱基序列分别如SEQ ID No.1-28所示。
进一步地,上述的核酸组合,还包括检测探针,该检测探针包括第1-14检测探针、阳性对照探针和阴性对照探针,第1-14检测探针的碱基序列分别如SEQ ID No.29-42所示,阳性对照探针的碱基序列如SEQ ID No.43所示,阴性对照探针的碱基序列如SEQ ID No.44所示;检测探针的5’端带有作为吸附剂的amino linker C6。
上述的核酸组合在制备致泻性大肠埃希氏菌的检测试剂盒中的应用。
一种致泻性大肠埃希氏菌的检测试剂盒,该检测试剂盒包括上述的核酸组合;检测引物组合的各引物对中的正向引物的5’端或反向引物的5’端带有生物素标记。
通过14对引物和16条探针的核酸组合,覆盖肠致病性大肠杆菌(EPEC)、肠产毒性大肠杆菌(ETEC)、肠侵袭性大肠杆菌(EIEC)、肠出血性大肠杆菌(EHEC)、肠黏附性大肠杆菌(EAEC)五种类型的大肠杆菌中常见的毒力基因的检测引物,即检测毒力基因uidA、stx1、stx2、escV、ipaH、invE、estB、lt、pic、aggR、astA、bfpB、sth和stp的引物依次与第1-14引物对相对应,由于不同类型的大肠杆菌具有的毒力基因不同,通过不同的毒力基因的检测引物扩增出的PCR产物和相对应的探针的杂交,并显色,就能综合判断出不同的大肠杆菌类型。且每个类型的大肠杆菌都通过两个以上的指标来进行判定,提高检测结果的准确性,以及检测结果的可靠性大大增加。
反应体系中,每对引物中修饰引物与非修饰引物的比例为3:2,通过添加更多的修饰引物序列,可以产生更多的经过修饰的产物,更有利于后期的检测。探针通过作为吸附剂的Amino linker C6作用,有利于探针附着于支持膜,有利于检测。
实验中,先用14对引物进行多重PCR,PCR产物与探针杂交,且与探针互补的一条链的PCR引物的5’端进行生物素修饰,不同的探针通过吸附剂依次有序的吸附连接到支持膜上;通过生物素的亲和反应,然后显色,得到大肠杆菌的类型。
通过引物与探针添加的标记分子,可以使检测更为灵敏。
进一步地,上述检测试剂盒还包括膜芯片、配液和PCR反应组分中至少一种。
进一步地,膜芯片包括支持膜和依次负载于支持膜的检测探针;支持膜包括硝酸纤维素膜、尼龙膜或具有三维孔径结构的薄膜中的一种。
将探针负载于支持膜上,探针与PCR产物杂交,然后通过探针和引物上标记的标记分子显色;通过显色反应,可以直接肉眼判定实验结果;方法简单易行。
实验过程中,选用硝酸纤维素膜、尼龙膜或具有三维孔径结构的薄膜中的一种作为支持膜,方便将探针负载于膜上;如具有三维孔径结构的薄膜可以方便的将探针分子吸附固定在薄膜上,便于后续的反应的进行。
进一步地,配液包括去活化液、去活化清洗液、杂交液、杂交清洗液、酶标液、酶标清洗液1、酶标清洗液2、显色液和显色清洗液中至少一种。
进一步地,去活化液包括100mmol/L的NaOH,去活化清洗液包括2×SSPE和0.1%SDS;杂交液包括2×SSPE和0.1%SDS;杂交清洗液包括2×SSPE和0.5%SDS;酶标液包括2×SSPE和0.5%SDS;酶标清洗液1包括2×SSPE和0.5%SDS;酶标清洗液2包括1M Tris-HCl,pH9.5,5M NaCl,1M MgCl2。
SSPE(Saline sodium phosphate EDTA,SSPE)缓冲液是一种常见的核酸杂交缓冲液;SSPE缓冲液包括NaCl、NaH2PO4·H2O(或NaH2PO4·2H2O)和EDTA-2Na。
配制1L的SSPE缓冲液,包括将17.53g的NaCl,27.6g的NaH2PO4·H2O(或31.2g的NaH2PO4·2H2O)和7.4g的EDTA-2Na,然后用10M的NaOH大约6ml调节pH值至7.4,然后定容至1L,过滤后高压蒸汽灭菌。
通过上述的各种配液,清除杂质,排除干扰,使结果更准确、清晰可靠。
显色液为碱性磷酸酶化学显色底物NBT/BCIP,含0.15mg/mL BCIP,0.30mg/mL NBT,100mmol/L Tris-HCl,5mmol/L MgCl2,pH 9.5);显色清洗液为双蒸水。
生物素与链霉亲和素(Streptavidin,SA)具有极高的亲和力,反应呈高度专一性。每个链霉亲和素分子具有4个生物素分子结合位点,因此,链霉亲和素可同时以多价形式结合生物素。生物素标记的引物与碱性磷酸酶标记的链霉亲和素联合使用,将检测信号级联放大,最后通过显色反应或化学发光可检测。
进一步地,PCR反应组分包括UNG酶、dNTPs、Taq DNA聚合酶、Mg2+和PCR缓冲液中的至少一种。
使用尿嘧啶-N-糖基化酶(UNG酶)移除DNA中的尿嘧啶,在PCR反应液配制时,将dUTP和dTTP按一定的比例混用,使得扩增产物含有脱氧尿嘧啶,这种产物对UNG酶敏感,所以可以在PCR前对新配制的反应体系用UNG酶处理,一定程度上杜绝气溶胶污染。dNTPs作为PCR反应的原料,应用于以原DNA为模板合成新的DNA序列;通过Taq DNA聚合酶的作用,DNA链更容易打开,使反应更容易进行;Mg2+作为Taq DNA聚合酶的活化剂,可以激活Taq DNA聚合酶的功能;PCR反应缓冲液,使反应在一个稳定的环境中反应,避免影响Taq DNA聚合酶的活性,进而影响反应的进行。PCR反应缓冲液使得反应顺利的进行。
上述的检测试剂盒在致泻性大肠埃希氏菌检测分型中的应用。
首先以待检样本为模板,通过多重PCR反应,得到PCR反应产物;将PCR反应产物与负载于支持膜的探针分别反应结合;然后通过引物与探针上修饰的标记与显色液的显色反应,显示出检测的结果,通过显色的情况判断出大肠杆菌的类型,达到分型的目的。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种检测致泻性大肠埃希氏菌的核酸组合;核酸组合包括检测引物组合和检测探针。
检测引物组合包括第1-14引物对,第1-14引物对的碱基序列分别如SEQ ID No.1-28所示。
第1-14引物对依次对应检测毒力基因uidA、stx1、stx2、escV、ipaH、invE、estB、lt、pic、aggR、astA、bfpB、sth和stp序列。
实施例2
本实施例提供一种检测致泻性大肠埃希氏菌的核酸组合;核酸组合包括检测引物组合和检测探针。
检测引物组合包括第1-14引物对,第1-14引物对的碱基序列分别如SEQ ID No.1-28所示;检测引物组合的各引物对中的正向引物的5’端或反向引物的5’端带有生物素标记。当然,还可以是其他的标记物可以对引物进行标记,本发明优选生物素进行标记。
第1-14引物对依次对应检测毒力基因uidA、stx1、stx2、escV、ipaH、invE、estB、lt、pic、aggR、astA、bfpB、sth和stp序列。
还包括检测探针,该检测探针包括第1-14检测探针、阳性对照探针和阴性对照探针,第1-14检测探针的碱基序列分别如SEQ ID No.29-42所示,阳性对照探针的碱基序列如SEQ ID No.43所示,阴性对照探针的碱基序列如SEQ ID No.44所示;检测探针的5’端带有作为吸附剂的amino linker C6。
实施例3
本实施例提供一种致泻性大肠埃希氏菌的检测试剂盒,该检测试剂盒包括实施例2提供的核酸组合;核酸组合包括检测引物组合和检测探针。
当然,本检测试剂盒还包括膜芯片、配液和PCR反应组分中至少一种。
其中,膜芯片包括作为支持膜的尼龙膜和依次负载于尼龙膜上的检测探针。检测探针通过添加的吸附剂amino linker C6与尼龙膜结合,使检测探针附着在尼龙膜上。
当然,支持膜还可以选择硝酸纤维素膜或者其他具有三维孔径结构的薄膜。
实施例4
本实施例提供一种致泻性大肠埃希氏菌的检测试剂盒,该检测试剂盒包括实施例1提供的核酸组合;核酸组合包括检测引物组合和检测探针。
本检测试剂盒还包括膜芯片、配液和PCR反应组分中至少一种。
其中,膜芯片包括作为支持膜的尼龙膜和依次负载于尼龙膜上的检测探针。
配液包括去活化液、去活化清洗液、杂交液、杂交清洗液、酶标液、酶标清洗液1、酶标清洗液2、NBT/BCIP显色液和显色清洗液中至少一种。
去活化液包括100mmol/L NaOH,去活化清洗液包括2×SSPE和0.1%SDS,杂交液包括2×SSPE和0.1%SDS,杂交清洗液包括2×SSPE和0.5%SDS,酶标液包括2×SSPE和0.5%SDS,酶标清洗液1包括2×SSPE和0.5%SDS,酶标清洗液2包括1M Tris-HCl,pH9.5,5M NaCl,1M MgCl2。
实验例1
本实验例选择实施例4提供的致泻性大肠埃希氏菌的检测试剂盒的检测使用。
致泻性大肠埃希氏菌的检测试剂盒的具体使用方法,具体如下:
膜芯片的制备
1.1用打印机在膜上打印出表格;
1.2把膜浸泡于50mL含有0.5%-5%(体积:体积)戊二醛的PBS溶液中,摇床缓慢摆动孵育2小时;
1.3在PBS中洗膜4次,一次50mL,每次5分钟;
1.4膜在空气中干燥并密封保存;
1.5用0.5M NaHCO3,pH8.4调整靶标探针浓度至10μM。
将阳性对照探针和阴性对照探针分别稀释到5μM;并将第1-14检测探针、阳性对照探针和阴性对照探针依次点样在尼龙膜上。点好探针的膜芯片放入烘箱中,80℃烘烤2小时备用。
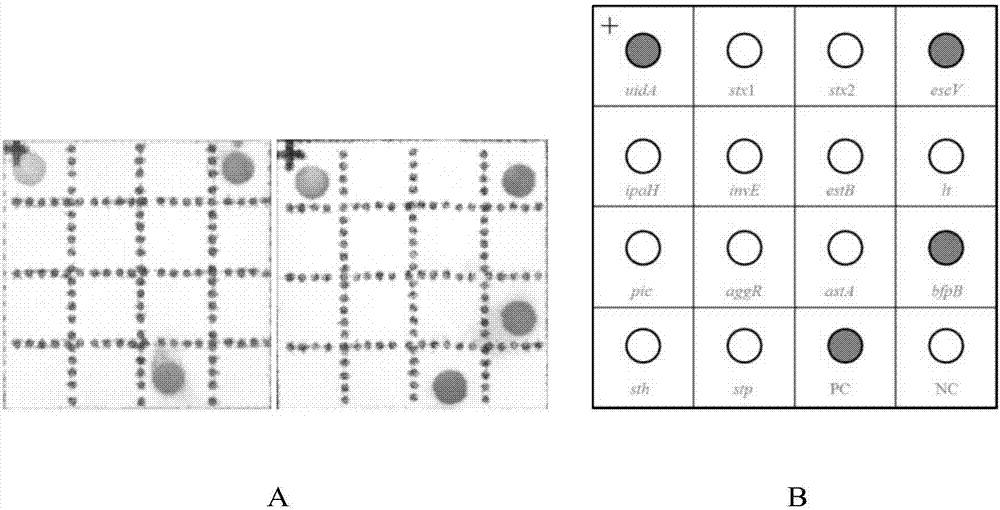
膜芯片的模式图如图1所示,uidA表示大肠杆菌通用保守序列,表示检测菌株为大肠杆菌;stx(stx1、stx2)表示志贺毒素,是EHEC的典型外毒素;escV表示EPEC上LEE毒力岛的紧密粘附素(intimin)编码基因,可致肠粘膜微绒毛附着;invE表示EIEC编码Ipa毒力侵袭蛋白的转录调节因子,由毒力因子质粒pINV携带;ipaH表示侵袭性质粒抗原H编码基因;lt表示ETEC上合成不耐热肠毒素LT蛋白亚单位的编码基因;estB表示ETEC上合成耐热肠毒素ST蛋白亚单位的编码基因;pic表示丝氨酸蛋白激酶;aggR表示EAEC上质粒编码的BFP和聚集黏附性菌毛(AAF)两种功能蛋白的表达调节基因;astA表示EAEC质粒编码产生耐热聚集黏附性肠毒素1(EAST1)的基因;bfpB表示束状菌毛B基因,介导细菌对肠壁细胞的黏附定植和微型菌落形成,sth表示人源热稳定性肠毒素基因,stp表示猪源热稳定性肠毒素基因,PC表示阳性对照(Positive control);NC表示阴性对照(Negative control)。
多重PCR反应
按照北京康为世纪生物科技有限公司细菌基因组提取试剂盒(Bacteria Genomic DNA Kit货号:CW0552S)的说明提取样品基因组DNA。取细菌培养物1-5ml按照试剂盒说明抽提后用50μL ddH2O(双蒸水)溶解基因组DNA,并用紫外分光光度计将DNA溶液稀释至同一质量浓度(50ng/μL)。
PCR扩增的反应体系如下所示:
2×Multiplex PCR MasterMix 10μL;
提取的样品基因组DNA(约50ng/μL):2μL;
ddH2O:补足至总体积20μL;
反应体系中,第1-14引物对均加入到反应体系中,其中每对引物的修饰引物与非修饰引物的比例为3:2,对上述反应体系进行PCR循环扩增,PCR循环条件如下所示,反应过程由UNG酶消化,Taq DNA聚合酶反应,经过预变性、变性、退火和延伸,条件分别为:
UNG酶消化反应:温度37℃,时间5分钟;预变性:温度95℃,时间3分钟;PCR循环:35个循环组成:变性:温度95℃,时间15秒;退火:温度55℃,时间30秒;延伸:温度68℃,时间15秒;最后延伸:温度68℃,时间3分钟;保存:温度4℃。
膜芯片杂交
将PCR产物放入PCR仪,95℃热变性10分钟,放于冰上备用。取冷却后的PCR产物20μL加入杂交液中,进行膜芯片斑点杂交检测,按膜芯片自动杂交仪操作说明书进行开机,预热,之后将包装有膜芯片的杂交卡盒放入自动杂交仪中开始杂交过程,依次自动完成去活化、去活化清洗、杂交、杂交清洗、酶标、酶标清洗、显色、显色清洗等步骤,自动完成杂交过程,自动杂交程序如表1所示。
表1自动杂交仪测定过程
实验完成后,即可进行结果判读,结果判读参照表2。
表2致泻性大肠埃希氏菌检测特征
根据检测引物对与毒力基因的对应关系,通过多重PCR扩增,对扩增产物进行检测就可得到结果。如果出现表2中阳性结果判定检测结果;比如,肠致病性大肠杆菌EPEC的检出的结果出现uidA和escV为阳性,而stx1和stx2为阴性,而bfpB、astA的检测结果为阳性或阴性均可,此时综合结果可判定大肠杆菌类型为肠致病性大肠杆菌EPEC。同理,根据检测结果的阳性情况,对应表2即可判定为相应的致泻性大肠埃希氏杆菌的类型。
实验例2
本实施例用实施例4提供的检测试剂盒建立各型大肠埃希氏菌的膜芯片模式图。
肠致病性大肠杆菌(EPEC)
用肠致病性大肠杆菌EPEC(Enteropathogenic Escherichia coli,EPEC)作为模板,用实验例1提供的方法检测。
检测结果图2所示,图2A表示EPEC检测结果图,图中uidA和escV的位置有斑点,为阳性结果;uidA、escV和bfpB的位置有斑点,为阳性结果;图2B表示EPEC膜芯片的结果模式图,根据实验例1中表2所示,当uidA、escV和bfpB的位置有斑点时,如果astA的位置也有斑点,也可以判定大肠杆菌类型为肠致病性大肠杆菌EPEC。
肠侵袭性大肠杆菌(EIEC)
以肠侵袭性大肠杆菌EIEC(Enteroinvasive Escherichia coli,EIEC)作为模板,用实验例1提供的方法检测。
检测结果图3所示,图3A表示EIEC检测结果图,图中uidA和ipaH位置有斑点,结果为阳性;uidA、ipaH和invE位置有斑点,结果为阳性;uidA、ipaH、invE和pic位置有斑点,结果为阳性;图3B表示EIEC膜芯片的结果模式图,根据实验例1中表2所示,当uidA、ipaH、invE位置有斑点时,而pic的检测结果为阳性或阴性均可,此时综合结果可判定大肠杆菌类型为肠侵袭性大肠杆菌EIEC。
肠产毒性大肠杆菌(ETEC)
以肠产毒性大肠杆菌ETEC(Enterotoxigenic Escherichia coli,ETEC)作为模板,用实验例1提供的方法检测。
检测结果图4所示,图4A表示ETEC检测结果图,图中uidA和estB位置有斑点,结果为阳性;uidA、lt、astA和sth位置有斑点,结果为阳性;uidA、lt和stp位置有斑点,结果为阳性;图4B表示ETEC膜芯片的结果模式图,根据实验例1中表2所示,当uidA位置有斑点,estB、lt、sth和stp中一个或一个以上的位置有斑点时,而astA的检测结果为阳性或阴性均可,此时综合结果可判定大肠杆菌类型为肠产毒性大肠杆菌ETEC。
肠出血性大肠杆菌(EHEC)
以肠出血性大肠杆菌EHEC(Enterohemorrhagic Escherichia coli,EHEC)作为模板,用实验例1提供的方法检测。
检测结果图5所示,图5A表示EHEC检测结果图,图中uidA、stx1、stx2、escV和astA位置有斑点,为阳性结果;图5B表示EHEC膜芯片的结果模式图,当uidA、stx1和stx2位置有斑点时,而escV、astA的检测结果为阳性或阴性均可,此时综合结果可判定大肠杆菌类型为肠出血性大肠杆菌EHEC。
肠黏附性大肠杆菌(EAEC)
以肠黏附性大肠杆菌EAEC(Enteroaggregtive Escherichia coli,EAEC)作为模板,用实验例1提供的方法检测。
检测结果图6所示,图6A表示EAEC检测结果图,图中uidA、pic和aggR位置有斑点,为阳性结果;uidA、pic、aggR和astA位置有斑点,为阳性结果;图6B表示EAEC膜芯片的结果模式图,当uidA位置有斑点时,pic、aggR和astA中一个或一个以上位置有斑点时可以判定大肠杆菌类型为肠黏附性大肠杆菌EAEC。
混合致泻性大肠埃希氏菌检测
以混合致泻性大肠杆菌(Diarrheagenic Escherichia coli)作为模板,用实验例1提供的方法检测。
检测结果图7所示,图7A表示混合致泻性大肠杆菌检测结果图,当uidA、stx1、stx2、escV、ipaH、invE、estB、lt、pic、aggR、astA、bfpB、sth和stp均有斑点,为阳性结果是为混合型大肠杆菌,包含5种类型的大肠杆菌;图7B表示混合致泻性大肠杆菌膜芯片的结果模式图。
实验例3
按照北京康为世纪生物科技有限公司细菌基因组提取试剂盒(Bacteria Genomic DNA Kit货号:CW0552S)的说明提取待检样本基因组DNA,以待检样本DNA为模板;用实验例1提供的多重PCR反应以及自动杂交的方法检测待检样本。
结果如图8所示,并与实施例2提供的模式图进行对比,发现实验检测样本为混合样本,检测结果经与模式图比较,检测结果含有与肠产毒性大肠杆菌ETEC与肠致病性大肠杆菌EPEC;通过显色结果判定,待检样本含有肠产毒性大肠杆菌ETEC和肠致病性大肠杆菌EPEC。
综上所述,本发明提供的核酸组合和检测试剂盒操作简单,得到待检样本,提取DNA,多重PCR扩增,膜芯片杂交就可以检测待检样本中多种致泻性大肠埃希氏菌指标,具有平行分析和多重判断的特点;并且可以很方便的加入新的检测指标;系统在多重PCR扩增过程中,提高了系统的灵敏度和准确性;试剂盒采用了可视化膜芯片的检测方式,提高了系统的检测通量,并且检测结果可以直接用肉眼判断,方便,快捷;试剂盒操作简单;经济实惠,无需特殊的昂贵仪器,适用于致泻性大肠埃希氏菌检测及检测分型。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
序 列 表
SEQUENCE LISTING
<110> 四川华汉三创生物科技有限公司
<120> 检测致泻性大肠埃希氏菌的核酸组合及其检测试剂盒与应用
<160> 45
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<400> 1
gtcacgccgt atgttattgc c 21
<210> 2
<211> 19
<212> DNA
<213> 人工序列
<400> 2
cggcgtggtg tagagcatt 19
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<400> 3
aagagcgatg ttacggtttg t 21
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
gtcaggcagg acactactca a 21
<210> 5
<211> 24
<212> DNA
<213> 人工序列
<400> 5
gttcagtggt aatacaatga ccag 24
<210> 6
<211> 22
<212> DNA
<213> 人工序列
<400> 6
tactccggaa gcacattgct ga 22
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<400> 7
gatgctttag ttgcccagat 20
<210> 8
<211> 20
<212> DNA
<213> 人工序列
<400> 8
ccgccagaaa caagaagacc 20
<210> 9
<211> 18
<212> DNA
<213> 人工序列
<400> 9
ttccttgacc gcctttcc 18
<210> 10
<211> 18
<212> DNA
<213> 人工序列
<400> 10
tcagcagcaa cagcgaaa 18
<210> 11
<211> 19
<212> DNA
<213> 人工序列
<400> 11
gcaggagcag atcttgaag 19
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<400> 12
gaaaggcacg agtgactttc 20
<210> 13
<211> 21
<212> DNA
<213> 人工序列
<400> 13
cacaacagtg acaacggagg c 21
<210> 14
<211> 20
<212> DNA
<213> 人工序列
<400> 14
ccggcaaagc tattggaaaa 20
<210> 15
<211> 18
<212> DNA
<213> 人工序列
<400> 15
tcccaccgga tcaccaag 18
<210> 16
<211> 21
<212> DNA
<213> 人工序列
<400> 16
gtgctcagat tctgggtctc c 21
<210> 17
<211> 20
<212> DNA
<213> 人工序列
<400> 17
caaacgtatg ggtgacctgc 20
<210> 18
<211> 21
<212> DNA
<213> 人工序列
<400> 18
tgctgtcggt ataggtcatc g 21
<210> 19
<211> 20
<212> DNA
<213> 人工序列
<400> 19
cgcctaaagg atgccctgat 20
<210> 20
<211> 22
<212> DNA
<213> 人工序列
<400> 20
acagaatcgt cagcatcagc ta 22
<210> 21
<211> 22
<212> DNA
<213> 人工序列
<400> 21
tgccatcaac acagtatatc cg 22
<210> 22
<211> 21
<212> DNA
<213> 人工序列
<400> 22
acggctttgt agtccttcca t 21
<210> 23
<211> 22
<212> DNA
<213> 人工序列
<400> 23
ttcaaacgag gaaactaaac gc 22
<210> 24
<211> 22
<212> DNA
<213> 人工序列
<400> 24
aatcgaattt caactctgct cc 22
<210> 25
<211> 20
<212> DNA
<213> 人工序列
<400> 25
ttcacctttc cctcaggatg 20
<210> 26
<211> 20
<212> DNA
<213> 人工序列
<400> 26
atagcacccg gtacaagcag 20
<210> 27
<211> 21
<212> DNA
<213> 人工序列
<400> 27
actgaatcac ttgactcttc a 21
<210> 28
<211> 20
<212> DNA
<213> 人工序列
<400> 28
agcacaggca ggattacaac 20
<210> 29
<211> 25
<212> DNA
<213> 人工序列
<400> 29
ctggtacttt ggacactcgt tcttc 25
<210> 30
<211> 25
<212> DNA
<213> 人工序列
<400> 30
ccgggaatgg tgattaccga cgaaa 25
<210> 31
<211> 19
<212> DNA
<213> 人工序列
<400> 31
tgttaccttt ccaggtaca 19
<210> 32
<211> 18
<212> DNA
<213> 人工序列
<400> 32
ctgaaactgc tcctgtgt 18
<210> 33
<211> 25
<212> DNA
<213> 人工序列
<400> 33
tggcgattat tcctggcttt cctac 25
<210> 34
<211> 24
<212> DNA
<213> 人工序列
<400> 34
cgcctttccg ataccgtctc tgca 24
<210> 35
<211> 25
<212> DNA
<213> 人工序列
<400> 35
cagcaaaaga gcatagcatc cgaga 25
<210> 36
<211> 21
<212> DNA
<213> 人工序列
<400> 36
caacagtgac aacggaggcg a 21
<210> 37
<211> 22
<212> DNA
<213> 人工序列
<400> 37
gatgatactt gtaatgagga ga 22
<210> 38
<211> 20
<212> DNA
<213> 人工序列
<400> 38
ttctgcagac ggtggttaca 20
<210> 39
<211> 20
<212> DNA
<213> 人工序列
<400> 39
ggaatatcaa aagtagatgc 20
<210> 40
<211> 24
<212> DNA
<213> 人工序列
<400> 40
aacagcctgc gcttcgtgtc atgg 24
<210> 41
<211> 20
<212> DNA
<213> 人工序列
<400> 41
tcagttcgga cagcaatagc 20
<210> 42
<211> 21
<212> DNA
<213> 人工序列
<400> 42
ctaaaccagc agggtcttca a 21
<210> 43
<211> 22
<212> DNA
<213> 人工序列
<400> 43
aatcagaaaa tatgaacgac ac 22
<210> 44
<211> 25
<212> DNA
<213> 人工序列
<400> 44
gcatccagat cagaagcaat aatga 25
<210> 45
<211> 26
<212> DNA
<213> 人工序列
<400> 45
ccctcgggtt aatgcgcgat tgtcac 26
- 还没有人留言评论。精彩留言会获得点赞!