一种同时检测鲇形目鱼类四种致病菌的多重PCR引物组及检测方法与流程
本发明涉及生物
技术领域:
,具体地涉及一种同时检测鲇形目养殖鱼类四种致病菌鲇爱德华氏菌、柱状黄杆菌、嗜水气单孢菌和点状气单胞菌的引物序列及检测方法。
背景技术:
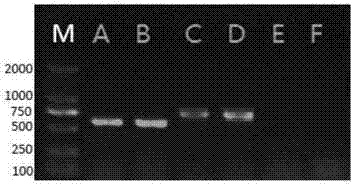
:鲇形目鱼类已成为当前世界淡水水产养殖发展的重点:美国主要饲养斑点叉尾鮰;欧洲主要饲养革胡子鲇、多河六须鲇、斑点叉尾鮰;非洲主要饲养革胡子鲇;我国黄颡鱼、南方大口鲇、革胡子鲇、胡子鲇、长吻鮠、江黄颡鱼、大鳍鳠等作为特种水产品正大量饲养,目前发展势头很快,其中尤以黄颡鱼最受欢迎。黄颡鱼是我国主要淡水水域中分布比较广、具有比较高经济价值的小型鱼类,因其肉质细嫩、味道鲜美、肌间刺少,深受广大消费者的欢迎。近年来,在江苏、浙江、广东和四川省的部分地区,人工养殖鲇形目鱼类的规模和集约化程度不断增加,部分养殖户也因此成功而获得了较好的经济效益。然而伴随养殖规模的迅速扩大、集约化程度大幅度提高,各种疾病对鲇形目鱼类的危害也日趋严重,其中细菌性疾病就是对养殖鲇形目鱼类危害比较严重的一类疾病。目前国内外报道的鲇形目鱼类细菌性疾病的病原主要包括鲇爱德华菌(Edwardsiellaictaluri),嗜水气单孢菌(Aeromonashydrophila)、柱状黄杆菌(Flavobacteriumcolumnare)和点状气单胞菌(Aeromonaspunctata)。其中鲇爱德华菌(E.ictaluri)是鲇形目鱼类的高发病原,可引起斑点叉尾鮰的败血病及黄颡鱼的裂头病,致死率极高,危害极大;柱状黄杆菌(F.columnare)可感染宿主较多,几乎所有淡水鱼都可感染,病菌感染后会造成烂鳃,烂身体等,病灶皮肤受损,免疫力减弱,随后可因细菌性败血病造成死亡;嗜水气单孢菌(A.hydrophila)与柱状黄杆菌一样,可危害鱼的种类很多,且流行季节长,危害鱼的年龄范围大,可造成严重的出血性败血症;点状气单胞菌(A.punctata)也是鲇形目的一种常见病原,可造成细菌性肠炎和打印病的发生。鱼类细菌病的发生原因有很多种,主要包括密度过高,温度影响,底泥过多,水质恶化等。其中底泥过多和水质恶化会导致水体中病原细菌的大量生长,从而诱发鱼类细菌病的产生,所以在高密度养殖过程中,对底泥和水质中病原微生物的鉴定和监测极其重要。然而传统的微生物鉴定法费时费力,以PCR(聚合酶链式反应)为代表的分子生物学及自动化控制技术的发展使得快速检测病原微生物成为可能。目前报道较多PCR法、PCR加杂交法等方法虽然大大提高了检测的灵敏度,简化了检测手续,但也存在一些不足之处。其中最局限的是上述方法在一次实验中只能检测一种微生物,检测微生物的种类非常少。而在普通PCR基础上发展起来的多重PCR(multiplexPCR,多重聚合酶链式反应)可以检测和分析更多的靶基因,大大提高了检测效率、降低了检测成本,成为医学和兽医学临床诊断的主要手段。然而相对于普通PCR,多重PCR的设计难度要高得多。传统PCR一般扩增一个片段,需要两条引物,而多重PCR一般至少扩增3个以上的片段,就需要至少6条引物。这些引物既不能互相结合,也不能与模板DNA上目标片段以外的区域结合。此外还要考虑不同扩增子的长度以便凝胶电泳。更麻烦的是,DNA多聚酶对不同的引物的扩增效率不同,多重PCR中的不同扩增片段还会互相竞争资源,常常出现扩增效率不均衡问题,造成假阴性结果,其结果是扩增效率高的片段能够被很容易的检测到,而效率低的片段彻底沦为背景。同时还容易出现引物二聚体,给检测带来了难题。技术实现要素:本发明针对以上问题,提供了一种检测效率高、结果准确的、可同时检测鲇形目鱼类四种致病菌的多重PCR引物组及检测方法。本发明的技术方案是:一种同时检测鲇形目鱼类四种致病菌的多重PCR引物组,所述多重PCR引物组包括鲇爱德华氏菌引物对、柱状黄杆菌引物对、嗜水气单孢菌引物对和点状气单胞菌引物对,所述鲇爱德华氏菌引物对的核酸序列为:EI-F1:5’-CGGCAGGTCATATCAAAGAG-3’,或者该序列的核酸互补序列;EI-R1:5’-CGATAATGTGGTAATGCGGT-3’,或者该序列的核酸互补序列;所述柱状黄杆菌引物对的核酸序列为:FC-F2:5’-ATCCAGAACGTGTGATAGGT-3’,或者该序列的核酸互补序列;FC-R2:5’-AAGTTCCAGCTACGATACCA-3’,或者该序列的核酸互补序列;所述嗜水气单孢菌引物对的核酸序列为:AH-F3:5’-AGTTTGTCGCCAATATCCGC-3’,或者该序列的核酸互补序列;AH-R3:5’-CTCGTACGCTCATGAGGACT-3’,或者该序列的核酸互补序列;所述点状气单胞菌引物对的核酸序列为:AP-F4:5’-CAGCTACCCCTCGACTATGG-3’,或者该序列的核酸互补序列;AP-R4:5’-TGCGGATCTTGTGACTGACT-3’,或者该序列的核酸互补序列。一种同时检测鲇形目鱼类四种致病菌的PCR检测方法,包括如下步骤:1)、制备DNA模板:利用DNA试剂盒抽提基因组DNA作为模板;2)、多重PCR扩增:利用多重PCR引物组对步骤1)中的DNA模板进行多重PCR扩增;3)、检测:对步骤2)中得到的扩增产物作为样品进行凝胶电泳检测,利用TAE缓冲液配置1.2%的琼脂糖凝胶,点样后,电压设置为100~140伏,电泳20~40分钟;若有1170bp的条带说明样品中有鲇爱德华氏菌,若有895bp的条带说明样品中柱状黄杆菌,若有554bp的条带说明样品中有嗜水气单孢菌,若有418bp的条带说明样品中有点状气单胞菌。所述步骤2)中的多重PCR扩增的反应体系为:所述的2×mix包含PhusionDNAPolymerase、2×PhusionPCRBuffer、3mMMgC12和400uMdNTP。所述步骤2)中的多重PCR扩增的扩增条件为:98℃预变性3~5min,98℃变性30~45s,57~60℃退火25~35s,72℃延伸50~60s,进行28-32个循环后,然后再72℃温度延伸7~10min,完成PCR扩增,扩增产物4℃保存。本发明的有益效果是:本发明设计了四对针对不同致病菌的PCR引物组,并利用该引物组建立了一个多重PCR反应,实现了同时、快速鉴定四种致病菌的目的,并且敏感性好,特异性高,相对于传统检测方法,本发明所需成本更低,操作更加简便,所需时间更短,针对性更强,可应用于多种含有鲇爱德华氏菌、点状气单胞菌、柱状黄杆菌和嗜水气单孢菌的环境中其中任何一种细菌样本的分析和检测,如水,底泥,养殖动物(鱼,虾,贝,甲鱼,浮游动物等)及其排泄物,进出口水产品等。本发明提供的检测方法经济实用,尤其适合鲇形目鱼类养殖过程中病原菌的鉴定及水质和底泥的长期监测。附图说明图1为本发明实施例5提供的多重PCR对养殖黄颡鱼鳃和肾组织中病原微生物检测的电泳显色图,其中M:TakaraDL2000DNAmarker(Takara公司的DL2000DNA标记);NC:空白对照;泳道1-10为不同个体鳃组织检测结果;泳道11-20为不同个体肾组织检测结果;图2为本发明实施例6提供的多重PCR对黄颡鱼养殖池塘中水体中病原微生物检测的电泳显色图,其中M:TakaraDL2000DNAmarker;泳道A-F为不同池塘水体的检测结果;图3为本发明实施例7提供的多重PCR对黄颡鱼养殖池塘中水体中病原微生物检测的电泳显色图,其中M:TakaraDL2000DNAmarker;泳道A-F为不同池塘底泥的检测结果。具体实施方式本发明提供的多重PCR检测引物组的核酸序列为:所述鲇爱德华氏菌引物对的核酸序列为:EI-F1:5’-CGGCAGGTCATATCAAAGAG-3’,或者该序列的核酸互补序列:3’-GCCGTCCAGTATAGTTTCTC-5’;EI-R1:5’-CGATAATGTGGTAATGCGGT-3’,或者该序列的核酸互补序列:3’-GCTATTACACCATTACGCCA-5’;所述柱状黄杆菌引物对的核酸序列为:FC-F2:5’-ATCCAGAACGTGTGATAGGT-3’,或者该序列的核酸互补序列:是3’-TAGGTCTTGCACACTATCCA-5’;FC-R2:5’-AAGTTCCAGCTACGATACCA-3’,或者该序列的核酸互补序列:3’-TTCAAGGTCGATGCTATGGT-5’;所述嗜水气单孢菌引物对的核酸序列为:AH-F3:5’-AGTTTGTCGCCAATATCCGC-3’,或者该序列的核酸互补序列:3’-TCAAACAGCGGTTATAGGCG-5’;AH-R3:5’-CTCGTACGCTCATGAGGACT-3’,或者该序列的核酸互补序列:3’-GAGCATGCGAGTACTCCTGA-5’;所述点状气单胞菌引物对的核酸序列为:AP-F4:5’-CAGCTACCCCTCGACTATGG-3’,或者该序列的核酸互补序列:3’-GTCGATGGGGAGCTGATACC-5’;AP-R4:5’-TGCGGATCTTGTGACTGACT-3’,或者该序列的核酸互补序列:3’-ACGCCTAGAACACTGACTGA-5’。实施例1DNA的提取利用DNA试剂盒抽提基因组DNA作为模板实施例2多重PCR扩增方法的建立首先通过单基因特异性PCR,初步探索每对引物组扩增对应基因片段的反应体系和反应条件。分别提取的四种病原菌的基因组DNA作为各自引物组的扩增模板,通过多次实验发现,各对引物组分别在以下的反应体系和条件下可以很好地扩增出对应的基因片段。1、单基因PCR反应体系和反应条件的建立1)、鲇爱德华氏菌单基因特异性PCR反应体系和条件PCR反应体系:PCR反应条件:98℃预变性5min,98℃变性30s,57~60℃退火30s,72℃延伸lmin,进行30个循环后,然后72℃终延伸10min。凝胶电泳检测,筛选出扩增成功的引物对。所述的2×mix包含PhusionDNAPolymerase(Phusion超保真DNA聚合酶)、2×PhusionPCRBuffer(PhusionPCR缓冲液)、3mMMgC12和400uMdNTP。2)、柱状黄杆菌单基因特异性PCR反应体系和条件反应体系:PCR反应条件:98℃预变性5min,98℃变性30s,57~60℃退火30s,72℃延伸lmin,进行30个循环后,然后72℃终延伸10min。凝胶电泳检测,筛选出扩增成功的引物对。3)、嗜水气单孢菌单基因特异性PCR反应体系和条件反应体系:PCR反应条件:98℃预变性5min,98℃变性30s,57~60℃退火30s,72℃延伸lmin,进行30个循环后,然后72℃终延伸10min。凝胶电泳检测,筛选出扩增成功的引物对。4)、点状气单孢菌单基因特异性PCR反应体系和条件反应体系:PCR反应条件:98℃预变性5min,98℃变性30s,57~60℃退火30s,72℃延伸lmin,进行30个循环后,然后72℃终延伸10min。凝胶电泳检测,筛选出扩增成功的引物对。2、多重PCR反应体系和反应条件的初探试验在单基因特异性PCR反应的基础上,将四种细菌的DNA模板等量混合,运用上述实验成功筛选出来的引物进行自由组合,建立多重PCR检测方法,研究其最佳反应条件。为了解4对引物组同时扩增其目的基因时,引物内部间的相互影响,预先将引物的最终浓度都定为0.2uM(uM是umol/L的缩写),按如下反应体系及反应条件同时进行扩增:1)、多重PCR初探试验反应体系2)、多重PCR初探试验反应条件98℃预变性5min,98℃变性30s,57℃退火30s,72℃延伸lmin,进行30个循环后,然后72℃终延伸10min。凝胶电泳检测可同时扩增出四条目的带的引物组合为EI-F1&EI-R1,FC-F2&FC-R2,AH-F3&AH-R3和AP-F4&AP-R4,其中引物组AH-F3&AH-R3和AP-F4&AP-R4的扩增的效果较好,而EI-F1&EI-R1和FC-F2&FC-R2引物组的扩增效果相对稍差。3、多重PCR反应体系和反应条件的优化1)、引物浓度的优化根据上述初探试验的结果,在反应体系中,保持引物AP-F4&AP-R4和AH-F3&AH-R3浓度不变,分别调整另外2对引物浓度,将其加入量逐渐调高为:0.3uM,0.4uM,0.6uM,0.8uM,1.0uM,进行多重PCR扩增;多重PCR的检测结果表明:当引物FC-F2&FC-R2浓度为0.3uM时,其扩增效果最好,而EI-F1&EI-R1引物组浓度为0.4uM时,其扩增效果最好;2)、退火温度的优化由于4对引物设计时,其适合退火温度为57~60℃,因此,运用优化后的引物浓度,在温度梯度PCR仪中设置温度梯度,进行多重PCR扩增。结果表明当多重PCR的退火温度为57~60℃,4对引物的扩增效果均较好,优其是59℃的退火温度效果最佳,综合考虑,将其最适退火温度设定为59℃。实施例3PCR扩增产物的电泳检测利用常规电泳缓冲液TAE缓冲液(0.04mol/LTris-乙酸,0.001mol/LEDTA)配置1.2%的琼脂糖凝胶,点样后,电压设置为100-140伏,电泳20-40分钟。实施例5多重PCR引物组特异性试验制备阴性对照样本,选取下表1中的9种常见病原菌,所有菌株均来自中科院武汉水生生物研究所。提取基因组DNA之后等量混合作为阴性对照。利用实施案例1中的多重PCR引物和实施例3、4中的检测方法进行检测,结果均为阴性。表1:常见病原菌阴性对照物种名称阴性对照物种名称(拉丁名)副溶血性弧菌VibrioParahemolyticus类志贺邻单胞菌Plesiomonasshigelloides豚鼠气单胞菌Aeromonascaviae温和气单胞菌Aeromonassobria脆弱气单胞菌Aeromonastrota荧光假单胞菌Pseudomonasfluorescens铜绿假单孢菌Pseudomonasaeruginosa维氏气单胞菌Aeromonasveronii迟缓爱德华氏菌Edwardsiellatarda实施例4敏感性试验分别取28℃培养20h的鲇爱德华氏菌、柱状黄杆菌、嗜水气单孢菌和点状气单胞菌菌液,参照国标法(GB/T4789.2-2003)进行细菌计数,四种菌的浓度均为2×108cfu/mL,上述的菌液离心收集菌体,然后提取基因组DNA,对基因组DNA进行系列梯度稀释,分别稀释为101、102、103、104、105、106和107倍,以实施例l、2、3中建立的多重PCR检测方法进行多重PCR检测。检测结果发现:(1)鲇爱德华氏菌检测时出现1170bp的条带,柱状黄杆菌检测时出现895bp的条带,嗜水气单孢菌检测时出现554bp的条带,点状气单胞菌检测时出现418bp的条带,(2)本发明的检测方法在循环数为30的条件下可对检出稀释106倍的菌液,本发明的检出下限可达200cfu/mL。实施例5养殖黄颡鱼中病菌的检测1、DNA模板制备样品为某养殖场10尾患病黄颡鱼的鳃和肾组织,利用组织DNA提取试剂盒抽提基因组DNA作为模板。2、多重PCR扩增利用实施案例1中的多重PCR引物组和反应条件进行PCR检测,具体如下:PCR反应条件:98℃预变性3min,98℃变性30s,57℃退火25s,72℃延伸50s,进行32个循环后,然后72℃终延伸10min。3、电泳分析取10uLPCR扩增产物在1-1.2%琼脂糖凝胶电泳检测,根据图1所示,样本2、4、5、7扩增到895bp左右的片段,说明有柱状黄杆菌的感染。样本11、13、20扩增到1170bp左右的片段,说明有鲇爱德华氏菌的感染。其他样本未扩增到条带,说明没有细菌感染。该结果与传统的传统常规检测方法:对组织病料进行病原菌的分离纯化,培养,进行常规生理生化鉴定,和用16SrRNA通用引物进行普通PCR鉴定结果一致。4、空白对照不添加任何DNA模板,实验条件与本实施例上述步骤2-3中相同,结果未扩增到条带。实施例6黄颡鱼养殖池塘中水样的检测1、DNA模板制备样品为某养殖场不同养殖池塘A,B,C,D,E,F共6组水样,进行抽滤后,利用细菌基因组试剂盒抽提基因组DNA作为模板。2、多重PCR扩增利用实施案例1中的多重PCR引物组和反应条件进行PCR检测,具体如下:PCR反应条件:98℃预变性5min,98℃变性45s,59℃退火30s,72℃延伸lmin,进行28个循环后,然后72℃终延伸7min。3、电泳分析取10uLPCR扩增产物在1-1.2%琼脂糖凝胶电泳检测,根据图2所示,样本A,B扩增到554bp左右的片段,说明有嗜水气单孢菌的感染。样本C.D扩增到895bp左右的片段,说明有柱状黄杆菌的感染。其他样本未扩增到条带,说明没有细菌感染。该结果与传统的传统常规检测方法:进行病原菌的分离纯化,培养,进行常规生理生化鉴定,和用16SrRNA通用引物进行普通PCR鉴定结果一致。4、空白对照不添加任何DNA模板,实验条件与本实施例上述步骤2-3中相同,结果未扩增到条带。实施例7黄颡鱼养殖池塘中底泥的检测1、DNA模板制备样品为某养殖场不同养殖池塘A,B,C,D,E,F共6组泥样,进行抽滤后,利用土壤基因组试剂盒抽提基因组DNA作为模板。2、多重PCR扩增利用实施案例1中的多重PCR引物组和反应条件进行PCR检测,具体如下:PCR反应条件:98℃预变性5min,98℃变性30s,59℃退火30s,72℃延伸lmin,进行30个循环后,然后72℃终延伸10min。3、电泳分析取10uLPCR扩增产物在1-1.2%琼脂糖凝胶电泳检测,根据图3所示,样本A,B,C扩增到554bp左右的片段,说明有嗜水气单孢菌的感染。样本D扩增到895bp左右的片段,说明有柱状黄杆菌的感染。其他样本未扩增到条带,说明没有细菌感染。该结果与传统的传统常规检测方法:进行病原菌的分离纯化,培养,进行常规生理生化鉴定,和用16SrRNA通用引物进行普通PCR鉴定结果一致。4、空白对照不添加任何DNA模板,实验条件与本实施例上述步骤2-3中相同,结果未扩增到条带。SEQUENCELISTING<110>扬州宏盛水产科技有限公司<120>一种同时检测鲇形目鱼类四种致病菌的多重PCR引物组及检测方法<130>2017<160>8<170>PatentInversion3.3<210>1<211>20<212>DNA<213>人工序列<400>1gccgtccagtatagtttctc20<210>2<211>20<212>DNA<213>人工序列<400>2cgataatgtggtaatgcggt20<210>3<211>20<212>DNA<213>人工序列<400>3atccagaacgtgtgataggt20<210>4<211>20<212>DNA<213>人工序列<400>4aagttccagctacgatacca20<210>5<211>20<212>DNA<213>人工序列<400>5agtttgtcgccaatatccgc20<210>6<211>20<212>DNA<213>人工序列<400>6ctcgtacgctcatgaggact20<210>7<211>20<212>DNA<213>人工序列<400>7cagctacccctcgactatgg20<210>8<211>20<212>DNA<213>人工序列<400>8tgcggatcttgtgactgact20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1