脂肪酸修饰的LDV衍生物,其合成,活性和应用的制作方法
本发明涉及结构式为ch3(ch2)nco-leu-asp-val(n=6,8,10,16)的化合物,涉及它们的制备方法,涉及它们的抗血栓活性,涉及它们的抗炎活性,因而本发明涉及它们在制备抗血栓药物和抗炎药物中的应用。本发明属于生物医药领域。
背景技术
动脉血栓性疾病例如心肌梗塞和缺血性中风严重威胁人类健康。动脉血栓性疾病的发病率随年龄增长呈指数态增加。我国人口的老龄化趋势使得动脉血栓性疾病对人民健康的威胁尤其严重。至少有一半血栓的形成与白细胞粘附有关。同样,许多炎症应答与白细胞粘附有关。从而血栓形成与炎症应答相互关联。于是,发明可口服的具有抗动脉血栓形成和抗炎双重作用的药物一直是新药研究的重要领域之一。虽然leu-asp-val(ldv)能抑制肿瘤细胞的迁移和侵袭,但是并不知道ldv具有抗肿瘤作用和抗白细胞粘附作用。申请人曾经用ldv修饰5-氟尿嘧定,并使5-氟尿嘧定抗肿瘤的有效剂量降低15倍(即从150μmol/kg降至15μmol/kg)。发明人还曾经发现ldv抑制sacc-lm细胞侵袭的有效浓度为1μm。发明人在反复探索的基础上,发现将ldv与脂肪酸ch3(ch2)nco2h偶联形成的ch3(ch2)nco-leu-asp-val(n=6,8,10,16)在很低的口服剂量同时具有抗血栓和抗炎作用。基于这个发现,发明人提出了本发明。
技术实现要素:
本发明的第一个内容是提供结构式为ch3(ch2)nco-leu-asp-val(n=6,8,10,16)的化合物。
本发明的第二个内容是提供结构式为ch3(ch2)nco-leu-asp-val(n=6,8,10,16)的化合物的合成方法,该方法包括:
(1)boc-asp(obzl)与tos·val-obzl缩合得boc-asp(obzl)-val-obzl;
(2)boc-asp(obzl)-val-obzl在氯化氢的乙酸乙酯溶液中脱boc得asp(obzl)-val-obzl;
(3)ch3(ch2)nco2h,其中n=6,8,10和16,与leu-obzl缩合得ch3(ch2)nco-leu-obzl;
(4)ch3(ch2)nco-leu-obzl氢解脱苄得ch3(ch2)nco-leu;
(5)ch3(ch2)nco-leu与asp(obzl)-val-obzl缩合得ch3(ch2)nco-leu-asp(obzl)-val-obzl;
(6)ch3(ch2)nco-leu-asp(obzl)-val-obzl氢解脱苄得ch3(ch2)nco-leu-asp-val。
本发明的第三个内容是评价ch3(ch2)nco-leu-asp-val的抗血栓活性。
本发明的第四个内容是评价ch3(ch2)nco-leu-asp-val的抗炎活性。
附图说明
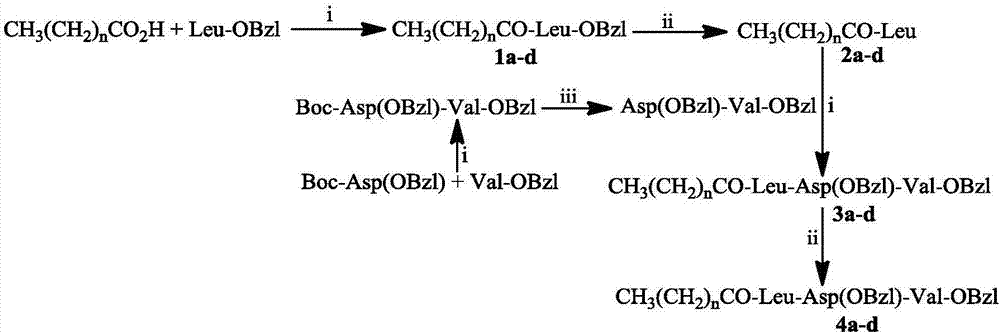
图1ch3(ch2)nco-leu-asp-val(n=6,8,10,16)的合成路线.i)二环己基碳二亚胺(dcc),n-羟基苯骈三氮唑(hobt),n-甲基吗啉;ii)氯化氢的乙酸乙酯溶液(4m);iii)pd/c,h2。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实例1制备boc-asp(obzl)-val-obzl
冰浴下向3.23g(10mmol)boc-asp(obzl)与40ml无水四氢呋喃的溶液中依次加入3.09g(15mmol)n,n-二环己基碳二亚胺(dcc)和1.42g(10.5mol)1-羟基苯丙三唑(hobt)并搅拌30min,得到反应液a。4.17g(11mmol)tos·val-obzl和30ml无水四氢呋喃的溶液用n-甲基吗啉调ph至8,得到反应液b。将得到反应液b加到得到反应液a中,用n-甲基吗啉调反应液ph值至8。室温搅拌8小时后,反应混合物减压浓缩,得到淡黄色糖浆加石油醚反复磨洗。残留物加200ml乙酸乙酯溶解,过滤,滤液分别用饱和碳酸氢钠水溶液洗三次,饱和氯化钠水溶液洗三次,饱和硫酸氢钾水溶液洗三次,饱和氯化钠水溶液洗三次,饱和碳酸氢钠溶液洗三次及饱和氯化钠溶液各洗三次。乙酸乙酯层加无水硫酸钠干燥8h。过滤,滤液减压浓缩得到4.56g(89%)标题化合物,为黄色糖浆状物。esi-ms(m/e):513[m+h]+。
实例2制备asp(obzl)-val-obzl
冰浴与搅拌下将4.56g(8.89mmol)boc-asp(obzl)-val-obzl与90ml氯化氢的乙酸乙酯溶液(4m)缓慢混合。得到的溶液在冰浴中搅拌5h。之后,反应混合物减压浓缩。残留物用50ml无水乙酸乙酯溶解,得到的溶液减压浓缩。该操作重复三次。残留物用无水乙醚充分洗,得到3.11g(85%)标题化合物,为无色粉末。esi-ms(m/e):413[m+h]+。
实例3制备ch3(ch2)6co-leu-obzl(1a)
按照实例1的方法从1.44g(10mmol)ch3(ch2)6co2h和4.3g(11mmol)leu-obzl得到3.12g(90%)标题化合物,为黄色糖浆状物。es-ms:348[m+1]+。
实例4制备ch3(ch2)6co-leu(2a)
往2.84g(9mmol)ch3(ch2)6co-leu-obzl与40ml甲醇的溶液中加630mgpd/c,通48hh2。滤去pd/c,滤液减压浓缩得2.23g(96%)标题化合物,为无色粉末。esi-ms(m/e):258[m+h]+。
实例5制备ch3(ch2)6co-leu-asp(obzl)-val-obzl(3a)
按照实例1的方法从2.23g(8.64mmol)ch3(ch2)6co-leu(2a)和3.72g(9mmol)asp(obzl)-val-obzl得到3.51g(62%)标题化合物,为黄色糖浆状物。es-ms:653[m+h]+。
实例6制备ch3(ch2)6co-leu-asp-val(4a)
按照实施例4的方法从1.22g(1.86mmol)ch3(ch2)6co-leu-asp(obzl)-val-obzl(3a)得到0.42g(48%)标题化合物。mp154-157℃;[α]20d=-15.9(c=0.1,ch3oh);esi-ms(m/e):472.60[m+h]+;ir(kbr,cm-1):3277,3069,2926,1633,1537,1428,1269,1216,708;1h-nmr(300mhz,dmso-d6):δ/ppm=8.30(d,1h),7.95(m,2h),4.08(m,1h),4.25(m,2h),2.79(m,1h),2.62(m,1h),2.09(m,4h),1.62(m,2h),1.43(m,10h),1.25~1.05(m,15h)。
实例7制备ch3(ch2)8co-leu-obzl(1b)
按照实例1的方法从1.72g(10mmol)ch3(ch2)8co2h和4.3g(11mmol)leu-obzl得到3.22g(85%)标题化合物,为黄色糖浆状物。es-ms(m/e):376[m+h]+。
实例8制备ch3(ch2)8co-leu(2b)
按照实施例4的方法从3.22g(8.56mmol)ch3(ch2)8co-leu-obzl(1b)得到1.89g(86%)标题化合物。esi-ms(m/e):286[m+h]+。
实例9制备ch3(ch2)8co-leu-asp(obzl)-val-obzl(3b)
按照实例1的方法从1.89g(6.60mmol)ch3(ch2)8co-leu(2b)和2.89g(7mmol)asp(obzl)-val-obzl得到3.74g(83%)标题化合物,为黄色糖浆状物。es-ms(m/e):681[m+h]+。
实例10制备ch3(ch2)8co-leu-asp-val(4b)
按照实施例4的方法从1.17g(1.71mmol)ch3(ch2)8co-leu-asp(obzl)-val-obzl(3b)得到0.54g(63%)标题化合物。mp162-167℃;[α]20d=27.9(c=0.1,ch3oh);esi-ms(m/e):500[m+h]+;ir(kbr,cm-1):3278,3070,2927,1635,1538,1429,1270,1217,708,640;1h-nmr(300mhz,dmso-d6):δ/ppm=8.34(d,1h),7.94(m,2h),4.08(m,1h),4.25(m,2h),2.79(m,1h),2.62(m,1h),2.09(m,4h),1.62(m,2h),1.43(m,14h),1.25~1.08(m,15h)。
实例11制备ch3(ch2)10co-leu-obzl(1c)
按照实例1的方法从2.00g(10mmol)ch3(ch2)10co2h和4.3g(11mmol)leu-obzl得到3.11g(77%)标题化合物,为黄色糖浆状物。es-ms(m/e):404[m+h]+。
实例12制备ch3(ch2)10co-leu(2c)
按照实施例4的方法从3.11g(7.78mmol)ch3(ch2)10co-leu-obzl(1c)得到1.92g(78%)标题化合物。esi-ms(m/e):314[m+h]+。
实例13制备ch3(ch2)10co-leu-asp(obzl)-val-obzl(3c)
按照实例1的方法从1.92g(6.11mmol)ch3(ch2)10co-leu(2c)和2.89g(7mmol)asp(obzl)-val-obzl得到3.23g(75%)标题化合物,为黄色糖浆状物。es-ms(m/e):709[m+h]+。
实例14制备ch3(ch2)10co-leu-asp-val(4c)
按照实施例4的方法从1.41g(1.99mmol)ch3(ch2)10co-leu-asp(obzl)-val-obzl(3c)得到0.58g(55%)标题化合物。mp156-159℃;[α]20d=36.9(c=0.1,ch3oh);esi-ms(m/e):528[m+h]+;ir(kbr,cm-1):3319,3043,2930,1657,1532,1425,1263,1211,645;1h-nmr(300mhz,dmso-d6):δ/ppm=8.34(d,1h),7.94(m,2h),4.08(m,1h),4.25(m,2h),2.79(m,1h),2.62(m,1h),2.09(m,4h),1.62(m,2h),1.43(m,18h),1.25~1.08(m,15h)。
实例15制备ch3(ch2)16co-leu-obzl(1d)
按照实例1的方法从2.84g(10mmol)ch3(ch2)16co2h和4.3g(11mmol)leu-obzl得到3.37g(69%)标题化合物,为黄色糖浆状物。es-ms(m/e):488[m+h]+。
实例16制备ch3(ch2)16co-leu(2d)
按照实施例4的方法从3.37g(8.46mmol)ch3(ch2)16co-leu-obzl(1d)得到2.54g(75%)标题化合物。esi-ms(m/e):398[m+h]+。
实例17制备ch3(ch2)16co-leu-asp(obzl)-val-obzl(3d)
按照实例1的方法从2.54g(6.38mmol)ch3(ch2)16co-leu(2d)和2.89g(7mmol)asp(obzl)-val-obzl得到3.56g(70%)标题化合物,为黄色糖浆状物。es-ms(m/e):793[m+h]+。
实例18制备ch3(ch2)16co-leu-asp-val(4d)
按照实施例4的方法从1.37g(1.99mmol)ch3(ch2)16co-leu-asp(obzl)-val-obzl(3d)得到0.71g(41%)标题化合物。mp172-176℃;[α]20d=-36.9(c=0.1,ch3oh);esi-ms(m/e):613[m+h]+;ir(kbr,cm-1):3262,3051,2924,1631,1539,1422,1222,1224,712;1h-nmr(300mhz,dmso-d6):δ/ppm=8.27(d,1h),7.96(m,2h),4.39(m,1h),4.25(m,2h),2.80(m,1h),2.57(m,1h),2.03(m,2h),1.70(m,4h),1.42~1.30(m,26h),1.26~0.98(m,15h)。
实施例19测定化合物4a-d的抗血栓活性
本测定模型采用sd大鼠(250±15g)颈总动脉—颈外静脉体外循环旁路模型,给药方式均为口服。化合物4a-d,阿司匹林及leu-asp-val(ldv)均悬浮于0.5%的cmc-na中。化合物4a-d的口服剂量为10nmol/kg,ldv的口服剂量为100nmol/kg,空白组对照为cmc-na,阳性对照为阿司匹林(167μmol/kg)。每组12只大鼠。按所述剂量给药30min后,大鼠腹腔注射20%的乌拉坦溶液麻醉(0.7ml/100g)。将大鼠仰卧位固定于固定板上,剪开颈部皮肤,分离右颈总动脉及左颈外静脉,分别将右颈总动脉和左颈外静脉的远心端用手术线进行结扎,于暴露的左颈外静脉剪一v字型小口。将预先制好的聚乙烯旁路插管的静脉端斜口插入左颈外静脉开口的近心端,插管处用手术线将血管与聚乙烯管固定。插管连接处固定一根准确称重的血栓附着丝线。以0.1ml/100g体重的剂量通过旁路插管准确注入肝素钠水溶液,注射器不撤离旁路插管。用动脉夹夹住右颈总动脉近心端,在暴露的动脉上剪一v字型小口,将旁路插管的尖端从注射器取下,将旁路插管插入右颈总动脉的近心端,用手术线将动脉血管与旁路插管固定,松开动脉夹,建立体外循环旁路。维持大鼠体温及旁路插管中血流通畅,体外循环15min。之后,先将静脉端插管断开观察血液循环是否顺畅。再从插管的动脉端取出血栓附着丝线,在滤纸上吸去丝线上的未凝固血液后称量。增加的重量即为血栓湿重。用t检验对数据进行统计分析。结果见表1。在10nmol/kg剂量下化合物4a-d表现出抗血栓的活性,活性不仅与剂量为167μmol/kg的阿司匹林没有统计学差异,而且显著强于剂量为100nmol/kg的ldv。这些数据表明,本发明有突出的技术效果。
表1化合物4a-d的抗血栓活性
a)与cmc-na及ldv比p<0.01,与阿司匹林比p>0.05;n=12.
实施例20测定化合物4a-d的抗炎活性
因为二甲苯引起的小鼠耳肿胀被公认为急性炎症模型,所以本发明在二甲苯引起的小鼠耳肿胀模型上测定化合物的治疗作用。因为阿司匹林是治疗急性炎症的阳性药,所以本发明选择阿司匹林为阳性对照药。化合物4a-d,阿司匹林及leu-asp-val(ldv)均悬浮于0.5%的cmc-na中。icr雄性小鼠(体重22±3g)在温度为22℃的环境静息2天,自由饮水和进食。之后,随机分为0.5%cmc-na组(剂量为0.2ml/只),阿司匹林组(剂量为1.11mmol/kg),化合物4a-d组(剂量为10nmol/kg),ldv组(剂量为100nmol/kg),每组12只小鼠。测定时小鼠按所在组或口服cmc-na,或口服阿司匹林,或口服化合物4a-d,或口服ldv。给药30min后,往小鼠的左耳廓均匀涂抹30μl二甲苯,2h后小鼠接受乙醚麻醉,断颈处死,剪下左右两耳,用7mm的打孔器在两耳的相同位置取圆形耳片,称重,求出两耳肿胀差值作为肿胀度。即肿胀度=左耳圆片重量–右耳圆片重量。数据列入表2。在10nmol/kg剂量下化合物4a-d不仅有效地抑制二甲苯引起的小鼠耳肿胀,而且活性与剂量为100nmol/kg的ldv无显著性差异。这些数据表明,本发明有突出的技术效果。
表2化合物4a-d对二甲苯引起的小鼠耳肿胀的影响
a)与cmc-na及ldv比p<0.01;b)与cmc-na比p<0.01,与ldv比p>0.05;n=12。
- 还没有人留言评论。精彩留言会获得点赞!