靶向Mesothelin的嵌合抗原受体并联合表达抗PD1抗体的方法及其用途与流程
本发明属于嵌合抗原受体领域,具体涉及靶向mesothelin(ss1)-cd28-bbz-apd1的嵌合抗原受体及其用途。
背景技术:
胰腺癌(pancreaticcarcinoma)是临床上常见的消化系统恶性肿瘤,多见于50岁以上的人群。其发病率有明显的地区差异,近年来发病率呈逐渐上升趋势,在欧美国家已是第4位常见的恶性肿瘤,居消化道癌症死因的第2位,仅次于大肠癌,其发病隐匿,早期症状无特异性,手术切除率低。在肿瘤发生发展的进程中,很多基因的活化及其产物的表达起到了重要的作用,其内在确切的分子机制尚不完全明确,随着现代影像及内镜技术的飞速发展,对一些症状体征及影像表现较为明显的胰腺癌,明确诊断己没有太大困难,但此时大多己失去最佳手术时机,而对于一些早期患者诊断较难。因此寻求新的治疗手段,对于胰腺癌的治疗是当务之急。
在肿瘤的浸润转移过程的研究方面,间皮素(mesothelin)也是当前研究的热点。1996年chang等利用宫颈癌hela细胞克隆出单克隆抗体识别的抗原,研究发现该抗原存在于正常间皮细胞,故命名为mesothelin。肿瘤患者术后生存率低预后差的主要原因与它的浸润转移有关,肿瘤的浸润转移机制研究是目前的热点和难点。mesothelin基因编码一种69kda的前体蛋白,经加工形成一个40kda的膜结合蛋白(即mesothelin)和一个3lkda称之为巨核细胞促进因子mpf的脱落片断。间皮素高表达于多种肿瘤组织中,卵巢癌患者血清中的mesothelinmrna和蛋白质水平高表达,组织切片染色显示非粘蛋白卵巢癌中有66%呈间皮素阳性;在胸膜间皮瘤的检测中发现,15例确诊为上皮性间皮瘤的病例全都呈阳性,4例肉瘤性间皮瘤全为阴性;argani等研究报道,切除的原发性胰腺癌中,免疫组化法检测表明60例有54例强阳性,而周围正常胰腺组织则无mesothelin反应活性;在其他实体肿瘤分析中,官颈、头、颈、阴道、肺及食管的鳞癌冰冻切片中均可发现间皮素免疫活性,肺腺癌、子宫内膜癌、交界性滑膜肉瘤及结缔组织增生性小圆细胞肿瘤有少量间皮素表达,在乳腺癌,甲状腺癌、肾细胞癌、膀胱移细胞癌、黑色素癌及肝癌中仅有少许或没有mesothelin表达。
mesothelin的生物学功能尚未明确。pastan等构建了一种mesothelin基因突变小鼠,这些基因突变小鼠与同胞的野生型小鼠生长和繁殖相同,并且二者的血小板计数没有统计学差异;有研究显示mesothelin与ca125结合能介导细胞粘附,由此研究者们也认为ca125和mesothelin在卵巢癌的转移扩散中可能起重要作用;另外,有研究亦表明,mesothelin基因的表达受到wnt等重要信号途径的调节,如在卵巢癌和胰腺癌中,wnt信号转导途径持续激活促使mesothelin表达增加。虽然。mesothelin的功能及其致癌作用仍有待于进一步明确,但其在正常组织中的分布有限而在某些肿瘤组织高度表达的特征,因而mesothelin可作为肿瘤特异性抗体治疗的靶向。
嵌合抗原受体(chimericantigenreceptor-tcell,car-t)t细胞是指经基因修饰后,能以mhc非限制性方式识别特定目的抗原,并且持续活化扩增的t细胞。2012年国际细胞治疗协会年会中指出生物免疫细胞治疗已经成为手术、放疗、化疗外的第四种治疗肿瘤的手段,并将成为未来肿瘤治疗必选手段。嵌合抗原受体(car)是car-t的核心部件,赋予t细胞hla非依赖的方式识别肿瘤抗原的能力,这使得经过car改造的t细胞相较于天然t细胞表面受体tcr能够识别更广泛的目标。car的基础设计中包括一个肿瘤相关抗原(tumor-associatedantigen,taa)结合区(通常来源于单克隆抗体抗原结合区域的scfv段),一个胞外铰链区,一个跨膜区和一个胞内信号区。目标抗原的选择对于car的特异性、有效性以及基因改造t细胞自身的安全性来讲都是关键的决定因素。
目前在clinicaltrials.gov注册的抗mesothelincar-t细胞治疗临床试验有10项,主要针对胰腺癌、卵巢癌、胸膜瘤、肺癌以及乳腺癌等恶性肿瘤。在宾夕法尼亚大学开展的i期临床研究中,病人都是在接受过一线治疗后病情进一步发展,并且肿瘤组织表达mesothelin,他们接受了瞬转carmrna的t细胞治疗。这种mesothelin特异性的二代car具有cd3ξ和4-1bb共刺激因子结构域。这些mesothelin特异性的cart存活期短,在两位病人中表现出了抗肿瘤作用,可见mesothelin能够作为cart细胞识别的抗原,并且瞬转mrna的方式也是可行的。另一项宾夕法尼亚大学开展的i期临床研究使用的是慢病毒转染的mesothelin特异性car。这项开始于2014年7月的研究是针对耐化疗的恶性胰腺癌、上皮性卵巢癌和恶性上皮胸膜间皮瘤。在6位病人的早期研究结果中,4位病人在cart细胞输注28天后病情稳定。cart细胞输注没有引起急性副反应,并且相比mrna瞬转,慢病毒转染构建的cart细胞的持续性得到提升。
pd1(programmeddeath1)最初是在凋亡的t细胞杂交瘤中得到的,由于其和细胞凋亡相关而被命名为程序性死亡1受体。pd1受体表达于t细胞表面和初级b细胞表面,在这些细胞的分化和凋亡中发挥作用。pd1有两个配体,分别是pd-l1(b7-h1)和pd-l2(b7-dc),属于b7家族蛋白(blood.2009.114(8):p.1537-44.)。pd-l1蛋白广泛表达于抗原提呈细胞、活化t、b细胞、巨噬细胞、胎盘滋养层、心肌内皮和胸腺皮质上皮细胞。pd-l1与t细胞上的受体pd1相互作用,在免疫应答的负性调控方面发挥着重要作用。正常情况下,机体遇到外来病原体或抗原侵犯时,抗原提呈细胞捕获抗原,对抗原进行加工使之成为t细胞可以识别的抗原表位,与mhc分子结合并呈现与细胞外侧供t细胞识别。t细胞通过tcr与抗原提呈细胞的mhc分子结合,另外共刺激信号cd28受体与初始t细胞表面的b7-1(cd80)或b7-2(cd86)结合,t细胞接到正向调控信号,初始t细胞活化为效应t细胞,启动免疫应答。当有持续抗原刺激时,为避免应答过度,活化t细胞表面表达pd1,与抗原提呈细胞表面的pd-l1结合,向t细胞传递负向调控信号,t细胞增殖减少或凋亡。研究发现,在许多人类肿瘤组织中均可检测到pd-l1蛋白的表达,肿瘤部位的微环境可诱导肿瘤细胞上pd-l1的表达,表达的pd-l1和t细胞表面的pd1结合抑制t细胞抗肿瘤活性,从而使肿瘤细胞逃避机体免疫系统的监视和清除,有利于肿瘤的发生和生长。
pd1/pd-l1通路抑制剂可以阻断pd1与pd-l1的结合,阻断负向调控信号,使t细胞恢复活性,从而增强免疫应答。pd1/pdl1通路抑制剂主要包括anti-pd1或anti-pd-l1单抗。2014年7月,施贵宝的opdivo率先在日本获批用于治疗晚期黑色素瘤,成为全球首个批准上市的pd1抑制剂。这是pd1抑制剂首次在iii期临床实验中显示生存期疗效,其和化疗药达卡巴嗪相比1年生存率73%对42%,应答率40%对14%,且不良反应有所降低。而美国默克的keytruda(pembrolizumab)2014年9月以一项非常规的有1000病人参与的大型i期临床实验结果以首个pd-1抑制剂身份成功登陆美国市场,其被批准用于治疗无法手术切除或已经出现转移且对其他药物无应答的晚期黑色素瘤患者(nengljmed.2013jul11;369(2):134-44.)。
虽然复方组合前景广阔,但目前的抗肿瘤药治疗窗口普遍较窄,联合用药的效果仍难以预测,严重制约了pd1作用的发挥。car-t细胞的快速发展则为此提供了新的契机。car-t细胞靶向性强、特异性高,在受到肿瘤抗原刺激后可快速大量增殖,由此可能受到抑制性信号的限制,从而使其抗肿瘤能力大打折扣。若能阻断t细胞表面抑制性受体pd1,则能使car-t细胞摆脱束缚,充分发挥肿瘤杀伤效应。基于此,将car-t细胞和阻断pd1/pd-l1信号联合应用的策略迅速得到了研究者们的关注(oncoimmunology.2014dec21;3(11):e970027.)。
宾夕法尼亚大学edmundmoon教授和他所带领的团队针对这一联合应用策略开展了一系列研究。在ny-eso-1为抗原靶点的tcr-t细胞杀伤肿瘤细胞实验时,加入抗pd1抗体,可显著改善t细胞功能减退的现象;相应地,在小鼠皮下移植瘤模型中,tcr-t细胞的肿瘤清除能力有限,而在同时给予pd1抗体处理后,则能达到完全消除肿瘤的目的(clincancerres.2016.22(2):p.436-47.)。同时,该团队利用基因工程技术设计了新一代car-t细胞,即通过病毒载体在car-t细胞中插入一转基因受体pd1cd28,这一结构由pd1的胞外段和共刺激分子cd28的跨膜段及胞内段组成,能在pd1和肿瘤细胞表面配体pd-l1结合后,将pd1/pd-l1抑制信号转变为活化信号,从而为car-t细胞的功能增加动力。此效应在临床前动物模型研究中也得到了成功验证,载入pd1cd28的car-t细胞相比于没有插入pd1cd28的t细胞,能对小鼠肿瘤模型产生较强的免疫反应,增加小鼠的存活率。
以上研究初步表明了car-t细胞和阻断pd1/pd-l1信号联合应用策略在肿瘤治疗中的可行性,我们需要在此基础之上,充分利用现今发展成熟的基因改造技术,实现两者之间的最佳结合。我们专利是以mesothelin抗体的scfv的重链和轻链作为car的结构,为今后的临床实验奠定了好的研发基础。
技术实现要素:
本发明第一方面提供一种多核苷酸序列,所述多核苷酸序列选自:
(1)含有依次连接的抗mesothelin单链抗体的编码序列、人cd8α铰链区的编码序列、人cd8跨膜区的编码序列、人cd28胞内区的编码序列、人41bb胞内区的编码序列、人cd3ζ胞内区的编码序列和抗人pd1单链抗体编码序列的多核苷酸序列;和
(2)(1)所述多核苷酸序列的互补序列。
在一个或多个实施方案中,所述多核苷酸序列在所述抗mesothelin单链抗体的编码序列前还含有信号肽的编码序列。在一个或多个实施方案中,所述信号肽的氨基酸序列如seqidno:1第1-22位氨基酸所示。在一个或多个实施方案中,所述抗mesothelin单链抗体的轻链可变区的氨基酸序列如seqidno:1第23-128位氨基酸所示。在一个或多个实施方案中,所述抗mesothelin单链抗体的重链可变区的氨基酸序列如seqidno:1第141-259位氨基酸所示。在一个或多个实施方案中,所述人cd8α铰链区的氨基酸序列如seqidno:1第260-306位氨基酸所示。在一个或多个实施方案中,所述人cd8跨膜区的氨基酸序列如seqidno:1第307-328位氨基酸所示。在一个或多个实施方案中,所述人cd28胞内区的氨基酸序列如seqidno:1第329-369位氨基酸所示。在一个或多个实施方案中,所述人41bb胞内区的氨基酸序列如seqidno:1第370-417位氨基酸所示。在一个或多个实施方案中,所述人cd3ζ胞内区的氨基酸序列如seqidno:1第381-491位氨基酸所示。在一个或多个实施方案中,所述人p2a的氨基酸序列如seqidno:1第529-554位氨基酸所示。在一个或多个实施方案中,所述人il-2信号肽的氨基酸序列如seqidno:1第555-574位氨基酸所示。在一个或多个实施方案中,所述抗pd1单链抗体的重链可变区的氨基酸序列如seqidno:1第575-687位氨基酸所示。在一个或多个实施方案中,所述抗pd1单链抗体的轻链可变区的氨基酸序列如seqidno:1第703-809位氨基酸所示。
在一个或多个实施方案中,在所述抗mesothelin单链抗体的编码序列前的所述信号肽的编码序列如seqidno:2第1-66位核苷酸序列所示。在一个或多个实施方案中,所述抗mesothelin单链抗体的轻链可变区的编码序列如seqidno:2第67-384位核苷酸序列所示。在一个或多个实施方案中,所述抗mesothelin单链抗体的重链可变区的编码序列如seqidno:2第421-777位核苷酸序列所示。在一个或多个实施方案中,所述人cd8α铰链区的编码序列如seqidno:2第778-918位核苷酸序列所示。在一个或多个实施方案中,所述人cd8跨膜区的编码序列如seqidno:2第919-984位核苷酸序列所示。在一个或多个实施方案中,所述人cd28胞内区的编码序列如seqidno:2第985-1107位核苷酸序列所示。在一个或多个实施方案中,所述人41bb胞内区的编码序列如seqidno:2第1108-1251位核苷酸序列所示。在一个或多个实施方案中,所述人cd3ζ胞内区的编码序列如seqidno:2第1252-1584位核苷酸序列所示。在一个或多个实施方案中,所述人p2a的编码序列如seqidno:2第1585-1662位核苷酸序列所示。在一个或多个实施方案中,所述人il-2信号肽的编码序列如seqidno:2第1663-1722位核苷酸序列所示。在一个或多个实施方案中,所述抗pd1单链抗体的重链可变区的编码序列如seqidno:2第1723-2061位核苷酸序列所示。在一个或多个实施方案中,所述抗pd1单链抗体的轻链可变区的编码序列如seqidno:2第2107-2427位核苷酸序列所示。
本发明第二方面提供一种融合蛋白,所述融合蛋白选自:
(1)含有依次连接的抗mesothelin单链抗体、人cd8α铰链区、人cd8跨膜区、人cd28胞内区、人41bb胞内区、人cd3ζ胞内区、和抗人pd1单链抗体的融合蛋白;和
(2)在(1)限定的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸且保留活化t细胞活性的由(1)衍生的融合蛋白;
优选地,所述抗mesothelin单链抗体为抗mesothelin单克隆抗体ss1。
在一个或多个实施方案中,所述多核苷酸序列在所述抗mesothelin单链抗体的编码序列前还含有信号肽的编码序列。在一个或多个实施方案中,所述信号肽的氨基酸序列如seqidno:1第1-22位氨基酸所示。在一个或多个实施方案中,所述抗mesothelin单链抗体的轻链可变区的氨基酸序列如seqidno:1第23-128位氨基酸所示。在一个或多个实施方案中,所述抗mesothelin单链抗体的重链可变区的氨基酸序列如seqidno:1第141-259位氨基酸所示。在一个或多个实施方案中,所述人cd8α铰链区的氨基酸序列如seqidno:1第260-306位氨基酸所示。在一个或多个实施方案中,所述人cd8跨膜区的氨基酸序列如seqidno:1第307-328位氨基酸所示。在一个或多个实施方案中,所述人cd28胞内区的氨基酸序列如seqidno:1第329-369位氨基酸所示。在一个或多个实施方案中,所述人41bb胞内区的氨基酸序列如seqidno:1第370-417位氨基酸所示。在一个或多个实施方案中,所述人cd3ζ胞内区的氨基酸序列如seqidno:1第381-491位氨基酸所示。在一个或多个实施方案中,所述人p2a的氨基酸序列如seqidno:1第529-554位氨基酸所示。在一个或多个实施方案中,所述人il-2信号肽胞内区的氨基酸序列如seqidno:1第555-574位氨基酸所示。在一个或多个实施方案中,所述抗pd1单链抗体的重链可变区的氨基酸序列如seqidno:1第575-687位氨基酸所示。在一个或多个实施方案中,所述抗pd1单链抗体的轻链可变区的氨基酸序列如seqidno:1第703-809位氨基酸所示。
本发明第三方面提供一种核酸构建物,所述核酸构建物含有本文所述的多核苷酸序列。
在一个或多个实施方案中,所述核酸构建物为载体。在一个或多个实施方案中,所述核酸构建物为逆转录病毒载体,含有复制起始位点,3’ltr,5’ltr,本文所述的多核苷酸序列,以及任选的可选择的标记。
本发明第四方面提供一种逆转录病毒,所述逆转录病毒含有本文所述的核酸构建物,优选含有所述载体,更优选含有所述逆转录病毒载体。
本发明第五方面提供一种基因修饰的t细胞,所述细胞含有本文所述的多核苷酸序列,或含有本文所述的核酸构建物,或感染了本文所述的逆转录病毒,或稳定表达本文所述的融合蛋白。
本发明第六方面提供一种含本文所述的基因修饰的t细胞的药物组合物。
本发明第七方面提供本文所述的多核苷酸序列、融合蛋白、核酸构建物或逆转录病毒在制备活化的t细胞中的应用。
本发明第八方面提供本文所述的多核苷酸序列、融合蛋白、核酸构建物、逆转录病毒、或基因修饰的t细胞或其药物组合物在制备治疗mesothelin介导的疾病的药物中的用途。
在一个或多个实施方案中,优选地,所述mesothelin介导的疾病为卵巢癌、胸膜间皮瘤、胰腺癌,以及宫颈、头、颈、阴道、肺及食管的鳞癌,优选为恶性胸膜间皮瘤、胰腺癌、卵巢癌及肺癌。
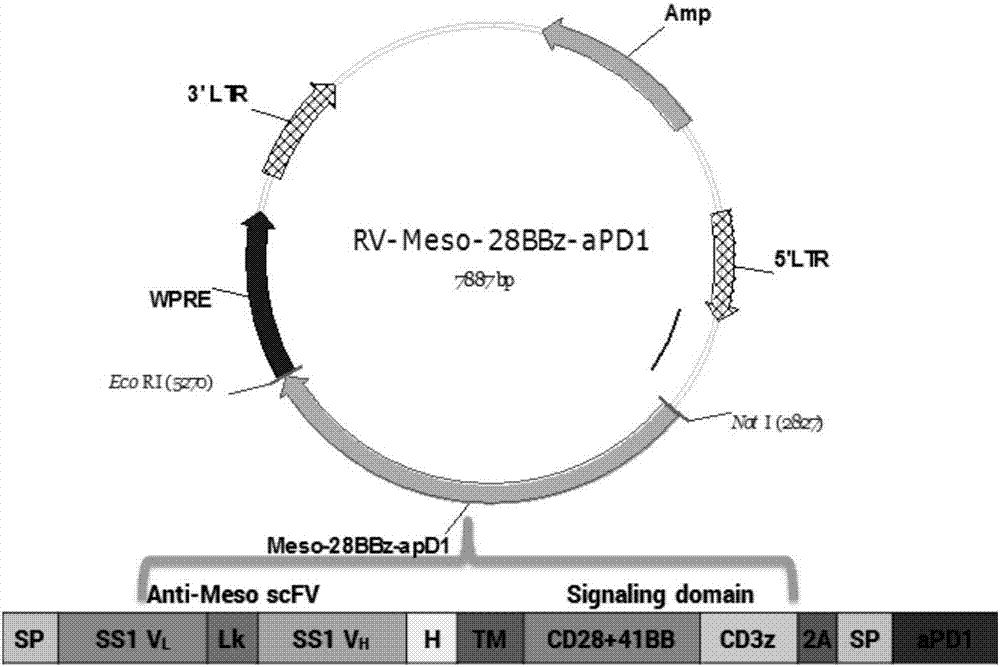
附图说明
图1为rv-mesothelin-apd1-car逆转录病毒表达载体示意图。sp:信号肽;vl:轻链可变区;lk:接头(g4s)3;vh:重链可变区;h:cd8α铰链区;tm:cd8跨膜区。
图2为rv-mesothelincar-apd1逆转录病毒表达质粒的部分测序结果峰值图
图3为流式细胞仪显示逆转录病毒感染t细胞72小时的mesothelin-apd1car-t表达效率
图4293t-pd1细胞与mesothelin-28bbz-apd1病毒孵育30min后染anti-humanfab结果
图5为制备5天的mesothelin-tegfrcar-t/mesothelin-apd1car-t细胞与靶细胞共培养5小时cd107a表达
图6为制备5天的mesothelin-tegfrcar-t/mesothelin-apd1car-t与靶细胞共培养24小时后car-t表面pd1表达
图7为制备5天的mesothelin-tegfrcar-t/mesothelin-apd1car-t细胞与靶细胞共培养16小时后对肿瘤细胞的杀伤作用
具体实施方式
本发明提供一种靶向mesothelin的嵌合抗原受体(car)。该car含有依次连接的抗mesothelin单链抗体、人cd8α铰链区、人cd8跨膜区、人cd28胞内区、人41bb胞内区、人cd3ζ胞内区和抗人pd1单链抗体的片段。
适用于本发明的抗mesothelin单链抗体可衍生自本领域周知的各种抗meso(ss1)单克隆抗体。
适用于本发明的抗间皮素单链抗体可衍生自本领域周知的各种抗间皮素单克隆抗体。优选的是,这些单克隆抗体特异性识别间皮素第296到390位氨基酸区段。
因此,在某些实施方案中,适用于本发明的抗间皮素单链抗体含有特异性识别人间皮素的第296到390位氨基酸区段的单克隆抗体的轻链可变区和重链可变区。任选地,所述轻链可变区和重链可变区可通过接头序列连接在一起。可举例的这类单链抗体包括但不限于yp218fv-pe38、yp223和ss1。在某些实施方案中,所述单克隆抗体是ss1。
形成本发明的融合蛋白,如抗间皮素单链抗体的轻链可变区和重链可变区、人cd8α铰链区、人cd8跨膜区、人cd28胞内区、41bb和人cd3ζ胞内区等,相互之间可直接连接,或者可通过接头序列连接。接头序列可以是本领域周知的适用于抗体的接头序列,例如含g和s的接头序列。通常,接头含有一个或多个前后重复的基序。例如,该基序可以是gggs、ggggs、ssssg、gsgsa和ggsgg。优选地,该基序在接头序列中是相邻的,在重复之间没有插入氨基酸残基。接头序列可以包含1、2、3、4或5个重复基序组成。接头的长度可以是3~25个氨基酸残基,例如3~15、5~15、10~20个氨基酸残基。在某些实施方案中,接头序列是多甘氨酸接头序列。接头序列中甘氨酸的数量无特别限制,通常为2~20个,例如2~15、2~10、2~8个。除甘氨酸和丝氨酸来,接头中还可含有其它已知的氨基酸残基,例如丙氨酸(a)、亮氨酸(l)、苏氨酸(t)、谷氨酸(e)、苯丙氨酸(f)、精氨酸(r)、谷氨酰胺(q)等。
应理解,在基因克隆操作中,常常需要设计合适的酶切位点,这势必在所表达的氨基酸序列末端引入了一个或多个不相干的残基,而这并不影响目的序列的活性。为了构建融合蛋白、促进重组蛋白的表达、获得自动分泌到宿主细胞外的重组蛋白、或利于重组蛋白的纯化,常常需要将一些氨基酸添加至重组蛋白的n-末端、c-末端或该蛋白内的其它合适区域内,例如,包括但不限于,适合的接头肽、信号肽、前导肽、末端延伸等。因此,本发明的融合蛋白(即所述car)的氨基端或羧基端还可含有一个或多个多肽片段,作为蛋白标签。任何合适的标签都可以用于本文。例如,所述的标签可以是flag,ha,ha1,c-myc,poly-his,poly-arg,strep-tagii,au1,ee,t7,4a6,ε,b,ge以及ty1。这些标签可用于对蛋白进行纯化。
本发明也包括seqidno:1第22-491位氨基酸序列所示的car、seqidno:1第22-809位氨基酸序列所示的car、seqidno:1第1-491位氨基酸序列所示的car或seqidno:1所示的car的突变体。这些突变体包括:与该car具有至少80%,优选至少85%,优选至少90%,优选至少95%,优选至少97%的序列相同性并保留该car的生物学活性(如活化t细胞)的氨基酸序列。可采用例如ncbi的blastp计算两条比对的序列之间的序列相同性。
突变体还包括:在seqidno:1第22-491位所示的氨基酸序列、seqidno:1第22-809位所示的氨基酸序列、seqidno:1第1-491位所示的氨基酸序列或seqidno:1所示的氨基酸序列中具有一个或数个突变(插入、缺失或取代)、同时仍保留该car的生物学活性的氨基酸序列。所述数个突变通常指1-10个以内,例如1-8个、1-5个或1-3个。取代优选是保守性取代。例如,在本领域中,用性能相近或相似的氨基酸进行保守性取代时,通常不会改变蛋白质或多肽的功能。“性能相近或相似的氨基酸”包括例如,具有相似侧链的氨基酸残基的家族,这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-分支侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)和具有芳香侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,在本发明多肽中用来自同一侧链类的另一氨基酸残基替换一个或几个位点,将不会在实质上影响其活性。
本发明包括编码本发明融合蛋白的多核苷酸序列。本发明的多核苷酸序列可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。本发明也包括编码融合蛋白的多核苷酸序列的简并变异体,即编码相同的氨基酸序列但核苷酸序列有所不同的核苷酸序列。
本文所述的多核苷酸序列通常可以用pcr扩增法获得。具体而言,可根据本文所公开的核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。例如,在某些实施方案中,编码本文所述融合蛋白的多核苷酸序列如seqidno:2第67-1107位核苷酸所示,或如seqidno:2第1-1107位核苷酸所示。
除此之外,可通过p2a多肽的编码序列将所述信号肽的编码序列与本发明car中人cd3ζ胞内区的编码序列相连。在一个或多个实施方案中,所述p2a肽的氨基酸序列如seqidno:1第529-554位氨基酸所示。
本发明也涉及核酸构建物,该核酸构建物含有本文所述的多核苷酸序列,以及与这些序列操作性连接的一个或多个调控序列。本发明所述的多核苷酸序列可以多种方式被操作以保证所述融合蛋白(car)的表达。在将核酸构建物插入载体之前可根据表达载体的不同或要求而对核酸构建物进行操作。利用重组dna方法来改变多核苷酸序列的技术是本领域已知的。
调控序列可以是合适的启动子序列。启动子序列通常与待表达蛋白的编码序列操作性连接。启动子可以是在所选择的宿主细胞中显示转录活性的任何核苷酸序列,包括突变的、截短的和杂合启动子,并且可以从编码与该宿主细胞同源或异源的胞外或胞内多肽的基因获得。调控序列也可以是合适的转录终止子序列,由宿主细胞识别以终止转录的序列。终止子序列与编码该多肽的核苷酸序列的3’末端操作性连接。在选择的宿主细胞中有功能的任何终止子都可用于本发明。调控序列也可以是合适的前导序列,对宿主细胞翻译重要的mrna的非翻译区。前导序列与编码该多肽的核苷酸序列的5′末端可操作连接。在选择的宿主细胞中有功能的任何终止子都可用于本发明。
在某些实施方案中,所述核酸构建物是载体。通常通过可操作地连接本发明的多核苷酸序列至启动子,并将构建体并入表达载体,实现本发明多核苷酸序列的表达。该载体对于复制和整合真核细胞可为合适的。典型的克隆载体包含可用于调节期望核酸序列表达的转录和翻译终止子、起始序列和启动子。
本发明的多核苷酸序列可被克隆入许多类型的载体。例如,可被克隆入质粒、噬菌粒、噬菌体衍生物、动物病毒和粘粒。进一步地,载体是表达载体。表达载体可以以病毒载体形式提供给细胞。病毒载体技术在本领域中是公知的并在例如sambrook等(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)和其他病毒学和分子生物学手册中进行了描述。可用作载体的病毒包括但不限于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒和慢病毒。
通常,合适的载体包含在至少一种有机体中起作用的复制起点、启动子序列、方便的限制酶位点和一个或多个可选择的标记(例如,wo01/96584;wo01/29058;和美国专利号6,326,193)。
例如,在某些实施方案中,本发明使用逆转录病毒载体,该逆转录病毒载体含有复制起始位点,3’ltr,5’ltr,pis包装信号,酶切位点,土拨鼠肝炎病毒转录后调节元件,本文所述的多核苷酸序列,以及任选的可选择的标记。所述土拨鼠肝炎病毒转录后调节元件可增强病毒转录物的稳定性。
合适的启动子的一个例子为即时早期巨细胞病毒(cmv)启动子序列。该启动子序列是能够驱动可操作地连接至其上的任何多核苷酸序列高水平表达的强组成型启动子序列。合适的启动子的另一个例子为延伸生长因子-1α(ef-1α)。然而,也可使用其他组成型启动子序列,包括但不限于类人猿病毒40(sv40)早期启动子、小鼠乳癌病毒(mmtv)、人免疫缺陷病毒(hiv)长末端重复(ltr)启动子、momulv启动子、鸟类白血病病毒启动子、eb病毒即时早期启动子、鲁斯氏肉瘤病毒启动子、以及人基因启动子,诸如但不限于肌动蛋白启动子、肌球蛋白启动子、血红素启动子和肌酸激酶启动子。进一步地,也可考虑使用诱导型启动子。诱导型启动子的使用提供了分子开关,其能够在期限表达时打开可操作地连接诱导型启动子的多核苷酸序列的表达,而在当表达是不期望的时关闭表达。诱导型启动子的例子包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
为了评估car多肽或其部分的表达,被引入细胞的表达载体也可包含可选择的标记基因或报道基因中的任一个或两者,以便于从通过病毒载体寻求被转染或感染的细胞群中鉴定和选择表达细胞。在其他方面,可选择的标记可被携带在单独一段dna上并用于共转染程序。可选择的标记和报道基因两者的侧翼都可具有适当的调节序列,以便能够在宿主细胞中表达。有用的可选择标记包括例如抗生素抗性基因,诸如neo等等。
报道基因用于鉴定潜在转染的细胞并用于评价调节序列的功能性。在dna已经被引入受体细胞后,报道基因的表达在合适的时间下进行测定。合适的报道基因可包括编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶或绿色萤光蛋白基因的基因。合适的表达系统是公知的并可利用已知技术制备或从商业上获得。
将基因引入细胞和将基因表达入细胞的方法在本领域中是已知的。载体可通过在本领域中的任何方法容易地引入宿主细胞,例如,哺乳动物、细菌、酵母或昆虫细胞。例如,表达载体可通过物理、化学或生物学手段转移入宿主细胞。
将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀、脂质转染法、粒子轰击、微注射、电穿孔等等。将感兴趣的多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。将多核苷酸引入宿主细胞的化学手段包括胶体分散系统,诸如大分子复合物、纳米胶囊、微球、珠;和基于脂质的系统,包括水包油乳剂、胶束、混合胶束和脂质体。
将多核苷酸引入宿主细胞的生物学方法包括使用病毒载体,特别是逆转录病毒载体,这已经成为最广泛使用的将基因插入哺乳动物例如人细胞的方法。其他病毒载体可源自慢病毒、痘病毒、单纯疱疹病毒i、腺病毒和腺伴随病毒等等。已经开发了许多基于病毒的系统,用于将基因转移入哺乳动物细胞。例如,逆转录病毒提供了用于基因传递系统的方便的平台。可利用本领域中已知的技术将选择的基因插入载体并包装入逆转录病毒颗粒。该重组病毒可随后被分离和传递至体内或离体的对象细胞。许多反转录病毒系统在本领域中是已知的。在一些实施方案中,使用腺病毒载体。许多腺病毒载体在本领域中是已知的。在一个实施方案中,使用慢病毒载体。
因此,在某些实施方案中,本发明还提供用于活化t细胞的逆转录病毒,该病毒含有本文所述的逆转录病毒载体以及相应的包装基因,如gag、pol和vsvg。
适用于本发明的t细胞可以是各种来源的各种类型的t细胞。例如,t细胞可来源于b细胞恶性肿瘤患者的pbmc。
在某些实施方案中,获得t细胞后,可先用适量的(例如30~80ng/ml,如50ng/ml)的cd3抗体刺激活化,然后在含有适量的(例如30~80iu/ml,如50iu/ml)的il2培养基进行培养备用。
因此,在某些实施方案中,本发明提供一种基因修饰的t细胞,该基因修饰的t细胞含有本文所述的多核苷酸序列,或含有本文所述的逆转录病毒载体,或感染了本文所述的逆转录病毒,或采用本文所述的方法制备得到。
本发明的car-t细胞可经历稳固的体内t细胞扩展并在血液和骨髓中以高水平持续延长的时间量,并形成特异性记忆t细胞。不希望被任何具体的理论所束缚,在遇到并随后消除表达替代抗原的靶细胞后,本发明的car-t细胞可体内分化成中心记忆样状态。
本发明还包括一类细胞疗法,其中t细胞被基因修饰以表达本文所述的car和任选的anti-pd1,和car-t细胞被注入需要其的接受者中。注入的细胞能够杀死接受者的肿瘤细胞。不像抗体疗法,car-t细胞能够体内复制,产生可导致持续肿瘤控制的长期持久性。
由car-t细胞引起的抗肿瘤免疫应答可为主动或被动免疫应答。另外,car介导的免疫应答可为过继免疫疗法步骤的一部分,其中car-t细胞诱导对car中的抗原结合部分特异性的免疫应答。
因此,可采用本发明的car、其编码序列、核酸构建物、表达载体、病毒以及car-t细胞治疗的疾病优选为间皮素介导的疾病。
具体而言,本文中,“间皮素介导的疾病”尤其包括各种类型的卵巢癌、胸膜间皮瘤(如上皮性间皮瘤)、胰腺癌,以及宫颈、头、颈、阴道、肺及食管的鳞癌。在某些实施方案中,所述间皮素介导的疾病为恶性胸膜间皮瘤、胰腺癌、卵巢癌及肺癌。
本发明的car-修饰的t细胞可被单独施用或作为药物组合物与稀释剂和/或与其他组分诸如相关的细胞因子或细胞群结合施用。简单地说,本发明的药物组合物可包括如本文所述的car-t细胞,与一种或多种药学或生理学上可接受载体、稀释剂或赋形剂结合。这样的组合物可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。
本发明的药物组合物可以以适于待治疗(或预防)的疾病的方式施用。施用的数量和频率将由这样的因素确定,如患者的病症、和患者疾病的类型和严重度。
当指出“免疫学上有效量”、“抗肿瘤有效量”、“肿瘤-抑制有效量”或“治疗量”时,待施用的本发明组合物的精确量可由医师确定,其考虑患者(对象)的年龄、重量、肿瘤大小、感染或转移程度和病症的个体差异。可通常指出:包括本文描述的t细胞的药物组合物可以以104至109个细胞/kg体重的剂量,优选105至106个细胞/kg体重的剂量。t细胞组合物也可以以这些剂量多次施用。细胞可通过使用免疫疗法中公知的注入技术(见例如rosenberg等,neweng.j.ofmed.319:1676,1988)施用。对于具体患者的最佳剂量和治疗方案可通过监测患者的疾病迹象并因此调节治疗由医学领域技术人员容易地确定。
对象组合物的施用可以以任何方便的方式进行,包括通过喷雾法、注射、吞咽、输液、植入或移植。本文描述的组合物可被皮下、皮内、瘤内、结内、脊髓内、肌肉内、通过静脉内注射或腹膜内施用给患者。在一个实施方案中,本发明的t细胞组合物通过皮内或皮下注射被施用给患者。在另一个实施方案中,本发明的t细胞组合物优选通过静脉注射施用。t细胞的组合物可被直接注入肿瘤、淋巴结或感染位置。
在本发明的一些实施方案中,本发明的car-t细胞或其组合物可与本领域已知的其它疗法结合。所述疗法包括但不限于化疗、放疗和免疫抑制剂。例如,可结合本领域周知的治疗间皮素介导的疾病的放疗或化疗制剂进行治疗。
本文中,“抗肿瘤效应”指一种生物学效应,其可由肿瘤体积的减少、肿瘤细胞数的减少、转移数的减少、预期寿命的增加或与癌相关的各种生理症状的改善表示。
“患者”、“对象”、“个体”等等在本文中可交换使用,指可引起免疫应答的活有机体,如哺乳动物。例子包括但不限于人、狗、猫、小鼠、大鼠和其转基因物种。
本发明采用抗间皮素抗体(具体是衍生自ss1的scfv)的基因序列,本发明全基因合成嵌合抗原受体mesothelinscfv-cd8h&tm-cd28-41bb-cd3ζ-pd1的基因片段,插入到逆转录病毒载体mscv,空载体mscv,其可以用于重组引入目的核酸序列,即编码car的核酸序列。重组质粒在293t细胞中包装病毒,感染t细胞,使t细胞表达该嵌合抗原受体。在本发明的一个实施方案中,实现嵌合抗原受体基因修饰的t淋巴细胞的转化方法是基于逆转录病毒转化方法。该方法具有转化效率高,外源基因能够稳定表达,且可以缩短体外培养t淋巴细胞到达临床级数量的时间等优点。在该转基因t淋巴细胞表面,转化的核酸通过转录、翻译表达在其上。本发明所获得的表达car的逆转录病毒通过retronectin法制备car-t细胞,制备3天后的car-t细胞用流式检测car的感染效率,检测上清pd1抗体的表达,制备5天后car-t细胞在体外与mesothelin阳性的肿瘤细胞(skov3和skov3-mesothelin)共培养5小时检测cd107a及pd1表达,制备5天后car-t细胞在体外与mesothelin阳性的肿瘤细胞(skov3和skov3-mesothelin)共培养16小时检测car-t细胞对肿瘤细胞的特异性杀伤作用(细胞毒性)。因此本发明所述mesothelincar-apd1可在间皮瘤、胰腺癌、卵巢癌等治疗中得到应用。
本发明通过参考以下实验实施例进一步详细地进行描述。这些实施例仅出于说明性的目的提供,并不意欲为限制性的,除非另有规定。因此,本发明决不应被解释为限于以下实施例,而是应被解释为包括由于本文提供的教导变得显而易见的任何和全部的变化。实施例中所用的方法和试剂,除非另有说明,否则为本领域常规的方法和试剂。
实施例中所用的nt细胞为与实施例4相同来源的未转染的t细胞,用作对照细胞。k562细胞和来源于atcc细胞库,为阴性表达mesothelin的细胞,用作对照细胞。skov3细胞和来源于atcc细胞库,为阳性表达mesothelin的细胞,用作对照细胞。skov3-mesothelin细胞(简称,skov3-meso)是经遗传工程手段使其高表达mesothelin的skov3稳定细胞株。
实施例1:mesothelincar-apd1基因序列的确定
从ncbi网站数据库搜索到抗mesothelin抗体重链和轻链可变区基因序列信息(ss1),序列在网站http://sg.idtdna.com/site上进行密码子优化,保证在编码氨基酸序列不变的情况下更适合人类细胞表达。
各氨基酸和基因序列信息见seqencelisting(sequnceidno.1-2)
将上述序列依次进行连接,在各序列连接处引入不同酶切位点,形成完整的mesothelincar-apd1基因序列信息。
实施例2:包含car分子的核酸序列的病毒载体的构建
将实施例1中制备的car分子的核苷酸序列经noti(neb)和ecori(neb)双酶切、经t4连接酶(neb)连接插入逆转录病毒rv(mscv)载体的noti-ecori位点,转化到感受态e.coli(dh5α),将重组质粒送上海生工生物技术有限公司进行测序,将测序结果与拟合成的mesocar-apd1序列比对来验证序列是否正确。测序引物为:
正义序列:agcatcgttctgtgttgtctc(sequnceidno.3)
反义序列:tgtttgtcttgtggcaatacac(sequnceidno.4)
经测序正确后,使用qiagen公司的质粒纯化试剂盒提取并纯化质粒,纯化质粒的质粒磷酸钙法转染293t细胞进行逆转录病毒包装实验。
本实施例所构建得到的质粒图谱如图1所示。图2显示该逆转录病毒表达质粒的部分测序结果峰值图。
实施例3:逆转录病毒包装
1.第1天293t细胞应是小于20代,不过分长满的。以0.6*10^6cells/ml铺板,10cm皿添加10ml的dmem培养基,充分混匀细胞,37度培养过夜;
2.第2天293t细胞融合度达到90%左右进行转染(通常是铺板14-18h左右);准备质粒复合物,各种质粒的量为retrobackbone为12.5ug,gag-pol为10ug,vsvg为6.25ug,cacl2250ul,h2o为1ml总体积为1.25ml;在另一个管里添加跟质粒复合物等体积的hbs,边加质粒复合物边涡旋震荡20s。温柔地将混合物沿着边加入到293t皿中,37度培养4h,去除培养基,pbs洗一遍,重新加入预热的新鲜培养基。
3.第4天:转染48h后收集上清并用0.45um滤器过滤后分装保存于-80度,继续添加预热的新鲜dmem培养基。
实施例4:逆转录病毒感染人的t细胞
1.用ficcol分离液(天津灏洋)分离获得较纯的cd3+t细胞,用含5%ab血清x-vivo(lonza)培养基调整细胞密度为1×106/ml。将细胞以1ml/孔接种到预先用抗人50ng/mlcd3抗体(北京同立海元)和50ng/mlcd28抗体(北京同立海元),再加入100iu/ml的白细胞介素2(北京双鹭),刺激培养48小时后病毒感染;
2.t细胞活化培养后隔天,pbs稀释至终浓度为15μg/ml的retronectin(takara)包被non-tissuetreated培养板,24孔板每孔250μl。避光,4℃过夜备用。
3.t细胞活化培养两天后,取出2块包被好的24孔板,吸弃包被液,加入含2%bsa的hbss室温封闭30min。封闭液体积为每孔500μl,吸弃封闭液,用含2.5%hepes的hbss洗板两次。
4.病毒液加入孔内,每孔加2ml病毒液,32℃,2000g,离心2h。
5.弃去上清液,24孔板每孔加入活化后的t细胞1×106个,体积1ml,培养基为t细胞培养基中添加il-2200iu/ml。30℃,1000g,离心10min。
6.离心完毕后,将培养板置于37℃,5%co2培养箱中培养。
7.感染后24h,将细胞悬液吸出,1200rpm,4℃,离心7min。
8.细胞感染后,每天观察细胞的密度,适时补加含il-2100iu/ml的t细胞培养液,使t细胞的密度维持在5×105/ml左右,使细胞扩增。
实施例5:流式细胞仪检测感染后t淋巴细胞的比例及表面car蛋白的表达
分别离心收集感染后72小时的car-t细胞和nt细胞(对照组),pbs洗涤1次后弃上清,加入相应的抗体避光30min后pbs洗涤,重悬,最后流式细胞仪检测。car+由anti-mouseiggf(ab')antibody(jacksonimmunoresearch)和apc-antiegfr抗体检测。
本实施例结果在图3显示,使用实施例3制备得到的逆转录病毒感染t细胞72小时后,mesothelin-apd1car+的表达效率达58.31%,mesothelin-tegfrcar+的表达效率达65.61%。
实施例6:流式检测病毒中分泌pd1抗体的表达
mesothelin-tegfr/mesothelincar-apd1病毒分别与293t-pd1(本公司制备的过表达pd1的细胞)孵育30min,再用anti-humanfab染色30min后上机检测。
本实施例结果如图4显示,流式结果检测到可分泌的anti-pd1表达率为96.3%。
实施例7:car-t细胞与靶细胞共培养后cd107a表达检测
1.取一块v底96孔板,每孔加car-t/nt细胞2*105个和靶细胞(skov3和skov3-meso)/对照细胞(k562)2*105个,重悬为100ul不含il-2的x-vivo完全培养基,加入bdgolgistop(含monesin,每1ml培养基中加入1μlbdgolgistop),每孔加入2ulcd107a抗体(1:50),37℃孵育5小时,收集细胞。
2.将样品离心去除培养基,pbs洗细胞一次,400g,4℃离心5分钟。弃上清,每管加入适量特异性表面抗体car、cd3、cd4、cd8,重悬体积100ul,冰上避光孵育30分钟。
3.每管用3ml的pbs清洗细胞1次,400g离心5分钟。仔细吸去上清。
4.适量pbs重悬,流式细胞仪检测car、cd3、cd4、cd8、cd107a。
本实施例结果显示在图5中。图5显示,mesothelin-tegfrcar-t细胞和mesothelin-apd1car-t细胞在与靶细胞共培养后,mesothelin-tegfrcar-t与两种靶细胞共培养cd107a表达达到60%左右,而mesothelin-apd1car-t细胞cd107a表达则达到70%左右。
实施例8:car-t细胞与靶细胞共培养后表面pd1表达检测
1.取一块v底96孔板,每孔加car-t/nt细胞2*105个和靶细胞(skov3和skov3-meso),设置加k562细胞组为阴性对照,重悬为100ul含il-2的x-vivo完全培养基,37℃孵育24小时和48小时,收集细胞。
2.将样品离心去除培养基,pbs洗细胞一次,400g,4℃离心5分钟。弃上清,每管加入适量特异性表面抗体cd3、car、pd1,重悬体积100ul,冰上避光孵育30分钟。
3.每管用3ml的pbs清洗细胞1次,400g离心5分钟。仔细吸去上清。
4.适量pbs重悬,流式细胞仪检测cd3、pd1,分析cd3+细胞群中pd1表达情况。
本实施例结果显示在图6中。图6显示,car-t与靶细胞共培养后表面pd1都有明显提高。
实施例9:car-t细胞与靶细胞共培养后检测肿瘤特异性细胞杀伤作用
1.k562细胞(阴性对照细胞)重悬在无血清培养基(1640)中,调整细胞浓度为1×106/ml,加入荧光染料bmqc(2,3,6,7-tetrahydro-9-bromomethyl-1h,5hquinolizino(9,1-gh)coumarin)至终浓度为5μm。
2.混匀,37℃孵育30min。
3.室温,1500rpm离心5min,弃上清,并重悬细胞于细胞毒性培养基(无酚红1640+5%ab血清)中,37℃孵育60min。
4.新鲜细胞毒性培养基清洗细胞两遍,并重悬在新鲜细胞毒性培养基中,密度1×106/ml。
5.靶细胞(skov3和skov3-meso)悬浮在含有0.1%bsa的pbs中,调整浓度为1×106/ml。
6.加入荧光染料cfse(carboxyfluoresceindiacetatesuccinimidylester)至终浓度为1μm。
7.混匀,37℃孵育10min。
8.孵育结束后,加入与细胞悬液等体积的fbs,室温孵育2min以终止标记反应。
9.清洗细胞并重悬在新鲜细胞毒性培养基中,密度1×106/ml。
10.清洗效应t细胞并悬浮在细胞毒性培养基中,调整浓度为5×106/ml。
11.在所有的实验中,car-t细胞的细胞毒性和未感染的阴性对照效应t细胞(nt)的细胞毒性做比较。
12.car-t和nt,按照效应细胞:靶细胞=5:1,1:1,的比例,于5ml无菌试验管(bdbiosciences)进行培养,每组设置两复孔。每一个共培养组中,靶细胞50,000个(50μl),阴性对照细胞为50,000个(50μl)。同时设置一组只包含靶细胞和阴性对照细胞。
13.将共培养细胞置于37℃孵育16h。
14.孵育完成后,pbs清洗细胞,然后立即按照说明书推荐的浓度快速加入7-aad(7-aminoactinomycind),冰上孵育30min。
15.不需清洗,直接进行流式上机检测,数据用flowjo进行分析。
16.分析使用7aad阴性的活细胞设门,测定t细胞和靶细胞共培养后活的u266靶细胞和活的k562阴性对照细胞的比例。
17.对于每一组共培养的t细胞和靶细胞
18.细胞毒性杀伤细胞%=100-校准的靶细胞存活%,即(无效应细胞时靶细胞活细胞数-含效应细胞时靶细胞活细胞数)/对照细胞活细胞数的比例。
本实施例结果显示在图7中。图6显示,效靶比为e:t=5:1时,meso-apd1car-t对两种靶细胞杀伤都在20%左右。
序列表
<110>上海恒润达生生物科技有限公司
<120>靶向mesothelin的嵌合抗原受体并联合表达抗pd1抗体的方法及其用途
<170>patentinversion3.3
<210>1
<211>809
<212>prt
<213>人工序列
<400>1
metasppheglnvalglnilepheserpheleuleuileseralaser
151015
valilemetserargglyaspilegluleuthrglnserproalaile
202530
metseralaserproglyglulysvalthrmetthrcysseralaser
354045
serservalsertyrmethistrptyrglnglnlysserglythrser
505560
prolysargtrpiletyraspthrserlysleualaserglyvalpro
65707580
glyargpheserglyserglyserglyasnsertyrserleuthrile
859095
serservalglualagluaspaspalathrtyrtyrcysglnglntrp
100105110
serlyshisproleuthrpheglycysglythrlysleugluilelys
115120125
glyglyglyserglyglyglyserglyglyglyserglnvalglnleu
130135140
glnglnserglyprogluleuglulysproglyalaservallysile
145150155160
sercyslysalaserglytyrserphethrglytyrthrmetasntrp
165170175
vallysglnserhisglylyscysleuglutrpileglyleuilethr
180185190
protyrasnglyalasersertyrasnglnlyspheargglylysala
195200205
thrleuthrvalasplysserserserthralatyrmetaspleuleu
210215220
serleuthrsergluaspseralavaltyrphecysalaargglygly
225230235240
tyraspglyargglypheasptyrtrpglyglnglythrthrvalthr
245250255
valserserthrthrthrproalaproargproprothrproalapro
260265270
thrilealaserglnproleuserleuargproglualacysargpro
275280285
alaalaglyglyalavalhisthrargglyleuaspphealacysasp
290295300
iletyriletrpalaproleualaglythrcysglyvalleuleuleu
305310315320
serleuvalilethrleutyrcysargserlysargserargleuleu
325330335
hisserasptyrmetasnmetthrproargargproglyprothrarg
340345350
lyshistyrglnprotyralaproproargaspphealaalatyrarg
355360365
serlyspheservalvallysargglyarglyslysleuleutyrile
370375380
phelysglnprophemetargprovalglnthrthrglnglugluasp
385390395400
glycyssercysargpheproglugluglugluglyglycysgluleu
405410415
argvallyspheserargseralaaspalaproalatyrglnglngly
420425430
glnasnglnleutyrasngluleuasnleuglyargarggluglutyr
435440445
aspvalleuasplysargargglyargaspproglumetglyglylys
450455460
proargarglysasnproglngluglyleutyrasngluleuglnlys
465470475480
asplysmetalaglualatyrsergluileglymetlysglygluarg
485490495
argargglylysglyhisaspglyleutyrglnglyleuserthrala
500505510
thrlysaspthrtyraspalaleuhismetglnalaleuproproarg
515520525
argalalysargglyserglyalathrasnpheserleuleulysgln
530535540
alaglyaspvalglugluasnproglypromettyrargmetglnleu
545550555560
leusercysilealaleuserleualaleuvalthrasnserglnval
565570575
glnleuvalgluserglyglyglyvalvalglnproglyargserleu
580585590
argleuaspcyslysalaserglyilethrpheserasnserglymet
595600605
histrpvalargglnalaproglylysglyleuglutrpvalalaval
610615620
iletrptyraspglyserlysargtyrtyralaaspservallysgly
625630635640
argphethrileserargaspasnserlysasnthrleupheleugln
645650655
metasnserleuargalagluaspthralavaltyrtyrcysalathr
660665670
asnaspasptyrtrpglyglnglythrleuvalthrvalsersergly
675680685
glyglyglyserglyglyglyglyserglyglyglyglysergluile
690695700
valleuthrglnserproalathrleuserleuserproglygluarg
705710715720
alathrleusercysargalaserglnservalsersertyrleuala
725730735
trptyrglnglnlysproglyglnalaproargleuleuiletyrasp
740745750
alaserasnargalathrglyileproalaargpheserglysergly
755760765
serglythraspphethrleuthrileserserleugluprogluasp
770775780
phealavaltyrtyrcysglnglnserserasntrpproargthrphe
785790795800
glyglnglythrlysvalgluilelys
805
<210>2
<211>2427
<212>dna
<213>人工序列
<400>2
atggacttccaggtgcagatttttagttttcttttgatctccgccagcgtgataatgtca60
cgaggagatatagagctcacccagagtcccgcaatcatgtcagcctctcccggcgaaaaa120
gtgaccatgacctgtagtgcttccagttctgttagttatatgcactggtatcaacagaag180
tccgggacaagtcctaaacgctggatttatgacacttccaaactggcttctggagtgcct240
gggcggttcagcgggagcggttccggtaactcttacagcctgaccatctcttcagtcgaa300
gctgaagacgatgccacgtattattgccagcaatggagtaagcacccactgacatttggg360
tgcgggaccaagcttgaaataaagggtggcggcagcgggggcggaagcggcgggggaagc420
caggtgcaacttcagcaatcaggtcccgagttggaaaagccgggagccagcgttaagatc480
tcatgcaaagctagcggctactctttcacaggatataccatgaattgggtcaagcaaagc540
catggaaaatgtttggaatggatcggactgattaccccctacaacggggccagctcctac600
aatcagaaatttaggggtaaggccactctcacagtggataaaagctcaagtactgcctat660
atggacctgcttagtctgacctcagaggatagtgccgtgtacttttgtgccagaggcggt720
tacgacgggcgagggtttgactactgggggcaggggacgacggttactgtgtctagtacg780
acaactcccgctccccggcctcccacccctgccccaactattgcctcccagcctctttcc840
ttgcgccccgaagcctgcaggcccgcagctgggggcgctgtgcatacaaggggtctcgac900
ttcgcatgcgacatctacatttgggcacccttggccgggacctgtggagtgctcctcctc960
agcctggtgatcacactgtactgcaggtccaaaagatctaggctgctgcattctgattac1020
atgaacatgacgccgcgccgccctggtccaaccagaaagcattatcagccctatgcaccc1080
cctagagactttgccgcctatcgttcgaagttcagtgtcgtgaagagaggccggaagaag1140
ctgctgtacatcttcaagcagcctttcatgaggcccgtgcagactacccaggaggaagat1200
ggatgcagctgtagattccctgaagaggaggaaggaggctgtgagctgagagtgaagttc1260
tcccgaagcgcagatgccccagcctatcagcagggacagaatcagctgtacaacgagctg1320
aacctgggaagacgggaggaatacgatgtgctggacaaaaggcggggcagagatcctgag1380
atgggcggcaaaccaagacggaagaacccccaggaaggtctgtataatgagctgcagaaa1440
gacaagatggctgaggcctactcagaaatcgggatgaagggcgaaagaaggagaggaaaa1500
ggccacgacggactgtaccaggggctgagtacagcaacaaaagacacctatgacgctctg1560
cacatgcaggctctgccaccaagaagagctaagcgcggctcaggcgcgaccaacttttct1620
ctgcttaagcaggcaggcgacgtggaagagaaccccgggcccatgtacagaatgcagctg1680
ttgtcttgtattgccctttctctcgccctcgtaacaaattcacaagtccaattggtggag1740
tctggcggtggggtagttcagcccggccgatccctgcgcctggactgcaaagcttctgga1800
attacgttctcaaactccggaatgcactgggtgcggcaagcacctgggaaagggctggag1860
tgggttgcggtgatttggtacgatggctctaagaggtactacgcagacagcgttaaaggc1920
agatttactatatcccgagataactctaaaaatacgctcttcctccaaatgaatagcctg1980
agggcagaagacacagccgtttactattgtgctaccaatgatgattactggggacagggc2040
accctggttaccgtaagttccggcggtggtggaagtggaggagggggatccggaggcggg2100
ggttctgagatcgtcctgacccagtctccagccactctctccctgtctccaggcgagcgc2160
gctacactgagttgtagagcttcccagtccgtgagcagctatctggcctggtatcagcag2220
aagcctgggcaggctccacggttgctgatttatgacgcctccaaccgcgcgactgggata2280
ccagctaggttttccggatcaggcagcggcactgattttacactgaccatctcatctctc2340
gagccggaagatttcgccgtttactattgtcaacagagttcaaactggccacggacattc2400
ggtcaggggaccaaggttgaaattaag2427
<210>3
<211>21
<212>dna
<213>人工序列
<223>引物
<400>3
agcatcgttctgtgttgtctc21
<210>4
<211>22
<212>dna
<213>人工序列
<223>引物
<400>4
tgtttgtcttgtggcaatacac22
- 还没有人留言评论。精彩留言会获得点赞!