3‑苄氧基‑四氢吡喃及其制备方法、单一构型的四氢吡喃‑3‑环醇的制备方法与流程
本发明涉及3-苄氧基-四氢吡喃及其制备方法、单一构型的四氢吡喃-3-环醇的制备方法,属于医药技术领域。
背景技术:
四氢吡喃-3-环醇是一种重要的医药中间体,具有重要的用途,例如可以用于合成mnk1和mnk2激酶抑制剂,抑制人体肺腺癌细胞增殖并诱导其凋亡;也可以用于合成葡萄糖激酶抑制剂的合成,治疗糖尿病;还可以用于合成atr激酶抑制剂的合成,应用于肿瘤治疗领域;四氢吡喃-3-环醇作为医药中间体具有重要的应用前景和商业价值。
外消旋体四氢吡喃-3-环醇的合成相对简单,已有很多文献报道,例如可以用3,4-二氢吡喃作为原料,采用便宜的商业化试剂如硼烷二甲硫醚,通过硼氢化-氧化反应得到(heterocycles,2011,82,1267-1282)。然而单一构型的四氢吡喃-3(s)-环醇和四氢吡喃-3(r)-环醇的合成较为困难,目前少有报道,文献报道的方法主要通过手性硼试剂还原,然后氧化得到。二十世纪八十年代中后期,brown等人(j.organomet.chem.1988,341,73-81)通过多年努力,以3,4-二氢吡喃为原料,采用手性硼试剂(+)-二异松蒎烯基硼烷进行还原,得到83%ee的含硼中间体,通过和氨基酸形成硼酸酯结晶后可达99%ee,然后用过氧化氢氧化可以得到高光学活性的四氢吡喃-3(r)-环醇。这些研究虽然得到了高光学纯度四氢吡喃-3-环醇,但手型硼试剂,价格昂贵,对空气和水稳定性差,保存困难,不适合大规模生产。
技术实现要素:
本发明的第一个目的在于提供3-苄氧基-四氢吡喃,用来制备单一构型的四氢吡喃-3-环醇。
本发明第二个目的在于提供一种上述3-苄氧基-四氢吡喃的制备方法。
本发明第三个目的在于提供一种单一构型的四氢吡喃-3-环醇的制备方法,以解决现有技术中单一构型的四氢吡喃-3-环醇难以制备、成本高的技术问题。
为实现上述目的,本发明的技术方案是:
一种3-苄氧基-四氢吡喃,具有式ⅰ或式ⅱ所示的结构,
上述3-苄氧基-四氢吡喃的制备方法,包括以下步骤:
1)在氮气保护下,将式ⅲ或式ⅳ所示的2-苄氧基-戊烷-1,5-二醇溶解到第一
有机溶剂中,然后加入有机碱和催化剂,得溶液a;
2)向步骤1)所得溶液a中加入酸酐溶液,0~50℃反应5~120min,反应结
束后分离提纯即得;
步骤1)中所述第一有机溶剂为二氯甲烷、1,2-二氯乙烷、三氯甲烷、四氢呋喃、乙腈、1,4-二氧六环中的任意一种。上述第一有机溶剂优选二氯甲烷。
步骤1)中将式ⅲ或式ⅳ所示的2-苄氧基-戊烷-1,5-二醇溶解到第一有机溶剂中,使2-苄氧基-戊烷-1,5-二醇的浓度为0.01~0.5mol/l。优选为0.25mol/l。
步骤1)中所述有机碱为三乙胺、n,n-二异丙基乙胺中的任意一种或两种。
所述有机碱与2-苄氧基-戊烷-1,5-二醇的物质的量之比2.0~10.0。所述有机碱与2-苄氧基-戊烷-1,5-二醇的物质的量之比进一步优选为3.0。
步骤1)中催化剂为4-二甲氨基吡啶。所述4-二甲氨基吡啶与2-苄氧基-戊烷-1,5-二醇的物质的量之比为0~3.0。
步骤2)中反应温度优选为20~25℃。反应时间优选为20min。
步骤2)中所述分离提纯是在反应结束后加入碳酸氢钠,搅拌5~30min,之后浓缩,加入第三有机溶剂溶解,过滤,滤液经洗涤、干燥、浓缩即得。
所述碳酸氢钠与2-苄氧基-戊烷-1,5-二醇的物质的量之比为2~5。
所述第三有机溶剂为无水乙醚、甲基叔丁基醚、石油醚、正己烷、正庚烷、乙酸乙酯、二氯甲烷、丙酮中的任意一种。优选石油醚。所述洗涤为用饱和氯化钠洗涤。所述干燥为采用无水硫酸钠干燥。所述浓缩为减压浓缩。
步骤2)中所述酸酐溶液是将三氟甲磺酸酐或甲磺酸酐溶于第二有机溶剂得到的;所述第二有机溶剂为二氯甲烷、1,2-二氯乙烷、三氯甲烷、四氢呋喃、乙腈、1,4-二氧六环中的任意一种。上述酸酐优选三氟甲磺酸酐。上述第二有机溶剂优选二氯甲烷。
步骤2)酸酐溶液中酸酐与2-苄氧基-戊烷-1,5-二醇的物质的量之比为1.0~2.0。优选为1.0。
上述第二有机溶剂体积与第一有机溶剂体积相同。
所述式ⅲ或式ⅳ所示的2-苄氧基-戊烷-1,5-二醇由包括以下步骤的制备方法制得:
1)将l-谷氨酸或d-谷氨酸与亚硝酸钠溶液于室温反应18h,后经减压浓缩加入甲醇、浓盐酸加热回流24h,再经洗涤、浓缩、过柱得中间化合物a;
2)将ag2o分散到乙酸乙酯中,然后加入化合物a的乙酸乙酯溶液,室温反应30min,加入溴化苄继续反应48h,所得反应体系经分离、纯化得化合物b;
3)将lialh4分散到无水乙醚中,降温至0℃,氩气保护下加入化合物b的无水乙醚溶液,室温反应48h,将反应体系降至0℃萃取纯化即得。
一种单一构型的四氢吡喃-3-环醇的制备方法,包括以下步骤:
将上述单一构型的3-苄氧基-四氢吡喃溶解到第四有机溶剂中,加入还原剂,将体系抽真空后,通入氢气,保持氢气压力在0.5-2个大气压,于25-60℃反应12-72h,反应完毕后,过滤,滤液浓缩,过柱即得。
所述抽真空具体为用水泵减压抽真空,抽真空后通入氢气。
上述减压抽真空和通入氢气的步骤重复三次。
所述第四有机溶剂为无水甲醇、异丙醇、乙醇、乙酸乙酯、四氢呋喃、1,4-二氧六环中的任意一种或几种。优选无水甲醇和乙酸乙酯的混合溶剂。
所述还原剂为氢氧化钯、钯碳、雷尼镍中的任意一种。优选氢氧化钯。
上述反应时间优选16h。
上述氢气压力优选1个大气压。
上述过滤优选硅藻土过滤。
上述过柱所用洗脱溶剂为石油醚、乙酸乙酯的混合液。所述石油醚与乙酸乙酯的体积比为50:1~3:1。
本发明单一构型的3-苄氧基-四氢吡喃,通过将单一构型的2-苄氧基-戊烷-1,5-二醇通过酸酐催化分子内醚化、一步关环反应生成。
本发明单一构型的四氢吡喃-3-环醇的制备方法,通过将单一构型的3-苄氧基-四氢吡喃氢解脱苄基得到光学纯度值大于97%的四氢吡喃-3(s)-环醇和四氢吡喃-3(r)-环醇中间体,合成方法简单,条件温和,成本低廉,适合大规模生产。
附图说明
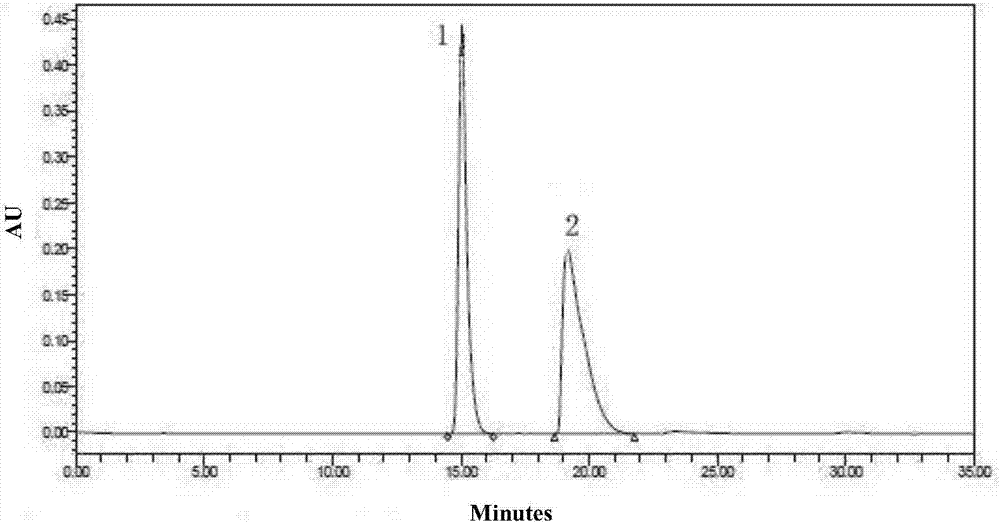
图1为(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯的hplc图谱;
图2为混合构型的(e)-四氢-2h-吡喃-3-肉桂酸酯的hplc图。
具体实施方式
实施例1
s-2-苄氧基-戊烷-1,5-二醇的合成:
将l-谷氨酸60g(0.41mol)溶解到120ml浓盐酸中,加入60ml水,降温至-5℃,在此温度下滴加亚硝酸钠溶液,亚硝酸钠溶液是将42g(0.62mol)亚硝酸钠溶解于40ml水中得到的,将亚硝酸钠溶液滴加完毕后升到室温,反应18h,反应结束后将反应液减压浓缩,温度低于50℃,残留物用乙酸乙酯洗涤,合并有机相,用无水硫酸钠干燥,再次减压浓缩后直接加入到300ml无水甲醇中,加入0.3ml浓盐酸,加热回流24h,反应结束后降到室温,加入乙酸乙酯600ml,用饱和碳酸氢钠200ml洗2次,饱和氯化钠溶液洗3次,无水硫酸钠干燥后减压浓缩,过柱,过柱时以乙酸乙酯和石油醚为洗脱剂进行梯度洗脱,其中乙酸乙酯与石油醚的体积比变化范围为1:20~1:1,过柱后可以得到化合物a,为无色油状物(58g,0.33mol);在氩气保护下,将ag2o87g(0.375mol)(ag2o经80℃真空干燥4h)分散到300ml乙酸乙酯中,缓慢滴加化合物a的乙酸乙酯溶液(将44g即0.25mol的化合物a溶解于300ml乙酸乙酯所得),滴加完毕后室温反应30分钟,加入溴化苄43ml(0.375mol),继续反应48h。反应结束后,反应体系用硅藻土过滤,滤液浓缩过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为10:1~3:1,过柱后得化合物b,为无色油状物(52g,0.195mol),收率78%。
将lialh411.4g(0.3mol)分散到无水乙醚800ml中,降温至0℃,氩气保护下滴加化合物b的无水乙醚溶液(将40g即0.15mol的化合物b溶解于800ml的无水乙醚中所得),滴加完毕后升至室温反应48h,将反应体系降温至0℃,依次滴加乙酸乙酯800ml、水600ml、naoh水溶液(4m)150ml,乙醚萃取两次,合并有机相,无水硫酸钠干燥后浓缩,过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为为5:1~1:2,过柱后得式ⅲ所示化合物,为无色油状物(26.8g,0.128mol),收率85%。
实施例2
(s)-3-苄氧基-四氢吡喃的合成:
将21g(0.1mol)实施例1中合成的s-2-苄氧基-戊烷-1,5-二醇溶解于400ml第一有机溶剂二氯甲烷中,氩气保护下,加入有机碱et3n30.3g(0.3mol),4-二甲氨基吡啶0.1mol,缓慢滴加三氟甲磺酸酐的二氯甲烷溶液,温度控制在20℃,三氟甲磺酸酐的二氯甲烷溶液为将28.2g即0.1mol的三氟甲磺酸酐溶解于400ml第二有机溶剂二氯甲烷而得,滴加完毕后,保持该温度下反应20分钟,加入固体碳酸氢钠25.2g(0.3mol),搅拌30分钟后,过滤浓缩,加入第三有机溶剂石油醚200ml,用饱和氯化溶液洗涤,硫酸钠干燥,浓缩后过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为100:1~1:20,过柱后得式ⅰ所示化合物(9.4g,49mmol),为无色油状物,收率49%。1hnmr(400mhz,cdcl3,ppm):δ=7.34-7.26(m,5h),4.60-4.54(m,2h),3.91-3.89(m,1h),3.75-3.71(m,1h),3.49-3.55(m,3h),2.05-2.01(m,1h),1.82-1.77(m,1h),1.62-1.53(m,2h).13cnmr(100mhz,cdcl3,ppm):138.6,128.4,127.6,72.6,70.6,70.5,68.0,29.3,24.0.gc-ms(ei,m/z):[m]+192.0。
实施例3
四氢吡喃-3(s)-环醇的合成:
将6.3g(30mmol)实施例2所得式ⅰ所示化合物溶于60ml第四有机溶剂无水甲醇中,加入630mgpd(oh)2,将体系用真空水泵减压抽真空后,通入氢气,减压和通入氢气的步骤重复三次,保持氢气压力在0.5个大气压,升温至40℃反应18h,反应结束后用硅藻土过滤,滤液浓缩过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为50:1~3:1,过柱后得2.5g(24.5mmol)化合物1,为无色油状物,收率为82%。
实施例4
r-2-苄氧基-戊烷-1,5-二醇的合成:
r-2-苄氧基-戊烷-1,5-二醇的合成方法与实施例1中s-2-苄氧基-戊烷-1,5-二醇的合成方法的区别仅在于,将l-谷氨酸替换为d-谷氨酸。1hnmr(400mhz,cdcl3,ppm):δ=7.35-7.29(m,5h),4.72(d,j=11.2hz,1h),4.40(d,j=11.6hz,1h),4.02-4.00(m,1h),3.75(s,3h),3.63(s,3h),2.47-2.44(m,2h),2.17-2.02(m,2h).13cnmr(100mhz,cdcl3,ppm):173.2,172.6,137.3,128.4,128.1,127.9,76.5,72.4,51.9(d,j=2.5hz),51.6(d,j=2.1hz),29.6,27.9,lc-ms(esi,m/z):[m+h]+267.2,[m+na]+289.1。
实施例5
(r)-3-苄氧基-四氢吡喃的合成:
(r)-3-苄氧基-四氢吡喃的合成方法与实施例2(s)-3-苄氧基-四氢吡喃的合成方法的不同仅在于将s-2-苄氧基-戊烷-1,5-二醇替换为r-2-苄氧基-戊烷-1,5-二醇。1hnmr(400mhz,cdcl3,ppm):δ=7.34-7.26(m,5h),4.60-4.54(m,2h),3.91-3.89(m,1h),3.75-3.71(m,1h),3.49-3.55(m,3h),2.05-2.01(m,1h),1.82-1.77(m,1h),1.62-1.53(m,2h).13cnmr(100mhz,cdcl3,ppm):138.6,128.4,127.6,72.6,70.6,70.5,68.0,29.3,24.0.gc-ms(ei,m/z):[m]+192.0。
实施例6
四氢吡喃-3(r)-环醇的合成:
四氢吡喃-3(r)-环醇的合成方法与实施例3四氢吡喃-3(s)-环醇的合成方法不同之处仅在于将(s)-3-苄氧基-四氢吡喃替换为(r)-3-苄氧基-四氢吡喃。1hnmr(400mhz,cdcl3,ppm):δ=3.79-3.73(m,2h),3.65-3.59(m,2h),3.45-3.41(m,1h),3.75-3.71(m,1h),1.99-1.81(m,3h),1.64-1.52(m,2h).13cnmr(100mhz,cdcl3,ppm):72.8,67.9,65.7,31.3,23.0.gc-ms(ei,m/z):[m]+101.9。
实施例7
(s)-3-苄氧基-四氢吡喃的合成:
将21g(0.1mol)实施例1中合成的s-2-苄氧基-戊烷-1,5-二醇溶解于400ml第一有机溶剂1,4-二氧六环中,氩气保护下,加入有机碱1moln,n-二异丙基乙胺,缓慢滴加甲磺酸酐的四氢呋喃溶液,温度控制在0℃,甲磺酸酐溶液为将0.2mol的甲磺酸酐溶解于400ml第二有机溶剂四氢呋喃而得,滴加完毕后,保持该温度下反应120分钟,加入固体碳酸氢钠0.5mol,搅拌30分钟后,过滤浓缩,加入第三有机溶剂正己烷200ml,用饱和氯化溶液洗涤,硫酸钠干燥,浓缩后过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为100:1~1:20,过柱后得式ⅰ所示化合物,为无色油状物。
实施例8
(s)-3-苄氧基-四氢吡喃的合成:
将21g(0.1mol)实施例1中合成的s-2-苄氧基-戊烷-1,5-二醇溶解于400ml第一有机溶剂乙腈中,氩气保护下,加入有机碱0.2moln,n-二异丙基乙胺,0.2mol催化剂4-二甲氨基吡啶,然后缓慢滴加甲磺酸酐的四氢呋喃溶液,温度控制在50℃,甲磺酸酐溶液为将0.1mol的甲磺酸酐溶解于400ml第二有机溶剂1,2-二氯乙烷而得,滴加完毕后,保持该温度下反应5分钟,加入固体碳酸氢钠0.2mol,搅拌30分钟后,过滤浓缩,加入第三有机溶剂丙酮200ml,用饱和氯化溶液洗涤,硫酸钠干燥,浓缩后过柱,过柱时以石油醚和乙酸乙酯液为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为100:1~1:20,得式ⅰ所示化合物,为无色油状物。
实施例9
四氢吡喃-3(s)-环醇的合成:
将6.3g(30mmol)实施例2所得式ⅰ所示化合物溶于60ml第四有机溶剂乙酸乙酯中,加入630mg钯碳,将体系用真空水泵减压抽真空后,通入氢气,减压和通入氢气的步骤重复三次,保持氢气压力在2个大气压,升温至25℃反应72h,反应结束后用硅藻土过滤,滤液浓缩过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为50:1~3:1,过柱后得化合物1,为无色油状物。
实施例10
四氢吡喃-3(s)-环醇的合成:
将6.3g(30mmol)实施例2所得式ⅰ所示化合物溶于60ml第四有机溶剂为无水甲醇与乙酸乙酯体积比为1:1的混合液,加入630mg雷尼镍,将体系用真空水泵减压抽真空后,通入氢气,减压和通入氢气的步骤重复三次,保持氢气压力在1个大气压,升温至60℃反应16h,反应结束后用硅藻土过滤,滤液浓缩过柱,过柱时以石油醚和乙酸乙酯为洗脱剂进行梯度洗脱,其中石油醚与乙酸乙酯的体积比变化范围为50:1~3:1,过柱后得化合物1,为无色油状物。
实验例1
(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯的合成:
将51mg化合物1四氢吡喃-3(s)-环醇(0.5mmol)溶解到3ml二氯甲烷中,加入55mget3n(0.55mmol),4-二甲氨基吡啶dmap(3mg,0.025mmol)氩气保护下降温至0℃,加入92mg肉桂酰氯(0.55mmol)升至室温反应2h。然后加入饱和碳酸氢钠溶液,分离,二氯甲烷相用饱和氯化钠溶液洗,无水硫酸钠干燥后浓缩,过柱得化合物1-a为白色固体(105mg,0.45mmol),收率90%。1hnmr(400mhz,cdcl3,ppm):δ=7.71(d,j=16.0hz,1h),7.54-7.52(m,2h),7.39-7.37(m,3h),6.48(d,j=16.0hz,1h),4.95-4.93(m,1h),3.85-3.81(m,1h),3.70-3.64(m,3h),2.03-1.80(m,3h),1.68-1.59(m,1h).13cnmr(100mhz,cdcl3,ppm):166.3,145.0,134.4,130.3,128.9,128.1,118.2,69.8,68.1,67.9,28.2,23.0..lc-ms(esi,m/z):[m+h]+233.1,[m+na]+255.2。
实验例2
(e)-四氢-2h-吡喃-3-肉桂酸酯的合成与实验例1的不同之处仅在于将化合物1替换为混合构型的四氢吡喃-3-环醇。
实验例3
为更准确地测定四氢吡喃-3(s)-环醇和四氢吡喃-3(r)-环醇的光学纯度分别对实验例1和实验例2所得(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯、(e)-四氢-2h-吡喃-3-肉桂酸酯进行hplc测试。测试条件为仪器:waters1525液相;waters2489紫外检测器;色谱条件:色谱柱:daicelad-h柱(4.6×250mm,5μm);流动相:正己烷-异丙醇=0.9:0.03(正己烷与异丙醇的体积比为0.9:0.03),检测波长:254nm,进样量:10μl,结果如图1和图2所示,其中图1为实验例1所得(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯的hplc图谱、图2为实验例2所得r和s混合构型的(e)-四氢-2h-吡喃-3-肉桂酸酯的hplc图谱。由图2内容可知,r和s两个异构体在hplc中得到较好的分离(峰1为r构型,峰2为s构型),可以作为准确判断光学纯度的依据,相应数据见表2所示。图1中得到的(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯在hplc中的出峰时间为:18.781分钟,如图1中峰2所示,光学纯度为97.54%;其r-构型的异构体出峰时间为15.115,积分面积为2.46%,如图1中峰1所示;具体数据如表1所示;(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯的ee值为:95.08%,从而可以间接的判断得到的式ⅰ化合物及化合物1的ee值>95%。
表1(e)-(s)-四氢-2h-吡喃-3-肉桂酸酯的hplc图谱的相应数据
表2混合构型的(e)-四氢-2h-吡喃-3-肉桂酸酯的hplc图谱的相应数据
- 还没有人留言评论。精彩留言会获得点赞!