一种可视化抗菌肽融合蛋白及其制备方法和其应用与流程
本发明属于基团工程领域,具体地,本发明涉及一种可视化抗菌肽融合蛋白及其制备方法和其应用。
背景技术:
抗菌肽(antibacterialpeptides)是一般由12~50个氨基酸残基组成的阳离子型(含过多的赖氨酸和精氨酸)的两性小分子多肽。在动物、植物和微生物中广泛存在,是宿主免疫防御系统的重要组成部分,其抗菌谱宽、免疫原性低,而且不易产生耐药性的特点及有抑制癌细胞生长的作用,这使得抗菌肽开发利用成为近年来的研究热点。但抗菌肽的开发利用并非易事,抗菌肽天然资源有限,提取非常复杂;化学合成,不但成本很高,还对环境造成严重污染。因此迫切需要一种廉价安全的生产技术来生产抗菌肽。基因工程生产方法可能是最经济的获得大量抗菌肽的方法。
目前抗菌肽基因工程表达主要在大肠杆菌和酵母菌系统中进行。酵母菌表达体系具有直接分泌抗菌肽的能力,易于直接从发酵液中分离抗菌肽,相比大肠杆菌表达体系更易于大规模工业化生产。但是,由于抗菌肽是小分子含有多个碱性氨基酸的碱性多肽,极易受到蛋白酶的攻击。同时表达的产物往往对宿主细胞有毒性,会直接抑制宿主菌的生长,影响表达效率。因此抗菌肽的外源表达较其它多肽类药物更为困难。另外,筛选抗菌肽的高效表达工程菌时,通常采用抗菌肽有特殊的抗菌活性,通过抑菌实验筛选,那么每次就要对成千上万的转化子进行鉴定,先对每个转化子进行初步筛选,利用抗菌筛选抗菌活性相对较高的工程菌,再来进行复筛,这样要消耗大量的人力和物力。因此,如何解决抗菌肽免受蛋白酶的攻击,减少其对宿主细胞的毒害,以及如何筛选高效表达抗菌肽的酵母工程菌成为了抗菌肽事业发展的瓶颈。
技术实现要素:
本发明提供了一种重组融合蛋白his-mapple-dp-ap,所述蛋白包括如下1)或2)所述的蛋白:
1)具有序列表中的seqid№.7所示的氨基酸序列的蛋白质;
2)将序列表中的seqid№.7的氨基酸残基序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有抗菌肽活性的由1)衍生的蛋白质。
序列表中seqid№.7所示的氨基酸序列由262个氨基酸残基组成。
上述1)或2)所述的蛋白可人工合成,也可先合成其编码基因,再进行重组异源表达得到。上述1)或2)所述的蛋白的编码基因可通过将序列表中seqid№.7所示dna序列缺失一个或几个编码氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变后得到。
编码所述蛋白的核酸分子也属于本发明的保护范围。
所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna、hnrna或trna等。
本发明还提供了一种编码基因,所述编码基因具有下述核苷酸序列之一:
1)编码本发明所述蛋白的多核苷酸序列;
2)序列表中seqid№:2所示核苷酸序列;
3)序列表中seqid№:4所示核苷酸序列;
4)序列表中seqid№:5所示核苷酸序列;
5)序列表中seqid№:6所示核苷酸序列;
6)在高严谨条件下可与序列表中seqid№:6限定的dna序列杂交的核苷酸序列;
7)与1)、5)、或6)限定的dna序列具有90%以上同源性,且编码相同功能蛋白质的dna序列。
具体的,所述同源性为95%以上;再具体的为96%以上;再具体的为97%以上;再具体的为98%以上;再具体的为99%以上。
上述高严谨条件可为用6×ssc,0.5%sds的溶液,在65℃下杂交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。
其中,序列表中的seqid№:6由789个核苷酸组成,其开放阅读框架(orf)为自5′末端第1-789位核苷酸,编码序列表中seqid№:7所示的蛋白质,即本发明所述的重组融合蛋白his-mapple-dp-ap;
序列表中的seqid№:2由726个核苷酸组成,其开放阅读框架(orf)为自5′末端第1-726位核苷酸,编码序列表中seqid№:1所示的蛋白质,即本发明所述的添加his纯化标签的红色荧光重组蛋白his-mapple;序列表中的seqid№:2为本发明所述的利用毕赤酵母密码子偏好性优化改造、并添加his纯化标签的红色荧光重组蛋白his-mapple的编码基因的核苷酸序列;
序列表中的seqid№:4由54个核苷酸组成,其开放阅读框架(orf)为自5′末端第1-54位核苷酸,编码序列表中seqid№:3所示的蛋白质,即本发明所述的蜜蜂抗菌肽ap;序列表中的seqid№:4为本发明所述的利用毕赤酵母密码子偏好性优化改造的编码所述蜜蜂抗菌肽ap的核苷酸序列;
序列表中的seqid№:5由60个核苷酸组成,其开放阅读框架(orf)为自5′末端第1-60位核苷酸,编码本发明所述的重组蛋白dp-ap;序列表中的seqid№:5为本发明所所述添加了dp二肽的基因编码序列的经毕赤酵母密码子偏好性优化改造的编码所述蜜蜂抗菌肽ap的核苷酸序列。
本发明还提供了一种载体、表达盒、转基因细胞系、重组菌、和/或微生物,所述载体、表达盒、转基因细胞系、重组菌、和/或微生物含有所述的编码基因。
所述重组载体可为重组表达载体,也可为重组克隆载体。
所述重组菌的出发菌株包括大肠杆菌、酵母菌、芽孢杆菌、和/或乳酸杆菌。
所述酵母菌包括毕赤酵母、酿酒酵母、啤酒酵母细胞、和/或多型逊酵母细胞。
所述重组表达载体可用现有的表达载体构建。所述表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3’端。使用所述基因构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,它们可单独使用或与其它的启动子结合使用;此外,使用本发明的基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子。为了便于对重组菌进行鉴定及筛选,可对所用表达载体进行加工,如加入在宿主菌中表达具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)。也可不加任何选择性标记基因,直接以逆境筛选转化菌株。
所述重组表达载体的出发载体具体为ppic9和/或pyes2质粒;所述重组菌的出发菌株具体为毕赤酵母gs115和/或酿酒酵母invsc1;
所述重组表达载体具体为ppic9-his-mapple-dp-ap和/或pyes2-his-mapple-dp-ap;所述重组菌具体为pp-ppic9-his-mapple-dp-ap和/或sc-pyes2-his-mapple-dp-ap。
扩增本发明所述编码基因全长或其任意片段的引物对也属于本发明保护的范围。
本发明还提供了一种酵母菌株,保藏号为cgmccno.14227。
本发明还提供了一种蛋白的制备方法,所述方法包括:
1)制备本发明所述的编码基因;
2)制备包含步骤1)所述编码基因的重组表达载体;
3)使步骤2)所述表达载体表达以获得目的蛋白。
所述方法还包括所述目的蛋白的酸切割。
本发明还提供了一种蛋白的制备方法,所述方法包括:
1)发酵本发明所述的重组菌、和/或微生物;
2)从发酵液中提取目标蛋白。
所述方法还包括所述目标蛋白的酸切割。
本发明的另一个目的是提供一种筛选产抗菌肽产品、筛选具抗菌肽相关活性的产品、降低抗菌肽降解几率和/或增强抗菌肽相关活性的方法,所述方法包括:将所述抗菌肽与荧光蛋白连接。
具体的,所述将抗菌肽与荧光蛋白连接包括:将抗菌肽的编码基因与荧光蛋白的编码基因连接后,再连接到表达载体中,将所述表达载体导入微生物中并使其表达即得;
再具体的,所述连接将抗菌肽与荧光蛋白连接包括:所述抗菌肽的编码基因通过dp二肽的编码基因与荧光蛋白的编码基因连接;
所述筛选包括根据所述荧光蛋白的颜色筛选,所述颜色越深表示产抗菌肽的产量越大和/或具有的抗菌肽相关活性越强;所述荧光蛋白包括红色荧光蛋白mapple;再具体的,所述红色荧光蛋白mapple的氨基酸序列为将序列表中seqidno.1所示的氨基酸序列的5’端去除6个组氨酸后的氨基酸序列;所述所述颜色包括粉色;
所述产品包括载体、表达盒、转基因细胞系、重组菌、和/或微生物。
本发明还提供了所述的蛋白、所述的编码基因、所述的重组载体、表达盒、转基因细胞系、重组菌、和/或微生物、所述引物对、所述菌株、所述制备方法、和/或所述方法的应用。
具体的,所述应用包括在如下1)-13)至少一种中的应用:
1)在制备抗菌肽相关产品中的应用;
2)在制备抗菌肽突变体和/或含有抗菌肽突变体相关产品中的应用;
3)在制备重组抗菌肽和/或含有重组抗菌肽相关产品中的应用;
4)在制备抗菌肽融合蛋白、和/或含有抗菌肽融合蛋白相关产品中的应用;
5)作为抗菌肽和/或制备具有抗菌肽活性相关产品中的应用;
6)在抗菌中的应用;
7)在制备应用于工业、农业、食品、医药、饲料、能源、废物处理和/或环境保护领域中的产品中的应用;
8)在工业、农业、食品、医药、饲料、能源、废物处理和/或环境保护领域中的应用;
9)在筛选产抗菌肽和/或具抗菌相关活性产品中的应用;
10)在制备可筛选产抗菌肽和/或具抗菌活性相关产品中的应用;
11)在提高抗菌肽产量和/或制备可提高抗菌肽产量的产品中的应用;
12)在增强抗菌肽抗菌活性和/或制备可增强抗菌活性的产品中的应用;
13)在降低抗菌肽降解几率和/或制备可降低抗菌肽降解几率的产品中的应用。
具体的,所述筛选包括,根据产品颜色筛选,所述颜色越深表示产抗菌肽的产量越大和/或具有的抗菌相关活性越强;所述颜色包括粉色;所述产品包括载体、表达盒、转基因细胞系、重组菌、和/或微生物;
具体的,所述抗菌包括抗革兰氏阴性菌;
所述抗菌肽包括蜜蜂抗菌肽;再具体的,所述抗菌肽的氨基酸序列如为序列表中seqidno.3所示氨基酸序列;所述抗菌肽突变体包括将所述抗菌肽经点突变后所获得的蛋白;所述重组抗菌肽包括将所述抗菌肽编码基因经同源重组后获得的蛋白,和/或经本发明所述任一蛋白制备方法制备得到的蛋白。
本发明提供的方法包括采用红色荧光蛋白和抗菌肽建成融合蛋白,使其属于同一个基因中,同时在红色荧光蛋白和抗菌肽之间引入dp二肽酸切割位点,在分泌表达融合蛋白后,将融合蛋白切割成红色荧光蛋白和抗菌肽。
本发明的优点主要有:第一、本发明大大降低了抗菌肽被降解的可能性,可以提高抗菌肽的表达量;第二、融合标签红色荧光蛋白在毕赤酵母中可视化呈现鲜亮的红色,从而可以通过颜色深浅判断融合蛋白的表达量,便于快速筛选工程菌;第三、融合标签红色荧光蛋白不会影响抗菌肽的抑菌活性,可以直接用于工业化应用;第四、若想得到单一的抗菌肽蛋白,通过调节酸ph即可实现,操作简单,成本低廉。因此该方法一举多得,具有很好的应用前景。
附图说明
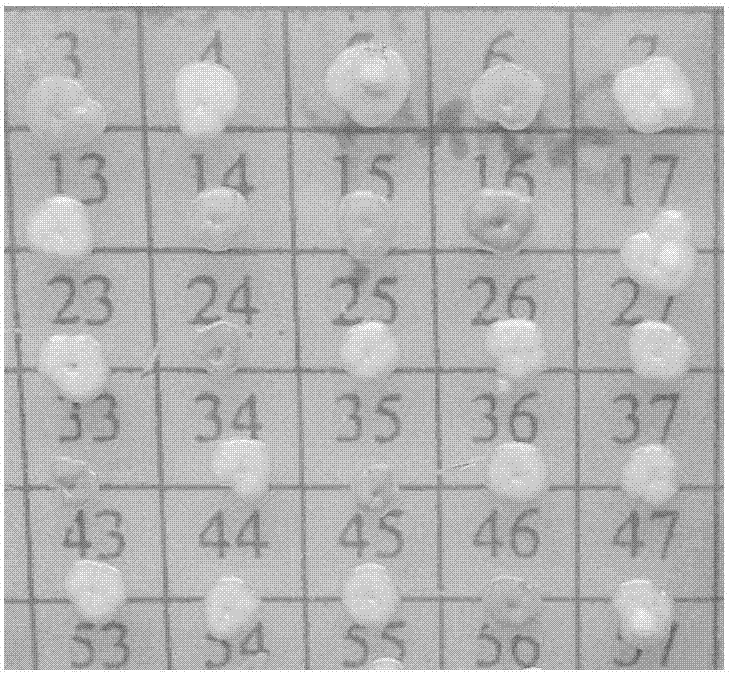
图1为毕赤酵母转化菌株在mm平板上的生长结果图。
图2为毕赤酵母菌株表达的纯化的重组融合蛋白his-mapple-dp-ap抑菌活性的测定结果图。
图3为酿酒酵母菌株sc-pyes2-his-mapple-dp-ap的发酵液上清的抑菌活性的测定结果图。
图4为毕赤酵母中纯化的重组融合蛋白his-mapple-dp-ap酸解后的tricine-sds-page电泳分析图。
图5为酿酒酵母中纯化的重组融合蛋白his-mapple-dp-ap酸解后的tricine-sds-page电泳分析图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
实施例1、红色荧光蛋白mapple基因获得及序列分析
根据基因mapple的已知序列,利用毕赤酵母密码子偏好性,在不改变其氨基酸序列的前提下进行序列优化改造,并在5’端添加his纯化标签,送公司合成序列。红色荧光蛋白mapple含有有236个氨基酸,加上6个组氨酸,总共242个氨基酸,成熟蛋白理论分子量28kda,所述的添加his纯化标签的红色荧光重组蛋白his-mapple的氨基酸序列如序列表中seqidno.1所示;
所述的利用毕赤酵母密码子偏好性优化改造、并添加his纯化标签的红色荧光重组蛋白his-mapple的编码基因的核苷酸序列如序列表中seqidno.2所示。
根据所述红色荧光重组蛋白his-mapple的编码基因序列设计引物:mapple-f1、mapple-f2和mapple-ap-r,同时在引物mapple-f1的末端引入酶切位点xhoⅰ,引物mapple-f2的末端引入酶切位点ecorⅰ,所述引物的核苷酸序列如表1所示。
以人工合成的红色荧光重组蛋白his-mapple的编码基因即具有序列表中seqidno.2所示核苷酸序列的核酸片段为模板,以mapple-f1、mapple-ap-r为引物进行pcr扩增,所得pcr产物命名为pcr产物a。
以人工合成的红色荧光重组蛋白his-mapple的编码基因即具有序列表中seqidno.2所示核苷酸序列的核酸片段为模板,以mapple-f2、mapple-ap-r为引物进行pcr扩增,所得pcr产物命名为pcr产物b。
pcr反应参数为:95℃5min;94℃30sec,55℃30sec,72℃60sec,32个循环;72℃10min。pcr产物纯化试剂盒纯化pcr产物。
表1
实施例2、蜜蜂抗菌肽ap前体的基因及dp二肽酸切割位点的合成
根据蜜蜂抗菌肽ap基因的已知序列,根据毕赤酵母密码子偏好性,在不改变其氨基酸序列的前提下进行核苷酸序列优化改造,并在其5’端添加dp二肽的基因编码序列:gaccca,送公司合成所述核苷酸序列。蜜蜂抗菌肽ap总共有18个氨基酸,成熟蛋白理论分子量2.2kda,所述的抗菌肽ap的氨基酸序列如seqidno.3所示;
所述的利用毕赤酵母密码子偏好性优化改造的编码所述蜜蜂抗菌肽ap的核苷酸序列如序列表中seqidno.4所示。
所述添加了dp二肽的基因编码序列的经毕赤酵母密码子偏好性优化改造的编码所述蜜蜂抗菌肽ap的核苷酸序列如序列表中seqidno.5所示,将该具有序列表中seqidno.5所示核苷酸序列的核酸片段命名为融合基因dp-ap,其编码的蛋白命名为重组蛋白dp-ap。
根据所述dp-ap融合基因的核苷酸序列设计引物:ap-mapple-f和ap-r,同时在引物ap-r的末端引入酶切位点notⅰ,所述引物的核苷酸序列如表2所示。以人工合成的所述dp-ap融合基因为模板,进行pcr扩增。pcr反应参数为:95℃5min;94℃30sec,55℃30sec,72℃30sec,32个循环;72℃10min。pcr产物纯化试剂盒纯化pcr产物。
表2
其中引物ap-mapple-f与mapple-ap-r之间有24个以上的互补碱基能互补配对,从而为后续基因的融合提供便利。
实施例3、融合基因his-mapple-dp-ap的获得
以上述实施例1获得的pcr产物a和实施例2所获得的pcr产物为共同模板,以mapple-f1和ap-r为引物进行pcr扩增。
以上述实施例1获得的pcr产物b和实施例2所获得的pcr产物为共同模板,以mapple-f2和ap-r为引物进行pcr扩增。
pcr反应参数为:95℃5min;94℃30sec,55℃30sec,72℃90sec,32个循环;72℃10min。pcr产物纯化试剂盒纯化pcr产物。
上述pcr扩增产物测序结果表明,上述pcr扩增得到的两种核酸片段分别包括xhoi、notⅰ双酶切位点和ecorⅰ、notⅰ双酶切位点,分别命名为his-mapple-dp-ap-1和his-mapple-dp-ap-2,上述两种核酸片段的两个酶切位点中间为具有序列表中seqid№:6所示核苷酸序列的核酸片段,将该具有序列表中seqid№:6所示核苷酸序列的核酸片段命名为融合基因his-mapple-dp-ap,编码序列表中seqid№:7所示的氨基酸序列,共262个氨基酸残基,将该具有序列表中seqid№:7所示氨基酸序列的蛋白命名为融合蛋白his-mapple-dp-ap。
实施例4、毕赤酵母融合表达载体的构建及转化
(一)毕赤酵母融合表达载体的构建
利用xhoi和notⅰ将实施例3制备的融合基因his-mapple-dp-ap-1进行双酶切处理,同时将ppic9质粒用相同的限制性内切酶notⅰ和xhoi进行双酶切处理。
酶切体系为:
37℃保温1.5h后,电泳回收融合基因his-mapple-dp-ap-1片段和质粒载体,并进行基因连接,转化大肠杆菌dh5α感受态细胞,得到融合表达载体,并利用酶切验证的方法挑选出阳性克隆子,进一步通过测序验证序列的正确性,用于下一步的转化。经测序验证,所述融合表达载体插入的外源基因序列为序列表中seqid№:6所示核苷酸序列,将该融合表达载体命名为ppic9-his-mapple-dp-ap。
(二)重组表达载体的线性化
(1)线性化的质粒更容易整和到毕赤酵母染色体中,所以先要使重组体质粒线性化。取100μl大提质粒ppic9-his-mapple-dp-ap用bglii酶切。
酶切体系为:
37℃温浴2-3h,电泳检测是否酶切完全。
(2)将400μl酶切产物依次用等体积的酚:氯仿、氯仿抽提,再加入1/10体积的乙酸钠(ph5.2)及2-3倍体积的无水乙醇沉淀,高速离心,用70%乙醇漂洗,真空干燥,置于-20℃待用
(三)毕赤酵母感受态细胞的制备
(1)挑取ypd平板上的毕赤酵母gs115单菌落于50mlypd液体培养基中,30℃、300rpm摇床过夜;
(2)将摇床过夜的新鲜gs115菌液按1~5/1000比例接种于500mlypd中,30℃、300rpm摇床培养至od600=1.3~1.5;
(3)菌液预冷后转移至预冷的离心管中,4℃、1500×g离心5min,弃上清,菌体用500ml预冷的无菌水重悬;
(4)4℃、1500×g离心5min,菌体用250ml预冷的无菌水重悬;
(5)4℃、1500×g离心5min,菌体用20ml预冷的1mol/l山梨醇溶液重悬;
(6)4℃、1500×g离心5min,菌体用1ml预冷的山梨醇溶液重悬,备用。
(四)电击转化
(1)将线性化的质粒溶于10μl无菌水,取80μl已制备好的感受态细胞与之混合,并将其转至0.2cm冰浴的电转化杯中,冰浴5min;
(2)调整好基因导入仪的参数(置于pic档),电转杯置电击仪电击转化;
(3)立即往转化杯中加入1ml预冷的1mol/l山梨醇溶液;
(4)混匀后涂布于md平板上,每个md平板上约涂200μl~300μl;
(5)倒置于30℃培养箱中培养2~4天,至菌落长出。
实施例5、酿酒酵母重组表达载体的构建及转化
(一)酿酒酵母重组表达载体的构建
利用ecorⅰ和notⅰ将实施例3制备的融合基因his-mapple-dp-ap-2进行双酶切处理,同时将pyes2质粒用相同的限制性内切酶ecorⅰ和notⅰ进行双酶切处理。
酶切体系为:
37℃保温1.5h后,电泳回收his-mapple-dp-ap-2融合基因片段和质粒载体,并进行基因连接,得到融合表达载体,进一步通过测序验证序列的正确性,用于下一步的转化。经测序验证,所述融合表达载体插入的外源基因序列为序列表中seqid№:6所示核苷酸序列,将该融合表达载体命名为pyes2-his-mapple-dp-ap。
(二)酿酒酵母重组表达载体的转化
电击转化融合表达载体pyes2-his-mapple-dp-ap至酿酒酵母invsc1感受态细胞,涂布于固体sc-u平板上,倒置于30℃培养箱中培养2d。
实施例6、抗菌肽表达菌株的筛选
(一)毕赤酵母阳性转化子的筛选及诱导表达
1)用灭过菌的牙签从长有转化子的md板上挑取单菌落,按照编号点到相应编号的mm平板上,每个平板上点100个单菌落。
2)将点有转化子的mm平板置于30℃培养箱中培养1~2天,至菌落长出。
3)根据单克隆的颜色从mm平板上挑取鲜艳红色的转化子,如将图1中16#接种于装有100mlbmgy培养基的250ml三角瓶中,30℃、260rpm摇床培养48h;将阳性重组菌提取质粒测序验证序列的正确性,将测序正确的含有融合表达载体ppic9-his-mapple-dp-ap的重组毕赤酵母菌命名为pp-ppic9-his-mapple-dp-ap。
4)将摇床培养48h的菌液3,000×g离心15min,去上清,三角瓶中再加入50ml含有0.5%甲醇的bmmy培养基,在30℃、260rpm诱导培养。
5)诱导培养48h后,3,000×g离心5min,取上清用于蛋白纯化,并检测抑菌活性。
(二)酿酒酵母阳性转化子的筛选及诱导表达
用灭过菌的牙签从长有转化子的sc-u板上挑取单菌落,用特异性引物mapple-f2和ap-r进行菌落pcr验证,将大小正确的片段所对应的菌液进行dna序列的测定,将测序正确的含有融合表达载体pyes2-his-mapple-dp-ap的重组酿酒酵母菌命名为sc-pyes2-his-mapple-dp-ap。
将测序正确的阳性重组菌sc-pyes2-his-mapple-dp-ap克隆挑到新的sc-u平板继续30℃恒温箱培养2d,同时转接至15mlsc-u液体培养基,30℃恒温摇床,200rpm振荡过夜培养,保存发酵液,并检测抑菌活性。
上述毕赤酵母和酿酒酵母阳性重组菌中的融合表达载体ppic9-his-mapple-dp-ap和pyes2-his-mapple-dp-ap所表达的融合蛋白的氨基酸序列如序列表中seqid№:7所示。
实施例7、抗菌肽活性的测定
先前的研究已经确定蜜蜂抗菌肽ap对革兰氏阴性菌和阳性菌都有很强的抑菌作用,为了进一步验证实施例6制备得到的毕赤酵母表达的纯化的his-mapple-dp-ap融合蛋白和阳性重组酿酒酵母sc-pyes2-his-mapple-dp-ap克隆的发酵液上清同样也具有较高的抗菌活性,利用牛津杯法测定上述样品对大肠杆菌dh5α感受态的抗菌活性。具体地,吸取50μle.colidh5α于5ml液体lb培养基中,过夜活化。第二天测菌液在a600的光吸收值,并将菌液稀释到0.5个麦氏单位(1.5×108cfu/ml)。取200μl上述稀释的菌液,用灭菌的涂布器均匀的涂布于lb固体培养基上,将灭菌的牛津杯轻又平稳的、有序的放在平板表面。
向不同的牛津杯中分别加入实施例6制备得到的毕赤酵母表达的纯化的his-mapple-dp-ap融合蛋白100μl和阳性重组酿酒酵母sc-pyes2-his-mapple-dp-ap克隆的发酵液上清,37℃恒温培养16h,测抑菌圈直径,通过抑菌圈直径的大小来确定重组酵母菌抑菌活性的大小。由图2的结果可以确定,筛选得到的毕赤酵母菌斑中颜色最深的转化子(图1中16#)具有最强的抑菌活性,抑菌圈达到2.1cm(图2中5#)。由图3的结果可以确定,筛选得到的酿酒酵母工程菌的发酵液上清也具有很强的抑菌活性,抑菌圈达到2.2cm(图3中2#)
由此可得知,本发明获得的his-mapple-dp-ap融合蛋白在毕赤酵母和酿酒酵母两种宿主中都成功表达,且酸切割之前就具有抑菌活性,工程菌的发酵液可直接应用于工业。
实施例8、融合蛋白的酸切割
利用冰乙酸对纯化的his-mapple-dp-ap融合蛋白进行酸切割,向体系中添加冰乙酸至终浓度为13%(v/v),50℃水浴处理72h,tricine-sds-page电泳鉴定酸水解结果,结果如图4和图5所示。
图4为毕赤酵母中纯化的重组融合蛋白his-mapple-dp-ap酸解后的tricine-sds-page电泳分析结果图,图中泳道1为酸水解上清;泳道2为酸水解沉淀;泳道3为工程菌ppic9-his-mapple-dp-ap的发酵液上清;泳道5为纯化的重组蛋白his-mapple-dp-ap。
图5为酿酒酵母中纯化的重组融合蛋白his-mapple-dp-ap酸解后的tricine-sds-page电泳分析结果图,图中泳道1为酸水解上清。
由图4(第一泳道1#)和图5(第一泳道1#)的结果可以确定,水解液的上清中含有切割下来的抗菌肽ap蛋白,而由图4(第二泳道2#)的结果可确定,水解液沉淀中只含有切割下来的mapple蛋白。由此抗菌肽实现了切割断裂,实现了与融合标签的分离。
实施例9、工程菌sc-pyes2-his-mapple-dp-ap高密度发酵及融合蛋白产量的测定
根据工程菌株颜色深浅筛选出的一株表达量和抑菌活性均较高(抑菌圈达到2.2cm,图3中2#)的重组酿酒酵母菌sc-pyes2-his-mapple-dp-ap进行保藏,该菌株已于2017年6月9日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏号为cgmccno.14227。
由于酿酒酵母工程菌sc-pyes2-his-mapple-dp-ap(保藏号为cgmccno.14227)的发酵液上清得到的抑菌活性最强,因此选用该菌株进行高密度发酵。以ypl培养基(2%乳糖,2%胰蛋白胨,l%酵母抽提物),通过乳糖作为诱导物,隔24h取样,测定上清液的抑菌活性和蛋白浓度。以5%的接种量,3.7l的发酵罐中,培养72h时,培养液上清的抑菌活性最强,抑菌圈达到2.8cm。进一步,通过lowry方法确定了培养液上清蛋白的浓度达到0.96mg/ml,高于现有报道的0.2mg/ml。
序列表
<110>中国农业科学院饲料研究所
<120>一种可视化抗菌肽融合蛋白及其制备方法和其应用
<160>7
<210>1
<211>242
<212>prt
<213>
<400>1
hishishishishishismetvalserlysglyglugluasnasnmet
151015
alaileilelysgluphemetargphelysvalhismetgluglyser
202530
valasnglyhisgluphegluilegluglygluglygluglyargpro
354045
tyrglualapheglnthralalysleulysvalthrlysglyglypro
505560
leuprophealatrpaspileleuserproglnphemettyrglyser
65707580
lysvaltyrilelyshisproalaaspileproasptyrphelysleu
859095
serpheprogluglypheargtrpgluargvalmetasnphegluasp
100105110
glyglyileilehisvalasnglnaspserserleuglnaspglyval
115120125
pheiletyrlysvallysleuargglythrasnpheproseraspgly
130135140
provalmetglnlyslysthrmetglytrpglualaserglugluarg
145150155160
mettyrprogluaspglyalaleulyssergluilelyslysargleu
165170175
lysleulysaspglyglyhistyralaalagluvallysthrthrtyr
180185190
lysalalyslysprovalglnleuproglyalatyrilevalaspile
195200205
lysleuaspilevalserhisasngluasptyrthrilevalglugln
210215220
tyrgluargalagluglyarghisserthrglyglymetaspgluleu
225230235240
tyrlys
<210>2
<211>726
<212>dna
<213>
<400>2
caccaccatcaccatcacatggtttccaaaggagaagaaaataatatggcaatcattaaa60
gaatttatgcgattcaaagttcatatggaaggcagtgttaacggccacgagtttgaaatc120
gaaggcgaaggggaaggaagaccctacgaagcattccagacagccaagctgaaagttaca180
aaaggcggcccgctgcctttcgcctgggatatattatcacctcaatttatgtacggttca240
aaggtttatatcaaacatcctgcggacataccggactatttcaaattaagtttcccagaa300
ggttttcgctgggagcgcgtgatgaattttgaagacggcggtatcattcacgttaatcag360
gactcctcgcttcaagatggggtgtttatctacaaggtcaagctgcgcggcactaacttc420
ccctctgacggtccagtcatgcaaaaaaaaaccatgggctgggaagcgtctgaagagcgg480
atgtacccggaagacggtgcactgaaaagtgaaatcaaaaaaagattaaagttaaaagat540
ggcggtcattatgcggccgaggtgaaaacgacctacaaagcaaagaagccagtgcaacta600
cctggtgcttacattgttgacatcaagctggacatcgtgagtcacaatgaagattacacc660
attgttgaacagtatgaacgagctgaaggacgtcactccaccggcgggatggatgaacta720
tataaa726
<210>3
<211>18
<212>prt
<213>
<400>3
glyasnasnargprovaltyrileproglnproargproprohispro
151015
argleu
<210>4
<211>54
<212>dna
<213>
<400>4
ggtaacaacagaccagtttacattccacaaccaagaccaccacatccaagattg54
<210>5
<211>60
<212>dna
<213>
<400>5
gacccaggtaacaacagaccagtttacattccacaaccaagaccaccacatccaagattg60
<210>6
<211>789
<212>dna
<213>
<400>6
caccaccatcaccatcacatggtttccaaaggagaagaaaataatatggcaatcattaaa60
gaatttatgcgattcaaagttcatatggaaggcagtgttaacggccacgagtttgaaatc120
gaaggcgaaggggaaggaagaccctacgaagcattccagacagccaagctgaaagttaca180
aaaggcggcccgctgcctttcgcctgggatatattatcacctcaatttatgtacggttca240
aaggtttatatcaaacatcctgcggacataccggactatttcaaattaagtttcccagaa300
ggttttcgctgggagcgcgtgatgaattttgaagacggcggtatcattcacgttaatcag360
gactcctcgcttcaagatggggtgtttatctacaaggtcaagctgcgcggcactaacttc420
ccctctgacggtccagtcatgcaaaaaaaaaccatgggctgggaagcgtctgaagagcgg480
atgtacccggaagacggtgcactgaaaagtgaaatcaaaaaaagattaaagttaaaagat540
ggcggtcattatgcggccgaggtgaaaacgacctacaaagcaaagaagccagtgcaacta600
cctggtgcttacattgttgacatcaagctggacatcgtgagtcacaatgaagattacacc660
attgttgaacagtatgaacgagctgaaggacgtcactccaccggcgggatggatgaacta720
tataaagacccaggtaacaacagaccagtttacattccacaaccaagaccaccacatcca780
agattgtaa789
<210>7
<211>262
<212>prt
<213>
<400>7
hishishishishishismetvalserlysglyglugluasnasnmet
151015
alaileilelysgluphemetargphelysvalhismetgluglyser
202530
valasnglyhisgluphegluilegluglygluglygluglyargpro
354045
tyrglualapheglnthralalysleulysvalthrlysglyglypro
505560
leuprophealatrpaspileleuserproglnphemettyrglyser
65707580
lysvaltyrilelyshisproalaaspileproasptyrphelysleu
859095
serpheprogluglypheargtrpgluargvalmetasnphegluasp
100105110
glyglyileilehisvalasnglnaspserserleuglnaspglyval
115120125
pheiletyrlysvallysleuargglythrasnpheproseraspgly
130135140
provalmetglnlyslysthrmetglytrpglualaserglugluarg
145150155160
mettyrprogluaspglyalaleulyssergluilelyslysargleu
165170175
lysleulysaspglyglyhistyralaalagluvallysthrthrtyr
180185190
lysalalyslysprovalglnleuproglyalatyrilevalaspile
195200205
lysleuaspilevalserhisasngluasptyrthrilevalglugln
210215220
tyrgluargalagluglyarghisserthrglyglymetaspgluleu
225230235240
tyrlysaspproglyasnasnargprovaltyrileproglnproarg
245250255
proprohisproargleu
260
- 还没有人留言评论。精彩留言会获得点赞!