四氢黄连素硝基咪唑类化合物及其制备方法和应用与流程
本发明属于化学合成领域,涉及四氢黄连素硝基咪唑类化合物,还涉及该化合物的制备方法和应用。
背景技术:
黄连素作为临床抗菌药物广泛存在于多种植物中,如黄连、黄柏、伏牛花等,其长达两千多年的应用历史被记载于《神农本草经》、《本草纲目》等多部古典医学著作中。天然黄连素是一类具有稠环芳香烃结构的季胺类异喹啉生物碱,其独特的稠环芳香烃结构及正负离子中心易于通过静电、氢键、π-π堆积、疏水作用等多种非共价键力与生物体内的许多酶、蛋白质及其他活性位点发生作用,因而表现出多种生物活性。同样地,四氢黄连素作为黄连素的类似物近年来也因其突出的生物活性而备受关注,在药物化学领域表现出巨大的开发价值和广阔的应用前景。黄连素较大的刚性平面结构使其在水中溶解度小,从而导致吸收差、生物利用度低、患者用药次数多、耐受性与疗效差等缺点,进而直接限制了它在临床中的应用。四氢黄连素在一定程度上改善了分子柔性,有利于提高水溶性,进而提高生物利用度。此外,越来越多的研究工作致力于以四氢黄连素为基本骨架的药物研发,包括在抗细菌、抗真菌、抗病毒、抗结核、抗癌、抗糖尿病、消炎镇痛、抗老年痴呆症等多个方面的积极探索,通过对其基本骨架进行结构修饰,引入不同的活性基团,期望获得药代动力学性质好、毒副作用低以及生物活性高的四氢黄连素类药物。
硝基咪唑是一类重要的抗微生物药物,如:奥硝唑、甲硝唑、尼莫拉唑等,其独特的芳香氮杂环结构使得硝基咪唑类衍生物能快速高效地与生物体内的蛋白质、酶及受体等生物大分子发生作用而发挥良好的生物活性。此外,硝基咪唑片段能有效促进自由基的产生从而对微生物致病菌发挥毒性作用,并且在相关酶的催化作用下对硝基的还原过程中会产生一些活性中间体,这些中间体能定向地与dna分子相结合而表现出广泛的抗微生物活性。近年来,大量研究表明,硝基咪唑的引入能有效地改善溶解度从而提高活性分子的生物利用度,但是硝基咪唑修饰四氢黄连素能否提高四氢黄连素的生物活性未见报道。
技术实现要素:
有鉴于此,本发明的目的之一在于提供一种四氢黄连素硝基咪唑类化合物及其可药用盐;本发明的目的之二在于提供四氢黄连素硝基咪唑类化合物及其可药用盐;本发明的目的之三在于提供所述的四氢黄连素硝基咪唑类化合物及其可药用盐在制备抗细菌和/或抗真菌药物中的应用;本发明的目的之四在于提供所述的四氢黄连素硝基咪唑类化合物及其可药用盐在制备dna嵌入剂中的应用;本发明的目的之五在于提供所述的四氢黄连素硝基咪唑类化合物及其可药用盐在制备微生物筛选剂中的应用。
为达到上述目的,本发明提供如下技术方案:
1、四氢黄连素硝基咪唑类化合物及其可药用盐,结构如通式ⅰ所示:
式中,
r为氢、脂肪族取代基、取代苄基;
优选的,r为氢、炔丙基、烯丙基、氰乙基、乙醇基、丙酮基、乙基、丁基、己基、辛基、癸基、2,4-二氯苄基、4-硝基苄基、4-氯苄基、3-氯苄基、2-氯苄基、2-氟苄基。
优选的,为下述化合物中的任一种:
更优选的,所述四氢黄连素硝基咪唑类化合物为i-1、i-2、i-6、i-7、i-9、i-10、i-11、i-12、i-13、i-14、i-15、i-16或i-17。
2、所述的四氢黄连素硝基咪唑类化合物及其可药用盐的制备方法,
a.通式iv所示化合物的制备:以黄连素为起始原料经去甲基化反应得到小檗红碱,再经还原反应得到9-羟基四氢黄连素,再以三氟乙酸作溶剂与六次甲基四胺反应即得四氢黄连素醛iv;
b.通式v所示化合物的制备:以2-甲基-5-硝基咪唑为起始原料,使其在乙腈作溶剂、碳酸钾作用下与氯乙腈发生亲核取代反应即得同时v所示化合物。
c.四氢黄连素硝基咪唑类化合物的制备:将通式iv所示化合物与通式v所示化合物在六氢吡啶的催化下发生缩合反应即制得四氢黄连素硝基咪唑类化合物,
或步骤c为将通式iv所示化合物与通式v所示化合物在六氢吡啶的催化下发生缩合反应,再将反应产物与卤代脂肪族化合物或取代的苄卤发生亲核取代反应即制得四氢黄连素硝基咪唑类化合物;
d.通式i所示四氢黄连素硝基咪唑类化合物的可药用盐的制备:将通式i所示四氢黄连素硝基咪唑类化合物溶于有机溶剂中,加入可药用酸反应至无沉淀生成为止,即制得四氢黄连素硝基咪唑类化合物的可药用盐。
优选的,步骤a中,所述去甲基反应的温度为190℃;所述还原反应的试剂为硼氢化钠;所述9-羟基四氢黄连素与六次甲基四胺的物质的量之比为1:5;
步骤b中,2-甲基-5-硝基咪唑:氯乙腈:碳酸钾的物质的量之比为1:1.5:1.5;
步骤c中,所述缩合反应的溶剂为乙腈;通式iv所述化合物:通式v所示化合物的质量之比为1–1.2:1;反应产物:卤代脂肪族化合物或取代的苄卤:碳酸钾的物质的量之比为1:1.5:1.5。
d.步骤d中,所述有机溶剂为氯仿、丙酮、乙腈、乙醚和四氢呋喃中的一种或多种混合。
3所述的四氢黄连素硝基咪唑类化合物及其可药用盐在制备抗细菌和/或抗真菌药物中的应用。
本发明中,所述细菌为耐甲氧西林金黄色葡萄球菌、金黄色葡萄球菌、粪肠球菌、枯草芽孢杆菌、藤黄微球菌、克雷白氏肺炎杆菌、大肠杆菌、铜绿假单胞菌中的任一种或多种;所述真菌为白色念珠菌、热带假丝酵母菌、烟曲霉菌、近平滑假丝酵母菌20019、啤酒酵母菌、产朊假丝酵母菌中的任一种或多种。
4.所述的四氢黄连素硝基咪唑类化合物及其可药用盐在制备dna嵌入剂中的应用,所述dna为细菌dna。
5、所述的四氢黄连素硝基咪唑类化合物及其可药用盐在制备微生物筛选剂中的应用所述微生物为大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌。
本发明的有益效果在于:本发明利用药物设计拼合原理,首次在四氢黄连素母核的12位引入硝基咪唑,设计合成了一系列结构新颖的四氢黄连素硝基咪唑类化合物,这些化合物经体外抗微生物活性检测发现对革兰氏阳性菌(耐甲氧西林金黄色葡萄球菌、粪肠球菌、金黄色葡萄球菌、金黄色葡萄球菌atcc25923、金黄色葡萄球菌atcc29213、枯草芽孢杆菌、藤黄微球菌)、革兰氏阴性菌(克雷白氏肺炎杆菌、大肠杆菌、铜绿假单胞菌、铜绿假单胞菌27853、大肠杆菌25922)和真菌(白色念珠菌、热带假丝酵母菌、烟曲霉菌、白色念珠菌atcc90023、近平滑假丝酵母菌20019、白色念珠菌atcc76615、啤酒酵母菌、产朊假丝酵母菌)都有一定抑制活性,可以用于制备抗细菌和/或抗真菌药物,从而为临床抗微生物治疗提供更多高效、安全的候选药物,有助于解决日趋严重的耐药性、顽固的致病性微生物以及新出现的有害微生物等临床治疗问题。此外,本发明的四氢黄连素硝基咪唑类化合物还可用于制备dna嵌入剂及微生物筛选剂。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为化合物i-17与诺氟沙星分别对十六代mrsa的抑制作用。
图2为化合物i-17(0.036μmol/ml)对大肠杆菌细胞膜的渗透作用。
图3为化合物i-17与中性红分别与dna之间的竞争作用(dna与中性红的浓度分别为5.18×10-5mol/l与2×10-5mol/l,化合物i-17的浓度从0至1.21×10-5mol/l)。
图4将含约104cfus的金黄色葡萄球菌、铜绿假单胞菌和白色念珠菌分别与大肠杆菌对照涂布于含0.003μmol/ml的化合物i-17和不含化合物i-17的琼脂培养基上培养10小时后的观察结果(a:含化合物i-17;b:无化合物i-17)。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
实施例1、化合物iv的制备
在150ml圆底烧瓶中加入9-羟基四氢黄连素(7.82g,0.024mol)和六次甲基四胺(4.099g,0.029mol),以三氟乙酸(60ml)作溶剂,120℃下搅拌反应,薄层色谱跟踪至反应结束。用质量分数10%的稀硫酸水解,再用饱和碳酸氢钠溶液调ph为中性,用乙酸乙酯溶液萃取,再经浓缩、重结晶、干燥等后处理即得化合物iv(6.613g),产率77.9%。
其中9-羟基四氢黄连素以盐酸小檗碱(黄连素)为起始原料经去甲基化反应得到小檗红碱,再经还原反应得到9-羟基四氢黄连素(方法参见ponmanij,liuhb,lavanyag,chengy,pengxm,gengrx,zhouch.novelbenzimidazolyltetrahydroprotoberberines:design,synthesis,antimicrobialevaluationandmulti-targetingexploration.bioorg.med.chem.lett.2017,27,1737–1743)。
实施例2、化合物v的制备
在150ml圆底烧瓶中加入2-甲基-5-硝基咪唑(4.000g,0.032mol)、碳酸钾(6.630g,0.048mol),用乙腈作溶剂80℃下搅拌15分钟后,加入氯乙腈(3.624g,0.048mol),继续在80℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得硝基咪唑衍生物(4.120g),通式如v所示,产率77.6%。
实施例3、化合物i-1的制备
在150ml圆底烧瓶中加入四氢黄连素醛iv(2.000g,5.659mmol)和硝基咪唑衍生物v(1.008g,5.659mmol),以六氢吡啶(2ml)作催化剂,乙腈(70ml)作溶剂,80℃下搅拌反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-1(0.512g),产率18.0%。
化合物i-1:黄色固体;熔点:197–199℃;1hnmr(600mhz,cdcl3)δ7.83(s,1h,im5-h),7.69(s,1h,c=ch),7.58(s,1h,ber11-h),6.67(s,1h,ber1-h),6.60(s,1h,ber2-h),5.91(d,2h,och2o),4.24(m,1h,ber14-h),3.99(s,3h,och3),3.57(s,1h,ber8-h),3.52(d,1h,ber8-h),3.20(s,2h,ber13-h),3.08(s,1h,ber5-h),2.69(d,3h,ber5-h,6-h),2.55(s,3h,imch3)ppm。
实施例4、化合物i-2的制备
在150ml圆底烧瓶中加入化合物i-1(0.300g,0.598mmol)、碳酸钾(0.103g,0.745mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴丙炔(0.106g,0.890mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-2(0.102g),产率31.7%。
化合物i-2:黄色固体;熔点:205–207℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.66(s,1h,c=ch),7.58(s,1h,ber11-h),6.66(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),4.94(d,1h,och2c≡ch),4.92(d,1h,och2c≡ch),4.32(m,1h,ber14-h),3.96(s,3h,och3),3.59(s,2h,ber8-h),3.18(s,2h,ber13-h),3.07(s,1h,ber5-h),2.69(m,3h,ber5,6-h),2.57(s,3h,imch3),2.50(s,1h,och2c≡ch)ppm。
实施例5、化合物i-3的制备
在150ml圆底烧瓶中加入化合物i-1(0.300g,0.598mmol)、碳酸钾(0.103g,0.745mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴丙烯(0.108g,0.893mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-3(0.160g),产率49.5%。
化合物i-3:墨绿色固体;熔点:201–203℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.66(s,1h,c=ch),7.57(s,1h,ber11-h),6.66(s,1h,ber1-h),6.60(s,1h,ber4-h),6.07(m,1h,och2ch=ch2),5.90(m,2h,och2o),5.41(d,1h,och2ch=ch2),5.27(s,1h,och2ch=ch2),4.74(m,1h,och2ch=ch2),4.67(s,1h,och2ch=ch2),4.23(s,1h,ber14-h),3.95(s,3h,och3),3.54(m,2h,ber8-h),3.19(m,2h,ber13-h),3.08(m,1h,ber5-h),2.66(s,3h,ber5,6-h),2.57(s,3h,imch3)ppm。
实施例6、化合物i-4的制备
在150ml圆底烧瓶中加入化合物i-1(0.500g,0.997mmol)、碳酸钾(0.206g,1.495mmol)和乙腈(70ml),80℃搅拌30分钟,加入氯乙腈(0.113g,1.495mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-4(0.124g),产率23.0%。
化合物i-4:绿色固体;熔点:206–209℃;1hnmr(600mhz,cdcl3)δ7.86(s,1h,im5-h),7.65(s,1h,c=ch),7.60(s,1h,ber11-h),6.65(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),5.01(d,2h,och2cn),4.28(m,1h,ber14-h),3.99(s,3h,och3),3.61(m,2h,ber8-h),3.18(m,2h,ber13-h),3.07(s,1h,ber5-h),2.68(d,3h,ber5,6-h),2.58(s,3h,imch3)ppm。
实施例7、化合物i-5的制备
在150ml圆底烧瓶中加入化合物i-1(0.500g,0.997mmol)、碳酸钾(0.206g,1.495mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴乙醇(0.186g,1.495mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-5(0.096g),产率17.7%。
化合物i-5:绿色固体;熔点:195–198℃;1hnmr(600mhz,cdcl3)δ7.85(s,1h,im5-h),7.65(s,1h,c=ch),7.61(s,1h,ber11-h),6.66(s,1h,ber1-h),6.59(s,1h,ber4-h),5.91(d,2h,och2o),4.30(m,2h,och2ch2oh),4.19(s,1h,ber14-h),3.96(s,3h,och3),3.92(m,2h,och2ch2oh),3.57(s,2h,ber8-h),3.18(s,2h,ber13-h),3.08(s,1h,ber5-h),2.73(s,1h,och2ch2oh),2.69(s,1h,ber5-h),2.66(s,2h,ber6-h),2.57(s,3h,imch3)ppm。
实施例8、化合物i-6的制备
在150ml圆底烧瓶中加入化合物i-1(0.500g,0.997mmol)、碳酸钾(0.206g,1.495mmol)和乙腈(70ml),80℃搅拌30分钟,加入氯丙酮(0.138g,1.496mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-6(0.126g),产率22.7%。
化合物i-6:黄色固体;熔点:210–213℃;1hnmr(600mhz,cdcl3)δ7.85(s,1h,im5-h),7.64(s,1h,c=ch),7.61(s,1h,ber11-h),6.66(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),4.80(d,1h,och2coch3),4.75(d,1h,och2coch3),4.31(d,1h,ber14-h),3.90(m,3h,och3),3.57(m,2h,ber8-h),3.20(m,2h,ber13-h),3.08(m,1h,ber5-h),2.68(d,3h,ber5,6-h),2.56(s,3h,imch3),2.28(s,3h,och2coch3)ppm。
实施例9、化合物i-7的制备
在150ml圆底烧瓶中加入化合物i-1(0.500g,0.997mmol)、碳酸钾(0.206g,1.495mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴乙烷(0.162g,1.495mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-7(0.103g),产率19.5%。
化合物i-7:红色固体;熔点:198–200℃;1hnmr(600mhz,dmso-d6)δ8.67(s,1h,im5-h),8.23(s,1h,c=ch),7.61(s,1h,ber11-h),6.99(s,1h,ber1-h),6.68(s,1h,ber4-h),5.94(d,2h,och2o),4.16(m,1h,ber14-h),4.10(m,2h,och2ch3),3.87(s,3h,och3),3.46(s,1h,ber8-h),3.41(m,2h,ber13-h),3.13(m,1h,ber8-h),2.90(m,1h,ber5-h),2.61(m,1h,ber5-h),2.56–2.52(m,1h,ber6-h),2.51–2.49(m,3h,imch3),2.47(m,1h,ber6-h),1.31(m,3h,och2ch3)ppm。
实施例10、化合物i-8的制备
在150ml圆底烧瓶中加入化合物i-1(0.350g,0.698mmol)、碳酸钾(0.145g,1.047mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴丁烷(0.143g,1.045mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-8(0.078g),产率20.1%。
化合物i-8:红色固体;熔点:201–203℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.66(s,1h,c=ch),7.58(s,1h,ber11-h),6.66(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),4.21(m,2h,och2(ch2)2ch3),4.13(s,1h,ber14-h),3.94(s,3h,och3),3.53(m,2h,ber8-h),3.19(m,2h,ber13-h),3.08(s,1h,ber5-h),2.67(m,3h,ber5,6-h),2.56(s,3h,imch3),1.77(m,2h,och2ch2ch2ch3),1.52(m,2h,o(ch2)2ch2ch3),1.00(t,3h,o(ch2)3ch3)ppm。
实施例11、化合物i-9的制备
在150ml圆底烧瓶中加入化合物i-1(0.350g,0.698mmol)、碳酸钾(0.145g,1.047mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴己烷(0.173g,1.045mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-9(0.073g),产率17.9%。
化合物i-9:红色固体;熔点:199–201℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.66(s,1h,c=ch),7.59(s,1h,ber11-h),6.67(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),4.20(m,2h,och2(ch2)4ch3),4.11(m,1h,ber14-h),3.93(s,3h,och3),3.54(m,2h,ber8-h),3.18(m,2h,ber13-h),3.09(s,1h,ber5-h),2.68(d,3h,ber5,6-h),2.56(s,3h,imch3),1.78(m,2h,och2ch2(ch2)3ch3),1.48(m,2h,o(ch2)2ch2(ch2)2ch3),1.36(m,4h,o(ch2)3(ch2)2ch3),0.93(t,3h,o(ch2)5ch3)ppm。
实施例12、化合物i-10的制备
在150ml圆底烧瓶中加入化合物i-1(0.350g,0.698mmol)、碳酸钾(0.145g,1.047mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴辛烷(0.202g,1.047mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-10(0.075g),产率17.5%。
化合物i-10:黄色固体;熔点:190–193℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.66(s,1h,c=ch),7.58(s,1h,ber11-h),6.67(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),4.21(m,2h,och2(ch2)6ch3),4.12(m,1h,ber14-h),3.93(s,3h,beroch3),3.54(m,2h,ber8-h),3.17(m,2h,ber13-h),3.09(s,1h,ber5-h),2.68(d,3h,ber5,6-h),2.56(s,3h,imch3),1.78(s,2h,och2ch2(ch2)5ch3),1.47(m,2h,o(ch2)2ch2(ch2)4ch3),1.31(s,8h,o(ch2)3(ch2)4ch3),0.90(t,3h,o(ch2)7ch3)ppm。
实施例13、化合物i-11的制备
在150ml圆底烧瓶中加入化合物i-1(0.500g,0.997mmol)、碳酸钾(0.206g,1.495mmol)和乙腈(70ml),80℃搅拌30分钟,加入溴癸烷(0.202g,1.495mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-11(0.114g),产率17.8%。
化合物i-11:黄色固体;熔点:191–193℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.66(s,1h,c=ch),7.58(s,1h,ber11-h),6.66(s,1h,ber1-h),6.60(s,1h,ber4-h),5.91(d,2h,och2o),4.20(m,2h,och2(ch2)8ch3),4.12(m,1h,ber14-h),3.93(s,3h,och3),3.53(m,2h,ber8-h),3.16(m,2h,ber13-h),3.08(m,1h,ber5-h),2.67(d,3h,ber5,6-h),2.56(s,3h,imch3),1.78(m,2h,och2ch2(ch2)7ch3),1.47(m,2h,o(ch2)2ch2(ch2)6ch3),1.30(m,12h,o(ch2)3(ch2)6ch3),0.89(t,3h,o(ch2)9ch3)ppm。
实施例14、化合物i-12的制备
在150ml圆底烧瓶中加入化合物i-1(0.445g,0.887mmol)、碳酸钾(0.184g,1.331mmol)和乙腈(70ml),80℃搅拌30分钟,加入2,4-二氯苄氯(0.260g,1.330mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-12(0.152g),产率26.0%。
化合物i-12:红色固体;熔点:210–212℃;1hnmr(600mhz,cdcl3)δ7.85(s,1h,im5-h),7.68(s,1h,c=ch),7.58(s,1h,ber11-h),7.56(s,1h,ph3-h),7.45(s,1h,ph5-h),7.32(s,1h,ph6-h),6.65(s,1h,ber1-h),6.59(s,1h,ber4-h),5.91(d,2h,och2o),5.30(d,1h,och2ph),5.24(d,1h,och2ph),4.20(m,1h,ber14-h),3.97(s,3h,och3)3.53(m,1h,ber8-h),3.47(m,1h,ber8-h),3.15(m,1h,ber5-h),3.10(m,2h,ber13-h),2.67(d,3h,ber5,6-h),2.58(s,3h,imch3)ppm。
实施例15、化合物i-13的制备
在150ml圆底烧瓶中加入化合物i-1(0.530g,1.057mmol)、碳酸钾(0.219g,1.585mmol)和乙腈(70ml),80℃搅拌30分钟,加入4-硝基苄溴(0.342g,1.583mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-13(0.086g),产率12.8%。
化合物i-13:黄色固体;熔点:214–216℃;1hnmr(600mhz,dmso-d6)δ8.68(s,1h,im5-h),8.29(d,2h,ph3,5-h),8.25(s,1h,c=ch),7.79(d,2h,ph1,6-h),7.65(s,1h,ber11-h),6.99(s,1h,ber1-h),6.67(s,1h,ber4-h),5.93(d,2h,och2o),5.28(q,2h,och2ph),4.13(m,1h,ber14-h),3.91(s,3h,och3),3.48(s,1h,ber8-h),3.42(m,2h,ber13-h),3.08(m,1h,ber8-h),2.87(m,1h,ber5-h),2.62(m,1h,ber5-h),2.56(m,1h,ber6-h),2.52(m,3h,imch3),2.44(m,1h,ber6-h)ppm。
实施例16、化合物i-14的制备
在150ml圆底烧瓶中加入化合物i-1(0.416g,0.830mmol)、碳酸钾(0.171g,1.237mmol)和乙腈(70ml),80℃搅拌30分钟,加入4-氯苄氯(0.200g,1.242mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-14(0.126g),产率24.3%。
化合物i-14:粉色固体;熔点:203–205℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.68(s,1h,c=ch),7.58(s,1h,ber11-h),7.38(s,4h,ph2,3,5,6-h),6.65(s,1h,ber1-h),6.59(s,1h,ber4-h),5.91(d,2h,och2o),5.22(d,1h,och2ph),5.13(d,1h,och2ph),4.15(m,1h,ber14-h),3.98(s,3h,och3),3.51(m,1h,ber8-h),3.42(m,1h,ber8-h),3.14(m,1h,ber5-h),3.08(m,2h,ber13-h),2.67(d,3h,ber5,6-h),2.57(s,3h,imch3)ppm。
实施例17、化合物i-15的制备
在150ml圆底烧瓶中加入化合物i-1(0.414g,0.826mmol)、碳酸钾(0.171g,1.237mmol)和乙腈(70ml),80℃搅拌30分钟,加入3-氯苄氯(0.199g,1.236mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-15(0.071g),产率13.7%。
化合物i-15:黄色固体;熔点:200–202℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.68(s,1h,c=ch),7.57(s,1h,ber11-h),7.38(s,4h,ph2,3,5,6-h),6.64(s,1h,ber1-h),6.59(s,1h,ber4-h),5.91(d,2h,och2o),5.22(d,1h,och2ph),5.13(d,1h,och2ph),4.15(m,1h,ber14-h),3.98(s,3h,och3),3.52(m,1h,ber8-h),3.42(m,1h,ber8-h),3.16(m,1h,ber5-h),3.08(m,2h,ber13-h),2.67(d,3h,ber5,6-h),2.57(s,3h,imch3)ppm。
实施例18、化合物i-16的制备
在150ml圆底烧瓶中加入化合物i-1(0.447g,0.891mmol)、碳酸钾(0.185g,1.339mmol)和乙腈(70ml),80℃搅拌30分钟,加入2-氯苄氯(0.215g,1.335mmol),控温80℃反应,薄层色谱跟踪至反应结束。再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-16(0.126g),产率22.6%。
化合物i-16:红色固体;熔点:204–206℃;1hnmr(600mhz,cdcl3)δ7.85(s,1h,im5-h),7.69(s,1h,c=ch),7.60(d,1h,ph3-h),7.59(d,1h,ber11-h),7.42(d,1h,ph6-h),7.32(s,2h,ph4,5-h),6.65(s,1h,ber1-h),6.58(s,1h,ber4-h),5.91(d,2h,och2o),5.34(d,1h,och2ph),5.29(d,1h,och2ph),4.23(m,1h,ber14-h),3.98(s,3h,och3),3.50(m,1h,ber8-h),3.45(m,1h,ber8-h),3.17(m,1h,ber5-h),3.10(m,2h,ber13-h),2.70(d,3h,ber5,6-h),2.58(s,3h,imch3)ppm。
实施例19、化合物i-17的制备
在150ml圆底烧瓶中加入化合物i-1(0.497g,0.991mmol)、碳酸钾(0.205g,1.487mmol)和乙腈(70ml),80℃搅拌30分钟,加入2-氟苄氯(0.214g,1.487mmol),控温80℃反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物i-17(0.100g),产率16.6%。
化合物i-17:黄色固体;熔点:199–201℃;1hnmr(600mhz,cdcl3)δ7.84(s,1h,im5-h),7.68(s,1h,c=ch),7.58(d,1h,ber11-h),7.51(s,1h,ph3-h),7.35(s,1h,ph4-h),7.18(s,1h,ph5-h),7.10(s,1h,ph6-h),6.64(s,1h,ber1-h),6.58(s,1h,ber4-h),5.89(d,2h,och2o),5.31(s,1h,och2ph),5.24(s,1h,och2ph),4.19(m,1h,ber14-h),3.98(s,3h,och3),3.51(m,1h,ber8-h),3.41(m,1h,ber8-h),3.16(m,1h,ber5-h),3.08(m,2h,ber13-h),2.66(d,3h,ber5,6-h),2.57(s,3h,imch3)ppm。
注:ber为黄连素,im为硝基咪唑,ph为苯。
实施例20、四氢黄连素硝基咪唑类化合物的体外抗微生物活性
采用符合1993年美国国家委员会制定的临床实验标准(nationalcommitteeforclinicallaboratorystandards,nccls)的96孔微量稀释法,检查实施例3–19制得的四氢黄连素硝基咪唑类化合物对对革兰氏阳性菌(耐甲氧西林金黄色葡萄球菌、粪肠球菌、金黄色葡萄球菌、金黄色葡萄球菌atcc25923、金黄色葡萄球菌atcc29213、枯草芽孢杆菌、藤黄微球菌)、革兰氏阴性菌(克雷白氏肺炎杆菌、大肠杆菌、铜绿假单胞菌、铜绿假单胞菌27853、大肠杆菌25922)和真菌(白色念珠菌、热带假丝酵母菌、烟曲霉菌、白色念珠菌atcc90023、近平滑假丝酵母菌20019、白色念珠菌atcc76615、啤酒酵母菌、产朊假丝酵母菌)的最低抑制浓度(mic),将待测化合物用少量二甲亚砜溶解,再加水稀释制成浓度为1.28mg/ml的溶液,再用培养液稀释至128μg/ml,35℃培养24–72小时,将培养板至振荡器上充分摇匀后,在波长490nm处测定mic,结果见表1–2。
表1、四氢黄连素硝基咪唑类化合物i-1–i-17的体外抗细菌活性数据(mic,μmol/ml)
从表1可以看出,本发明实施例3–19制得的化合物i-1–i-17,对所测试的细菌表现出一定的抑制作用,更重要的是,部分化合物的抗细菌活性可与参考药物黄连素及诺氟沙星相媲美,甚至更强。
表2、四氢黄连素硝基咪唑类化合物i-1–i-17的体外抗真菌活性数据(mic,μmol/ml)
从表2可以看出,本发明实施例3–20制得的化合物i-1–i-17,对所测试的真菌表现出一定的抑制作用,更重要的是,部分化合物的抗细菌活性可与参考药物黄连素、氟康唑相媲美,甚至更强。
实施例21、四氢黄连素硝基咪唑类化合物的耐药性试验
将mrsa(耐甲氧西林金光色葡萄球菌)进行传代培养以研究本发明实施例19制得的化合物i-17的耐药性发展,并以诺氟沙星作为对照组,结果如图1。由图1可以看出,化合物i-17在前十三代mrsa的mic值基本保持不变,后三代有微弱的上升趋势,表明四氢黄连素硝基咪唑i-17没有明显的诱发细菌耐药性产生。
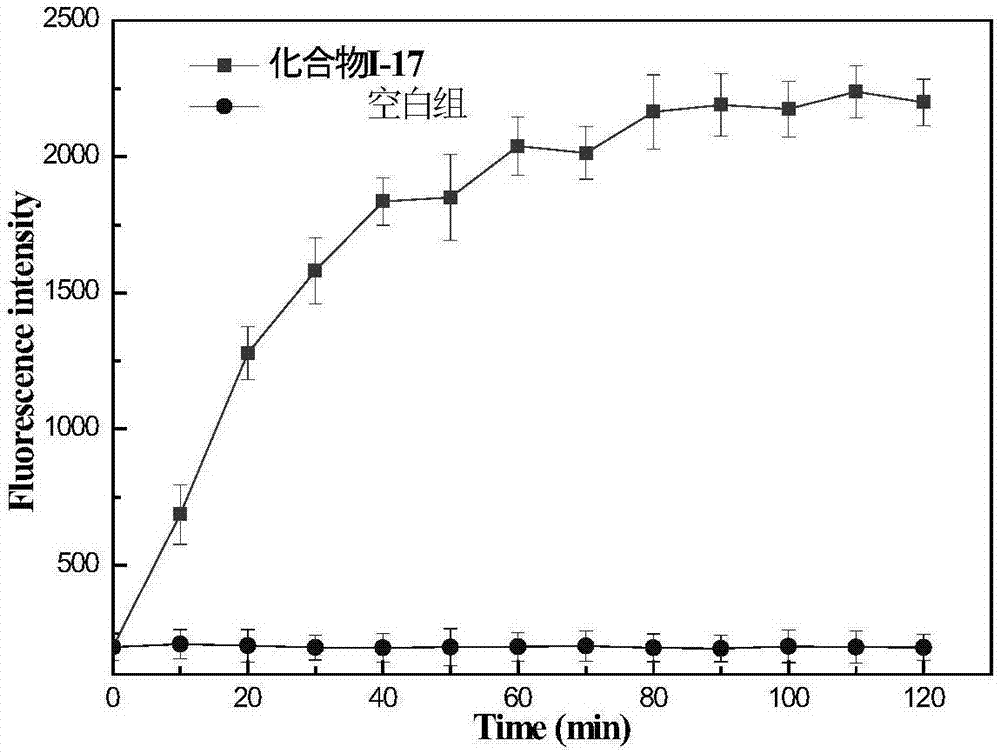
实施例22、四氢黄连素硝基咪唑类化合物对细胞膜的渗透性试验
本发明实施例19制得的化合物i-17能使细菌细胞膜的渗透性增强。利用碘化丙啶作为指示剂,通过荧光监测其渗透作用见图2。由图2可以看出,四氢黄连素硝基咪唑i-17能够增强大肠杆菌细胞膜的渗透性,并于两小时左右达到最大化。
实施例23、四氢黄连素硝基咪唑类化合物作为dna嵌入剂
本发明实施例19制得的化合物i-17能作为人工嵌入剂有效的嵌入细菌dna。利用紫外吸收光谱与dna探针中性红(neutralred)检测其嵌入效果见图3。
实施例24、四氢黄连素硝基咪唑类化合物作为微生物筛选剂
本发明实施例19制得的化合物i-17能在多种不同的复合菌中选择性的抑制大肠杆菌的生长。利用琼脂培养基检测其抑制效果,结果如图4所示。
从图4可以看出,在含有化合物i-17的琼脂培养基上,大肠杆菌均不能正常的生长而金黄色葡萄球菌、铜绿假单胞菌以及白色念珠菌的生长并没有被抑制。表明四氢黄连素硝基咪唑化合物i-17在一定浓度范围内能够有效的选择性抑制大肠杆菌的生长。
实施例25、四氢黄连素硝基咪唑类化合物的制药用途
根据上述抗微生物活性检测结果,本发明的四氢黄连素硝基咪唑类化合物具有较好的抗细菌、抗真菌活性,可以制成抗细菌、抗真菌药物供临床使用。这些药物既可以是单方制剂,例如由一种结构的四氢黄连素硝基咪唑类化合物与药学上可接受的辅料制成;也可以是复方制剂,例如由一种结构的四氢黄连素硝基咪唑类化合物与已有抗细菌、抗真菌活性成分(如诺氟沙星、环丙沙星、磺胺甲噁唑、氟康唑、磷氟康唑、伊曲康唑等)以及药学上可接受的辅料制成,或者由不同结构的几种四氢黄连素硝基咪唑类化合物与药学上可接受的辅料制成。所述制剂类型包括但不限于片剂、胶囊剂、散剂、颗粒剂、滴丸剂、注射剂、粉针剂、溶液剂、混悬剂、乳剂、栓剂、软膏剂、凝胶剂、膜剂、气雾剂、透皮吸收贴剂等剂型,以及各种缓释、控释制剂和纳米制剂。
1、化合物i-17片剂的制备
处方:化合物i-1710g,乳糖187g,玉米淀粉50g,硬脂酸镁3.0g,体积百分浓度为70%的乙醇溶液适量,共制成1000片。
制法:将玉米淀粉与105℃干燥5小时备用;将化合物i-17与乳糖、玉米淀粉混合均匀,用70%的乙醇溶液制软材,过筛制湿颗粒,再加入硬脂酸镁,压片,即得;每片重250mg,活性成分含量为10mg。
2、化合物i-6胶囊剂的制备
处方:化合物i-625g,改性淀粉(120目)12.5g,微晶纤维素(100目)7.5g,低取代羟丙纤维素(100目)2.5g,滑石粉(100目)2g,甜味剂1.25g,橘子香精0.25g,色素适量,水适量,制成1000粒。
制法:将处方量的化合物i-6微粉化粉碎成极细粉末后,与处方量的改性淀粉、微晶纤维素、低取代羟丙纤维素、滑石粉、甜味剂、橘子香精和色素混匀,用水制软材,12–14目筛制粒,40–50℃干燥,过筛整粒,装入空胶囊,即得;每片重50mg,活性成分含量为25mg。
3、化合物i-1颗粒剂的制备
处方:化合物i-126g,糊精120g,蔗糖280g。
制法:将化合物i-1、糊精、蔗糖混合均匀,湿法制粒,60℃干燥,分装,即得。
4、化合物i-4注射剂的制备
处方:化合物i-410g,丙二醇500ml,注射用水500ml,共制成1000ml。
制法:称取化合物i-4、加入丙二醇和注射水,搅拌溶解,再加入1g活性炭,充分搅拌后静置15分钟,用5μm钛棒过滤脱炭,再依次用孔径为0.45μm和0.22μm的微孔滤膜精滤,最后灌封于10ml安瓿中,100℃流通蒸气灭菌45分钟,即得。
5、化合物i-9粉针剂的制备
制法:化合物i-9无菌粉末在无菌条件下分装,即得。
6、化合物i-10滴眼剂的制备
处方:化合物i-103.78g,氯化钠0.9g,苯乙醇3g,硼酸缓冲溶液适量,蒸馏水加至1000ml。
制法:称取化合物i-10、氯化钠加至500ml蒸馏水中,溶解完全后用硼酸缓冲溶液调节ph至6.5,加蒸馏水至1000ml,搅拌均匀,微孔滤膜过滤,灌装,密封,100℃流通蒸气灭菌1小时,即得。
7、化合物i-12搽剂的制备
处方:化合物i-124g,钾肥皂7.5g,樟脑5g,蒸馏水加至100ml。
制法:将樟脑用体积百分浓度为95%的乙醇溶液溶解,备用;将钾肥皂加热液化,备用,称取化合物i-12,在不断搅拌下加入钾肥皂液和樟脑乙醇溶液,再逐渐加入蒸馏水,乳化完全后再加入蒸馏水至全量,即得。
8、化合物i-7栓剂的制备
处方:化合物i-74g,明胶14g,甘油70g,蒸馏水加至100ml,公制100枚。
制法:称取明胶和甘油,加蒸馏水至100ml,水浴60℃加热熔化呈糊状时加入化合物i-7,搅拌均匀,近凝固时倒入阴道栓模具中,冷却凝固,即得。
9、化合物i-8软膏剂的制备
处方:化合物i-80.5–2g,十六醇6–8g,白凡士林8–10g,液体石蜡8–19g,单甘脂2–5g,聚氧乙烯(40)硬脂酸脂2–5g,甘油5–10g,尼泊金乙酯0.1g,蒸馏水加至100g。
制法:将十六醇、白凡士林、液体石蜡、单甘脂和聚氧乙烯(40)硬脂酸脂加热完全溶化后混匀,保温80℃,作为油相备用;将尼泊金乙酯加入甘油和蒸馏水中,加热至85℃溶解,再在不断搅拌下加入油相,乳化后加入化合物i-8,搅拌冷却,即得。
10、化合物i-5与氟康唑复方粉针剂的制备
处方:化合物i-550g,氟康唑50g,苯甲酸钠1g,共制成100瓶。
制法:取处方量的化合物i-5、氟康唑和苯甲酸钠,在无菌状态下混合均匀,分装100瓶,即得。
11、化合物i-11气雾剂的制备
处方:化合物i-112.5g,span203g,滑石粉(100目)4g,三氯一氟甲烷加至适量。
制法:将化合物i-11、span20和滑石粉分别置真空干燥箱内干燥数小时,置干燥器内冷却至室温,用气流粉碎机粉碎成微粉,再按处方量混匀,灌入密闭容器内,加入三氯一氟甲烷至规定量,即得。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!