一种铱联吡啶配合物及合成方法以及在DNA纳米载药系统中的应用与流程
本发明属于生物医药领域,特别涉及一种铱联吡啶配合物及合成方法以及在dna纳米载药系统中的应用。
背景技术:
癌症已经超越心血管病成为威胁公共健康的主要原因。目前临床上使用的许多抗肿瘤药物如avastin,pazopanib以及sunitinib主要通过抑制血管生成来提高抗肿瘤疗效。最近研究表明,肿瘤血管生成并不是肿瘤获得血供的唯一方式,在黑色素瘤、胃癌、乳腺癌等高侵袭肿瘤中发现了一种不依赖于内皮细胞的肿瘤内血管生成模式--血管生成拟态(vasculogenicmimicry,vm)。vm是指某些恶性细胞发生基因逆转回到多潜能未分化的胚胎样细胞表型,并通过自身变形模拟内皮细胞并与细胞外基质相互作用,模仿血管壁结构形成可以运输血液(血浆、红细胞)的管道系统,从而重塑肿瘤微循环,并与宿主血管相连使肿瘤获得血液供应,这是近十几年来发现的一种全新的肿瘤微循环模式(liuetal.,j.modernoncol.2013;04.)。临床研究表明,vm的存在与肿瘤的发生、发展、转移以及远期的不良预后都有着密切的关系,提示抑制肿瘤vm可成为肿瘤血管靶向治疗的新靶点。
目前,已有学者致力于抗vm药物的研发工作。经过化学修饰的四环素col-3能够抑制侵袭性细胞的vm的相关基因表达,进而抑制vm的形成,其机制可能与抑制mmp活性有关(seftoretal.,clin.exp.metastasis,2002,19,233-246)。沙利度胺可抑制c57小鼠肿瘤的生长,pas/cd31双染色结果提示肿瘤中血管生成拟态结构被明显抑制,且肿瘤中vegf、mmp-2和mmp-9等表达明显降低(zhangetal.,j.exp.clin.cancerres.,2008,27,60)。力达霉素可抑制神经胶质瘤细胞c6和u87中血管生成拟态的形成(李兴起等,中华医学杂志,2009,89,1736-1740)。但为了提高抗vm药物在体内的药代动力学特性、肿瘤靶向性和实体瘤穿透能力,需要合理化设计药物的剂型,使之能被体内有效吸收,实现高效低毒的目标。
近年来,人们发现纳米药物载体可利用其独特的尺寸效应、界面效应和宏观量子隧道效应增强药物的抗肿瘤效果,明显降低药物引起的毒副作用。比如,李亚平(duanetal.,acsnano,2013,7,5858-5869.)通过构建具有ph和时间响应性的聚苯乙烯纳米载药系统,同时负载阿霉素与双硫仑,协同抑制了肿瘤细胞增殖,最终扭转肿瘤多药耐药;史进进等设计了富勒烯-纳米金复合材料,并将其应用在肿瘤原位深度光热治疗中射频或微滤照射药物中(中国专利号:cn201310260339),为新一代纳米药物的设计提供了理论基础和数据支撑。
随着纳米科技的发展,人们对现代纳米药物运输体系有了更高的要求。即纳米药物输运载体需具备良好的生物相容性和肿瘤靶向性,且可结合多种功能组分于一体,使其更好地适应体内环境,达到准确、高效、稳定、安全运输药物的目的[peppas.adv.drugdeliver.rev.,2013,65,5-9.]。目前,关于设计具有良好生物相容性的复合型纳米材料应用于肿瘤早期诊断、癌症靶向治疗、药物控释和智能药物输送正在如火如茶地开展。其中,一个重要的研究策略是将具有生物相容性的功能分子在组装纳米粒子表面,使其在实现多维度抗肿瘤效果的同时降低对组织的毒性。比如,天津医科大学肿瘤医院宋天强课题组将阿霉素(dox)装载在β-环糊精接枝透明质酸(hacd)纳米粒子上,能在实现明显靶向肝癌细胞的作用下同时降低药物对机体的毒性。[baietal.,int.j.biomed.eng.,2017,40,1-11]。liu等人用透明质酸(ha)修饰的纳米脂质载体(nlcs)递送黄芩素(baicalein,bcl)和dox。与其他制剂相比,该粒子体内外细胞毒性研究均显示出较大的抗肿瘤活性。[liuetal.,drugdeliver.,2016,23,1364-1368]。这些结果提示了基于生物相容性的复合型纳米药物设计在肿瘤诊疗中的广阔应用前景。但在临床治疗上,人们对抗肿瘤药物的设计不仅要在短期内对患者无害,还要不产生长期毒性为宜。这就要求纳米载体在高效发挥多种功能的同时,载体本身也要有良好的生物相容性和可降解性。因此,寻找生物来源的载体材料肿瘤药物设计的新趋势,有望推动临床抗肿瘤新药的发展。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种铱联吡啶配合物。
本发明的另一目的在于提供所述铱联吡啶配合物的合成方法。
本发明的又一目的在于提供所述铱联吡啶配合物在dna纳米载药系统中的应用。
本发明的目的通过下述技术方案实现:一种铱联吡啶配合物,其结构式如式i所示:
所述的铱联吡啶配合物的合成方法,包括如下步骤:
(1)将4-甲基-[2,2’联吡啶]-4-羧酸、nhs(n-羟基琥珀酰亚胺)、edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)分散于dmf(n,n-二甲基甲酰胺)中,加热至40~60℃进行反应,反应结束后减压浓缩dmf溶液,加水,再用二氯甲烷萃取,收集有机层,干燥、抽滤、取滤液、旋干,得到产物1(2,5-二羰基-1-吡咯烷基4'-甲基-[2,2'-联吡啶]-4-羧酸酯);其中,4-甲基-[2,2’联吡啶]-4-羧酸、nhs和edc按摩尔比为1:(1~2):(1~2)进行配比;
(2)将二碳酸二叔丁酯((boc)2o)分散于甲醇中,在冰浴条件下滴加到己二胺的甲醇溶液中,常温进行反应,反应结束后减压旋干,取固体,分散于水中,然后用乙酸乙酯萃取,收集乙酸乙酯层,减压浓缩,调ph至酸性,再用水萃取,收集水层,调ph至碱性,冻干,得产物2(叔丁基-(6-氨己基)-氨基甲酸酯);其中,己二胺和二碳酸二叔丁酯按摩尔比为(3~6):1进行配比;
(3)将步骤(1)得到的产物1、步骤(2)得到的产物2、dmap(4-二甲氨基吡啶)、三乙胺加入dcm(二氯甲烷)中,常温下反应12~24h,反应结束后,洗涤,收集有机层,干燥,抽滤,取滤液,旋干,得到产物3(叔丁基-(6-(4'-甲基-[2,2'-联吡啶]-4-甲酰胺)己基)氨基甲酸酯);其中产物1、产物2、dmap、三乙胺按摩尔比为1:(1.1~1.5):(0.5~1.0):(5~13)进行配比;
(4)将步骤(3)得到的产物3溶于dcm,冰浴下滴加dcm稀释的三氟乙酸,常温下搅拌反应,反应结束后,旋干溶剂,得到产物4(n-(6-氨基己基)-4'-甲基-[2,2'-联吡啶]-4-甲酰胺);其中,产物3与三氟乙酸按摩尔比为1:(5~10)进行配比;
(5)将ircl3(三氯化铱)和2-(2-噻吩)-吡啶分散于混合溶剂中,加热至110~135℃进行反应,反应结束后,抽滤、洗涤、取滤饼、干燥,得到产物5(氯桥连中间体);其中,混合溶剂为乙二醇乙醚和水按体积比(1~3):1配比得到的混合溶剂,ircl3与2-(2-噻吩)-吡啶按摩尔比为1:2进行配比;
(6)将步骤(5)得到的产物5和步骤(4)得到的产物4加入到混合溶剂中,加热至40~55℃进行反应,反应结束后再加入六氟磷酸铵,常温下搅拌,抽滤,取滤液,旋干,得到铱联吡啶配合物;其中,混合溶剂为二氯甲烷和甲醇按体积比1:(1~3)配比得到的混合溶剂,产物4和产物5按摩尔比为(2.1~2.6):1进行配比。
步骤(1)中所述的反应的温度优选为50℃。
步骤(1)中所述的反应的时间为10~16h;优选为12h。
步骤(1)中所述的旋干为采用旋转蒸发仪蒸干。
步骤(1)中所述的萃取的次数优选为3次。
步骤(1)中所述的4-甲基-[2,2’联吡啶]-4-羧酸、nhs和edc优选为按摩尔比1:1.1:1.3配比计算。
步骤(1)和(2)中所述的水优选为去离子水。
步骤(1)和(3)中所述的干燥优选为采用无水硫酸钠进行干燥。
步骤(2)中所述的己二胺和二碳酸二叔丁酯((boc)2o)优选为按摩尔比6:1配比计算。
步骤(2)中所述的己二胺的甲醇溶液优选为通过如下方法制备得到:将己二胺分散于甲醇中,冰浴条件下搅拌0.5~1.0h,得到己二胺的甲醇溶液。
步骤(2)中所述的滴加时间为0.5~1.0h;优选为0.5h。
步骤(2)中所述的反应时间为6~12h;优选为6h。
步骤(2)中所述的乙酸乙酯萃取的次数为3~6次;优选为5次。
步骤(2)中所述的用水萃取的次数为3~6次;优选为5次。
步骤(2)中所述的调ph至酸性为采用稀盐酸溶液调至ph=4。
所述的稀盐酸溶液优选为ph=4的稀盐酸溶液。
步骤(2)中所述的调ph至碱性为采用氢氧化钠溶液调至ph=9。
所述的稀氢氧化钠的浓度优选为1mol/l。
步骤(2)中所述的冻干优选为通过如下方法实现:在-20℃下保存2~4h后,放入冷冻干燥机中干燥。
步骤(3)中所述的反应时间优选为12h。
步骤(3)中所述的洗涤为采用稀盐酸水溶液进行洗涤;优选为用稀盐酸水溶液洗涤3次。
所述的稀盐酸溶液优选为ph=4的稀盐酸溶液。
步骤(3)中所述的产物1、产物2、dmap(4-二甲氨基吡啶)、三乙胺按摩尔比为1.0:1.3:1.0:8.0配比计算。
步骤(4)中所述的滴加的时间为0.25~0.75h;优选为0.5h。
步骤(4)中所述的dcm和三氟乙酸的体积比为30~50:1;优选为40:1。
步骤(4)中所述的反应的时间为4~8h;优选为6h。
步骤(4)中所述的产物3与三氟乙酸优选为按摩尔比1:6.73配比计算。
步骤(5)中所述的混合溶剂优选为乙二醇乙醚和水按体积比3:1配比得到的混合溶剂。
步骤(5)中所述的反应的温度优选为130℃。
步骤(5)中所述的反应的时间为10~15h;优选为12h。
步骤(5)中所述的洗涤为用去离子水洗2~5次;优选为用去离子水洗3次。
步骤(5)中所述的反应的温度优选为50℃。
步骤(5)和(6)中所述的反应优选为在惰性气体保护下进行反应。
所述的惰性气体优选为氮气。
步骤(6)中所述的反应的时间为6~8h。
步骤(6)中所述的六氟磷酸铵的添加量为按六氟磷酸铵和金属铱(ircl3)摩尔比为10~20:1配比计算。
步骤(6)中所述的搅拌的时间为6~8h;优选为6h。
步骤(6)中所述的铱联吡啶配合物还可以进一步经氧化铝柱层析纯化。
所述的氧化铝胶柱层析为采用二氯甲烷和甲醇的洗脱剂进行洗脱。
所述的二氯甲烷和甲醇的体积比为1~100:1,优选为30:1。
所述的铱联吡啶配合物在制备抗肿瘤药物中的应用。
所述的肿瘤包括人非小细胞肺癌、人宫颈癌、人胃癌、黑色素瘤、人成骨肉瘤、乳腺癌和脑胶质瘤。
一种肿瘤血管生成拟态靶向性dna纳米载药系统,包含上述铱联吡啶配合物。
所述的肿瘤血管生成拟态靶向性dna纳米载药系统的制备方法,包括如下步骤:
(a)将靶向分子修饰的四条寡核苷酸链溶解在1×tae/mg2+缓冲液中,2分钟内加热至95℃,逐渐冷却至2~8℃,得到靶向分子修饰的正四面体dna纳米粒子;
(b)将铱联吡啶配合物溶液与步骤(a)中得到的靶向分子修饰的正四面体dna纳米粒子共孵育1~72小时,然后离心、弃上清,再将沉淀用1×tae/mg2+缓冲液重悬,得到肿瘤血管生成拟态靶向性dna纳米载药系统(负载铱联吡啶配合物的dna纳米载药系统)。
步骤(a)中所述的靶向分子为muc-1粘蛋白适配体、整合素、as1411核酸适配体、叶酸、转铁蛋白、穿膜肽、半乳糖胺、新生血管靶向肽和粒细胞巨噬细胞刺激因子中的一种或以上;优选为muc-1粘蛋白适配体和/或as1411适配体,muc-1粘蛋白适配体或as1411适配体可以与四条寡核苷酸链的任意一条单链结合在dna5’端上。
步骤(a)中所述的四条寡核苷酸链的序列如下所示:
s1:5’-ggctatagcacatgggtaaaagacaggcagttgagacgaacattcctaagtctgaaatttatcacccgccatagtagacgtatcacc-3’(seqidno:1);
s2:5’-ggtggtggtggttgtggtggtggtggcttgctacacgattcagacttaggaatgttcgacatgcgagggtccaataccgacgattacag-3’(seqidno:2);
s3:5’-ggtggtggtggttgtggtggtggtggggtgataaaacgtgtagcaagctgtaatcgacgggaagagcatgcccatccactactatggcg-3’(seqidno:3);
s4:5’-ggctatagcacatgggtaaaacgaccctcgcatgactcaactgcctggtgatacgaggatgggcatgctcttcccgacggtattggac-3’(seqidno:4)。
步骤(a)中所述的冷却的时间优选为2~48h;优选为2h。
步骤(a)和(b)所述的1×tae/mg2+缓冲液的配方为:20mmtris、2mmedta、12.5mmmgcl2。
步骤(a)中所述的寡核苷酸链的浓度优选为1~100μm。
步骤(b)所述的铱联吡啶配合物溶液为将铱联吡啶配合物溶解于dmso(二甲基亚砜)得到的溶液。
所述的铱联吡啶配合物溶液的浓度优选为0.01~1mm。
步骤(b)中所述的孵育的时间优选为24h。
步骤(b)中所述的离心的转速优选为5000~10000rpm;离心的时间优选为10分钟;离心的次数优选为2次。
步骤(b)中所述的负载铱联吡啶配合物的dna纳米载药系统的保存方式为:在2~8℃的磷酸盐缓冲溶液中以液体形态保存。
本发明相对于现有技术具有如下的优点及效果:
1、本发明的目的在于开发一种具有良好抗肿瘤活性的新型铱联吡啶配合物,并设计构建了具有肿瘤血管生成拟态靶向性的dna纳米载药体系负载铱联吡啶配合物,以提高其对肿瘤血管生成拟态的靶向性,实现高效低毒的肿瘤治疗目标。
2、本发明所合成的新型铱联吡啶配合物较其他类型配合物具有较好的水溶性和较强的荧光性质,可增强药物在体内的稳定性和可示踪性。采用单边保护己二胺,再脱保护的方式,可高效选择性地合成配体bpy-c6-nh2,产率高达80%以上。
3、由于铱联吡啶配合物结构不具有靶向基团,因此其对肿瘤细胞和正常细胞无选择性。为了克服铱联吡啶配合物的缺点,本发明利用铱联吡啶配合物与dna具有高亲和性的特点,通过构建具有vm靶向性的dna纳米载体来负载铱联吡啶配合物,提高了铱联吡啶配合物对肿瘤的靶向性和抗肿瘤效果。且本发明制备方法简单易行,制备的产物可在磷酸盐缓冲溶液中稳定保存,利于储藏。
4、本发明中将vm靶向分子(优选muc-1粘蛋白适配体)修饰在dna链5端,可实现对人非小细胞肺癌、人宫颈癌、人胃癌、黑色素瘤、人成骨肉瘤、乳腺癌和脑胶质瘤等细胞的靶向识别效果。
5、传统药物进入胞浆后只有1-5%可以进入细胞核发挥疗效,而本发明将靶向细胞核的适配体(as1411适配体)修饰在dna链5端,可有效提高药物进入肿瘤细胞核的效率,从而发挥更好的抗肿瘤效果。
6、由于铱联吡啶配合物具有强荧光性,因此可通过荧光示踪或活体成像技术对vm靶向性dna纳米载药体系进行体内示踪与定位,为给药方式和给药剂量提供指导。
附图说明
图1是本发明实施例1所得产物1—联吡啶活性酯2,5-二羰基-1-吡咯烷基4'-甲基-[2,2'-联吡啶]-4-羧酸酯的合成路线图。
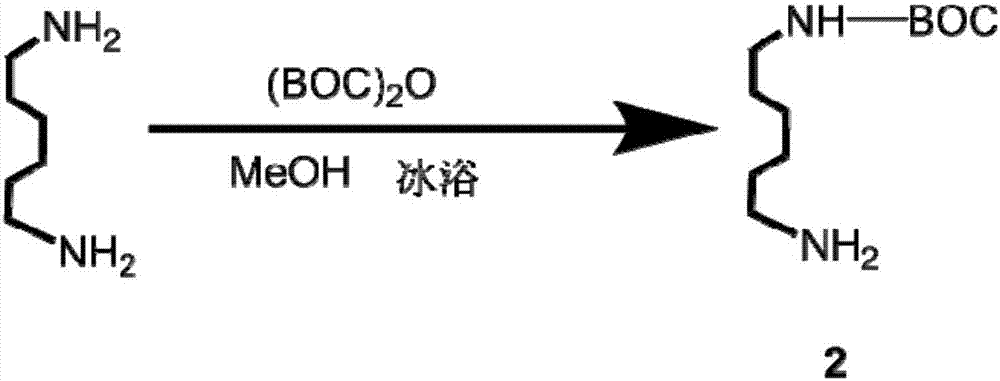
图2是本发明实施例1所得产物2—叔丁基-(6-氨己基)-氨基甲酸酯的合成路线图。
图3是本发明实施例1所得产物3叔丁基-(6-(4'-甲基-[2,2'-联吡啶]-4-甲酰胺)己基)氨基甲酸酯的合成路线图。
图4是本发明实施例1所得产物4(n-(6-氨基己基)-4'-甲基-[2,2'-联吡啶]-4-甲酰胺)的合成路线图。
图5是本发明实施例1所得产物5—氯桥连中间体的合成路线图。
图6是实施例1所得产物6—铱联吡啶配合物的合成路线图。
图7是实施例1所得铱联吡啶配合物质谱表征图,其中,图a为全谱图,图b为同位素谱图,图c为理论同位素谱图。
图8是实施例1所得铱联吡啶配合物氢谱表征图。
图9是本发明实施例3所得负载铱联吡啶配合物的靶向性dna纳米粒子(apt-cage@ir)的粒度分布图。
图10是本发明实施例3所得apt-cage@ir的电位图。
图11是本发明实施例3所得apt-cage@ir的原子力显微镜形貌图,其中,图a为apt-cage的2d形貌图,图b为apt-cage@ir的2d形貌图,图c为apt-cage3d形貌图,图d为apt-cage@ir的3d形貌图。
图12是本发明实施例3所得apt-cage@ir的紫外光谱图。
图13是本发明实施例3所得apt-cage@ir的荧光光谱图。
图14是本发明实施例4中apt-cage@ir抑制u251人脑胶质瘤、u87人脑胶质瘤、mcf-7人乳腺癌、chem-5人脑胶质细胞和hbm人脑微血管内皮细胞的细胞存活率图。
图15是本发明实施例4中apt-cage@ir诱导人脑胶质瘤细胞凋亡时发生的线粒体断裂图。
图16是本发明实施例4中apt-cage@ir处理人脑胶质瘤细胞的活性氧(ros)水平变化图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1铱联吡啶配合物的制备
1.铱联吡啶配合物的合成
(1)产物1的合成:如图1所示,取4-甲基-[2,2’联吡啶]-4-羧酸(0.3g,1.4mmol)(购于郑州阿尔法公司)与n-羟基琥珀酰亚胺(nhs,0.257g,2.24mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc,0.322g,1.68mmol)分散于15mldmf(n,n-二甲基甲酰胺)口烧瓶中,加热至50℃,反应12h。待反应结束后,减压旋干dmf溶液。加入去离子水50ml,见固体析出。二氯甲烷萃取(15ml,萃取3次),取淡黄色的有机层。然后用无水硫酸钠干燥、抽滤、取滤液,用旋转蒸发仪蒸干滤液,得到淡粉白色固体,即为联吡啶羧基的活性酯:2,5-二羰基-1-吡咯烷基4'-甲基-[2,2'-联吡啶]-4-羧酸酯(产物1),产率65.2%。
(2)产物2的合成:如图2所示,取己二胺15.97g(137.46mmol)分散于300ml甲醇在500ml圆底烧瓶中,冰浴下搅拌0.5h,得到己二胺的甲醇溶液。而后取二碳酸二叔丁酯(boc)2o10g(45.82mmol)溶于100ml甲醇,加入150ml恒压滴液漏斗中,冰浴下滴加入己二胺的甲醇溶液中,滴加时间不少于30min为宜,而后常温下反应6h。待反应结束后,减压旋干溶剂甲醇得白色固体。将固体分散于300ml去离子水溶液中,乙酸乙酯萃取(60ml,萃取5次),收集乙酸乙酯层,减压浓缩乙酸乙酯体积至100ml;而后在浓缩的乙酸乙酯溶液中加入ph=4的盐酸水溶液,调节体系至ph=5,常温下搅拌20min。再取用去离子水(20ml,5次)萃取盐酸盐boc-c6-nh3+cl-,收集水层。取1m的氢氧化钠溶液调节水层ph至9左右,-20℃下保存3h,而后冻干得白色固体,即产物2:叔丁基-(6-氨己基)-氨基甲酸酯,产率70.5%。
(3)产物3的合成:如图3所示,取上述产物1(0.91mmol)0.31g与产物2叔丁基-(6-氨己基)-氨基甲酸酯0.26g(1.19mmol)溶于50ml二氯甲烷(dcm)在100ml单口圆底烧瓶中,再加入4-二甲氨基吡啶(dmap)0.11g(0.91mmol),三乙胺1ml(7.2mmol),常温下反应12h。待反应结束后,用ph=4的盐酸水溶液,分三次洗涤反应所得溶液,每次10ml。收集有机层,无水硫酸钠干燥,抽滤,取滤液,减压旋蒸,得浅棕色的固体,即产物3:叔丁基-(6-(4'-甲基-[2,2'-联吡啶]-4-甲酰胺)己基)氨基甲酸酯,产率82.4%。
(4)产物4的合成:如图4所示,取产物3叔丁基-(6-(4'-甲基-[2,2'-联吡啶]-4-甲酰胺)己基)氨基甲酸酯0.412g(1.00mmol)分散于40mldcm在100ml圆底烧瓶中。取0.5ml三氟乙酸(6.73mmol)分散于20mldcm中,加入100ml恒压滴液漏斗中,冰浴下滴加入产物3的dcm溶液中(滴加时间为0.5h),而后常温下搅拌6h。待反应结束后,减压旋干溶剂,得淡黄色油状物,即产物4(n-(6-氨基己基)-4'-甲基-[2,2'-联吡啶]-4-甲酰胺),产率85.8%。
(5)产物5的合成:如图5所示,取三氯化铱(ircl3)固体0.6g(1.7mmol),2-(2-噻吩)-吡啶0.58g(3.5mmol)分散于装有乙二醇乙醚和水的混合溶剂的三颈瓶中,其中乙二醇乙醚和水体积比为3:1,总体积为40ml。在氮气保护下,130℃反应12h。待反应结束后,抽滤,去离子水洗(10ml,洗3次),取滤饼。真空干燥箱中50℃干燥,即为氯桥连中间体(产物5),产率71.5%。
(6)产物6的合成:如图6所示,取上述产物5(氯桥连中间体)0.2g(0.18mmol)与上述产物4(n-(6-氨基己基)-4'-甲基-[2,2'-联吡啶]-4-甲酰胺)0.12g(0.4mmol)分散于二氯甲烷和甲醇的混合溶剂中,其中二氯甲烷和甲醇的体积比为1:1,总体积为150ml。加热至50℃,氮气保护下,反应6h。待反应结束后,加入六氟磷酸铵0.59g(3.6mmol),常温下搅拌6h,而后抽滤,取滤液,减压旋蒸,得粗产物6。而后,使用200~300目的氧化铝进行柱层析纯化,用8ml二氯甲烷:甲醇=10:1的混合溶剂溶解样品,每次上样量为0.5g,洗脱剂为二氯甲烷和甲醇(体积比为30:1),减压旋蒸溶剂,得产物6(即铱联吡啶配合物),产率为53.3%。利用esi-tofms、核磁共振氢谱、chns元素分析进行表征。(图7、图8)。
[ir(iii)(thpy)2(bpy-c6-nh2)](pf6)
anal.calcdforc36h36f6irn6ops2(%):c,44.58;h,3.74;n,8.66,s,6.61.found(%):c,44.24;h,3.81;n,8.68,s,6.61esi-tofms(ch3oh):m/z825.2834[m]+.1hnmr:(dmso-d6,δppm)δ9.24(d,2h),8.92(s,1h),7.96(dd,1h),7.85(d,1h),7.75(dd,4h),7.68(dd,2h),7.61–7.57(m,3h),7.54–7.50(m,2h),7.45(d,1h),6.93–6.82(m,2h),6.10(dd,2h),3.26(dd,2h),2.73–2.67(m,2h),2.46–2.42(m,3h),1.52–1.45(m,4h),1.30–1.25(m,4h).
实施例2靶向性dna纳米粒子的制备
在寡核苷酸1链(s1)和4链(s4)的5’端连接muc-1粘蛋白适配体(生工生物工程股份有限公司),在寡核苷酸2链(s2)和3链(s3)的5’端连接as1411核酸适配体(生工生物工程股份有限公司),四条寡核苷酸链(生工生物工程股份有限公司)的碱基序列如下:
s1:(5’)ggctatagcacatgggtaaaagacaggcagttgagacgaacattcctaagtctgaaatttatcacccgccatagtagacgtatcacc(3’);
s2:(5’)ggtggtggtggttgtggtggtggtggcttgctacacgattcagacttaggaatgttcgacatgcgagggtccaataccgacgattacag(3’);
s3:(5’)ggtggtggtggttgtggtggtggtggggtgataaaacgtgtagcaagctgtaatcgacgggaagagcatgcccatccactactatggcg(3’);
s4:(5’)ggctatagcacatgggtaaaacgaccctcgcatgactcaactgcctggtgatacgaggatgggcatgctcttcccgacggtattggac(3’)。
将靶向修饰的四条寡核苷酸链(摩尔比1:1:1:1)溶解在1×tae/mg2+缓冲液(20mmtris、2mmedta、12.5mmmgcl2)至终浓度为25μm(每条单链的浓度)。将混合物在2分钟内加热至95℃,并逐渐冷却至2℃,冷却时间为2小时,得到muc-1和as1411修饰的正四面体dna纳米粒子(apt-cage)。
实施例3靶向性dna纳米粒子负载铱联吡啶配合物的制备
将铱联吡啶配合物溶于dmso(二甲基亚砜)中,得到100μm的铱联吡啶配合物溶液,再与实施例2中得到的muc-1和as1411修饰的正四面体dna纳米粒子共孵育24小时。反应结束后,2轮离心(每轮10分钟,转速8000rpm),弃上清,将沉淀用1×tae/mg2+缓冲液重悬,得到负载铱联吡啶配合物的靶向性dna纳米粒子(apt-cage@ir),apt-cage@ir可在2~8℃的磷酸盐缓冲溶液中以液体形态保存。用nano-zs(malverninsrumentslimited)表征apt-cage@ir的粒度及zeta电位。如图9所示,铱联吡啶配合物与apt-cage的结合使dna纳米载药体系的流体力学直径从571.9nm变成712.4nm,说明所合成的vm靶向性dna纳米载药体系粒度均一,分散均匀。zeta电位数据证明,负载了铱联吡啶配合物后,dna纳米载药体系的zeta电位值从-9.3mv±2.6变成21.0mv±3.0(图10),这说明配合物已成功负载到dna纳米载药体系中。原子力显微镜照片显示,apt-cage@ir的平均尺寸为235nm±2.9,平均高度为17.7nm±3.9(图11),说明铱联吡啶配合物的载入能增大了apt-cage的结构,但仍维持三角锥的结构。将等量的dna溶液(0.25μm)加入到含0.25mm铱联吡啶配合物的1×tae/mg2+缓冲溶液中连续滴定,铱联吡啶配合物的紫外吸收强度和荧光强度均逐渐减弱,证明了铱联吡啶配合物通过部分插入的作用与apt-cage结合(图12,13)。
实施例4靶向性dna纳米粒子负载铱联吡啶配合物的抗肿瘤活性及相关机制
本实施例中使用的细胞均购自atcc全球生物资源中心。首先用mtt比色法检测apt-cage@ir抑制u251人脑胶质瘤(atcc)、u87人脑胶质瘤(atcc)、mcf-7人乳腺癌(atcc)、chem-5人脑胶质细胞和hbm人脑微血管内皮细胞生长的能力(图14);用线粒体荧光探针&细胞核荧光探针双染法(mitotracker&hoechstco-stainingassay)在荧光显微镜(nikoneclipse80i)下观察apt-cage@ir诱导u251人脑胶质瘤细胞凋亡时线粒体断裂的情况(图15);基于apt-cage@ir诱导线粒体功能紊乱的结果,我们进一步检测apt-cage@ir对u251人脑胶质瘤细胞内活性氧(ros)水平的影响(图16)。
结果显示,apt-cage@ir能明显提高铱联吡啶配合物对脑胶质瘤细胞和乳腺癌细胞的毒性,并明显降低其对正常脑胶质细胞和正常人脑微血管内皮细胞的毒性。此外,apt-cage@ir能诱导肿瘤细胞线粒体功能紊乱,促使细胞内ros上升,引起细胞死亡,具有良好的抗肿瘤效果。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>暨南大学
广州市药品检验所
<120>一种铱联吡啶配合物及合成方法以及在dna纳米载药系统中的应用
<130>1
<160>4
<170>patentinversion3.5
<210>1
<211>87
<212>dna
<213>artificialsequence
<220>
<223>s1
<400>1
ggctatagcacatgggtaaaagacaggcagttgagacgaacattcctaagtctgaaattt60
atcacccgccatagtagacgtatcacc87
<210>2
<211>89
<212>dna
<213>artificialsequence
<220>
<223>s2
<400>2
ggtggtggtggttgtggtggtggtggcttgctacacgattcagacttaggaatgttcgac60
atgcgagggtccaataccgacgattacag89
<210>3
<211>89
<212>dna
<213>artificialsequence
<220>
<223>s3
<400>3
ggtggtggtggttgtggtggtggtggggtgataaaacgtgtagcaagctgtaatcgacgg60
gaagagcatgcccatccactactatggcg89
<210>4
<211>88
<212>dna
<213>artificialsequence
<220>
<223>s4
<400>4
ggctatagcacatgggtaaaacgaccctcgcatgactcaactgcctggtgatacgaggat60
gggcatgctcttcccgacggtattggac88
- 还没有人留言评论。精彩留言会获得点赞!