一种检测凝血酶蛋白浓度的方法与流程
本发明涉及一种检测凝血酶蛋白浓度的方法,属于生物医学领域中的蛋白质检测领域。
背景技术:
凝血酶是一种在凝血系统中有着重要调节作用的丝氨酸蛋白酶,在生理学上起着十分重要的作用。它参与人体生理和病理的一些反应,如组织修复、炎症、血小板激活和创伤愈合等过程。凝血酶在凝血系统中有促凝和抗凝的双重特性,它在血液中含量的变化会引起凝血功能异常。同时,它作为凝血机制的一种重要衡量指标,也是某些疾病诊断如软骨滑膜炎症等诊断标志物。因此,凝血酶在体内含量的检测对临床上疾病的诊断、治疗、预防和评估都具有十分重要的意义。
核酸适配体是一段由几十个碱基组成的单链寡聚核苷酸,它能通过“假碱基对”的堆积、氢键作用、静电作用和形状匹配等方式与各种目标分子特异性、紧密地结合。这些目标分子可以是各种小分子、氨基酸、病毒、蛋白质和染料,甚至可以是亚细胞器和细胞。一般,目标分子可以诱导它形成一些特定的空间结构,如g-四链体、发卡、t结、茎环等。它能特异性识别靶分子,因此,它和传统的化学抗体相似,但是与抗体相比,它又表现出许多优势,如活性稳定、易修饰、成本低、分子量小和易于长期储存等特点。因此,基于核酸适配体的传感器在很多方面都有很好的应用,如食品检测、药物分析、环境监控及生化分析等方面。由于凝血酶蛋白与其核酸适配体具有非常高的亲和力,能够以g-四链体的形式与凝血酶蛋白发生特异性结合,因此利用它们之间的特异性相互作用,可以在分子水平上对凝血酶蛋白进行含量的监测,这对临床疾病的诊断、疾病的发展、疗效的评估等都具有十分重要的意义。
目前基于核酸适配体检测凝血酶蛋白(thrombin)的方法主要荧光共振能量转移、电化学法、表面等离子共振技术和吸光度法等,但这些方法技术要求高,灵敏度不高,很难满足现在检测的要求。而且,基于这些方法的检测,不能对检测物范围进行很好的调控,从而限制了这些方法的实际应用。
技术实现要素:
本发明的目的是提供一种检测凝血酶蛋白浓度的方法,本发明通过在核酸适配体一端修饰磁珠,通过测量磁珠产生的弱磁场,在获得磁珠本身剩磁大小的同时,通过磁信号强度的变化获得目标检测物的浓度;不仅可以通过核酸适配体互补序列对目标检测物的范围进行动态调控,也能通过机械力的改变,拓宽目标物的检测限,降低其灵敏度。
本发明提供的一种检测凝血酶蛋白浓度的方法,包括如下步骤:
(1)修饰的基底:将所述基底表面羟基化,然后依次使其表面氨基化和醛基化,得到修饰的基底;
(2)dna与所述修饰的基底的连接:将凝血酶蛋白核酸适配体与其互补dna链杂交并反应,然后与所述修饰的基底孵育,得到含有双链dna的基底;
(3)磁珠的连接与磁化:将磁珠加入所述含有双链dna的基底上孵育,然后采用磁铁对所述磁珠进行磁化;
(4)互补dna链临界点的测定:将步骤(3)处理的所述含有双链dna的基底上加入凝血酶蛋白的缓冲溶液,孵育,在超低场中检测双链dna之间的解离力;在上述相同的条件下,通过调控所述互补dna链的序列长度,分别在有凝血酶和无凝血酶存在情况下测定,得到不同配对碱基数的双链dna解离力谱图,得出凝血酶蛋白核酸适配体与互补dna链、凝血酶蛋白之间相互竞争的临界互补dna链长度和互补dna链临界点;
(5)凝血蛋白酶浓度的检测:通过下述步骤1)或2),即得到凝血蛋白酶的浓度;
1)通过序列调控对凝血酶蛋白进行检测:在步骤(3)得到的含有双链dna的基底上加入凝血酶蛋白,反应,然后在作用力下测定磁信号的强度,通过磁信号的变化,得出所述凝血酶蛋白的浓度;
2)通过机械力调控对凝血酶蛋白进行检测:选取所述互补dna链临界点之上的互补dna链与凝血酶蛋白核酸适配体杂交,再加入所述凝血酶蛋白,反应,然后通过机械力作用测定磁信号的强度,得到凝血酶蛋白的浓度。
本发明中,步骤(4)中,所述调控所述互补dna链的序列长度指的是改变碱基的种类,以改变互补碱基的数量。
上述的方法中,所述基底的材料为玻璃基底和/或pdms基底;所述氨基化的时间可为1~20小时,具体可为2小时;采用3-氨丙基三乙氧基硅烷溶液进行所述氨基化;所述3-氨丙基三乙氧基硅烷溶液为体积分数为1%的3-氨丙基三乙氧基硅烷的甲苯溶液;
所述醛基化的时间可为1~10小时,具体可为3小时、1~3小时、3~10小时或2~8小时;采用含有戊二醛的tris-hcl缓冲溶液进行所述醛基化;所述含有戊二醛的tris-hcl缓冲溶液为tris-hcl缓冲溶液中添加体积分数1%戊二醛的溶液制成。
上述的方法中,所述凝血酶蛋白核酸适配体序列为5’-biotin-tttttttttttttttttttttgtcactgtggttggtgtggttgg-3’,上述划线部分为与凝血酶蛋白特异性结合的序列;所述互补dna链为3’-acagtgacaccaaccacaccaacct20-nh2-5’,上述划线部分为可调控序列;
步骤(2)中,所述杂交的温度可为80~95℃,具体可为90℃;所述反应的时间可为1~10分钟,具体可为5min;所述孵育的时间可为10~60分钟,具体可为60分钟。
上述的方法中,所述磁珠的浓度可为1~20mg/ml,具体可为10mg/ml;
步骤(3)中,所述孵育的时间可为0.5~3小时,具体可为2小时;
所述磁化的时间可为0.1~30min,具体可为2min;
所述磁铁的强度为1t,所述磁铁与所述磁珠的距离可为0.5~10cm,具体可为2cm。
本发明中,步骤(4)中双链dna之间的解离力的测定,磁珠所受离心力大小可由公式精确得到:f=(ρm-ρb)vmω2r;上述公式中,ρm是磁性粒子的密度,ρb是缓冲液的密度(1.0g·cm-3),vm是磁性粒子的体积,ω是旋转速度,r是样品到旋转中心的距离。
上述的方法中,所述临界点为6个碱基到7个碱基之间,具体指的是互补dna链中的6个碱基与所述凝血酶蛋白核酸适配体序列中划线部分的6个碱基配对时,所述凝血酶蛋白核酸适配体仍能与凝血酶蛋白结合,形成g-四链体,当配对碱基个数为7个时,所述凝血酶蛋白核酸适配体与所述互补dna链结合紧密,此时所述凝血酶蛋白核酸适配体不能形成g-四链体与过量凝血酶蛋白结合;
所述缓冲溶液为tris-hcl缓冲溶液;所述tris-hcl缓冲溶液包括20mmtris-hcl、140mmnacl、5mmkcl、1mmcacl2和1mmmgcl2,ph值为7.4。
上述的方法中,步骤(5)-1)中,所述作用力大小为25pn;
与所述凝血酶蛋白发生特异性结合配对的所述互补dna碱基序列个数为2到5个。
上述的方法中,步骤(5)-2)中,所述互补dna链临界点之上的互补dna链配对碱基个数为9,所述机械力的大小为76pn、89pn、102pn和120pn。
上述的方法中,步骤(3)中还包括在孵育后进行离心的步骤,采用低速离心,以去除物理吸附;
所述离心的离心力为5pn。
本发明具有以下优点:
1、本发明所采用的信号源是磁信号,与传统荧光信号相比,不受环境光线及溶液颜色的干扰,因此检测更灵敏,使用范围更加广泛。
2、本发明实现了对凝血酶蛋白的无标记检测,实验中的凝血酶蛋白处于完全自由的状态,没有经过任何化学修饰。
3、本发明通过序列调控的手段,通过改变互补dna的长度,调节了对凝血酶蛋白的检测范围,与传统的固定互补dna序列的长度相比,拓展了其动态检测范围。
4、本发明可以通过机械力的调控,改变了互补dna链之间的作用力,通过施加不同的机械力,也可以实现对凝血酶蛋白的动态检测,现有的其他方法很少能做到通过机械力的调控来拓宽其检测范围。
5、本发明还可以同时结合序列调控和机械调控,进一步调控其对凝血酶蛋白的检测范围,使其检测范围更广,灵敏度更低。
6、本发明除了能检测蛋白质以外,还能够实现对小分子,细胞等的检测,进一步拓展其应用范围。
附图说明
图1为本发明利用超低场机械传感器检测凝血酶蛋白的检测原理图。
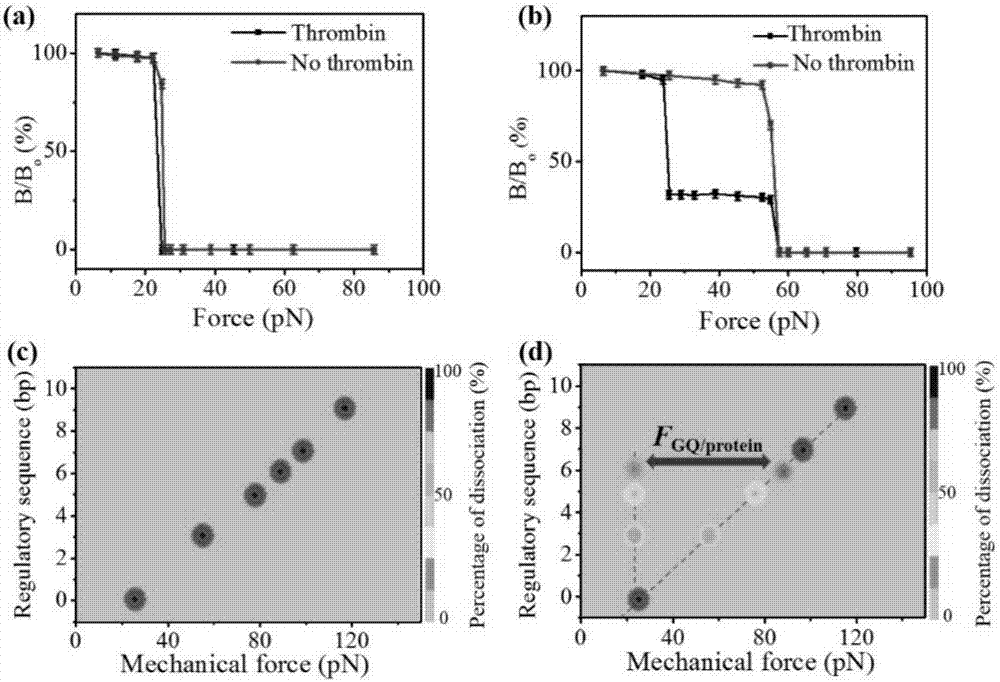
图2为通过序列调控,双链dna(a,b)在有凝血酶蛋白和没有凝血酶蛋白存在情况下,双链dna的解离力谱图;通过二维力谱(c,d)获得核酸适配体与凝血酶蛋白和互补dna三者之间的平衡点。
图3为在26pn的固定机械力作用下,通过序列调控获得核酸适配体读凝血酶蛋白的动态检测范围。
图4为当与核酸适配体配对碱基个数为9时,通过机械力的调控获得核酸适配体对凝血酶蛋白的动态检测范围。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中,tris-hclbuffer,即tris-hcl缓冲溶液,具体包括20mmtris-hcl,140mmnacl,5mmkcl,1mmcacl2,1mmmgcl2,ph=7.4;
凝血酶蛋白核酸适配体序列为5’-biotin-tttttttttttttttttttttgtcactgtggttggtgtggttgg-3’,上述划线部分为与凝血酶蛋白特异性结合的序列;互补dna链为3’-acagtgacaccaaccacaccaacct20-nh2-5’,上述划线部分为可调控序列。
实施例1、醛基化玻璃基底的制备
将小玻片放在丙酮溶液中超声清洗,再用超纯水清洗,再用1m的naoh溶液超声清洗10分钟,去除表面的油污,然后用去离子水和无水乙醇清洗,250℃下灭菌处理3h。将上述处理好的小玻片放入新配制的piranha溶液(食人鱼溶液,体积比,98%浓h2so4/30%h2o2=7:3)在90℃下处理30分钟,使玻璃表面羟基化。再将羟基化的小玻片放在含有1%的aptes的甲苯溶液中,室温孵育2小时,使小玻片表面氨基化。将氨基化的玻片在含有戊二醛(1%v/v)的tris-hclbuffer中室温孵育3小时,然后用tris-hclbuffer清洗2次,即得修饰的玻璃基底。
实施例2、dna的杂交与固定
将50ul3um的凝血酶核酸适配体(gqdna)与50ul3um的互补dna序列ri(i=1、2、3……15)等体积混合,在90℃下反应5min,自然冷却至室温得杂交双链dna。取20ul杂交后的双链dna溶液滴涂在本发明实施例1中修饰的玻璃基底表面,4℃孵育10h。然后用tris-hcl缓冲溶液冲洗掉表面没有键合的双链dna分子,再用质量体积分数为1%的含bsa的基准缓冲溶液孵育30min,再连接上磁珠m-280,过程如图1所示。
实施例3、力谱的测量
在上述连接dna的玻璃基底上,加入20ul300nm的凝血酶蛋白,溶解凝血酶蛋白所用的缓冲溶液为tris-hclbuffer(20mmtris-hcl,140mmnacl,5mmkcl,1mmcacl2,1mmmgcl2,ph=7.4),在37℃条件下,将凝血酶蛋白与双链dna孵育30min,用标准缓冲溶液冲洗掉未反应的凝血酶蛋白。将上述处理好的待测样品在磁铁(~0.8t)下磁化2分钟,然后在1000rpm下离心5分钟,去除物理吸附。然后在超低场原子磁力仪上检测磁信号。逐渐增加离心力的大小,每次离心时间仍为5分钟,记录每次离心力对应的磁信号强度。由于双链dna之间是非共价键结合,在逐渐增加离心力的情况下,最先发生解离的为双链dna。一旦解离发生,磁性粒子将会发生布朗运动,磁偶极发生改变,磁信号就会下降。通过测量不同离心力作用下磁信号的变化,就可以获得双链dna之间的解离力。其中,磁珠所受离心力大小可由公式精确得到:f=(m-b)vm2r。公式中,m是磁性粒子的密度(1.5g·cm-3),b是缓冲液的密度(1.0g·cm-3),vm是磁性粒子的体积(直径为2.8m),是旋转速度,r是样品到旋转中心的距离(4.5cm)。如图2a、b,通过序列调控,在有凝血酶和无凝血酶存在情况下,不同配对碱基数的双链dna解离力谱图。如图2c、d通过二维力谱获得信号突变点,得到核酸适配体与凝血酶蛋白结合的临界点在6个碱基和7个碱基之间。
实施例4、通过序列调控的方法检测凝血酶蛋白
调控配对碱基数,使与凝血酶蛋白特异性结合的核酸适配体序列部分和互补dna配对的碱基数依次为2、3、4、5、6,调控核酸适配体与凝血酶蛋白的结合强度。然后加入不同浓度的凝血酶蛋白,孵育30分钟后,在26pn的作用力下离心,依次记录磁信号的变化曲线,得到磁信号随凝血酶蛋白的变化曲线,如图3所示。
通过图3可以得出,通过序列调控,本发明能调控核酸适配体对凝血酶蛋白的检测范围,与传统方法相比,检测范围更广。
实施例5、通过力谱调控的方法检测凝血酶蛋白
固定和凝血酶特异性结合的核酸适配体与互补dna的配对碱基数为9,分别在76pn,89pn,102pn的机械力作用下,加入不同浓度的凝血酶蛋白,孵育30分钟后离心,记录磁信号随凝血酶蛋白的变化曲线,如图4所示。
通过图4可以看出,通过力谱调控,进一步提高了实验的灵敏度,降低了最低检测浓度。本发明通过力谱方法成功拓展了对凝血酶蛋白的动态检测范围。
- 还没有人留言评论。精彩留言会获得点赞!