林可霉素的连续色谱分离纯化方法与流程
本发明属于药学领域,涉及一种抗菌药物林可霉素的分离纯化方法。
背景技术:
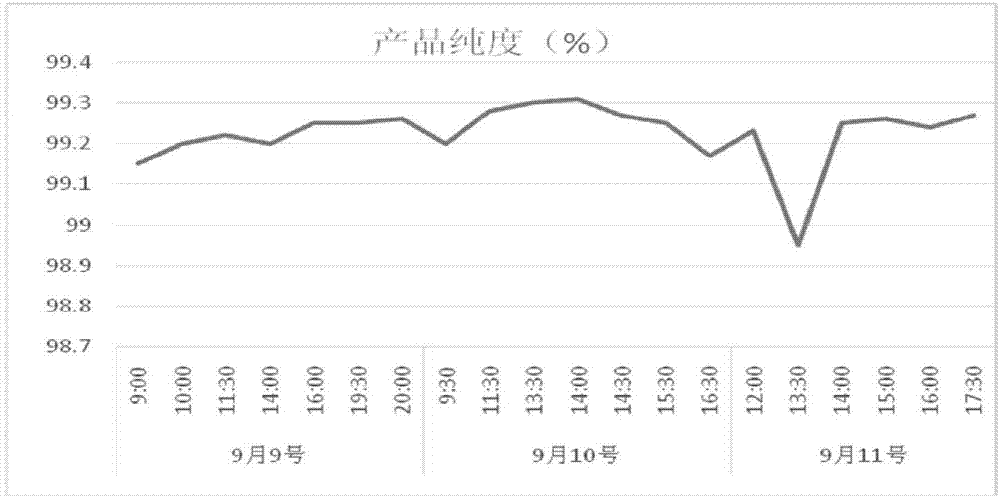
:林可霉素(c18h34n2o6s)又称林肯霉素、洁霉素,是一种对革兰氏阳性菌的有效抑制剂,其作用原理是作用于敏感菌核糖体的50s亚基,阻止肽链的延长,抑制细菌细胞的蛋白质合成。在高浓度下,对高度敏感细菌也具有杀菌作用。林可霉素具有耐药性发展缓慢、组织渗透性好、对呼吸系统感染等有较好的疗效,因此林可霉素被广泛用于临床治疗。在青霉素等其它抗生素的耐药菌逐渐被发现,导致这些抗生素使用受限制的情况下,林可霉素需求量在逐渐增加。林可霉素分子中因取代基团r的不同而分为a、b、c、d、k、s六种组份(见表1),在发酵过程中有不同程度的表达,其中a组份占90%以上,b组份占5~10%,其临床疗效仅为a组份的20%,且毒性较大,其余4种组份的总量不超过1%,疗效与a组份相似。b组份的衍生物的临床应用有很大的副作用,特别是对肠、肝、肾功能影响较大。因此,林可霉素b组份在其质量控制中占有重要地位。在直接作为药用的林可霉素产品中,要求b组份含量低于5%,而利用林可霉素作原料生产衍生物时,一般希望b组份含量低于3%。美国fda出口型更是要求b组份含量低于1%。表1林可霉素各组份取代基经过研究我们发现,目前林可霉素的生产工艺比较传统,生产得到的盐酸林可霉素含量不高,杂质含量也较多,且生产工艺时间长,无法满足市场需求。现有的林可霉素的生产工艺:林可霉素一般采用林可霉素链霉菌在一定条件下进行三级发酵,发酵液经酸化处理后过滤除去菌丝体,滤液用naoh调ph至11,向其中加入丁醇进行萃取提炼,加入hcl溶液反萃,减压浓缩后,活性炭吸附、结晶、干燥,得盐酸林可霉素原料药。为此,本发明在纯化方法上进行改进,通过林可霉素发酵滤液上连续色谱柱,利用林可霉素不同组份在树脂上的吸附速度不同,达到分离纯化的目的,得到一种高纯度的林可霉素制备的方法。技术实现要素:本发明的目的在于提供一种林可霉素的连续色谱分离纯化方法。本发明所述的纯化方法,步骤如下:步骤1,林可霉素发酵滤液上连续色谱柱,得到洗脱液;步骤2,洗脱液经过浓缩,结晶干燥得到林可霉素纯品。其中,步骤1所述上连续色谱柱,树脂选自:大孔吸附树脂hz-802、r-802、蓝欣-30、ab-8、ypr-ⅱ树脂,树脂颗粒直径在50~100目,均匀度95%以上。其中,步骤2所述洗脱液经过浓缩、干燥的过程如下:浓缩采用减压浓缩,真空度为0.02~0.15mpa,操作温度为35~90℃,浓缩至林可霉素质量浓度为25%~70%,得到浓缩液;浓缩液用丙酮结晶的方法得固体。其中,连续色谱选自:圆盘传送式连续色谱分离系统或者模拟移动床式连续色谱分离系统。其中,步骤1所述上连续色谱柱,由以下各段区组成:a、进料区(14-17#):该区域中进料分为两组平行进料。通过流速控制,原料首先进入14#口与15#口,在串联17#口与16#口,原料液经过树脂柱,产品被吸附在树脂上,检测14#柱出口料液与原料液一致,则判定为过饱和吸附。17#口与16#口出来的料液为中间料,进行套用进料。b、进料后水洗区(10-13#):该区域中的4个阀口以串联方式连接,位于吸附区后,树脂柱吸附饱和后,转动到洗料区,树脂柱内有过量的原料液,用水将柱子内剩余的料液与杂质b、c洗脱。洗脱下来的料液进入中间料进行套用进料。c、二次进料区(18-20#)该区域的阀口为串联连接。由于吸附区过饱和吸附,洗料区也含有部分原料液,所以设置二次进料区,这样可以保证产品的完全吸附,增加产品收率。同时由于杂质b与林可a在树脂上的吸附速度不一样,通过流速调整,可以将杂质b洗脱出来,但也会带出部分林可a。d、产品解析区(7-9#)在该区域内,采用串联连接方式。经过洗料区后,树脂柱内的杂质b、c已经很少,使用正丁醇将产品完成解析下来即可。该区域在柱子快要转动前一分钟,需要检测7#出口,确保7#出口不含有产品a或含极少量产品a,则代表产品完全解析。另检测产品周期样,确认解析下来的产品浓度与纯度。e、洗醇区(2-6#)在该区域内,采用串联连接方式。由于正丁醇密度比水小,所以采用反进水清洗,这样清洗效果会比较好,减少清洗用水量,该区域在转动前1分钟,需要检测2#出口的洗水,检测是否含有丁醇,以判断洗醇区是否清洗干净。f、树脂下压区(1#)由于洗醇区采用反进水清洗方式,所以树脂会被顶上去,在1#柱使用水将树脂下压回落,可以保证下个周期进料的使用效果。使用大流量冲洗,由于树脂柱清洗干净,该区域水可以反复使用。优选的,本发明的纯化方法,包括以下步骤:步骤1,林可霉素发酵滤液上连续色谱柱,得到洗脱液;步骤2,洗脱液经过浓缩,结晶干燥得到林可霉素纯品;其中,步骤1所述上连续色谱柱,树脂选自:大孔吸附树脂hz-802、r-802、蓝欣-30、ab-8、ypr-ⅱ树脂,树脂颗粒直径在50~100目,均匀度95%以上。其中,步骤2所述浓缩干燥,方法如下:浓缩采用减压浓缩,真空度为0.02~0.15mpa,操作温度为35~90℃,浓缩至林可霉素质量浓度为25%~70%,得到浓缩液;浓缩液用丙酮结晶的方法得固体;采用圆盘传送式连续色谱分离或者模拟移动床式连续色谱分离,步骤如下:a、进料区(14-17#):该区域中进料分为两组平行进料。通过流速控制,原料首先进入14#口与15#口,在串联17#口与16#口,原料液经过树脂柱,产品被吸附在树脂上,检测14#柱出口料液与原料液一致,则判定为过饱和吸附。17#口与16#口出来的料液为中间料,进行套用进料。b、进料后水洗区(10-13#):该区域中的4个阀口以串联方式连接,位于吸附区后,树脂柱吸附饱和后,转动到洗料区,树脂柱内有过量的原料液,用水将柱子内剩余的料液与杂质b、c洗脱。洗脱下来的料液进入中间料进行套用进料。c、二次进料区(18-20#)该区域的阀口为串联连接。由于吸附区过饱和吸附,洗料区也含有部分原料液,所以设置二次进料区,这样可以保证产品的完全吸附,增加产品收率。同时由于杂质b与林可霉素a在树脂上的吸附速度不一样,通过流速调整,可以将杂质b洗脱出来;d、产品解析区(7-9#)在该区域内,采用串联连接方式。经过洗料区后,树脂柱内的杂质b、c已经很少,使用正丁醇将产品完成解析下来即可。该区域在柱子快要转动前一分钟,需要检测7#出口,确保7#出口不含有产品a或含极少量产品a,则代表产品完全解析。另检测产品周期样,确认解析下来的产品浓度与纯度。e、洗醇区(2-6#)在该区域内,采用串联连接方式。由于正丁醇密度比水小,所以采用反进水清洗,这样清洗效果会比较好,减少清洗用水量,该区域在转动前1分钟,需要检测2#出口的洗水,检测是否含有丁醇,以判断洗醇区是否清洗干净。f、树脂下压区(1#)由于洗醇区采用反进水清洗方式,所以树脂会被顶上去,在1#柱使用水将树脂下压回落,可以保证下个周期进料的使用效果。使用大流量冲洗,将树脂柱清洗干净,该区域水可以反复使用。其中,所述杂质b、c分别为林可霉素b组份;其他混合杂质(含林可霉素c、d、k、s及其他)。其中,林可霉素发酵滤液由江西国药有限责任公司提供。林可霉素发酵滤液上连续色谱柱前,林可霉素a组分含量:20-25g/l,杂质林可霉素b组分含量:4-4.5%,ph:10-10.5,旋光检测:4.0-4.3。用本发明的纯化方法可以有效的去除或减少相关杂质,所得到的结果是:杂质林可霉素b组分≤0.3%,用高效液相色谱法(hplc)测定盐酸林可霉素(林可霉素a)纯度≥99.5%,水分≤5%。本发明的连续色谱分离纯化相对于现有方法而言,具有以下优点:1)缩短纯化时间,由原来的8h缩短为40min;2)降低成本,减缓操作流程;3)提高林可霉素的纯度,减少杂质的产生;4)由于连续运行,吸附或者离子交换后的产品成分和浓度保持稳定。5)相对固定床系统,树脂用量可减少50-90%。附图说明图1连续色谱分离纯化林可霉素的流程图图2实施例1:9-11日产品纯度图3实施例2:22-26日产品纯度图4实施例2:26-28日产品纯度具体实施方式实施例1步骤1,林可霉素发酵滤液上连续色谱柱,得到洗脱液;步骤2,洗脱液经过浓缩,结晶干燥得到林可霉素纯品。其中,步骤1所述上连续色谱柱,树脂选自:大孔吸附树脂hz-802,树脂颗粒直径在50~100目,均匀度95%以上。其中,步骤2所述洗脱液经过浓缩、干燥的过程如下:浓缩采用减压浓缩,真空度为0.02~0.15mpa,操作温度为35~90℃,浓缩至林可霉素质量浓度为25%~70%,得到浓缩液;浓缩液用丙酮结晶的方法得固体。其中,连续色谱选自:圆盘传送式连续色谱分离系统或者模拟移动床式连续色谱分离系统。其中,步骤1所述上连续色谱柱,由以下各段区组成:a、进料区(14-17#):该区域中进料分为两组平行进料。通过流速控制,原料首先进入14#口与15#口,在串联17#口与16#口,原料液经过树脂柱,产品被吸附在树脂上,检测14#柱出口料液与原料液一致,则判定为过饱和吸附。17#口与16#口出来的料液为中间料,进行套用进料。b、进料后水洗区(10-13#):该区域中的4个阀口以串联方式连接,位于吸附区后,树脂柱吸附饱和后,转动到洗料区,树脂柱内有过量的原料液,用水将柱子内剩余的料液与杂质b、c洗脱。洗脱下来的料液进入中间料进行套用进料。c、二次进料区(18-20#)该区域的阀口为串联连接。由于吸附区过饱和吸附,洗料区也含有部分原料液,所以设置二次进料区,这样可以保证产品的完全吸附,增加产品收率。同时由于杂质b与林可a在树脂上的吸附速度不一样,通过流速调整,可以将杂质b洗脱出来,但也会带出部分林可a。d、产品解析区(7-9#)在该区域内,采用串联连接方式。经过洗料区后,树脂柱内的杂质b、c已经很少,使用正丁醇将产品完成解析下来即可。该区域在柱子快要转动前一分钟,需要检测7#出口,确保7#出口不含有产品a或含极少量产品a,则代表产品完全解析。另检测产品周期样,确认解析下来的产品浓度与纯度。e、洗醇区(2-6#)在该区域内,采用串联连接方式。由于正丁醇密度比水小,所以采用反进水清洗,这样清洗效果会比较好,减少清洗用水量,该区域在转动前1分钟,需要检测2#出口的洗水,检测是否含有丁醇,以判断洗醇区是否清洗干净。f、树脂下压区(1#)由于洗醇区采用反进水清洗方式,所以树脂会被顶上去,在1#柱使用水将树脂下压回落,可以保证下个周期进料的使用效果。使用大流量冲洗,由于树脂柱清洗干净,该区域水可以反复使用。下面结合图1、图2及实施例进行详细说明进料液为江西国药目前进固定床前的粗品:每天开机情况及检测结果:日期料液纯度(%)一次结晶(%)二次结晶(%)9号99.1299.5299.5410-11号99.2699.5799.63设备参数如下:通过上面的数据分析,产品纯度可以稳定在99%以上。将9月10日-9月11日的产品取样进行结晶,得出一次结晶后的产品纯度为99.57%,二次结晶后的产品为99.63%。可判定使用该工艺可以达到目标的产品纯度。并进行二次实验判定产品收率。实施例2步骤如下:步骤1,林可霉素发酵滤液上连续色谱柱,得到洗脱液;步骤2,洗脱液经过浓缩,结晶干燥得到林可霉素纯品。其中,步骤1所述上连续色谱柱,树脂选自:大孔吸附树脂hz-802,树脂颗粒直径在50~100目,均匀度95%以上。其中,步骤2所述洗脱液经过浓缩、干燥的过程如下:浓缩采用减压浓缩,真空度为0.02~0.15mpa,操作温度为35~90℃,浓缩至林可霉素质量浓度为25%~70%,得到浓缩液;浓缩液用丙酮结晶的方法得固体。其中,连续色谱选自:圆盘传送式连续色谱分离系统或者模拟移动床式连续色谱分离系统。其中,步骤1所述上连续色谱柱,由以下各段区组成:a、进料区(14-17#):该区域中进料分为两组平行进料。通过流速控制,原料首先进入14#口与15#口,在串联17#口与16#口,原料液经过树脂柱,产品被吸附在树脂上,检测14#柱出口料液与原料液一致,则判定为过饱和吸附。17#口与16#口出来的料液为中间料,进行套用进料。b、进料后水洗区(10-13#):该区域中的4个阀口以串联方式连接,位于吸附区后,树脂柱吸附饱和后,转动到洗料区,树脂柱内有过量的原料液,用水将柱子内剩余的料液与杂质b、c洗脱。洗脱下来的料液进入中间料进行套用进料。c、二次进料区(18-20#)该区域的阀口为串联连接。由于吸附区过饱和吸附,洗料区也含有部分原料液,所以设置二次进料区,这样可以保证产品的完全吸附,增加产品收率。同时由于杂质b与林可a在树脂上的吸附速度不一样,通过流速调整,可以将杂质b洗脱出来,但也会带出部分林可a。d、产品解析区(7-9#)在该区域内,采用串联连接方式。经过洗料区后,树脂柱内的杂质b、c已经很少,使用正丁醇将产品完成解析下来即可。该区域在柱子快要转动前一分钟,需要检测7#出口,确保7#出口不含有产品a或含极少量产品a,则代表产品完全解析。另检测产品周期样,确认解析下来的产品浓度与纯度。e、洗醇区(2-6#)在该区域内,采用串联连接方式。由于正丁醇密度比水小,所以采用反进水清洗,这样清洗效果会比较好,减少清洗用水量,该区域在转动前1分钟,需要检测2#出口的洗水,检测是否含有丁醇,以判断洗醇区是否清洗干净。f、树脂下压区(1#)由于洗醇区采用反进水清洗方式,所以树脂会被顶上去,在1#柱使用水将树脂下压回落,可以保证下个周期进料的使用效果。使用大流量冲洗,由于树脂柱清洗干净,该区域水可以反复使用。下面结合图1、图3、图4及实施例进行详细说明进料液为江西国药目前进固定床前的粗品:每天开机情况及检测结果:二次实验9月22日开始进行,下表为调整运行时的纯度数据变化。从上表可以看出:前期实验阶段产品纯度不高,而且废料口有很多产品出来,可能是由于二次进料区域过长导致料液堆积,后期减少二次进料区域柱子数量,产品纯度逐渐上升。数据稳定后,26号开始连续进料,判断实验稳定性和收率。具体数据如下:每批次进料固定,做物料守恒并计算收率,具体数据如下表:收率是醇相与水相百分比之和。具体设备参数如下:其二次进料区柱子数为2根。取样结晶,实验结果如下:日期料液纯度(%)一次结晶(%)二次结晶(%)27号99.5399.6899.7428号第一批99.5899.7499.7928号第二批99.699.7199.77在实施例1工艺的基础上,通过调整不同区域柱子数量分配比,寻求提高产品纯度的最佳分配比,并进行产品收率判定。实施例3、本发明的纯化方法与现有纯化方法的比较为了考察林可霉素的最佳制备方法,将本发明的制备方法与现有工艺进行了对比实验,其中:方案1:发酵液经酸化处理后过滤除去菌丝体,滤液用naoh调ph至11,向其中加入丁醇进行萃取提炼,加入hcl溶液反萃,减压浓缩后,活性炭吸附、结晶、干燥,得盐酸林可霉素原料药。方案2:本发明的纯化方法(实施例2)。结果表明,本发明的纯化方法纯化的林可霉素纯度指标明显优于现有纯化方法。实施例4、按本发明所述纯化方法,将料液通过装填不同型号、颗粒直径、均匀度的树脂的连续色谱柱洗脱,后续结晶条件相同,所得林可霉素成品纯度数据如下:树脂型号颗粒直径均匀度(%)料液纯度(%)一次结晶(%)二次结晶(%)hz-80250~100≥9599.5399.6899.74hz-802>100≥9599.5385.9498.12hz-802>100<9599.5384.7296.65ab-850~100≥9599.5399.5299.69ab-8>100≥9599.5386.1597.95ab-8>100<9599.5383.1896.35蓝欣-3050~100≥9599.5399.4599.66蓝欣-3050~100<9599.5386.3598.37蓝欣-30>100<9599.5384.1796.28d-10150~100≥9599.5361.8465.58d-10150~100<9599.5359.7562.38d-101>100<9599.5355.1358.95bs-7550~100≥9599.5346.3866.29bs-7550~100<9599.5344.6860.37bs-75>100<9599.5334.9854.76当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1