一种芳香甲基酮SP3‑H直接脒化合成脒类化合物的方法与流程
本发明涉及一种脒类化合物的合成方法,特别涉及一种以芳基甲基酮或芳杂环甲基酮为原料,将其sp3-h直接脒化一步反应生成脒类化合物的方法,属于有机中间体合成领域。
背景技术:
脒是同一碳原子上同时连接有氨基和亚氨基的结构,主要包括环脒或非环脒两类。脒是许多天然产物和生物活性分子中的重要结构基团,包含脒结构的化合物在不同领域中具有广泛应用,如药物化学、合成中间体、催化剂设计、材料科学、超分子化学和配位化学等等。
现有技术中合成含脒结构化合物的方法,原始的方法是以亚胺氯与氨缩合得到,该方法对基团修饰困难,且亚胺氯原料成本高,反应不易控制,该方法逐渐淘汰。目前,含脒结构化合物的方法主要是以异腈和有机叠氮化合物作为原料,在过渡金属催化作用下进行酰胺化反应,可以得到含咪唑结构的化合物,该方法被认为是现有构建环状脒和无环脒重要途径。最近有报道通过c-h键与胺直接通过脱氢偶联脒化,c-h主要包括sp2杂化的c-h或sp3杂化的c-h键。jiao团队已经开发芳基乙醛和芳基胺(反应1)的铜催化氧化脱氢偶联,主要是伯胺与芳基乙醛进行缩合反应后,余下的sp2杂化的c-h进行脱氢与胺进行偶联反应(zhang,c.;zhang,l.;jiao,n.adv.synth.catal.2012,354,1293-1300.)。艾哈迈德和休姆报道了采用苯基乙醛酮与伯胺及仲胺(反应2)在不使用金属催化剂的作用下先进行缩合,再进行sp2杂化的c-h脱氢与胺偶联,得到含脒结构化合物(a.kumar,n.battini,r.r.kumar,s.athimoolam,q.n.ahmed,eur.j.org.chem.2016,3344-3348.)(g.martinez-ariza,n.mcconnell,c.hulme,org.lett.2016,18,1864-1867.)。最近,huang团队报道了α-氨基羰基化合物的次级sp3-h在铜催化下与胺进行氧化交叉偶联,也可以得到α氧代乙脒(反应3)(x.-x.liu,z.-y.wu,y.-q.he,x.-q.zhou,t.hu,c.-w.ma,g.-s.huang,adv.synth.catal.2016,358,2385-2391.)。这些报道主要以芳基醛类为原料,其成本高,稳定性差,不利于大规模生产。而芳基甲基酮稳定性好,成本较低,但是到目前为止,并未见到芳基甲基酮的三个sp3-h与胺一步反应直接脒化的相关报道。
反应1:
反应2:
反应3:
技术实现要素:
针对现有技术中芳基甲基酮或芳杂环甲基酮难以直接与胺反应获得脒类结构化合物的缺陷,本发明的目的是在于提供一种以芳基甲基酮或芳杂环甲基酮为原料将三个sp3-h直接氧化酰胺化一步反应生成脒类化合物的方法,该方法步骤简单、低成本,有利于工业化生产。
为了实现上述技术目的,本发明提供了一种脒类化合物的合成方法,在含氧气氛中,以及苯甲酸盐/极性非质子溶剂混合体系中,芳基甲基酮或芳杂环甲基酮,与芳基伯胺在铜盐和/或亚铜盐催化下反应,得到脒类化合物。
优选的方案,所述芳基甲基酮具有式1结构:
其中,ar选自苯基、含取代基的苯基、萘基或含取代基的萘基。所述含取代基的苯基为烷基苯基、烷氧基苯基、卤代苯基、三氟甲基苯基或烷氧酰基苯基。含取代基的苯基更优选为2-甲基苯基、3-甲基苯基、4-甲基苯基、4-叔丁基苯基、4-氟苯基、4-氯苯基、4-溴苯基、4-碘苯基、3-氯苯基、3-溴苯基、4-甲氧基苯基、4-三氟甲基苯基或4-甲氧酰基苯基。所述含取代基的萘基为烷基萘基、烷氧基萘基或卤代萘基。
优选的方案,所述芳杂环甲基酮具有式2结构:
其中,x为硫、氧或氮;x优选为硫或氧。
优选的方案,所述芳基伯胺具有式3结构:
其中,r和r1独立选自氢、烷基、烷氧基、卤代基、三氟甲基或烷氧酰基。优选的芳基伯胺包含的芳基为苯基或含间位或对位取代基的苯基,如4-甲基苯基、4-异丙基苯基、3-甲氧基苯基、4-氟苯基、4-氯苯基、4-溴苯基、4-碘苯基、3-氯苯基、3-溴苯基或3-碘苯基。
优选的方案,所述脒类化合物具有式4或式5结构:
其中,
x为硫、氧或氮;
ar选自苯基、含取代基的苯基、萘基或含取代基的萘基;
r和r1独立选自氢、烷基、烷氧基、卤代基、三氟甲基或烷氧酰基。
优选的方案,所述含取代基的苯基为烷基苯基、烷氧基苯基、卤代苯基、三氟甲基苯基或烷氧酰基苯基。
优选的方案,所述含取代基的萘基为烷基萘基、烷氧基萘基或卤代萘基。
优选的方案,所述苯甲酸盐为苯甲酸钠和/或苯甲酸钾;最优选为苯甲酸钠。
优选的方案,所述铜盐为氯化铜和/或溴化铜;较优选为氯化铜。
优选的方案,所述亚铜盐为氯化亚铜、碘化亚铜、溴化亚铜中至少一种;较优选为氯化亚铜。
本发明的技术方案最优选的催化剂为氯化铜。
优选的方案,所述极性非质子溶剂为dmso和/或dmf。更优选为dmso。
优选的方案,所述反应的条件为:温度为65~110℃,时间为10~30h,氧气分压1atm以上。较优选的反应条件为:温度为70~90℃,时间为20~30h,氧气分压1atm以上。
本发明的技术方案中芳基甲基酮或芳杂环甲基酮与芳基伯胺反应时,两者的理论反应摩尔比为1:2,实际反应过程中芳基伯胺稍微过量,一般反应摩尔比为1:2~2.5;最佳为1:2.2。铜盐或亚铜盐催化剂的加入量为芳基甲基酮或芳杂环甲基酮摩尔量的5~30%;最佳为芳基甲基酮或芳杂环甲基酮摩尔量的20%。醋酸盐的用量一般为芳基甲基酮或芳杂环甲基酮摩尔量的0.2~1倍,最佳用量为芳基甲基酮或芳杂环甲基酮摩尔量的0.5倍。
相对现有技术,本发明的技术方案带来的有益技术效果:
1)本发明首次将芳基甲基酮或芳杂环甲基酮的三个sp3-h成功直接脒化,填补了现有技术中的空白。
2)本发明以芳基甲基酮或芳杂环甲基酮为原料相对现有的芳基醛类原料具有成本低、稳定性好的优点。
3)本发明的脒类化合物收率高,根据引入基团的不同,最高收率可达91%。
4)本发明的合成方法步骤简单,通过一锅反应实现,反应条件温和,有利于工业化生产。
5)本发明的合成方法具有普适性,有利于引入不同的功能基团,可以根据需要设计不同的有机中间体。
附图说明
【图1】为实施例1制备的咪唑类化合物的核磁氢谱图;
【图2】为实施例1制备的咪唑类化合物的核磁碳谱图;
【图3】为实施例2制备的咪唑类化合物的核磁氢谱图;
【图4】为实施例2制备的咪唑类化合物的核磁碳谱图。
具体实施方式
以下实施例旨在进一步说明本发明内容,而不是限制本发明权利要求的保护范围。
以下实施例中涉及的底物原料,以及溶剂等均为市售商业产品(分析纯试剂),并且没有进一步纯化。
产品分离采用色谱法,色谱柱硅胶(300-400目)。
1hnmr(400mhz/500mhz),13cnmr(100mhz),以dmso为溶剂,以tms为内标。
多重性定义如下:s(单峰);d(二重峰);t(三重峰);q(四重峰)和m(多重峰)。偶合常数j(赫兹)。
实施例1~19按照以下方法进行:
向密封管中加入酮类化合物(0.5mmol),苯胺(1.1mmol),cucl2(13.4mg,0.1mmol),phcoona(36mg,0.25mmol)和dmso(1.0ml),并将反应混合物在80℃,1atm氧气氛下搅拌30小时,将有机层混合,用na2so4干燥,过滤并真空浓缩并通过硅胶柱颜色分类(洗脱剂:石油醚/乙酸乙酯)纯化,得到脒类化合物。
具体反应过程如下:
实施例1
酮类原料:
目标产物:
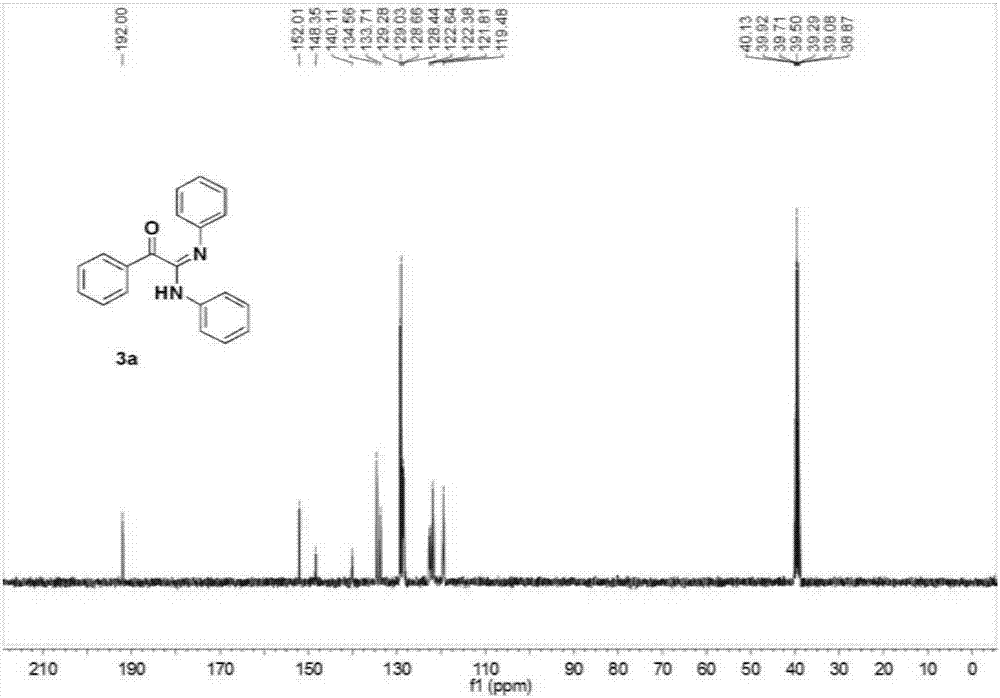
得到目标产物128.4mg,产率86%;黄色固体;1hnmr(400mhz,dmso)δ9.79(s,1h),7.85(d,j=7.9hz,2h),7.80(d,j=7.7hz,2h),7.62(t,j=7.3hz,1h),7.48(t,j=7.4hz,2h),7.34(t,j=7.5hz,2h),7.04(t,j=7.4hz,3h),6.78(t,j=7.2hz,1h),6.71(d,j=7.6hz,2h).13cnmr(101mhz,dmso)δ192.00,152.01,148.35,140.11,134.56,133.71,129.28,129.03,128.66,128.44,122.64,122.38,121.81,119.48。
实施例2
酮类原料:
目标产物:
得到目标产物105mg;产率67%;黄色固体;1hnmr(400mhz,dmso)δ9.80(s,1h),7.88(d,j=7.7hz,2h),7.69(d,j=7.7hz,1h),7.40(t,j=7.4hz,1h),7.34(t,j=7.5hz,2h),7.29(t,j=7.6hz,1h),7.16(d,j=7.5hz,1h),7.05(d,j=7.9hz,2h),7.00(s,1h),6.77(t,j=7.1hz,1h),6.64(d,j=7.5hz,2h),2.34(s,3h).13cnmr(101mhz,dmso)δ194.22,153.04,148.38,140.22,139.36,133.20,133.17,131.84,131.81,128.64,128.29,126.10,122.56,122.27,121.62,119.39,20.64.
实施例3
酮类原料:
目标产物:
得到目标产物116mg,产率74%;黄色固体;1hnmr(400mhz,dmso)δ9.76(s,1h),7.85(d,j=6.9hz,2h),7.62(d,j=10.0hz,2h),7.43(d,j=7.4hz,1h),7.38(d,j=7.5hz,1h),7.34(d,j=6.9hz,2h),7.05(s,3h),6.80(d,j=6.2hz,1h),6.72(d,j=6.8hz,2h),2.31(s,3h).13cnmr(101mhz,dmso)δ191.99,152.00,148.39,140.11,138.44,135.27,133.64,129.31,128.95,128.65,128.44,126.83,122.60,122.34,121.75,119.44,20.69.
实施例4
酮类原料:
目标产物:
得到目标产物119mg,产率76%;黄色固体;1hnmr(400mhz,dmso)δ9.76(s,1h),7.86(d,j=7.1hz,2h),7.72(d,j=7.7hz,2h),7.41–7.25(m,4h),7.05(s,3h),6.83–6.77(m,1h),6.73(d,j=6.8hz,2h),2.32(s,3h).13cnmr(101mhz,dmso)δ191.45,152.16,148.44,145.36,140.20,131.30,129.62,129.45,128.63,128.43,122.57,122.32,121.79,119.44,21.27.
实施例5
酮类原料:
目标产物:
得到目标产物119mg;产率67%;黄色固体;1hnmr(500mhz,dmso)δ9.77(s,1h),7.90(d,j=8.0hz,2h),7.81(d,j=8.4hz,2h),7.54(d,j=8.5hz,2h),7.34(t,j=7.7hz,2h),7.07(t,j=7.8hz,2h),7.04(d,j=10.0hz,1h),6.80(t,j=9.4hz,3h),1.27(s,9h).13cnmr(126mhz,dmso)δ191.33,157.93,152.12,148.45,140.21,131.28,129.43,128.65,128.46,125.98,122.57,122.34,121.84,119.43,35.01,30.65.
实施例6
酮类原料:
目标产物:
得到目标产物135mg,产率85%;黄色固体;1hnmr(400mhz,dmso)δ9.83(s,1h),7.89(t,j=6.5hz,4h),7.39–7.27(m,4h),7.06(s,3h),6.80(t,j=7.1hz,1h),6.73(d,j=7.4hz,2h).13cnmr(101mhz,dmso)δ190.53,166.87,164.34,151.80,148.31,140.05,132.46,132.36,130.61,130.59,128.68,128.49,122.73,122.47,121.78,119.51,116.42,116.19.
实施例7
酮类原料:
目标产物:
得到目标产物133.8mg,产率80%,黄色固体;1hnmr(400mhz,dmso)δ9.85(s,1h),7.86(d,j=7.1hz,2h),7.81(d,j=8.2hz,2h),7.55(d,j=8.3hz,2h),7.34(d,j=6.8hz,2h),7.06(s,3h),6.81(d,j=6.5hz,1h),6.72(d,j=6.9hz,2h).13cnmr(101mhz,dmso)δ191.01,151.61,148.20,140.00,139.50,132.44,131.03,129.29,128.68,128.51,122.74,122.52,121.77,119.48.
实施例8
酮类原料:
目标产物:
得到目标产物142mg,产率75%;黄色固体;1hnmr(400mhz,dmso)δ9.84(s,1h),7.85(d,j=6.6hz,2h),7.73(d,j=8.6hz,2h),7.70(d,j=8.5hz,2h),7.34(s,2h),7.06(s,3h),6.81(d,j=5.7hz,1h),6.72(d,j=6.5hz,2h).13cnmr(101mhz,dmso)δ191.24,151.57,148.18,139.99,132.73,132.25,131.07,128.86,128.68,128.52,122.75,122.53,121.77,119.47.
实施例9
酮类原料:
目标产物:
得到目标产物106.5mg,产率50%;黄色固体;1hnmr(400mhz,dmso)δ9.81(s,1h),7.89(d,j=8.2hz,2h),7.84(d,j=6.1hz,2h),7.55(d,j=8.1hz,2h),7.34(s,2h),7.06(s,3h),6.81(s,1h),6.71(d,j=5.7hz,2h).13cnmr(101mhz,dmso)δ191.60,151.59,148.18,139.98,138.11,132.97,130.67,128.67,128.52,122.72,122.51,121.77,119.46,103.90.
实施例10
酮类原料:
目标产物:
得到目标产物145.5mg;产率87%;黄色固体;1hnmr(400mhz,dmso)δ9.85(s,1h),7.85(d,j=7.2hz,2h),7.77(d,j=7.6hz,1h),7.69(d,j=8.2hz,2h),7.52(t,j=7.8hz,1h),7.35(t,j=6.4hz,2h),7.07(s,3h),6.81(t,j=6.8hz,1h),6.71(d,j=7.0hz,2h).13cnmr(101mhz,dmso)δ190.96,151.32,148.11,139.91,135.46,134.25,133.82,131.20,128.70,128.55,128.20,128.03,122.82,122.59,121.73,119.50.
实施例11
酮类原料:
目标产物:
得到目标产物150mg,产率79%;黄色固体;1hnmr(400mhz,dmso)δ9.85(s,1h),7.83(dd,j=13.9,9.6hz,5h),7.45(t,j=7.8hz,1h),7.35(t,j=7.3hz,2h),7.07(s,3h),6.81(t,j=7.1hz,1h),6.72(d,j=7.4hz,2h).13cnmr(101mhz,dmso)δ190.88,151.27,148.10,139.89,137.10,135.60,131.39,130.99,128.70,128.54,128.52,122.82,122.59,122.15,121.72,119.49.
实施例12
酮类原料:
目标产物:
得到目标产物133.6mg;产率81%;黄色固体;1hnmr(400mhz,dmso)δ9.73(s,1h),7.87(d,j=6.2hz,2h),7.79(d,j=8.4hz,2h),7.33(s,2h),7.12–7.01(m,4h),7.00(s,1h),6.80(s,1h),6.74(d,j=5.9hz,2h),3.80(s,3h).13cnmr(101mhz,dmso)δ190.17,164.17,152.33,148.56,140.22,131.88,128.63,128.43,126.70,122.53,122.28,121.75,119.44,114.39,55.66.
实施例13
酮类原料:
目标产物:
得到目标产物112mg;产率61%;1hnmr(400mhz,dmso)δ9.87(s,1h),7.98(d,j=7.9hz,2h),7.85(d,j=8.0hz,4h),7.35(t,j=7.4hz,2h),7.10–7.02(m,3h),6.79(t,j=6.9hz,1h),6.71(d,j=7.3hz,2h).13cnmr(101mhz,dmso)δ191.45,151.35,148.01,139.87,136.77,133.59,133.27,129.93,128.69,128.63,128.54,128.51,126.07,126.04,126.00,124.80,122.84,122.59,122.09,121.78,120.43,119.49.
实施例14
酮类原料:
目标产物:
得到目标产物114.5mg,产率64%;1hnmr(500mhz,dmso)δ9.91(s,1h),8.03(d,j=8.4hz,2h),7.92(d,j=8.3hz,2h),7.87(s,2h),7.35(s,2h),7.04(s,3h),6.75(d,j=31.1hz,3h),3.85(s,3h).13cnmr(126mhz,dmso)δ191.91,165.29,151.60,148.09,140.01,136.93,134.21,129.76,129.48,128.63,128.60,122.71,121.85,121.83,119.48,52.55.
实施例15
酮类原料:
目标产物:
得到目标产物115.5mg;产率66%;1hnmr(400mhz,dmso)δ9.86(s,1h),8.47(s,1h),8.18(d,j=8.2hz,1h),7.97(d,j=3.2hz,1h),7.95(s,1h),7.89(d,j=7.7hz,2h),7.82(d,j=8.6hz,1h),7.68(t,j=7.5hz,1h),7.60(t,j=7.5hz,1h),7.36(t,j=7.4hz,2h),7.06(t,j=7.2hz,1h),6.99(t,j=7.3hz,2h),6.77(d,j=7.5hz,2h),6.71(t,j=7.1hz,1h).13cnmr(101mhz,dmso)δ192.01,152.01,148.53,140.20,135.50,132.62,131.96,131.00,129.92,129.49,128.79,128.67,128.42,127.71,127.24,123.30,122.63,122.30,121.70,119.50.
实施例16
酮类原料:
目标产物:
得到目标产物130mg;产率85%;1hnmr(400mhz,dmso)δ9.86(s,1h),8.06(d,j=4.7hz,1h),7.87(d,j=4.4hz,2h),7.77(s,1h),7.34(s,2h),7.19(t,j=3.9hz,1h),7.10(d,j=6.6hz,2h),7.05(s,1h),6.85(d,j=5.7hz,1h),6.78(d,j=6.5hz,2h).13cnmr(101mhz,dmso)δ183.87,151.50,148.57,141.15,140.12,137.54,136.95,129.16,128.63,128.54,122.70,122.44,121.70,119.52.
实施例17
酮类原料:
目标产物:
得到目标产物96mg;产率66%;1hnmr(400mhz,dmso)δ9.78(s,1h),8.03(s,1h),7.82(d,j=7.4hz,2h),7.37(d,j=2.2hz,1h),7.33(t,j=7.3hz,2h),7.11(t,j=7.4hz,2h),7.04(t,j=7.1hz,1h),6.86(t,j=7.2hz,1h),6.75(d,j=7.5hz,2h),6.68(d,j=1.3hz,1h).13cnmr(101mhz,dmso)δ178.68,151.22,150.28,149.74,148.51,140.13,128.65,128.53,122.87,122.66,122.42,121.62,119.39,113.33.
实施例18
酮类原料:
未得到目标产物。
实施例19
酮类原料:
未得到目标产物。
实施例20~33按以下方法进行:
向密封管中加入苯乙酮(0.5mmol),伯胺类化合物(1.1mmol),cucl2(13.4mg,0.1mmol),phcoona(36mg,0.25mmol)和dmso(1.0ml),并将反应混合物在80℃,1atm氧气氛下搅拌30小时,将有机层混合,用na2so4干燥,过滤并真空浓缩并通过硅胶柱颜色分类(洗脱剂:石油醚/乙酸乙酯)纯化,得到脒类化合物。
具体反应过程如下:
实施例20
伯胺类原料:
目标产物:
得到目标产物92mg,产率56%;1hnmr(400mhz,dmso)δ9.62(s,1h),7.80(d,j=7.7hz,2h),7.72(d,j=7.8hz,2h),7.62(t,j=7.3hz,1h),7.48(t,j=7.5hz,2h),7.13(d,j=7.8hz,2h),6.84(d,j=7.6hz,2h),6.60(d,j=7.6hz,2h),2.27(s,3h),2.09(s,3h).13cnmr(101mhz,dmso)δ192.31,151.88,145.80,137.65,134.50,133.67,131.40,130.87,129.22,129.00,128.97,128.92,121.63,119.43,20.41,20.19。
实施例21
伯胺类原料:
目标产物:
得到目标产物132.5mg,产率69%;1hnmr(400mhz,dmso)δ9.65(s,1h),7.79(t,j=9.8hz,4h),7.59(t,j=7.2hz,1h),7.47(t,j=7.5hz,2h),7.19(d,j=7.0hz,2h),6.90(d,j=6.7hz,2h),6.64(d,j=6.6hz,2h),2.85(d,j=5.5hz,1h),2.68(d,j=5.7hz,1h),1.20(d,j=5.5hz,6h),1.05(d,j=5.6hz,6h).13cnmr(101mhz,dmso)δ192.40,151.82,146.15,142.62,142.02,137.98,134.39,133.92,129.21,128.96,126.27,126.20,121.65,119.54,32.90,32.57,23.97,23.83.
实施例22
伯胺类原料:
目标产物:
得到目标产物106mg,产率59%;1hnmr(400mhz,dmso)δ9.80(s,1h),7.84(d,j=7.5hz,2h),7.63(t,j=6.9hz,2h),7.50(t,j=7.4hz,2h),7.37(s,1h),7.25(s,1h),6.95(s,1h),6.65(d,j=4.8hz,1h),6.38(d,j=5.1hz,1h),6.32(s,2h),3.74(s,3h),3.57(s,3h).13cnmr(101mhz,dmso)δ191.93,159.52,159.39,152.05,149.65,141.17,134.59,133.76,129.44,129.33,129.21,129.05,114.31,111.95,108.40,107.90,107.42,105.67,54.95,54.74.
实施例23
伯胺类原料:
目标产物:
得到目标产物123.5mg,产率74%;1hnmr(400mhz,dmso)δ9.90(s,1h),7.89(dd,j=7.7,5.1hz,2h),7.82(d,j=7.7hz,2h),7.63(t,j=7.3hz,1h),7.50(t,j=7.6hz,2h),7.19(t,j=8.6hz,2h),6.87(t,j=8.5hz,2h),6.76–6.68(m,2h).13cnmr(101mhz,dmso)δ192.03,159.19,158.92,156.82,156.54,152.48,144.74,144.72,136.41,136.39,134.75,133.57,129.28,129.15,123.22,123.14,121.23,121.16,115.35,115.13,114.92。
实施例24
伯胺类原料:
目标产物:
得到目标产物142mg,产率73%;1hnmr(400mhz,dmso)δ10.06(s,1h),7.90(d,j=8.3hz,2h),7.83(d,j=7.7hz,2h),7.64(t,j=7.3hz,1h),7.50(t,j=7.5hz,2h),7.40(d,j=8.3hz,2h),7.09(d,j=8.0hz,2h),6.74(d,j=8.0hz,2h).13cnmr(101mhz,dmso)δ191.46,152.28,147.11,138.77,134.86,133.43,129.31,129.18,128.56,128.35,126.62,126.47,123.44,121.09。
实施例25
伯胺类原料:
目标产物:
得到目标产物208mg,产率91%;1hnmr(400mhz,dmso)δ10.07(s,1h),7.83(d,j=6.8hz,4h),7.64(t,j=7.3hz,1h),7.53(d,j=6.9hz,2h),7.49(d,j=7.6hz,2h),7.22(d,j=8.0hz,2h),6.69(d,j=8.0hz,2h).13cnmr(101mhz,dmso)δ191.37,152.17,147.49,139.15,134.89,133.39,131.47,131.25,129.32,129.20,123.89,121.48,114.71,114.48。
实施例26
伯胺类原料:
目标产物:
得到目标产物210mg,产率76%;1hnmr(400mhz,dmso)δ10.01(s,1h),7.81(d,j=7.6hz,2h),7.67(s,4h),7.64(d,j=7.6hz,1h),7.51(t,j=7.5hz,2h),7.37(d,j=7.9hz,2h),6.54(d,j=7.9hz,2h).13cnmr(101mhz,dmso)δ191.31,152.01,147.90,139.58,137.29,137.08,134.89,133.36,129.30,129.20,124.24,121.77,86.43,86.20.
实施例27
伯胺类原料:
目标产物:
得到目标产物136mg,产率74%;1hnmr(400mhz,dmso)δ10.17(s,1h),8.13(s,1h),7.84(d,j=7.7hz,2h),7.65(dd,j=14.4,7.3hz,2h),7.52(t,j=7.6hz,2h),7.37(t,j=8.1hz,1h),7.13(d,j=7.9hz,1h),7.07(t,j=7.9hz,1h),6.86(d,j=7.9hz,1h),6.78(s,1h),6.69(d,j=7.8hz,1h).13cnmr(101mhz,dmso)δ191.03,152.48,149.64,141.09,135.00,133.39,133.08,132.81,130.37,130.06,129.38,129.24,122.66,122.50,121.65,120.53,119.06,118.06.
实施例28
伯胺类原料:
目标产物:
得到目标产物176mg,产率77%;1hnmr(400mhz,dmso)δ10.15(s,1h),8.25(s,1h),7.84(d,j=7.7hz,2h),7.66(t,j=7.2hz,2h),7.52(t,j=7.6hz,2h),7.31(t,j=8.0hz,1h),7.26(d,j=7.6hz,1h),7.00(s,2h),6.92(s,1h),6.73(d,j=5.7hz,1h).13cnmr(101mhz,dmso)δ191.00,152.46,149.76,141.21,134.99,133.39,130.67,130.34,129.37,129.23,125.57,125.36,124.48,121.89,121.55,121.31,120.89,118.44.
实施例29
伯胺类原料:
目标产物:
得到目标产物152mg,产率55%;1hnmr(400mhz,dmso)δ10.04(s,1h),8.37(s,1h),7.83(d,j=7.5hz,2h),7.74(d,j=7.0hz,1h),7.65(t,j=7.3hz,1h),7.51(t,j=7.5hz,2h),7.43(d,j=7.0hz,1h),7.13(d,j=11.2hz,2h),7.09(s,1h),6.85(t,j=7.1hz,1h),6.74(d,j=7.0hz,1h).13cnmr(101mhz,dmso)δ191.08,152.33,149.62,141.08,134.90,133.48,131.49,131.20,130.70,130.37,129.32,129.18,127.71,127.69,121.31,118.92,94.52,94.37.
实施例30
伯胺类原料:
没有得到目标产物。
实施例31
伯胺类原料:
没有得到目标产物。
实施例32
伯胺类原料:
没有得到目标产物。
实施例33
伯胺类原料:
没有得到目标产物。
对照实验组:
以苯乙酮与苯胺反应为例,对催化剂、溶剂的选择及反应条件的选择做对照实验,以进一步说明本发明内容,具体实验数据如下表,具体实验过程如实施例1所示。
反应条件:1a(0.5mmol),2a(1.1mmol),catalyst(0.1mmol),andbase(0.25mmol),solvent(1ml),o2(1atm),30h,bisolatedyields,cphcoona(0.5mmol).d10h.e20h.
从上表中可以看出,对该反应具有较好催化活性的催化剂主要是含卤素的亚铜盐和铜盐,其中铜盐相对亚铜盐效果较好,含氯和溴的铜盐或亚铜盐比其他卤素的铜盐或亚铜盐效果要好。而其它有机铜盐和络合铜对反应表现出相对较差的催化活性。
有机羧酸盐为弱碱性物质,在苯甲酸盐、醋酸盐、碳酸盐和碳酸氢盐等弱碱性物质存在下,反应都能进行,但是在有机羧酸盐存在下,反应能获得较高收率,特别是在苯甲酸盐作用下,反应效果达到最佳。
反应溶剂主要选择强极性非质子溶剂,如在二甲基亚砜、dmf等溶剂中反应可以获得较高的收率,而dce、1,4-dioxane等极性较小的溶剂中,反应几乎不能进行。
反应温度在80℃附近时具有最佳的反应效果,而温度较低或较高时,反应效果均表现不佳。
另外,反应需要在氧气气氛中进行,在没有氧气,或氧气含量较低的气氛条件下,反应难以进行。
- 还没有人留言评论。精彩留言会获得点赞!