N‑烷基‑N‑取代乙烯基甲酰胺类化合物及其合成方法与流程
本发明属于有机合成领域,具体涉及一种n-烷基-n-取代乙烯基甲酰胺类类化合物及其合成方法。
背景技术:
n-烷基-n-取代乙烯基甲酰胺类化合物的母核是n-乙烯基甲酰胺(简称nvf)。n-乙烯基甲酰胺是乙烯酰胺中最简单的成员,也是一种性能优异的聚合物单体和溶剂。nvf的工业化最早是由日本三菱公司1992年实现的。随后hoechstdynapol及celanese等公司相继实现了n-甲基-n-乙烯基乙酰胺,n-乙烯基乙酰胺的工业化。现有相关类商品有:n-乙烯吡咯烷酮、n-乙烯噁唑烷酮、己内酰胺、n-甲基-n-乙烯甲酰胺等乙烯酰胺类化合物。目前nvf的合成方法主要有:
(1)由亚乙基乙酸合成的nvf方法。亚乙基乙酸在常温下很容易由乙酸酐和乙醛(ach)通过碱催化合成。反应过程中的碱用量应该是亚乙基乙酸摩尔数的两倍,反应得到nvf。但反应的选择性只有23%(反应式1)。
(2)α取代乙基甲酰胺制备nvf。以α取代乙基甲酰胺为原料,通过加热和加入催化剂脱去hx,从而得到产率高于90%的nvf(反应式2)
(其中x为or,oac,oh等)
(3)亚乙基二甲酰胺制备nvf。亚乙基二甲酰胺(bis)是合成nvf的一种重要中间体,在一定条件下裂解得到等物质的量的nvf和甲酰胺。根据报道研究人员先后尝试了用盐酸水溶液催化乙醛和甲酰胺合成bis,随后的研究发现硫酸的催化效果优于高氯酸,dawson等用酸催化甲酰胺和乙醛反应制备二甲酰胺取代中间体(bis),加入乙酸酐作为氨的去除剂,进而脱除一个甲酰胺分子,生成nvf(反应式3)。
技术实现要素:
本发明的目的之一在于提供一种新型结构的n-烷基-n-取代乙烯基甲酰胺类化合物。
为达到上述目的,本发明提供如下技术方案:
一种n-烷基-n-取代乙烯基甲酰胺类化合物,其结构通式如式ⅰ和式ⅱ所示:
其中,r1为正丙基、异丙基、正丁基、苯丙基或环己基,r2为芳基。
本发明的目的之二在于提供一种n-烷基-n-取代乙烯基甲酰胺类化合物的合成方法,该合成方法反应条件温和,不需高温高压,操作简单,原料廉价易得,产物收率高。
为达到上述目的,本发明提供如下技术方案:
一种n-烷基-n-取代乙烯基甲酰胺类化合物的合成方法,式ⅲ结构的2-芳氧基乙酰胺类化合物在有机溶剂中,与pocl3反应,制得式ⅰ和/或式ⅱ结构的n-烷基-n-取代乙烯基甲酰胺类化合物;
其中,r1为正丙基、异丙基、正丁基、苯丙基或环己基,r2为芳基。
作为本发明的优选技术方案,所述有机溶剂为n,n-二甲基甲酰胺。
作为本发明的优选技术方案,先加入有机溶剂,后恒压加入pocl3。
作为本发明的优选技术方案,所述式ⅲ结构的2-芳氧基乙酰胺类化合物与pocl3的摩尔比为1:1.5~4。
作为本发明的优选技术方案,反应物先在冰浴中反应1h,然后升温至20~50℃反应3~5h。
本发明中,式ⅲ结构的2-芳氧基乙酰胺类化合物可用现有文献报道的方法合成,比如以含有氨基的烷烃或芳烷烃、氯乙酰氯、邻氯苯酚为原料,在二氯甲烷和碳酸钾存在下,合成2-芳氧基乙酰胺。
本发明的有益效果在于:
本发明合成了文献中没有报道的n-烷基-n-取代乙烯基甲酰胺类化合物,该类化合物可作为聚合物单体。
n-烷基-n-取代乙烯基甲酰胺类化合物具有低毒和高的共聚反应活性,通过阳离子、阴离子和自由基聚合都可以得到聚合物。n-烷基-n-取代乙烯基甲酰胺类化合物还可与多种单体共聚,如丙烯、丙烯酸酯、丙烯酸、苯乙烯、醋酸乙烯酯、氯乙烯、丙烯酰胺和n-乙烯乙酰胺等。生成的聚合物具有广泛商业用途,应用于阳离子高分子絮凝剂、水处理剂、造纸用添加剂及离子交换树脂等。
除此之外,该类化合物还可作为溶剂,具有类似于二甲基甲酰胺(dmf)的良好的溶解能力,是一种性能优异的溶剂,能与水及大部分有机溶剂互溶。
并且本发明的合成方法反应条件温和,不需高温高压,操作简单,原料廉价易得,产物收率高。
附图说明
图1为(e)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的1hnmr谱图;
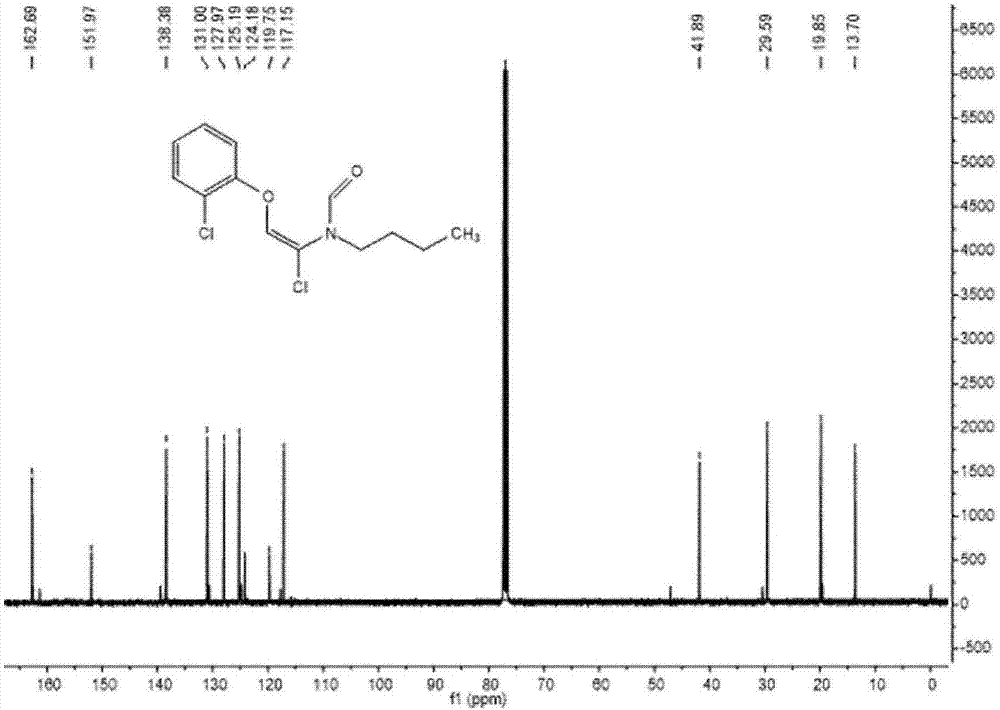
图2为(e)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的13cnmr谱图;
图3为(e)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的hrms谱图;
图4为(z)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的1hnmr谱图;
图5为(z)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的13cnmr谱图;
图6为(z)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的hrms谱图;
图7为(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺的1hnmr谱图;
图8为(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺的13cnmr谱图;
图9为(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺的hrms谱图;
图10为(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺的x-ray单晶衍射图。
具体实施方式
为了使本发明的目的、技术方案和有益效果更加清楚,下面将对本发明的优选实施例进行详细的描述。
实施例1n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的合成
称取正丁基胺72.20mmol、碳酸钾114.20mmol,加入150ml二氯甲烷,冰浴冷至0–5℃,加入7.0ml氯乙酰氯,常温反应3h,得到n-正丁基-2-氯乙酰胺粗品6.87g;取n-正丁基-2-氯乙酰胺粗品和4.27g邻氯苯酚在nah/dmf中过夜反应,制得n-正丁基-2-(2-氯苯氧基)乙酰胺。
称取0.76gn-正丁基-2-(2-氯苯氧基)乙酰胺,在dmf中,恒压加入1.0mlpocl3,反应物先在冰浴中反应1h,然后升温至30℃反应4h,柱层析分离提纯,得到的产物经1h、13c核磁共振波谱和高分辨质谱分析,为n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的两种同分异构体。
(e)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的1hnmr谱图、13cnmr谱图、hrms谱图如图1、2、3所示,其谱图分析如下,可以确定为(e)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺:
1hnmr(400mhz,cdcl3)δ8.31(s,1h),7.41(dd,j=7.9,1.5hz,1h),7.24–7.28(m,1h),7.07–7.11(m,1h),7.04(dd,j=8.2,1.2hz,1h),6.81(s,1h),3.59(t,j=7.3hz,2h),1.58–1.63(m,2h),1.36–1.44(m,2h),0.91(t,j=7.3hz,3h)ppm.
13cnmr(100mhz,cdcl3)δ162.7,152.0,138.4,131.0,128.0,125.2,124.2,119.8,117.2,41.9,29.6,19.9,13.7ppm.
hrms:(esi)m/z(%):288.0614[m+h]+(calc.c13h15cl2no2:288.1679).
(z)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺的1hnmr谱图、13cnmr谱图、hrms谱图如图4、5、6所示,其谱图分析如下,可以确定为(z)-n-正丁基-n-(1-氯-2-(2-氯苯氧基)乙烯基)甲酰胺:
1hnmr(400mhz,cdcl3)δ8.26(s,1h),7.45(dd,j=8.0,1.5hz,1h),7.28–7.30(m,1h),7.11–7.15(m,1h),7.08(dd,j=8.1,1.4hz,1h),6.77(s,1h),3.55(t,j=7.3hz,2h),1.53–1.60(m,2h),1.31–1.40(m,2h),0.95(t,j=7.3hz,3h)ppm.
13cnmr(100mhz,cdcl3)δ162.4,151.9,139.6,131.1,128.1,125.6,124.5,118.5,118.2,42.4,29.2,19.9,13.7ppm.
hrms:(esi)m/z(%):288.0505[m+h]+(calc.c13h15cl2no2:288.1679).
实施例2n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺的合成
称取环己基胺60.0mmol,碳酸钾k2co390mmol,加入80ml二氯甲烷,冰浴冷至0-5℃,用恒压滴液漏斗加入氯乙酰氯72mmol,常温反应3h,得到n-环己基-2-氯乙酰胺粗品;取n-环己基-2-氯乙酰胺粗品24mmol和2,4-二氯苯酚20mmol,在60mldmf和30mmolnah存在下,过夜反应,制得n-环己基-2-(2,4-二氯苯氧基)乙酰胺。
称取n-环己基-2-(2,4-二氯苯氧基)乙酰胺15mmol,在60mldmf中,恒压加入45mmolpocl3,反应物先在冰浴中反应1h,然后升温至40℃反应4h,柱层析分离提纯。得到的产物经1h、13c核磁共振波谱和x-ray单晶衍射分析,主要为(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺。
(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺的1hnmr谱图、13cnmr谱图、hrms谱图、x-ray单晶衍射图如图7、8、9、10所示,其谱图分析如下,可以确定为(z)-n-环己基-n-(1-氯-2-(2,4-二氯苯氧基)乙烯基)甲酰胺:
1hnmr(400mhz,cdcl3)δ8.24(s,1h),7.46(d,j=2.1hz,1h),7.23–7.29(m,1h),7.01(d,j=8.7hz,1h),6.71(s,1h),4.10–4.17(m,1h),1.85(s,4h),1.53–1.68(m,4h),1.32–1.42(m,3h),1.08–1.22(m,1h)ppm.
13cnmr(101mhz,cdcl3)δ163.0,150.6,141.7,130.9,130.4,128.1,125.5,119.0,117.3,54.1,30.8,25.7,25.3ppm.
hrms:(esi)m/z(%):348.0327[m+h]+(calc.c15h17cl3no2:348.0319).
需要说明的是,当r1为其他取代基,比如正丙基、异丙基或苯丙基,r2为其他芳基时,其合成方法与以上实施例相同,生成结构通式如式ⅰ和/或式ⅱ所示的相应的n-烷基-n-取代乙烯基甲酰胺类化合物。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!