人前列腺癌早期诊断用长链非编码RNA序列及其应用的制作方法
本发明属于肿瘤分子生物学领域,具体涉及一种前列腺癌特异性的长链非编码rna的精确cdna序列、该序列的制备方法、癌症联合诊断标志物,以及长链非编码rna的表达抑制剂及其用途。
背景技术:
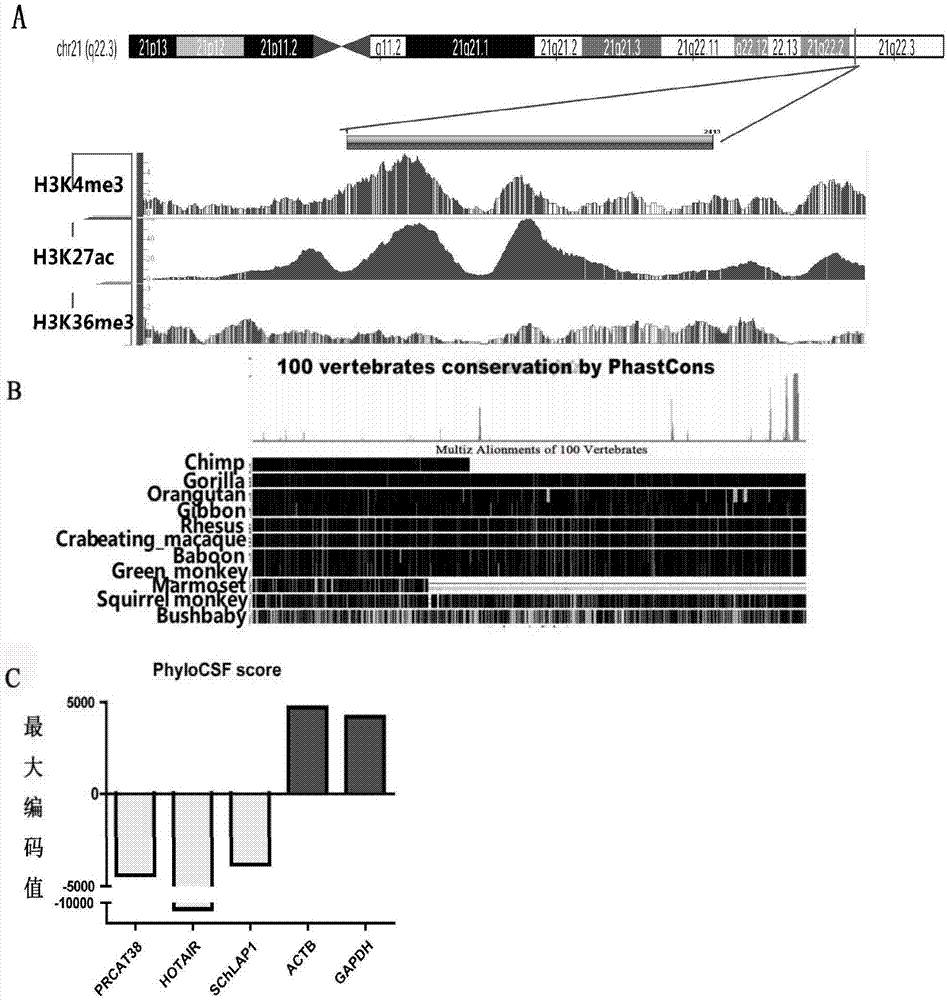
:前列腺癌(prostatecancer,pca)是发生于前列腺上皮的恶性肿瘤,是男性生殖系统中特有且最常见的恶性肿瘤,前列腺癌的发病率随年龄增长而持续性增加,95%发生于60岁以上的老年男性。近十年来,每年新诊断的前列腺癌患者大约有一百万,约占世界范围内每年男性癌症新发病例的15%左右,位居男性所有恶性肿瘤发病率的第二位。在美国前列腺癌的发病率已经超过前列腺癌,成为第一位危害男性健康的肿瘤。而在我国,前列腺癌发病率相对较低,但近年来随着男性寿命的延长,饮食结构和生活方式的改变,其发病率和死亡率也一直处在上升阶段,且增长速度超过欧美等发达国家,现已成为我国男性第五大常见癌症。前列腺癌早期多无任何症状,即使有所不适,也不足以引起病人的重视,当肿瘤增大压迫尿道时,又往往与前列腺增生相混淆。在我国约80%的病人首先发现远处转移病灶才发现前列腺癌。此时,癌症病变已达晚期,预后不良。血清前列腺特异性抗原(psa)是目前列腺癌的临床诊断中应用最为广泛的分子标志物,由前列腺的解剖结构可知psa通过前列腺导管进入血液和尿液中,一些病例或生理情况下psa会进入血液中去,如前列腺炎症、尿潴留、前列腺感染、前列腺增生和前列腺癌等,因此通过检测血清psa水平来预测前列腺癌具有一定的假阳性率。特别是在psa浓度4-10ng/ml灰区部分,特异性是最低的,这时往往需要通过侵入性的穿刺活检进行确定,给患者带来极大痛苦及精神和经济负担。所以psa并不能较好的作为诊断前列腺癌的标志物。在人类基因组的转录本当中,90%以上的基因并不具备编码蛋白的能力,他们往往被转录成非编码rna(non-codingrna,ncrna)。依据核苷酸的长度,我们把ncrna又分为两大类:分别为核苷酸长度少于200nt的短链非编码rna和核苷酸长度大于200nt的长链非编码rna(lncrna)。过去人们对短链ncrna的研究比较多,lncrna一度曾被认为是基因转录时的“噪音”,并不具有特定的生物学功能。随着这些年的研究发现,lncrna在多种类型肿瘤细胞(包括乳腺癌、肝癌、前列腺癌、前列腺癌、黑色素瘤等)的增殖、克隆、凋亡、侵袭、转移以及药物耐药等方面均发挥着重要的作用,同时由于lncrna具有显著的肿瘤组织特异性,因此在肿瘤细胞中表达异常的lncrna有希望作为肿瘤早期诊断标志物(特别是在某些肿瘤发生的早期),为癌症临床诊断提供无创、快捷和低成本的筛查手段。随着lncrna研究的兴起,人们开始关注前列腺癌中lncrna的表达及调控方式,以期完善对前列腺癌的发生发展机制的理解,实现精准医疗的目标。长链非编码rna:pca3已被证实是一个前列腺癌中特异表达的基因,其表达仅局限在前列腺上皮细胞,具有肿瘤特异性。pca3位于9号染色体,含有4个外显子,通过选择性剪切和多聚腺苷酸化产生至少四种不同的转录产物。northernblot检测分析50例患者中47例pca3高表达,而前列腺良性病变组织中不表达或低度表达(cancerreserch,1999,dec,1;59(23):5975-9)。pca3是到目前为止针对前列腺癌特异性最优的标志物。多年以来,以鉴别超越pca3用于前列腺癌诊断的标志物为目标,已评估了多种基因,但目前尚未发现能够有效或准确检测前列腺癌的早期发生,以及疾病进展的分子标志物。另外,据报道尿液中pca3的诊断敏感度仅有67%、特异度为83%(韩仁强.2003_2007年中国前列腺癌发病与死亡分析.chinesecancer.2012;21(11):805-11),pca3在尿液样本中检测的低灵敏度限制了pca3的临床应用价值。因此,目前亟需发现一种新的具有高特异性和灵敏度的癌症检测标志物,以实现前列腺癌的早期特异性诊断、预后评估,以及以异常表达基因作为靶点实现对前列腺癌患者的基因治疗。技术实现要素:为此,本发明要解决的技术问题是提供一种具有高特异性和高灵敏度,能够用于前列腺癌的早期特异性诊断、预后评估的长链非编码rna。为此,本发明提供了一种长链非编码rna,所述长链非编码rna的cdna序列如seqidno.1所示。本发明提供了一种克隆上述的长链非编码rna的全长cdna序列的引物组,包括如下所述引物:引物gsp1-f,其核苷酸序列如seqidno.2所示;引物gsp1-r,其核苷酸序列如seqidno.3所示;引物gsp2-f,其核苷酸序列如seqidno.4所示;引物gsp2-r,其核苷酸序列如seqidno.5所示;引物gsp3-f,其核苷酸序列如seqidno.6所示;引物gsp3-r,其核苷酸序列如seqidno.7所示;引物gsp4,其核苷酸序列如seqidno.8所示;和引物gsp5,其核苷酸序列如seqidno.9所示。本发明提供了一种用于前列腺癌诊断的引物对,所述引物对包括基于seqidno.1所示的核苷酸序列设计的引物。所述引物对包括如下所述引物:prcat38-f,其核苷酸序列如seqidno.10所示;prcat38-r,其核苷酸序列如seqidno.11所示。本发明提供了一种用于前列腺癌诊断的试剂盒,所述试剂盒包括上述的引物对。本发明提供了一种癌症诊断标志物,包括上述的长链非编码rna。所述的癌症诊断标志物,所述癌症诊断标志物还包括ezh2和mir-24-2。本发明提供了上述的长链非编码rna或上述的癌症诊断标志物在制备前列腺癌诊断、预后评估和/或治疗的产品中的用途。本发明提供了一种上述的长链非编码rna的表达抑制剂,所述表达抑制剂包括sirna和/或shrna。所述的表达抑制剂,所述表达抑制剂抑制ezh2的表达。所述的表达抑制剂,所述sirna的正义链的核苷酸序列如seqidno.12所示,所述sirna的反义链的核苷酸序列如seqidno.13所示;或者所述sirna的正义链的核苷酸序列如seqidno.14所示,所述sirna的反义链的核苷酸序列如seqidno.15所示;或者所述sirna的正义链的核苷酸序列如seqidno.16所示,所述sirna的反义链的核苷酸序列如seqidno.17所示。所述的表达抑制剂,所述shrna的核苷酸序列如seqidno.18~seqidno.20任一序列所示。所述的表达抑制剂在制备治疗前列腺癌的药物中的用途。本发明提供了包含所述的表达抑制剂的重组表达载体、转基因细胞系或转基因重组菌。本发明相对现有技术具有如下优点:1、本发明所述的一种长链非编码rna,所述长链非编码rna的cdna序列如seqidno.1所示。本发明提供的长链非编码rna是能够用于前列腺癌检测的新标志物,也即长链非编码rnaprcat38。prcat38应用于前列腺癌的检测具有特异性强、灵敏度高的优势,其检测结果的准确度高,为前列腺癌的诊断、预后或疗效监测提供可靠信息。同时,本发明首次克隆了精确的prcat38的全长cdna序列,其cdna的全长序列如seqidno.1所示。prcat38的现有预测序列与本发明克隆出的prcat38全长序列相比,在序列上游存在约110bp的多余碱基,在序列下游存在约730bp的多余碱基,因此,基于prcat38的现有预测序列所设计的检测引物或rnai序列,容易因首位多余片段的干扰导致检测或prcat38的抑制失败。prcat38的全长cdna序列的获得为进一步研究prcat38在前列腺癌发生发展过程中的功能奠定了基础,且针对seqidno.1所示序列设计的引物能够提高检测prcat38基因表达的准确度,进而为提高前列腺癌的诊断和预后提供更加准确的检测信息;另外,基于prcat38的全长cdna序列设计的rna干扰的靶位点序列具有更高的靶向准确性,为前列腺癌治疗药物的研发和前列腺癌的基因治疗提供了更多以及更为有效的功能靶点,显著提高其药物和基因治疗的效果。2、本发明所述的克隆上述长链非编码rna的全长cdna序列的引物组,利用上述的引物组,通过cdna末端快速扩增技术(rapid-amplificationofcdnaends,race),能够克隆得到prcat38的全长cdna序列,cdna序列结果准确,且克隆过程步骤简单、易操作。3、本发明提供的用于前列腺癌诊断的引物对,包括基于seqidno.1所示的核苷酸序列设计的引物。利用上述引物对,通过rt-pcr技术,可以实现prcat38在细胞和组织中的高精度检测,为前列腺癌的早期诊断、预后评估和疗效监测提供可靠信息。4、本发明提供的用于前列腺癌诊断的引物对,包括核苷酸序列如seqidno.10所示的引物prcat38-f,和核苷酸序列如seqidno.11所示的prcat38-r。采用prcat38-f和prcat38-r对prcat38进行扩增具有特异性强、效率高和扩增结果准确的优势,通过rt-pcr技术能够实现对prcat38表达的准确定量。5、本发明提供的用于前列腺癌诊断的试剂盒,包括上述的引物对,能够特异性检测prcat38的表达情况,检测结果准确,在前列腺癌的早期诊断、预后和疗效监测中具有较高的应用价值。6、本发明提供的癌症诊断标志物,包括上述的长链非编码rna、ezh2和mir-24-2。ezh2(genbankid:nc_000007)和mir-24-2(genbankid:nc_000019)均是已报道过的与前列腺癌相关的基因,其中ezh2在前列腺癌中显著高表达,mir-24-2在前列腺癌中低表达。在本次研究中首次发现,prcat38的表达与ezh2和mir-24-2具有密切的相关性:prcat38与ezh2的表达呈现正相关关系,prcat38和mir-24-2的表达呈现负相关关系。由于肿瘤发生是一个多基因、多步骤的癌变过程,尽管prcat38是前列腺癌诊断的理想候选指标,仅靠一个指标进行诊断,常常会导致假阳性和假阴性,所以,单个标志物的检测必然存在一些局限性,影响前列腺癌的临床诊断。以prcat38、ezh2和mir-24-2作为联合诊断标志物对前列腺癌进行检测,使前列腺癌的检测灵敏度达到1.0,有效避免癌症检测时出现漏诊的情况;同时以三种基因进行联合诊断,能够避免在单个基因检测时由于个体表达差异、检测过程中单一指标检测数据的误读误判导致的检测失误,提高前列腺癌检测的准确度。另一方面,利用prcat38和ezh2在前列腺癌发生发展过程中的协同相关性,针对性地设计能够同时抑制prcat38和ezh2表达的抑制剂,相对单一标志物的靶向治疗能够有效增强对前列腺癌细胞增殖、侵袭转移等的抑制效果,降低前列腺癌的浸润深度,显著提高肿瘤治疗疗效,具有重要的临床应用价值。7、本发明提供的长链非编码rna或长链非编码rna、ezh2和mir-24-2的癌症诊断标志物在制备前列腺癌诊断、预后评估和/或治疗的产品中的用途,兼顾前列腺癌诊断的敏感性和特异性,提高了前列腺癌的早期诊断和预后评估的效率和准确性。同时,以上述标志物作为前列腺癌治疗靶点研发抗癌药物,具有特异性强、靶向效果和治疗效果好的优势。8、本发明提供的长链非编码rna的表达抑制剂,包括sirna和/或shrna。sirna和/或shrna用于基因抑制时,其干扰效果好,能够有效抑制癌症基因的表达,诱导肿瘤细胞的增殖、侵袭和转移。9、本发明提供的表达抑制剂在抑制prcat38表达的同时,能够抑制ezh2的表达,利用单一sirna或shrna靶向两个肿瘤相关基因,避免了同时导入多种sirna或shrna时可能产生的相互干扰,提高了对前列腺细胞的抑制水平和抑制效率,为前列腺癌的抗癌药物和基因治疗提供了重要的研发途径。10、本发明提供的sirna,其正义链的核苷酸序列如seqidno.12所示,反义链的核苷酸序列如seqidno.13所示;或者正义链的核苷酸序列如seqidno.14所示,反义链的核苷酸序列如seqidno.15所示;或者正义链的核苷酸序列如seqidno.16所示,反义链的核苷酸序列如seqidno.17所示。shrna的核苷酸序列如seqidno.18~seqidno.20任一序列所示。上述的sirna和shrna能够同时实现prcat38和ezh2的表达抑制,其中seqidno.18和seqidno.19所示的shrna对prcat38和ezh2的干扰效率达75%以上,且抑制效果稳定,在prcat38和ezh2敲减后的前列腺癌细胞中,细胞的增殖、迁移和克隆形成能力均显著降低;seqidno.20所示的shrna能够形成对前列腺癌细胞克隆形成的完全抑制。由于shrna脱靶效应低、在细胞中稳定性强,具有重要的基因治疗的应用前景。11、本发明提供的包含上述表达抑制剂的重组表达载体、转基因细胞系或转基因重组菌,能够有效用于前列腺癌的诊断、预后或治疗。附图说明图1为本发明实施例1中克隆长链非编码rna精准全长序列的实验结果图,图a为5’-race的测序结果,图b为5’-race的琼脂糖凝胶电泳结果,图c为3’-race的测序结果,图d为3’-race的琼脂糖凝胶电泳结果;图2为本发明实施例2中长链非编码rna的保守性、转录活性分析和编码能力的检测结果图,图a为长链非编码rna的保守性和转录活性分析结果,图b为长链非编码rna的保守性分析结果,图c为长链非编码rna的编码能力计算值;图3为本发明实施例3中长链非编码rna在细胞和组织中的表达检测结果图,图a为长链非编码rna在不同前列腺癌细胞株中的表达量检测结果,图b为长链非编码rna在前列腺癌的癌组织和其癌旁组织中表达的原位杂交结果,图c为长链非编码rna在前列腺癌的癌组织和癌旁组织中表达的量化结果,图d为长链非编码rna在前列腺癌病人样本和正常人样本中表达结果,图e为长链非编码rna在不同癌组织和正常组织中的表达结果;图4为本发明实施例4中长链非编码rna检测前列腺癌的roc曲线图;图5为本发明实施例5中长链非编码rna、ezh2和mir-24-2的相互作用关系验证结果图,图a为prcat38的cerna网络图,图b从左向右依次显示mir-24-2在前列腺癌组织和癌旁组织中的表达结果和ezh2在前列腺癌组织和癌旁组织中的表达结果,图c为ezh2随mir-24-2表达量增加的表达变化结果,图d从左向右依次显示ezh2随prcat38表达量增加的表达变化结果和mir-24-2随prcat38表达量增加的表达变化结果,图e为前列腺癌细胞中过表达prcat38后ezh2蛋白表达变化量的蛋白免疫印记检测结果;图6为本发明实施例6中癌症联合诊断标志物联合检测前列腺癌的roc曲线图;图7为本发明实施例8中利用lna干扰序列对前列腺癌细胞的增殖、克隆形成和迁移影响的检测结果图,图a为利用lna-1和lna-2敲减前列腺癌细胞后prcat38的表达检测结果,图b为利用lna-1和lna-2敲减前列腺癌细胞后的细胞生长曲线,图c为利用利用lna-1和lna-2敲减前列腺癌细胞后的细胞克隆形成结果,图d为利用lna-1和lna-2敲减前列腺癌细胞后的细胞克隆形成数量的量化结果,图e为利用lna-1和lna-2敲减前列腺癌细胞后培养0h、12h和24h的细胞迁移结果,图f为利用lna-1和lna-2敲减前列腺癌细胞后培养0h、12h和24h的细胞迁移量化结果;图8为本发明实施例8中shrna表达质粒对前列腺癌细胞中prcat38和ezh2表达抑制的检测结果图,图a为利用shrna1和shrna2敲减前列腺癌细胞后prcat38的表达检测结果,图b为shrna1和shrna2敲减前列腺癌细胞后ezh2的表达检测结果;图9为本发明实施例8中利用shrna表达质粒验证prcat38对前列腺癌细胞的增殖、克隆形成和迁移影响的检测结果图,图a为利用shrna1、shrna2和shrna3敲减前列腺癌细胞后的细胞生长曲线,图b为利用利用shrna1、shrna2和shrna3敲减前列腺癌细胞后的细胞克隆形成结果,图c为利用shrna1、shrna2和shrna3敲减前列腺癌细胞后的细胞克隆形成数量的量化结果,图d为利用shrna1和shrna2敲减前列腺癌细胞后培养0h、12h和24h的细胞迁移结果,图e为利用shrna1和shrna2敲减前列腺癌细胞后培养0h、12h和24h的细胞迁移量化结果;图10为本发明实施例8中过表达prcat38对前列腺癌细胞的增殖、克隆形成和迁移影响的检测结果图,图a为利用plvx-prcat38过表达prcat38后前列腺癌细胞中prcat38的表达检测结果,图b为prcat38过表达后前列腺癌细胞的细胞生长曲线,图c为prcat38过表达后前列腺癌细胞的细胞克隆形成结果,图d为prcat38过表达后前列腺癌细胞的细胞克隆形成数量的量化结果,图e为prcat38过表达后前列腺癌细胞培养0h、12h和24h后的细胞迁移结果,图f为prcat38过表达后前列腺癌细胞培养0h、12h和24h后的细胞迁移量化结果。图11为本发明实施例8中shrna3对前列腺癌细胞的克隆形成的抑制结果图。具体实施方式以下通过具体实施例来说明本发明的实施方式,除非另外说明,本发明中所公开的实验方法均采用本
技术领域:
常规技术,所有引物合成、基因合成由南京金斯瑞生物科技有限公司完成,测序工作由上海生工生物工程科技有限公司完成,实施例中所用到的试剂和原料均可由市场购得。如t-vector购自promega,psih-h1购自adegene,plvx-neo购自clontechlaboratories,lna干扰序列(包括lna-1,lna-2和lna-control)购自exiqon;下述实施例中所有涉及的细胞均购自上海生命科学研究院细胞所。实施例1本实施例提供一种长链非编码rna(prcat38)精准全长cdna序列的克隆方法,具体包括以下步骤:1)、根据mitranscriptome数据库中的prcat38的已知序列设计一组gene-specificprimer,依次命名为gsp1、gsp2、gsp3、gsp4、gsp5、gsp6,所述引物组可特异性识别prcat38,引物组中的各引物序列如表1所示。表1特异性识别prcat38的引物组2)、提取人前列腺癌细胞株pc3、lncap、22rv1和du145的总rna,并用thermofisher的iiifirst-strandsynthesissystem的反转录试剂盒以oligodt为反转录引物,将总rna反转录为cdna。3)、以步骤2)中的cdna为模板,用引物对gsp1-f、gsp1-r和gsp2-f、gsp2-r,以及gsp3扩增prcat38特异片段,连接t-vector,通过测序验证序列的正确性,所述序列通过与人类基因组比对,只要确定其属于人类基因组即可说明所述序列是正确的。4)、用smartertmracecdnaamplificationkit试剂盒中的5'-racecdsprimera为反转录引物,smarteriiaoligonucleotide为接头引物,将步骤2)提取的总rna反转录为cdna,获得prcat38的5’末端的cdna;所述5'-racecdsprimera:5'–(t)25vn–3',(n=a,c,g,ort;v=a,g,orc);所述smarteriiaoligonucleotide:5'–aagcagtggtatcaacgcagagtacxxxxx–3'。5)、以步骤4中的cdna为模板,用10xuniversalprimeramix和gsp4为引物扩增prcat38的5’末端片段,5’末端片段的琼脂糖凝胶电泳结果如图1b所示;5’末端片段连接t-vector,通过测序获得prcat38的5’端序列,5’端序列的测序结果如图1a所示;所述10xuniversalprimeramix为:long(0.4μm):5'–ctaatacgactcactatagggcaagcagtggtatcaacgcagagt–3';short(2μm):5'–ctaatacgactcactatagggc–3';6)用smartertmracecdnaamplificationkit试剂盒中的3'-racecdsprimera为反转录引物,将步骤2)提取的总rna反转录为cdna,获得prcat38的3’末端cdna;所述3'-racecdsprimera:5'–aagcagtggtatcaacgcagagtac(t)30vn–3',(n=a,c,g,ort;v=a,g,orc);7)以步骤6)中的cdna为模板,用所述10xuniversalprimeramix和引物gsp5扩增prcat38的3’末端片段,所述3’末端片段的琼脂糖凝胶电泳结果如图1d所示;所述3’末端片段连接t-vector,通过测序获得prcat38的3’端序列,3’端序列的测序结果如图1c所示;8)将上述步骤5)得到的5’末端片段和步骤7)所得到的3’末端片段进行拼接得到所述长链非编码rna的全长cdna序列。实施例2本实施例提供一种通过生物信息学方法,对所述长链非编码rna(prcat38精准全长cdna序列)的保守性、转录活性和编码能力进行分析,具体如下:1、利用roadmap得到前列腺癌细胞株pc3中h3k4me3、h3k36me3和h3k27ac的数据,利用encode数据库(https://www.encodeproject.org/)得到正常组织和前列腺癌组织中h3k4me3、h3k36me3和h3k27ac的数据,geoaccessionnumber分别为gse96019(h3k4me3,pc3)、gse96418(h3k36me3,pc3)和gse96399(h3k27ac,pc3),encodeexperimentid为encsr748rbt(h3k4me3,normalprostate)、encsr499fxi(h3k36me3,normalprostate)和encsr763idk(h3k27ac,normalprostate)。将前列腺癌细胞株pc3中所得数据在ucsc网站显示(http://genome.ucsc.edu/),得到h3k4me3、h3k36me3和h3k27ac在prcat38基因启动子和基因区的富集情况(图2a)。活跃转录基因的转录起始位点以h3k4me3和h3k27ac为特征,并且活跃的增强子能够被h3k4me1和h3k27ac富集鉴定。活跃转录基因的基因体与h3k36me3相关。图2a所示的前列腺癌细胞中h3k4me3、h3k36me3和h3k27ac在prcat38基因启动子和基因区的富集情况表明prcat38前列腺癌细胞中有较强的转录活性,提示prcat38的转录与前列腺癌具有一定的相关性。2、在ucsc网站上得到prcat38在100种脊柱动物中的phastconsscore,用于分析prcat38在不同物种之间的保守性(图2b),保守性分析结果图2b从上向下依次显示100种脊椎动物中prcat38保守型分析峰图,以及prcat38在黑猩猩、大猩猩、猩猩、长臂猿、恒河猴、食蟹猕猴、狒狒、绿长尾猴、狨猴、松鼠猴和夜猴中的保守性分析结果。分析结果表明prcat38在不同物种之间的保守性极低。3、通过phylocsf方法分析了prcat38、hotair、schlap1、gapdh和actb的编码能力,结果如图2c所示:prcat38的phylocsfscore为负值,介于hotair与schlap1之间,hotair和schlap1均为长链非编码rna,对比蛋白编码基因gapdh和actb的phylocsfscore均为正值,表明prcat38基因不具备蛋白编码能力。实施例3本实施例提供一种rt-pcr和生物信息学检测长链非编码rna(prcat38)在前列腺癌细胞、前列腺正常组织和癌组织,以及多种其他正常的人体组织和癌组织中的表达情况,具体包括以下步骤:1、rt-pcr的检测不同前列腺腺癌细胞株中prcat38的表达情况:(1)引物设计基于prcat38的全长cdna序列,设计rt-pcr的扩增引物,其中上游引物prcat38-f的核苷酸序列如seqidno.10所示,下游引物prcat38-r的核苷酸序列如seqidno.11所示。(2)按照如下方法分别提取人前列腺癌细胞pc3、lncap、du145和22rv1的总rna:①将一个培养有上述任一细胞的6cm培养皿用pbs(ph为7.4)清洗,加入1mltrizol,移入1.5mlep管中,混匀,静置5min;②12000rpm,4℃离心10min;③加入200μl氯仿,剧烈摇晃15s,静置5min;④12000rpm,4℃离心15min;小心将上层水相移入新的1.5mlep管中,加入等体积的异丙醇,混匀后放入-20℃保存1小时;⑤12000rpm,4℃离心10min,小心弃上清;⑥加入1ml的体积浓度为75%乙醇(depc水配置)洗涤沉淀,加入乙醇后,将rna沉淀弹起漂洗;⑦12000rpm,4℃离心10min,倒出液体,剩余的少量液体短暂离心,然后用枪头吸出,注意不要吸弃沉淀;⑧室温晾干,用30μl的depc(焦碳酸二乙酯)水溶解,测浓度。(3)去除基因组dna的反应,使用iiifirst-strandsynthesissystemkit,将步骤(2)中提取的细胞总rna配制为表2所示的混合体系,将混合体系在42℃下静置2min,去除rna中混有的基因组dna。表2去除dna的反应混合体系试剂使用量5*gdnaeraserbuffer2μlgdnaeraser1μltotalrna1μgrnasefreeh2oupto10μl(4)使用iiifirst-strandsynthesissystemkit,将步骤(3)中获得的细胞总rna反转录为cdna,所述细胞总rna反应液为10μl,反转录的反应程序为:37℃保持15min,85℃保持5s,4℃恒温静置,所述反转录的扩增体系如下所示:表3反转录扩增体系试剂使用量primescriptrtenzymemix11μlrtprimermix*41μl5*primescriptbuffer24μlrnasefreedh2o4μl(5)以步骤(4)中所得的cdna为模板,应用步骤(1)中设计的引物对(prcat38-f和prcat38-r),通过荧光定量pcr检测所述长链非编码rna的表达水平。其中,荧光定量pcr使用greendye在abisteponepcrinstrument上进行检测,荧光定量pcr的反应体系如表4所示,反应程序为:50℃保持2min,95℃保持10min,95℃保持15s,60℃保持30s,40个循环,95℃保持15s,60℃保持1min,95℃保持15s。表4荧光定量pcr扩增体系不同细胞中的prcat38表达情况如图3a所示,相对细胞株du145和22rv1,prcat38在pc3和lncap中有较高的表达量。2、原位杂交检测prcat38在癌旁组织与前列腺癌组织中的表达情况,癌症组织样本和癌旁组织样本的原位杂交检测由上海芯超生物科技有限公司完成,检测过程包括以下步骤:①在通风橱中将组织样本脱蜡:二甲苯处理3次,每次5min,然后去除二甲苯,pbs缓冲液冲洗2-5min后,蛋白酶消化组织样本;②用浓度为15ug/ml的蛋白酶k在37℃下处理40min;③用pbs冲洗2次,并简单震摇;④酒精脱水,脱水步骤为:乙醇70%上下浸洗10,乙醇70%冲洗1min,乙醇96%上下浸洗10次,乙醇96%冲洗1min,乙醇100%上下浸洗10次,乙醇100%冲洗1min;⑤将组织样本放在干净的纸上空气干燥15min;⑥使用prcat38的探针进行杂交(杂交温度等于探针的tm值减21℃);⑦在每张组织玻片上加50-100μl的杂交液,然后盖上盖玻片,用胶水封片,在50℃的杂交温度下进行杂交1h;⑧用镊子小心的把封片胶撕掉,避免玻片刮花组织样本,把玻片放入室温下的杂交缓冲液(5xssc)中;⑨在杂交温度根据下面溶液梯度洗片:5xssc的杂交缓冲液洗片5min,1xssc的杂交缓冲液洗片5min,0.2xssc的杂交缓冲液洗片5min,0.2xssc的杂交缓冲液室温下洗片5min;⑩室温下用pbs缓冲液冲洗5min;将玻片甩干,室温放入封闭液1ml(封闭液:10xroche封闭液100μl,1x顺丁烯二酸缓冲液900ul)中,封闭15min;用纸吸干封闭液后,放在湿盒中加入1μl抗体和800μl封闭液(10xroche封闭液100ul,1x顺丁烯二酸缓冲液900ul,正常羊血清20μl)1:800(在1:500-1:2000之间)anti-dig-apfabfragments,4℃过夜室温下用pbst缓冲液冲洗3次,每次冲洗3min;然后在避光环境下进行颜色反应,反应结束后用pbst缓冲液冲洗3次,每次冲洗3min;在水中洗片2次,每次1min;加200μl核固红染液染色1分钟后,在自来水中冲洗10分钟,酒精脱水;甘油封片后观察。原位杂交的结果如图3b和图3c所示,prcat38在前列腺癌组织中异常高表达,与在癌旁组织中的表达有显著差异,表示prcat38的表达与前列腺癌的发生具有密切相关性,prcat38具有作为前列腺癌诊断/预后标志物的潜能。3、检测prcat38在不同癌组织和正常组织中的表达情况获取包括前列腺、肺和肝和胰腺等不同组织的癌组织样本与正常组织中prcat38的表达情况,其中prcat38及它的表达数据从mitranscriptome(http://mitranscriptome.org)下载,病人样本从tcga上下载,通过wilcoxonranksumtest检测prcat38在多种正常组织和癌组织中表达量的差异。结果如图3d和3e所示:图3d显示与正常组织相比,prcat38在癌症组织中显著高表达;图3e显示在多种不同的癌组织(图3e的横坐标从左向右依次显示:白血病、膀胱癌、膀胱、脑癌、乳腺癌、乳腺、宫颈癌、宫颈、结肠癌、胃癌、胃、成胶质细胞瘤、头颈癌、头颈、肾癌、肾结核杆菌细胞癌、肾、肝癌、肝、肺腺癌、肺鳞癌、肺、黑色素瘤、对照正常组织、卵巢癌、胰腺癌、胰腺、前列腺癌、前列腺、直肠癌、甲状腺癌、甲状腺、子宫癌和子宫)中,prcat38在前列腺癌中异常高表达,且在前列腺癌组织中的表达具有高度的特异性,进一步验证了prcat38是一种有效的前列腺癌诊断/预后的分子标志物,能够用于检测个体中前列腺癌的存在或者发展。实施例4本实施例提供一种通过绘制roc曲线,对长链非编码rna(prcat38)作为前列腺癌诊断标志物的能力评估的方法,具体包括以下步骤:将实施例3中通过tcga数据库获取的前列腺癌病人组织数据通过rgui软件进行编辑,获得roc(receiveroperatorcharacteristiccurve)曲线,roc曲线是反映真阳性率(灵敏度,又称敏感性,sensitivity)和假阳性率(特异性,specificity)连续变量的综合指标,是用构图法揭示灵敏度和特异性的相互关系。prcat38作为前列腺癌诊断标志物的roc曲线如图4所示,以prcat38作为标志物诊断前列腺癌的灵敏度为0.881,特异性为0.929,auc值达0.95,表示prcat38作为诊断标志物具有特异性强、灵敏度高的优势,应用其检测前列腺癌,能够显著提高检测结果的准确性,为前列腺癌患者的早期诊断、预后,以及治疗效果的评估提供重要的参考信息,便于提供及时、针对性的治疗,提高患者的存活率和生存质量。实施例5本实施例提供一种癌症联合诊断标志物,癌症联合诊断标志物包括长链非编码rna(prcat38)、ezh2和mir-24-2,上述基因联合应用对前列腺癌进行检测和抑制的方法如下:1、基于前列腺癌中的已知功能的mirna,利用网站(https://genie.weizmann.ac.il/pubs/mir07/mir07_prediction.html)分析mirna与prcat38的结合潜能,绘制得到cerna网络图(图5a)。2、基于cerna网络图,通过tcga数据库获取prcat38和相关基因的表达数据,分析prcat38和相关基因的表达关系,首先发现与prcat38与ezh2和mir-24-2的相互作用关系。ezh2(genbankid:nc_000007)和mir-24-2(genbankid:nc_000019)均是已报道过的与前列腺癌相关的基因,如图5b所示:ezh2在前列腺癌中高表达,mir-24-2在前列腺癌中低表达;如图5c所示:ezh2和mir-24-2在前列腺癌组织中呈负的表达相关性;如图5d所示:随着prcat38表达量的增长,ezh2表达量随之增长,而mir-24-2的表达量相对下降,因此,prcat38与ezh2的表达呈现正相关关系,prcat38和mir-24-2的表达呈现负相关关系。ezh2、prcat38和mir-24-2具有癌症联合诊断标志物的潜能。3、实施例7中构建的过表达质粒plvx-prcat38和对照质粒plvx-neo转染到prcat38低表达的前列腺癌细胞du145中,构建prcat38过表达的细胞株,然后利用westernblot检测细胞中ezh2的蛋白表达情况,检测结果如图5e所示:在prcat38过表达的细胞中,ezh2的表达量显著上升,进一步验证了prcat38和ezh2之间正的相关性,ezh2、prcat38和mir-24-2能够用于前列腺癌的联合检测,为癌症的早期诊断、预后评估和疗效监测提供有效信息。另一方面,由于ezh2是已报道的在前列腺癌发生、浸润和转移过程中发挥作用的癌基因,根据ezh2和prcat38在前列腺癌中的协同增强的表达关系,设计一种同时抑制ezh2和prcat38表达的抑制剂,能够显著提高对前列腺癌细胞的增殖和转移的抑制作用,避免抑制剂只能靶向单一癌基因时由于基因表达的个体差异而产生的无效抑制,对前列腺癌的基因治疗或者临床治疗药物的研发具有重要的应用价值。实施例6本实施例提供一种通过绘制roc曲线,对长链非编码rna(prcat38)、ezh2和mir-24-2作为前列腺癌联合诊断标志物的能力评估的方法:依据实施例4中所示的roc曲线的绘制方法获得ezh2、prcat38和mir-24-2联合应用于检测前列腺的roc曲线,结果如图6所示:以ezh2、prcat38和mir-24-2联合诊断前列腺癌的auc为0.941,其中联合检测灵敏度(1.000)较ezh2(0.827)、mir-24-2(0.578)或prcat38(0.792)单独检测的灵敏度获得了显著的提升,能够有效避免癌症检测时出现漏诊的情况。另一方面,由于肿瘤发生是一个多基因、多步骤的癌变过程,尽管prcat38是前列腺癌诊断的理想候选指标,仅靠一个指标进行诊断,常常会导致假阳性和假阴性,所以,单个标志物的检测必然存在一些局限性,影响前列腺癌的临床诊断。同时以prcat38、ezh2和mir-24-2三种基因进行联合诊断,能够避免在单个基因检测时由于个体表达差异、检测过程中单一指标检测数据的误读误判导致的检测失误,提高前列腺癌检测的准确度。实施例7本实施例提供一种长链非编码rna(prcat38)特异性rna干扰质粒与过表达质粒的构建方法,具体包括以下步骤:1、构建prcat38的rna干扰质粒:shrna1表达质粒、shrna2表达质粒和shrna3表达质粒(1)根据实施例1中所获得的prcat38精准全长cdna序列,利用rnai设计网站(https://rnaidesigner.thermofisher.com/rnaiexpress/;http://cancan.cshl.edu/rnai_central/rnai.cgi?type=shrna),获得三个可信度高的rnai的靶位点(也即sirna干扰位点),其中,sirna1正义链的核苷酸序列如seqidno.12所示,sirna1反义链的核苷酸序列如seqidno.13所示;sirna2正义链的核苷酸序列如seqidno.14所示,sirna2反义链的核苷酸序列如seqidno.15所示;sirna3正义链的核苷酸序列如seqidno.16所示,sirna3反义链的核苷酸序列如seqidno.17所示。(2)根据上述的sirna的干扰序列,设计shrna,其中,shrna1的核苷酸序列如seqidno.18所示,shrna2的核苷酸序列如sseqidno.19所示,shrna3的核苷酸序列如seqidno.20所示。(3)根据步骤2中设计的三条shrna序列构建相应的shrna表达质粒,具体构建步骤如下:①选择步骤(2)中的shrna作为目的发夹片段序列,选择psih-h1作为干扰载体设计引物,构建shrna1表达质粒的引物shrna1-f(5’-gatccgcttagtgataagactgtatcttcaagagagatacagtcttatcactaagcttttttg-3’),引物shrna1-r(5’-aattcaaaaaagcttagtgataagactgtatctctcttgaagatacagtcttatcactaagcg-3’);构建shrna2表达质粒的引物shrna2-f(5’-gatccggccacgtgatacttccaacattcaagagatgttggaagtatcacgtggccttttttg-3’),引物shrna2-r(5’-aattcaaaaaaggccacgtgatacttccaacatctcttgaatgttggaagtatcacgtggccg-3’);构建shrna3表达质粒的引物shrna3-f(5’-gatccgatgtcctcacttgatattctcaattcttttcaagagaaagaattgagaatatcaagtgaggacatcttttttg-3’),引物shrna3-r(5’-aattcaaaaaagatgtcctcacttgatattctcaattctttctcttgaaaagaattgagaatatcaagtgaggacatcg-3’);上述引物序列退火后分别通过的酶切位点5’-bamhi和3’-ecori连接到载体psih-h1上;②退火反应反应条件为:37℃保持30min,95℃保持5min,以6℃/min速度梯度退火至25℃;退火反应体系如下所示:shrna1-f、shrna2-f或shrna3-f,100μm,1μl,shrna1-r、shrna2-r或shrna3-r,100μm,1μl,10xt4dnaligasebuffer,1μl,t4pnk,0.3-0.5μl,ddh2o,补齐10μl;③连接以1μl退火产物加入99μlddh2o的比例稀释上述退火产物,按照如下反应体系连接:psih-h1(bamhi/ecori双酶切),100ng,dilutedoligo,2μl,10xt4ligasebuffer,2μl,t4ligase,0.5μl,ddh2o,补齐20μl,连接条件:4℃过夜或37℃3-5h。④转化突变挑克隆送测序。2、过表达质粒plvx-prcat38的构建过程(1)设计引物prcat38-f2(5’-ccgctcgaggaataccaaaccttgtgaagatgagcgttg-3’)和prcat38-r2(5’-cgcggatcctgactttaacccaggtctacttctattgaattcc-3’)。(2)pcr反应pcr扩增反应体系:ddh20,36μl;含有prcat38全长的质粒,所述含有prcat38全长的质粒为采用实施例1中获得的prcat38的全长cdna序列基因合成连接在puc载体上,2μl;prcat38-f2,10μm,1μl;prcat38-r2,10μm,1μl;pfu,1μl;pfubuffer,5μl;dntps,4μl;pcr反应程序设定:95℃预变性5min,95℃变性30s,60℃退火30s,72℃2-4kb/min延伸,35个循环,72℃终延伸:10min,最后降温至4℃;(3)将上述pcr产物纯化后与plvx-neo载体同时双酶切(xhoi/bamhi双酶切),跑胶纯化,连接,连接体系如下所示:plvx-neo(xhoi/bamhi双酶切产物),50ng,pcr产物(xhoi/bamhi双酶切产物),50ng,10*t4ligasebuffer,2μl,t4ligase,1μl,ddh2o,补齐20μl,连接条件:4℃过夜,将连接产物转化挑克隆送测序。实施例8本实施例检测prcat38对前列腺癌细胞的增殖、克隆形成和迁移的影响,具体包括以下步骤:(一)利用lna干扰序列验证prcat38对前列腺癌细胞的增殖、克隆形成和迁移的影响:1、以lna-control作为空白对照,将购买的prcat38的干扰序列lna-1和lna-2分别转染至前列腺腺癌细胞株pc3中,构建prcat38敲减的pc3细胞,lna转染具体操作步骤为:(1)取两个ep管,在第一个ep管中加入2ullna(50um),然后在两个ep管中分别加入200μlopti-mem,再在第二个ep管中加入10μl的pei转染试剂,旋涡混匀,静置5min;(3)将含有转染试剂pei的溶液加入lna中,旋涡混匀,静置15min;(4)用6cm细胞培养皿铺pc3,使第二天时能够达到60-70%;(5)将(3)中溶液加入细胞;(6)6h后换液;(7)第三天即获得可用的目的细胞。2、生长曲线及克隆形成(1)在96孔板中,将各细胞株调整为每100μl中2000个细胞。使用lμminescentcellviabilityassay(ctg)每24h测定一次,通过prism5.0处理数据后得到生长曲线;(2)分别将prcat38敲减的细胞株pc3按照2000/孔或者1000/孔种植于六孔板中,培养10-14天后,细胞克隆形成,将培养基去掉,用pbs洗一两次,甲醇:乙酸=3:1处理1h,用结晶紫处理12h以后,用pbs清洗,计数。通过prism5.0处理数据。3、细胞迁移(1)第一天,在24孔板中放入培养插件,计数后分别加入步骤1中筛选好的稳定表达细胞系,使第二天细胞能刚好长满;(2)第二天取出培养插件,用pbs洗两次,加入500μl无血清的培养基。并分别在0、12、24h对划痕位置进行拍照(7e);(3)利用imagej统计划痕位置空白面积,0h面积与12h或24h面积的差值即为细胞移动面积。以对照组细胞移动面积归一,计算实验组移动面积占对照组的比例即得到柱状图(7f)。lna-1和lna-2在pc3细胞株中对prcat38的干扰效率如图7a所示,两种干扰序列对prcat38的干扰效率均在50%左右,能够形成对prcat38的表达抑制,得到prcat38敲减的前列腺癌细胞株;在得到prcat38低表达的前列腺癌细胞株后,检测细胞的增殖能力、细胞克隆形成能力和细胞迁移能力,如图7b所示的细胞生长曲线显示:在细胞中敲减prcat38后,细胞增殖能力相应被抑制;如图7c所示的细胞克隆形成数和对应图7c的量化柱形图7d显示:与未敲减prcat38的细胞相比,在细胞中敲减prcat38后,细胞克隆形成能力降低,如图7e所示的细胞迁移结果和对应图7e的量化柱形图7f显示:在细胞培养12h和24h后,与未敲减prcat38的细胞相比,敲减prcat38的细胞其细胞迁移能力显著降低。说明prcat38参与前列腺癌细胞的生长、克隆形成和迁移过程,prcat38能够起到癌基因的功能。(二)利用shrna表达质粒验证prcat38对前列腺癌细胞的增殖、克隆形成和迁移的影响:1、以psih-h1作为空白对照,将构建的shrna1、shrna2和shrna3分别转染至前列腺癌细胞株pc3中,构建prcat38敲减的pc3细胞,转染具体操作步骤为:(1)第一天用6cm细胞培养皿铺lenti-xtm293t,使第二天转染时能够达到70-80%;(2)第二天当细胞密度达到70-80%可以转染时,取两个ep管,质粒在第一个ep管中按照pmd2g:pspax2:目的质粒=1.5ug:3ug:4ug进行混匀,然后在两个ep管中分别加入160μlopti-mem,再在第二个ep管中加入25.5μl的pei转染试剂,旋涡混匀,静置5min;(3)将含有转染试剂pei的溶液加入质粒中,旋涡混匀,静置15min;(4)取出细胞,吸弃上清,用pbs(ph)洗一下,加入1.6mlopti-mem;(5)将质粒加入细胞;(6)6h后换液;(7)第二天铺目的细胞,使第二天感染时能够达到70-80%;(8)第三天将48h病毒取出,3000rpm离心10min;(9)取出目的细胞,吸弃上清,加入病毒;(10)第四天同一时间加入含有puromysin(嘌呤霉素)的dmem培养基,其中a549细胞使用含有puromysin浓度为1.5ug/ml的培养基,pc9细胞使用含有puromysin致死浓度2ug/ml的培养基,筛选感染成功的阳性细胞。2、分别利用步骤(一)中所示的生长曲线、克隆形成和细胞迁移的测方法,通过步骤1中构建的prcat38和ezh2低表达的前列腺癌细胞株获取prcat38和ezh2表达抑制后细胞的增殖(9a)、克隆形成能力(9b和9c)和迁移能力(9d和9e)。shrna1和shrna2在pc3细胞株中对prcat38的干扰效率如图8a所示,两种shrna质粒对prcat38的干扰效率均在75%以上,干扰效果优于步骤(一)中使用的lna干扰序列,形成对prcat38的有效抑制,同时,利用上述质粒对前列腺癌细胞株敲减的稳定性高,能够得到prcat38稳定抑制的细胞株;同时检测shrna1和shrna2对癌基因ezh2的抑制效果,检测结果如图8b所示,在转染shrna1和shrna2表达质粒的细胞中,ezh2的蛋白表达量显著性降低,说明shrna1和shrna2能够形成对ezh2的有效抑制。shrna3对前列腺癌的克隆形成的检测结果如图11所示,shrna3在转染到pc3细胞株中能够形成对前列腺癌细胞的完全抑制,抑制率达100%,有效杀死前列腺癌细胞,避免前列腺癌细胞的增殖、克隆形成和迁移。利用shrna1和shrna2表达质粒敲减prcat38和ezh2后,检测前列腺癌细胞的增殖和克隆形成能力,如图9a所示的细胞生长曲线显示:在细胞中敲减prcat38和ezh2后,细胞增殖能力被有效抑制;如图9b所示的细胞克隆形成数和对应图9b的量化柱形图9c显示:在细胞中敲减prcat38和ezh2后,细胞克隆形成能力显著降低;利用shrna1和shrna2表达质粒敲减prcat38和ezh2后,检测前列腺癌细胞的迁移能力,如图9d所示的细胞迁移结果和对应图9d的量化柱形图9e显示:在细胞培养12h和24h后,与未敲减的细胞相比,敲减prcat38和ezh2后细胞的迁移能力显著降低。(三)利用prcat38过表达质粒验证prcat38对前列腺癌细胞的增殖、克隆形成和迁移的影响:1、将实施例7中构建的过表达质粒plvx-prcat38和对照质粒plvx-neo转染到prcat38低表达的前列腺癌细胞du145中,转染方法如步骤(一)中所示(所述转染方法中采用的含有g418的rpmi-1640培养基中,培养基中g418为致死浓度200μg/ml)。2、分别利用步骤(一)中所示的生长曲线、克隆形成和细胞迁移的测方法,通过步骤1中构建的prcat38过表达的前列腺癌细胞株获取prcat38表达抑制后细胞的增殖、克隆形成能力和迁移能力。图10a显示在转染plvx-prcat38的du145细胞株中,prcat38的表达量显著上升,说明构建得到了prcat38过表达的细胞株;在得到prcat38稳定过表达的前列腺癌细胞株后,检测细胞的增殖能力、细胞克隆形成能力和细胞迁移能力,如图10b所示的细胞生长曲线显示:在细胞中过表达prcat38后,细胞增殖能力显著增强;如图10c所示的细胞克隆形成数和对应10c的量化柱形图10d显示:在细胞中过表达prcat38后,细胞克隆形成能力得到了有效的提高,如图10e所示的细胞迁移结果和对应10e的量化柱形图10f显示:在细胞培养12h和24h后,过表达prcat38的细胞其细胞迁移能力显著相应增强。结果说明:通过rnai技术和过表达研究不同prcat38表达水平对前列腺癌细胞增殖、克隆形成能力和迁移作用的影响。包括生长曲线、克隆形成实验和迁移实验。结果发现prcat38被敲低表达之后前列腺癌细胞的迁移、增殖和克隆形成能力被显著性抑制,prcat38过表达之后前列腺癌细胞的迁移、增殖和克隆形成能力被显著性增强,这表明prcat38能够起到促进前列腺癌细胞增殖和迁移的能力,prcat38与肿瘤的发生发展和转移密切相关,利用prcat38能够实现在前列腺癌早期的精确诊断,并有效诊断前列腺癌的恶性程度,和是否发生进展转移。同时,由于ezh2和prcat38均属于在前列腺癌发生、发展和转移过程中发挥作用的癌基因,且两者在前列腺癌中的表达具有协同效应,本实施例中设计得到的shrna1和shrna2,实现了以单一的表达抑制剂,对prcat38和ezh2的共同抑制,且shrna1和shrna2的干扰效果好、稳定性高,能够形成对前列腺腺癌细胞的生长、克隆和迁移的显著抑制。本实施例中通过设计单一的分子靶向抑制剂(sirna或shrna),实现对prcat38和ezh2表达的同时抑制,与单一标志物的靶向治疗相比具有对前列腺癌细胞增殖、侵袭转移等的抑制效果增强,进而增强了对前列腺癌的浸润深度的抑制作用,显著提高肿瘤治疗疗效,具有重要的临床应用价值。同时,利用单一sirna或shrna靶向两个肿瘤相关基因,避免了同时导入多种sirna或shrna时可能产生的相互干扰,提高了对前列腺细胞的抑制水平和抑制效率。由于shrna1和shrna2的低脱靶效应、高干扰效率和高稳定性,为前列腺癌的基因治疗提供了重要的应用途径,同时,本实施例提供的sirna干扰序列也为前列腺癌的抗癌药物的研发提供了重要的研发基础。上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。sequencelisting<110>中国科学院苏州生物医学工程技术研究所<120>人前列腺癌早期诊断用长链非编码rna序列及其应用<130>sha201700567<160>20<170>patentinversion3.3<210>1<211>2413<212>dna<213>人工序列(prcat38)<400>1gaataccaaaccttgtgaagatgagcgttgggaaaggagtaggaaggtcccaatttggaa60ttttgacatcctaaaagccttgggtgccgcagaatgagtaagctggagggtactgtgtaa120agacctcggctactgcagcagagaaacagatcaaaaaagtcaagaccggcgagaggaaag180tgattgaaaggccatcactgaaagaggtgacaagcttggatttggcagggcaggagggat240gcagagagggacggatgtgagagtccacaggaagaagccttctgattgaaagggtgcttg300gctgtggatgtgagggacagaaaggggtcgaggctgtcactgagatcctcagcttcagca360aggggatgcatggtgccttaatttactgtaagaacatggaagaggcacaggtttaggggg420cgatatggagccccattgtggaaatgcagggtctgaggagtgcctggccttctgctggcg480ctgcccaggagagcactggaggagcagacgtggcctccgggagatgctgagccagggctg540aggacatgagatgcgcagggagggcagacactcccaccaggtcagaggagagacagggag600gccagccctgccaaagccaggcctcagtttatttgtagagtgagagcttgaatttcagga660tcacaaaaggttttttccaagagccaaaaggacttagtttctaactgttctcctccctcc720tttttgtggctgacaatgaacaacctaatccccttcctttttgaataattctccctgccc780agtgactcacccaggtgcagatgagacacagagctcatggttgcctcctgtgaagtgcag840gaaggatggagcagacagacccaaaagcactggcctcccagatgaatcaggagggatgtg900caggctgggtgacgtctgccccggaaccaggaaagtgcggctgcttcctccacaccccgc960ccgccgcccaggacccagggcccttctgaaaagtgagcattgtgttgttctttagactta1020ttttatatgaaagcacatcacgctctaagaagagtcacccaggctttctgttctcaggtg1080gagcctccctacaccctacgcacacggcggctgttccccacgacacagcggggggcaaat1140gaccaccaggagccagggagtcccagggaaaggacgcagatggctcgtgtcctggaattt1200catgggagccatttgaaatcatcagcaaatgacgcccgagtctataagggacctcagcgc1260aggggctggatgagacagggtgggcagccacaaaacagggtggtgaaggcccgaggccag1320gagggctgggttagcactcggccaccagagggaagcaagcaagctccctccctctctctc1380tttctctctgtctatgtgtctttctctctccctctctgtctctctccatctctctctcca1440cccacacctcctgaggattgttgggttttcccatggactagggttagacagccagcgagt1500ctgaacggaaggcgccaggtgtggcagtggggaagtgaggtggggcctggaacacaaggg1560caagggcctctgggaggaccgcgcaggctcggcacactgagcggactgactgcagaccct1620cctcccacaccagggggaccacctctctgtgcaaagatgtcctcacttgatattctcaat1680tctttgaggtcaaggttttattaacactccctgaaaagtgggagagcttagtgataagac1740tgtatcatttttgcaagacacaaagcaagcacagctggatggcatgtgccagctccctca1800ccatgctgagcacttttactcacatctcacccctgcagacagatgccagtgtcctcactc1860acccactggggcagacattattagttgccaatgcaagacccatttcctcacgtcctaact1920aatagaaccccaactgtgtccaggcaggtgacgtgcccagctaaaaatactcaccttttc1980agactcccttgaagttagtagcggccacgtgatacttccaacaaataagacatacacaga2040gatctgctggggcttctgtgaaaacttttacttccctgaaacgggtaccaccttccttct2100cccattctttcttcctccttgaagcacagaagcaatgcctggagctgcagcggccatttt2160gtgattgtgaagcaatgacctgaggaatgaaggccaacatcaaggatggcaaaacagaga2220gaggaaaagagcaattgtcccctgatggcatggctgggccactgccccaaccctgtgagg2280ccatgtgactccttattacatgagcacaggctagtcggggtttgtgctatctgcaggtga2340atgcttggagattgtacaaaagtttatactggaggctttggaattcaatagaagtagacc2400tgggttaaagtca2413<210>2<211>21<212>dna<213>人工序列(gsp1-f)<400>2tgcaaagctaaagggggtcaa21<210>3<211>21<212>dna<213>人工序列(gsp1-r)<400>3cagtgcttttgggtctgtctg21<210>4<211>20<212>dna<213>人工序列(gsp2-f)<400>4acagagctcatggttgcctc20<210>5<211>20<212>dna<213>人工序列(gsp2-r)<400>5ctggctcctggtggtcattt20<210>6<211>19<212>dna<213>人工序列(gsp3-f)<400>6agcctccctacaccctacg19<210>7<211>20<212>dna<213>人工序列(gsp3-r)<400>7cttgcttgcttccctctggt20<210>8<211>37<212>dna<213>人工序列(gsp4)<400>8gattacgccaagcttctggctcctggtggtcatttgc37<210>9<211>40<212>dna<213>人工序列(gsp5)<400>9gattacgccaagcttacagagctcatggttgcctcctgtg40<210>10<211>19<212>dna<213>人工序列(prcat38-f)<400>10agcctccctacaccctacg19<210>11<211>20<212>dna<213>人工序列(prcat38-r)<400>11cttgcttgcttccctctggt20<210>12<211>21<212>dna<213>人工序列(sirna-1-f)<400>12gcttagtgataagactgtatc21<210>13<211>21<212>dna<213>人工序列(sirna-1-r)<400>13gatacagtcttatcactaagc21<210>14<211>21<212>dna<213>人工序列(sirna-2-f)<400>14ggccacgtgatacttccaaca21<210>15<211>21<212>dna<213>人工序列(sirna-2-r)<400>15tgttggaagtatcacgtggcc21<210>16<211>29<212>dna<213>人工序列(sirna-3-f)<400>16gatgtcctcacttgatattctcaattctt29<210>17<211>29<212>dna<213>人工序列(sirna-3-r)<400>17aagaattgagaatatcaagtgaggacatc29<210>18<211>63<212>dna<213>人工序列(shrna1)<400>18gatccgcttagtgataagactgtatcttcaagagagatacagtcttatcactaagctttt60ttg63<210>19<211>63<212>dna<213>人工序列(shrna2)<400>19gatccggccacgtgatacttccaacattcaagagatgttggaagtatcacgtggcctttt60ttg63<210>20<211>79<212>dna<213>人工序列(shrna3)<400>20gatccgatgtcctcacttgatattctcaattcttttcaagagaaagaattgagaatatca60agtgaggacatcttttttg79当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- Pkib和naaladl2用作前列腺癌治疗和诊断的靶基因的制作方法
- Crisp3蛋白在前列腺癌诊断和治疗中的应用的制作方法
- 用于前列腺癌转移早期诊断的试剂盒的制作方法
- 一种前列腺癌症早期诊断、转移、复发的综合检测试剂盒及检测方法和应用的制作方法
- 一种前列腺癌生物标志物miR-21*、诊断试剂盒及应用的制作方法
- 一种前列腺癌生物标志物miR-126-5P、诊断试剂盒及应用的制作方法
- 一种用于前列腺癌早期诊断和治疗的抗psma/fitc双特异性抗体及其制备方法
- 用于前列腺癌早期诊断的引物对、探针和试剂盒的制作方法
- 作为检测日光照射、前列腺癌和其它癌症的诊断工具的线粒体突变及重排的制作方法
- 用于治疗和诊断前列腺癌的组合物和方法