化合物及其有机电子装置的制作方法
本发明是关于一种新颖化合物以及一种使用其的有机电子装置,尤指一种用于电子传输层的新颖化合物以及使用其的有机电子装置。
背景技术:
随着科技的进步,各种使用有机材料制成的有机电子装置蓬勃发展,常见的有机电子装置如有机发光二极管(organic light emitting device,OLED)、有机光敏晶体管(organic phototransistor)、有机光伏打电池(organic photovoltaic cell)和有机光检测器(organic photodetector)。
OLED最初是由伊士曼柯达公司(Eastman Kodak)所发明并提出,伊士曼柯达公司的邓青云博士和Steven VanSlyke以真空蒸镀法(vacuum evaporation method)于形成有有机芳香二元胺电洞传输层的透明氧化铟锡(indium tin oxide,ITO)玻璃上沉积电子传输材料{例如三(8-羟基喹啉)铝[tris(8-hydroxyquinoline)aluminum(III),简称为Alq3]};再于电子传输层上沉积金属电极,即可完成OLED的制作。OLED因兼具反应速率快、质轻、薄形化、广视角、亮度高、对比高、无需设置背光源以及低耗能的优点,因此备受关注,但OLED仍具有低效率和寿命短的问题。
为了克服低效率的问题,其中一种改善方式为于阴极和阳极间设置中间层,请参阅图1所示,改良的OLED依序设置有基板11、阳极12、电洞注入层13(hole injection layer,HIL)、电洞传输层14(hole transport layer,HTL)、发光层15(an emitting layer,EL)、电子传输层16(electron transport layer,ETL)、电子注入层17(electron injection layer,EIL)和阴极18。当于阳极12和阴极18施加电压时,由阳极12射出的电洞会穿过HIL和HTL并移动至EL,而由阴极18射出的电子会穿过EIL和ETL移动至EL,使电洞和电子在EL层重组成激子(exciton),当激子由激发态衰退返回基态时即可产生光线。
另一改善方式为改良OLED中ETL的材料,使电子传输材料展现出电洞阻挡能力,传统的电子传输材料包括3,3′-[5′-[3-(3-吡啶基)苯基][1,1′:3′,1″-三联苯]-3,3″-二基]联吡啶{(3,3′-[5′-[3-(3-Pyridinyl)phenyl][1,1′:3′,1″-terphenyl]-3,3″-diyl]bispyridine,TmPyPb}、1,3,5-三(1-苯基-1H-苯并咪唑-2-基)苯[1,3,5-tris(1-phenyl-1H-benzimidazol-2-yl)benzene,TPBi]、三(2,4,6-三甲基-3-(3-吡啶基)苯基)硼烷[tris(2,4,6-trimethyl-3-(pyridin-3-yl)phenyl)borane,3TPYMB]、1,3-二(3,5-二吡啶-3-基-苯基)苯[1,3-bis(3,5-dipyrid-3-yl-phenyl)benzene,BmPyPb]和9,10-二(3-(3-吡啶基)苯基)蒽[9,10-bis(3-(pyridin-3-yl)phenyl)anthracene,DPyPA]。
然而,即使使用了所述电子传输材料,OLED的电流效率仍具有可改善的空间,因此,本发明提供了一种新颖的化合物以克服传统低电流效率的问题。
技术实现要素:
本发明的目的为提供一种新颖化合物,其可用于有机电子装置。
本发明的另一目的为提供一种使用该新颖化合物的有机电子装置,藉此降低有机电子装置的驱动电压。
再者,本发明的另一目的为提供一种使用该新颖化合物的有机电子装置,藉此提升有机电子装置的效率。
为达上述目的,本发明的新颖化合物如下式(I)所示:
式(I)中,X1和X2分别独立为C(Ra),该二(Ra)彼此相同或不同,该二(Ra)相互连接形成第一芳香环;
式(I)中,X3和X4分别独立为C(Rb),该二(Rb)彼此相同或不同,该二(Rb)相互连接形成第二芳香环,该第二芳香环为多环芳香环;
式(I)中,Z1至Z12分别独立选自于由下列所构成的群组:氢原子、氘原子、卤基、氰基、硝基、碳数为1至40的烷基、碳数为2至40的烯基、碳数为2至40的炔基、碳数为3至60的环烷基、碳数为3至60的杂环烷基、碳数为6至60的芳香基、碳数为3至60的杂芳基、碳数为1至40的烷氧基、碳数为6至60的芳氧基、碳数为1至40的硅烷基(alkylsilyl group)、碳数为6至60的芳硅基(arylsilyl group)、碳数为1至40的硼烷基(alkylboron group)、碳数为6至60的芳硼基(alkylboron group)、碳数为1至40的膦基(phosphine group)和碳数为1至40的氧膦基(phosphine oxide group)。
根据本发明,式(I)中由X3和X4延伸形成的该多环芳香环包含至少二相互连接并合的芳香环,该多环芳香环中的该至少二芳香环的环上的原子为碳原子,不包含如氮、氧或硫的原子,即该至少二芳香环不会是杂芳环,但该芳香环可连接有任何取代基,且该取代基可包含除了碳以外的其他原子。
根据本发明,式(I)中X1和X2间的双键以及该二(Ra)间的键共轭形成该第一芳香环。相似的,式(I)中由X3和X4间的双键以及该二(Rb)间的键共轭形成该多环芳香环。根据本发明,由X1和X2延伸形成的第一芳香环和由X3和X4延伸形成的多环芳香环相互连接并合成芳香基,该芳香基具有至少六个共轭的双键,较佳的,该芳香基具有至少八个共轭的双键。
由X3和X4延伸形成的多环芳香环可以为但不限:经取代或未经取代的萘环(naphthalene ring)、经取代或未经取代的蒽环(anthracene ring)、经取代或未经取代的菲环(phenanthrene ring)、经取代或未经取代的芴环(fluorene ring)、经取代或未经取代的芘环(pyrene ring)、经取代或未经取代的苯并菲环(benzophenanthrene ring)、经取代或未经取代的苯并芘环(benzopyrene ring)、经取代或未经取代的荧蒽环(fluoranthene ring)、经取代或未经取代的苯并荧蒽环(benzofluoranthene ring)或经取代或未经取代的三亚苯环(triphenylene ring)。前述多环芳香环可取代有至少一氘原子、至少一碳数为1至12的烷基、至少一碳数为2至12的烯基、至少一碳数为2至12的炔基或至少一碳数为6至12的芳香基。例如,该经取代的芴环可取代有一甲烷基、二甲烷基或二苯基,即,该经取代的芴环为9-二甲基芴环(9-methylfluorene ring)、9,9-二甲基芴环(9,9-dimethylfluorene ring)或9,9-二苯基芴环(9,9-diphenylfluorene ring)。
较佳的,Z1至Z12分别独立选自于由下列所构成的群组:氢原子、氘原子、卤基、氰基、硝基、碳数为1至12的烷基、碳数为2至12的烯基、碳数为2至12的炔基、碳数为3至30的环烷基、碳数为3至30的杂环烷基、碳数为6至30的芳香基、碳数为3至30的杂芳基、碳数为1至12的烷氧基、碳数为6至30的芳氧基、碳数为1至12的硅烷基、碳数为6至30的芳硅基、碳数为1至12的硼烷基、碳数为6至30的芳硼基、碳数为1至12的膦基和碳数为1至12的氧膦基。
举例而言,该化合物可下式(I-I)至(I-XII)中任一表示:
于上述式(I-I)至(I-XII)中,n1为0至4的正整数,T可以是但不限于:氢原子、氘原子、甲基、乙基、丙基、丁基、戊基、己基或苯基。
较佳的,所述任一通式中自X1和X2延伸形成的该第一芳香环为经取代或未经取代且碳数为6至60的碳环,更佳的,自X1和X2延伸形成的该第一芳香环为经取代或未经取代且碳数为6至20的碳环。例如,该经取代或未经取代且碳数为6至60的碳环可以选自于由下列所构成的群组:经取代或未经取代的苯环结构、经取代或未经取代的萘环结构、经取代或未经取代的蒽环结构、经取代或未经取代的菲环结构、经取代或未经取代的芘环结构、经取代或未经取代的苯并菲环结构、经取代或未经取代的苯并芘环结构、经取代或未经取代的荧蒽环结构、经取代和未经取代的苯并荧蒽环结构和经取代或未经取代的芴环结构,但不限于此。更佳的,该经取代或未经取代且碳数为6至60的碳环为经取代或未经取代的苯环结构。该碳数为6至60的碳环上的取代基可以是但不限于氘原子、卤基、氰基、硝基、碳数为1至12的烷基、碳数为2至12的烯基或碳数为2至12的炔基。
较佳的,所述任一通式中Z1至Z8中的至少一者是独立选自于由下列所构成的群组:碳数为1至40且具有至少一官能基的烷基、碳数为2至40且具有至少一官能基的烯基、碳数为2至40且具有至少一官能基的炔基、碳数为3至60且具有至少一官能基的环烷基、碳数为3至60且具有至少一官能基的杂环烷基、碳数为6至60且具有至少一官能基的芳香基、碳数为1至40且具有至少一官能基的烷氧基、碳数为6至60且具有至少一官能基的芳氧基、碳数为1至40且具有至少一官能基的硅烷基、碳数为6至60且具有至少一官能基的芳硅基、碳数为1至40且具有至少一官能基的硼烷基、碳数为6至60且具有至少一官能基的芳硼基、碳数为1至40且具有至少一官能基的膦基和碳数为1至40且具有至少一官能基的氧膦基;而所述任一通式中Z1至Z8中的其他者可以是氢原子、氘原子或说明书中提到的其余取代基。所述官能基可选自于由氰基、硝基、三氟甲基、氟基和氯基所构成的群组。
详细来说,所述任一通式中Z1至Z8中的至少一者是特定芳香取代基,该特定芳香取代基是选自于由下列所构成的群组:
其中,R1至R7分别独立选自于由下列所构成的群组:氢原子、氘原子、卤基、氰基、硝基、碳数为1至12的烷基、碳数为2至12的烯基、碳数为2至12的炔基、碳数为3至30的环烷基、碳数为3至30的杂环烷基、碳数为6至30的芳香基、碳数为3至20的杂芳基、碳数为1至40的烷氧基、碳数为6至30的芳氧基、碳数为1至40的硅烷基、碳数为6至30的芳硅基、碳数为1至40的硼烷基、碳数为6至30的芳硼基、碳数为1至30的膦基和碳数为1至30的氧膦基;
其中n为0至4的正整数;m为0至3的正整数;o是0至3的正整数;m和o的总和小于或等于5。
较佳的,R1至R3各自独立为但不限于苯基、吡啶基、嘧啶基、吡嗪基、哒嗪基、苯并吡啶基、苯并嘧啶基、苯并吡嗪基或苯并哒嗪基。
于其中一实施例,所述任一通式中Z1至Z8中至少一者为其中,R1可以是吡啶基或苯氰基(cyanophenyl),且R2和R3可以是上述的任一取代基。
于另一实施例,所述任一通式中Z1至Z8中至少一者为其中,R2可以是吡啶基或苯氰基(cyanophenyl),且R1和R3可以是上述的任一取代基。
较佳的,所述任一通式中Z1、Z2、Z3、Z6、Z7和Z8中至少一者是经二苯基、二吡啶基、二嘧啶基、二吡嗪基、二哒嗪基、二苯并吡啶基、二苯并嘧啶基、二苯并吡嗪基或二苯并哒嗪基取代的三嗪基(triazine group)。
较佳的,所述任一通式中Z1、Z2、Z3、Z6、Z7和Z8中至少一者是选自于上述特定芳香取代基,而Z4和Z5各自独立选自于由氢原子、氘原子、卤基、氰基、硝基、碳数为1至12的烷基、碳数为2至12的烯基和碳数为2至12的炔基所构成的群组。
较佳的,所述任一通式中Z2、Z3、Z6和Z7中至少一者是选自于由下列所构成的群组:
较佳的,所述任一通式中的Z9至Z12可独立选自于由下列所构成的群组:氢原子、氘原子、卤基、氰基、硝基、碳数为1至12的烷基、碳数为2至12的烯基和碳数为2至12的炔基。
根据本发明,所述任一通式中的Z1和Z8可以是相同或是不同,Z2和Z7可以是相同或是不同,Z3和Z6可以是相同或是不同;于其中一实施例,Z1、Z2、Z3、Z6、Z7和Z8中的任其中二者可以是上述相同的取代基,而Z1、Z2、Z3、Z6、Z7和Z8中其他者可以选自于由下列所构成的群组:氢原子、氘原子、卤基、氰基、硝基、碳数为1至12的烷基、碳数为2至12的烯基和碳数为2至12的炔基。
例如,Z1、Z4至Z8各自独立为氢原子或氘原子,Z2和/或Z3可以是该特定的芳香取代基;或者,Z1、Z2、Z4、Z5、Z7和Z8各自独立为氢原子或氘原子,且Z3和Z6皆为上述特定的芳香取代基。
举例而言,化合物可以选自于由下列所构成的群组:
本发明提供了一种有机电子装置,该有机电子装置包括第一电极、第二电极和设置于该第一电极和该第二电极间的有机层,该有机层具有前述化合物。
较佳的,该有机电子装置为有机发光二极管。更佳的,本发明的新颖化合物可被用于形成电子传输层或电洞阻挡层的材料。
具体而言,该有机发光二极管包括:电洞注入层、电洞传输层、发光层、电子传输层和电子注入层;该电洞注入层形成于该第一电极上;该电洞传输层形成于该电洞注入层上;该发光层形成于该电洞传输层上;该电子传输层形成于该发光层上;该电子注入层形成于该电子传输层和该第二电极之间。
于其中一实施例,该有机层可以为电子传输层,即该电子传输层包含前述的新颖化合物。
较佳的,该电洞注入层可以为双层结构,即该OLED于第一电极和电洞传输层之间具有第一电洞注入层和第二电洞注入层。
较佳的,该电洞传输层亦可以为双层结构,即该OLED于电洞注入层的双层结构与发光层之间具有第一电洞传输层和第二电洞传输层。
较佳的,该电子传输层是由该新颖化合物(如所述化合物I至CXXXVIII)所制成,本发明的OLED相较于商业上的OLED具有较佳的电流效率。其中,商业上OLED中使用的已知电子传输层材料如2-{4-[9,10-二(2-萘基)-2-蒽基]苯基}-1-苯基-1H-苯并[d]咪唑{2-[4-(9,10-di(naphthalen-2-yl)anthracen-2-yl)phenyl]-1-phenyl-1H-benzo[d]imidazole}、二(2-甲基-8-羟基喹啉)(p-苯基苯酚)铝[bis(2-methyl-8-quinolinolato)(p-phenylphenolato)aluminum]或2-(4-联苯基)-5-(4-叔丁苯基)-1,3,4-恶二唑[2-(4-biphenylyl)-5-(4-tert-butylphenyl)-1,3,4-oxadiazole),PBD]。
较佳的,该OLED包括电洞阻挡层,该电洞阻挡层形成于电子传输层和发光层之间,可防止电洞由发光层移动至电子传输层,所述电洞阻挡层可由所述化合物、2,9-二甲基-4,7-联苯基-1,10-邻二氮杂菲(2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline,BCP)或2,3,5,6-四甲基-1-苯基-1,4-邻苯二甲酰亚胺[2,3,5,6-tetramethyl-phenyl-1,4-(bis-phthalimide),TMPP]所形成,但不限于上述。于另一实施例,该有机层可以为电洞阻挡层,该电洞阻挡层具有前述新颖化合物。
较佳的,该OLED包括形成于电洞传输层和发光层之间的电子阻挡层,可防止电子由发光层移动至电洞传输层,所述电子阻挡层可由9,9’-(1,1’-联苯基)-4,4’-二基二-9H-咔唑[9,9'-(1,1'-biphenyl)-4,4'-diylbis-9H-carbazole,CBP]或4,4',4”-三(N-咔唑基)三苯胺[4,4',4”-tri(N-carbazolyl)-triphenylamine,TCTA]所形成,但不限于上述。
当OLED设置有电洞阻挡层或电子阻挡层于时,本发明的OLED相较于传统的OLED具有较高的发光效率。
所述第一和第二电洞传输层可由N,N'-(联苯-4,4’-二基)二(N1-(1-萘基))-N4,N4'-二苯基苯-1,4-二胺[N1,N1’-(biphenyl-4,4'-diyl)bis(N1-(naphthalen-1-yl)-N4,N4’-diphenylbenzene-1,4-diamine)]或N4,N4'-二(萘-1-基)-N4,N4’-二苯联苯基-4,4'-二胺[N4,N4'-di(naphthalen-1-yl)-N4,N4’-diphenylbiphenyl-4,4'-diamine,NPB]所制成。
所述第一和第二电洞注入层可由聚苯胺(polyaniline)或聚乙烯基二氧噻吩(polyethylenedioxythiophene)所制成,但不限于上述。
所述发光层可由一发光材料制成,该发光材料包括主发光体(host)和掺杂物(dopant),其中主发光体的材料例如9-[4-(1-萘基)苯基]-10-(2-萘基)蒽[9-(4-(naphthalen-1-yl)phenyl)-10-(naphthalen-2-yl)anthracene],但不限于此。
针对红光OLED,发光层中的掺杂物(dopant)可以为具有苝配位基(perylene ligands)、荧蒽配位基(fluoranthene ligands)或二茚并配位基(periflanthene ligands)的二价铱有机金属化合物,但不限于此。针对绿光OLED,发光层中的掺杂物可以为二氨基芴(diaminofluorenes)、蒽二胺(diaminoanthracenes)或具有苯基吡啶配位基(phenylpyridine ligands)的二价铱有机金属化合物,但不限于此。针对蓝光OLED,发光层中的掺杂物可以为二氨基芴、蒽二胺、芘二胺(diaminopyrenes)或具有苯基吡啶配位基的二价铱有机金属化合物,但不限于此。通过不同的主发光体材料,OLED可发出红光、绿光或蓝光。
所述电子注入层可以电子注入材料制成,例如8-氧代萘-1-基锂[(8-oxidonaphthalen-1-yl)lithium(II)],但不限于此。
所述第一电极可以为氧化铟锡电极(indium-doped tin oxide electrode),但不限于上述。
所述第二电极的功函数(work function)低于第一电极的功函数。因此,第二电极可以是但不局限于铝电极、铟电极或镁电极。
本发明的其他目的、功效和技术特征,会以图、实施例和比较例进行更详细的说明。
附图说明
图1为OLED的侧视剖面图。
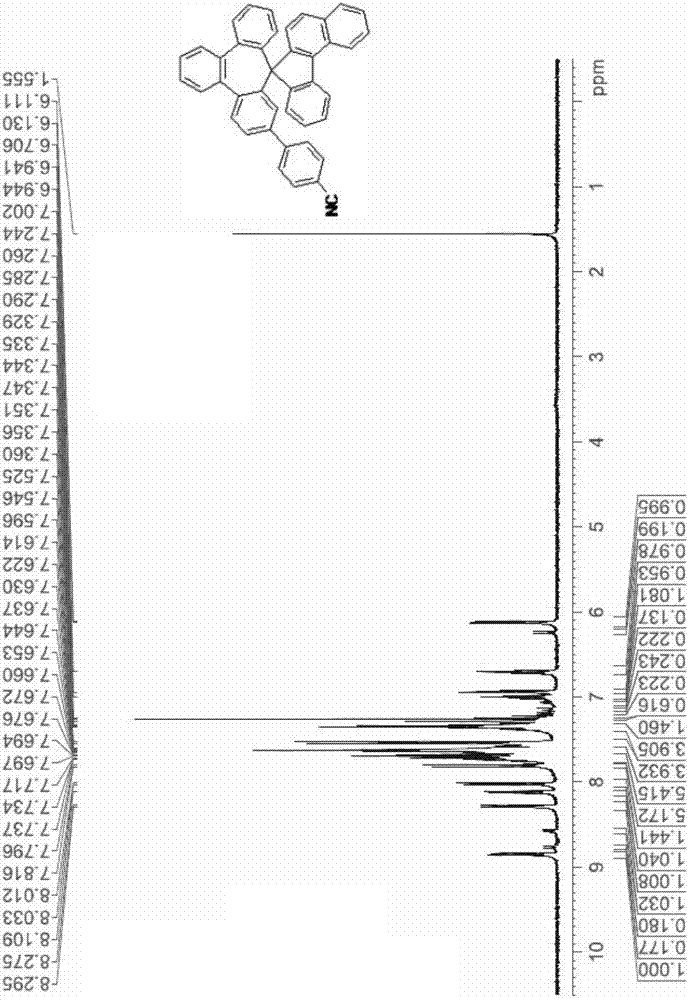
图2至图13分别为化合物I至XII的氢核磁共振光谱图。
具体实施方式
以下列举数种实施例作为例示说明本发明的化合物及其有机电子装置的实施方式,以突显本发明相较于现有技术的差异;本领域技术人员可通过本说明书的内容轻易了解本发明所能达成的优点与功效,并且于不背离本发明的精神下进行各种修饰与变更,以施行或应用本发明的内容。
中间物A1的合成
中间物A1(Intermediate A1)用于制备一种新颖化合物,中间物A1可通过下述合成机制A1中的步骤进行合成。
步骤1:合成中间物A1-1
混合86克(1.0当量)的3-溴二苯并[a,d]环庚烯-5-酮(3-bromodibenzo[a,d]cyclohepten-5-one)、106克(2.0当量)的N-溴代丁二酰亚胺(N-bromosuccinimide,NBS)和0.7克(0.01当量)的过氧化苯甲酰(benzyl peroxide)于起始材料5倍体积的四氯化碳(carbon tetrachloride,CCl4)中,并加热至85℃进行反应,在反应的过程中以高效液相层析仪(high performance liquid chromatography,HPLC)进行监测;当反应完成后,过滤分离反应产生的沉淀物,并以甲醇冲洗再以再结晶的方式纯化,接着经浓缩和干燥后,获得123克的白色固体产物,产率为92.3%。
经场脱附质谱(field desorption mass spectroscopy,FD-MS)分析确定,白色固体产物即为中间物A1-1。FD-MS分析结果:C15H9Br3O,理论值444.94,检测值444.94。
步骤2:合成中间物A1-2
秤取116.0克(1.0当量)的中间物A1-1,使中间物A1-1溶解于960毫升呋喃(furan)和四氢呋喃(tetrahydrofuran,THF)体积比为2:1的混合溶液中,降温至0℃,再加入87.8克(3.0当量)的叔丁醇钾(potassium tert-butoxide,K-OtBu)后于0℃下搅拌1小时,另接续于室温下再搅拌12小时。在反应进行后,以去离子水急速冷却并以溶剂萃取得有机层,再以硫酸钠达到除水的目的,接着通过减压蒸馏法去除有机层中的溶剂,并以硅胶管柱层析纯化获得纯化产物,纯化产物经浓缩和干燥后可获得46.8克淡黄色固体产物,产率为51.1%。
经FD-MS分析确定,淡黄色固体产物即为中间物A1-2。FD-MS分析结果:C19H11BrO2,理论值351.19,检测值为351.19。
步骤3:合成中间物A1-3
将53.5克(1.0当量)的中间物A1-2悬浮液和8.1克(0.025当量)、5%的钯碳催化剂(palladium on carbon,Pd/C)于535毫升的乙酸乙酯(ethyl acetate,EA)中混合,并在氢气气球提供的氢气环境下搅拌3至6小时;接着,反应后的混合产物以硅藻土层过滤并以EA洗净,并使滤液在减压环境下进行浓缩,最后获得100克的黄色固体产物,产率为100%。
经FD-MS分析确定,黄色固体产物即为中间物A1-3。FD-MS分析结果:C19H13BrO2,理论值为353.21,检测值为353.21,中间物A1-3不需进一步纯化即可直接使用于接下来的步骤。
步骤4:合成中间物A1-4
53g、1.0当量的中间物A1-3和2.0当量的对甲苯磺酸(p-toluenesulfonic acid,PTSA)在530毫升的甲苯中加热回流12小时,形成反应混合液;待反应混合液降至室温后,以碳酸氢钠饱和水溶液急速冷却反应混合液,再以二氯甲烷萃取获得有机层,并水洗有机层、使有机层浸泡于无水硫酸钠中干燥获得产物溶液,在减压环境下浓缩产物溶液,并以二氯甲烷和己烷体积比为1:1的洗提液于硅胶管柱中层析纯化,最后获得46克的淡黄色固体产物,产率为91.5%。
经FD-MS分析确定,淡黄色固体产物即为中间物A1-4。FD-MS分析结果:C19H11BrO,理论值335.19,检测值为335.19。
中间物A2的合成
中间物A2用于制备一种新颖化合物,中间物A2是以类似于合成中间物A1的步骤1至步骤4所合成,其差异在于起始物3-溴二苯并[a,d]环庚烯-5-酮以2-溴二苯并[a,d]环庚烯-5-酮(CAS No.198707-82-3)代替,中间物A2的合成路径统整于合成机制A2中,在合成机制A2中所有中间物的分析方法皆同前述,分析结果列于下表1。
中间物A3的合成
中间物A3用于制备一种新颖化合物,中间物A3是以类似于合成中间物A1的步骤1至步骤4所合成,其差异在于起始物3-溴二苯并[a,d]环庚烯-5-酮以3,7-二溴二苯并[a,d]环庚烯-5-酮(3,7-dibromodibenzo[a,d]cyclohepten-5-one)(CAS No.226946-20-9)代替,中间物A3的合成路径统整于合成机制A3中,在合成机制A3中所有中间物的分析方法皆同前述,分析结果列于下表1。
表1:中间物的化学结构式、产率、分子式与以FD-MS分析所得质量。
中间物A1至A3的修饰
除了中间物A1至A3之外,本领域技术人员可更替合成机制A1至A3中的起始物,并以类似于合成机制A1至A3的合成路径合成出其他中间物,例如以下列出的中间物A4至A15:
中间物B1至B4和B6的合成
中间物B1至B4和B6是以1-溴-2-碘苯(1-bromo-2-iodobenzene)与芳硼酸(boronic acid,即反应物A),中间物Bn的合成路径如合成机制B1所示。在合成机制B1中,“反应物A”选自表2中的反应物A1至A5,“中间物Bn(Intermediate Bn)”选自于包括前述中间物B1至B4的群组。
中间物B1至B4和B6是根据合成机制B1中的步骤所合成。
将1.0当量的1-溴-2-碘苯、1.2当量的芳硼酸(反应物A)、3当量的碳酸钾、200毫升的甲苯、0.06当量的三间基苯基膦(tri(m-tolyl)phosphine,P(m-toyl)3)和0.015当量的醋酸钯于80℃下搅拌混合12小时,再冷却至室温,接着以饱和氯化钠水溶液和醋酸乙酯萃取有机层、以硫酸镁干燥再以活性碳于硅胶管柱中过滤纯化;产物于浓缩后经减压过滤并以己烷洗涤而获得中间物B,上述中间物B皆以上述方法进行分析,并将结果列于表2中。
表2:用以合成中间物B1至B4和B6的反应物A以及中间物B1至B4和B6的化学结构式、产率和以FD-MS分析的分子式与质量。
中间物B5的合成
除了上述合成机制B1,中间物B5另可以合成机制B2来合成。
步骤1:合成中间物B5-1
将0.05当量的双三苯基膦氯化钯(dichloro bis-(triphenylphosphine)palladium)和1当量的2-溴苯甲醛混合于0.13至0.15M的四氢呋喃中,再加入3.0当量的三乙基胺和0.05当量的碘化铜;接着,于室温下搅拌24小时,再以饱和氯化铵水溶液快速冷却、以醋酸乙酯萃取三次并以卤水洗涤;再以硫酸钠干燥并以减压脱气过滤,获得初产物,该初产物经硅胶管柱层析后获得中间物B5-1的产率为92.4%,FD-MS的分析结果为如下,分子式:C15H10O,理论分子量:206.64,实际分子量:206.64。
步骤2:合成中间物B5
将1.0当量的中间物B5-1、0.05当量的三氟甲烷磺酸酮(copper(II)trifluoromethanesulfonate,Cu(OTf)2)混合于相当于中间物B5-1五倍体积的1,2-二氯乙烷中,再依序于室温和通以氩气的环境下加入1.2当量的1-(2-溴乙炔基苯)(1-(2-bromoethynyl)benzene)和1.0当量的三氟醋酸形成一混合物,并使该混合物于100℃下搅拌15分钟再冷却至室温;接着,以饱和碳酸氢钠水溶液萃取混合物三次、以硫酸镁干燥、蒸干再以己烷作为洗提液于硅胶管柱层析得中间物B5,产率为80%,FD-MS的分析结果为如下,分子式:C16H11Br,理论分子量:283.16,实际分子量:283.16。
中间物B1至B6的修饰
除了中间物B1至B6之外,本领域技术人员可采用除了1-溴-2-碘苯的其他二卤代苯与有别于反应物A1至A5的芳基硼酸反应,以类似于合成机制B1的合成步骤成功合成其他中间物Bn;同样的,本领域技术人员亦可采用除了2-溴苯甲醛外的其他卤代芳香醛以类似于合成机制B2的方式合成出除了中间物B1至B6之外的其他中间物Bn。例如下列中间物B7至B14:
中间物Cn的合成
前述中间物B1至B14(尤其指中间物B1至B5)可另用于合成中间物Cn,中间物Cn的合成路径如合成机制C1所示。在合成机制C1中,“中间物An”选自于包括中间物A1至A15及其相似物的群组;“中间物Bn”选自于包括中间物B1至B14及其相似物的群组;“中间物Cn”选自于表3-1中包括中间物C1至C11的群组;中间物C1至C11分别以下述步骤所合成。
步骤1:醇中间物的合成
1.0当量的中间物Bn溶于120毫升、0.4M的THF中,降温至-78℃后缓慢加入1.0当量、2.5M的正丁基锂(n-Butyllithium,n-BuLi)并搅拌1小时,接着将0.7当量的中间物An加入反应溶液中并于室温下再搅拌3小时,反应完成后,以饱和氯化铵水溶液冷却反应溶液并萃取有机相,分离有机相后以石油醚再结晶产物获得白色产物。
接着使白色产物以FD-MS分析,以中间物C1-1为例,FD-MS的分析后的分子式:C37H23BrO2,理论分子量:579.48,实际分子量:579.48。各醇中间物Cn-1不需进一步纯化即可用于步骤2,以不同中间物An和中间物Bn合成的醇中间物Cn-1的化学结构式以及FD-MS的测量结果列于表3-1中。
步骤2:中间物Cn的合成
将1.0当量的醇中间物Cn-1、醋酸(相较于反应物w/v=1/3)和五滴硫酸混合并于110℃下搅拌6小时,再以旋转蒸发器去除溶剂,并通过管柱层析纯化,再以甲苯使残余物在结晶获得中间物Cn,中间物C1至C11以FD-MS分析确定,并将分析结果列于表3-1中。
表3-1:合成中间物C1至C11使用的中间物An和Bn;醇中间物的化学结构式;中间物C1至C11的化学结构式和产率以FD-MS侧得的分子式和质量。
中间物C1至C11的修饰
除了前述中间物C1至C11,本领域技术人员可通过置换除了中间物A1至A4外的其他中间物An,或是置换除了中间物B1至B5的其他中间物Bn,使用类似于反应机制C1的合成路径合成出其他中间物Cn,例如下列的中间物C12至C23:
中间物Cn-B的合成
前述中间物Cn可再通过Miyaura硼基化反应(Miyaura borylation reaction)进一步修饰为中间物Cn-B,“中间物Cn-B”是将中间物Cn的溴基取代为频那醇硼基[(pinacolato)boron group],中间物Cn-B可通过下述合成机制C1-B中的合成路径合成。
1.2当量的联硼酸频那醇酯[bis(pinacolato)diboron]、1.0当量的中间物Cn、0.015当量的[1,1-双(二苯基膦基)二茂铁]二氯化钯[1,1-bis(diphenylphosphino)-ferrocene dichloropalladium(II),PdCl2(dppf)]和3.0当量的醋酸钾于在0.3M的无水1,4-二恶烷(1,4-dioxane)中形成的混合溶液,并在110℃的氮气环境下搅拌8小时,待冷却至室温后,于低压环境下去除溶剂,并将残余物以管柱层析纯化获得白黄色产物。该白黄色产物的化学结构式和产率以及FD-MS分析的分子式和质量结果列于表3-2中。
表3-2:合成中间物Cn-B使用的中间物Cn以及中间物Cn-B的化学结构式和产率以FD-MS分析而得的分子式和质量。
中间物Cn-B的修饰
除了上述中间物C1-B、C2-B、C4-B、C6-B、C8-B和C10-B之外,本领域技术人员可任选自前述中间物Cn所构成的群组中除了中间物C1、C2、C4、C6、C8和C10的其他中间物Cn,并以类似于合成机制C1-B的方式对任一中间物Cn进行Miyaura硼基化反应以合成中间物Cn-B,如下所示。
新颖化合物的合成
前述中间物C1至C11和C1-B至C11-B可依合成机制I用以合成所述新颖化合物,于合成机制I中,“反应物B”选自于表4中包括反应物B1至B34的群组;“中间物C”包含前述中间物Cn、Cn-B及其相似物。
表4:反应物B1至B34的化学结构式和CAS编号。
1.0当量的中间物Cn、2.1当量的反应物Bn、0.01当量的醋酸钯、0.04当量的2-(二环己基磷基)联苯[dicyclohexylphosphine(2-biphenyl),P(Cy)2(2-biPh)]、甲苯/乙醇(0.5M、v/v=10/1)和3.0M的碳酸钾水溶液混合,于氮气环境下以100℃的温度下回流12小时,反应完全后,将水和甲苯加入反应物溶液中,接着,使用溶剂将有机相萃取出来并以硫酸钠干燥,于低压环境下使溶剂挥发后利用硅胶管柱层析纯化剩余物,并以甲苯再结晶获得新颖化合物
用以合成化合物I至XII的反应物Bn和中间物C列于表5中,各化合物I至XII分别以氢核磁共振光谱仪(H1-NMR)和FD-MS分析确定,化合物I至XVIII的氢核磁共振光谱图如依序为图2至图13,且化合物I至XII的化学结构式、产率、分子式和质量列于表5中。
表5:合成化合物I至XII使用的反应物B和中间物C以及化合物I至XII的化学结构式和产率以FD-MS分析而得的分子式和质量。
化合物I至XII的修饰
除了前述化合物I至XII之外,本领域技术人员可更替不同的中间物C(即中间物Cn或Cn-B)和反应物B,并以类似于合成机制I的合成路径合成出其他新颖化合物。
OLED装置的制备
将涂布有厚ITO层的玻璃基板(以下简称为ITO基板)置于含有洗洁剂(厂牌:Fischer Co.)的蒸馏水(以Millipore Co.公司的滤器过滤二次而得的蒸馏水)中,并以超声波震荡30分钟;更换蒸馏水后再以超声波震荡10分钟以洗净ITO基板,并重复上述洗净步骤一次;洗净后,将前述玻璃基板以异丙醇、丙酮和甲醇以超声波震荡洗净,并使之干燥;接着,将玻璃基板置于电浆表面清洁机内,并以氧电浆清洁玻璃基板5分钟,再将清洁后的玻璃基板置于真空蒸镀机内。
之后,将真空蒸镀机的真空度维持在1x10-6torr至3x10-7torr,并于ITO基板上依序沉积各种有机材料和金属材料,并获得实施例1至29的OLED装置。于此,该ITO基板上依序沉积有第一电洞注入层(HIL-1)、第二电洞注入层(HIL-2)、第一电洞传输层(HTL-1)、第二电洞传输层(HTL-2)、蓝/绿/红发光层(BEL/GEL/REL)、电子传输层(ETL)、电子注入层(EIL)和阴极(Cthd)。
在上述OLED装置的各层中,HAT是用于形成HIL-1的材料和添加于HIL-2的掺杂物;HI-2是用于形成HIL-2的材料;HT-1和HT-2分别是用于形成HTL-1和HTL-2的材料;传统ET材料和本发明的新颖化合物是用于形成ETL的材料;Liq是添加于ETL的掺杂物和形成EIL的材料;RH/GH/BH分别为形成REL/GEL/BEL的主要材料;RD/GD/BD分别可作为REL/GEL/BEL的掺杂物。实施例的OLED装置和比较例的OLED装置的主要差异为:比较例的OLED装置中ETL是以BCP制成,实施例的OELD装置中ETL是以列于表5的新颖化合物所制成。上述各传统材料的详细化学结构式列于表6。
表6:使用于OLED装置中商业材料的化学结构式
红光OLED装置的制备
红光OLED装置包括复数有机层,各有机层依序沉积于ITO基板上,用以制备红光OLED的各有机层的材料和厚度分别列于表7中。
表7:红光OLED装置中各有机层的涂布顺序、名称、材料和厚度。
绿光OLED装置的制备
绿光OLED装置包括复数有机层,各有机层依序沉积于ITO基板上,用以制备绿光OLED的各有机层的材料和厚度分别列于表8中。
表8:绿光OLED装置中各有机层的涂布顺序、名称、材料和厚度。
蓝光OLED装置的制备
蓝光OLED装置包括复数有机层,各有机层依序沉积于ITO基板上,用以制备蓝光OLED的各有机层的材料和厚度分别列于表9中。
表9:蓝光OLED装置中各有机层的涂布顺序、名称、材料和厚度。
OLED装置的效能
为了评估OLED装置的效能,分别将红光、绿光和蓝光OLED装置连接于电源供应器(厂牌:Keithley;型号:2400),并以PR650的亮度计检测,所测得的色度以为国际照明委员会(Commission Internationale de L’Eclairage 1931,CIE)制定的色度坐标[color coordinate(x,y)]示之,检测结果列于下表10中。其中,蓝光和红光的OLED装置是在1000尼特(1nit=1cd/m2)的亮度下检测;绿光的OLED装置是在3000尼特的亮度下检测。
实施例1至29和比较例1至3中OLED装置的ETL材料、CIE颜色、驱动电压、电流效率和外部量子效率(external quantum efficiency,EQE)列于表10中。
表10:实施例1至29和比较例1至3中OLED装置的特性及效能表现。
根据表10的结果,相较于用于商业上电子传输材料(BCP),本发明通过添加化合物I至XII于电子传输层中,可降低红光、绿光或蓝光OLED装置的驱动电压并改善电流效率和外部电流效率,证实本发明的新颖化合物适用添加于各色OLED装置中,并可达到降低驱动电压、改善电流效率和改善外部电流效率的功效。
上述实施例仅为说明本发明的示例,并非于任何方面限制本发明所主张的范围,本领域技术人员能根据本发明的精神针对例如取代基的数量、位置或排列加以调整。本发明所主张的范围自应以申请范围所述为准,而非仅限于上述具体实施例。
- 还没有人留言评论。精彩留言会获得点赞!