一种无创产前亲权鉴定方法及其试剂盒与流程
本发明涉及亲权鉴定领域,尤其涉及一种无创产前亲权鉴定方法及其试剂盒。
背景技术:
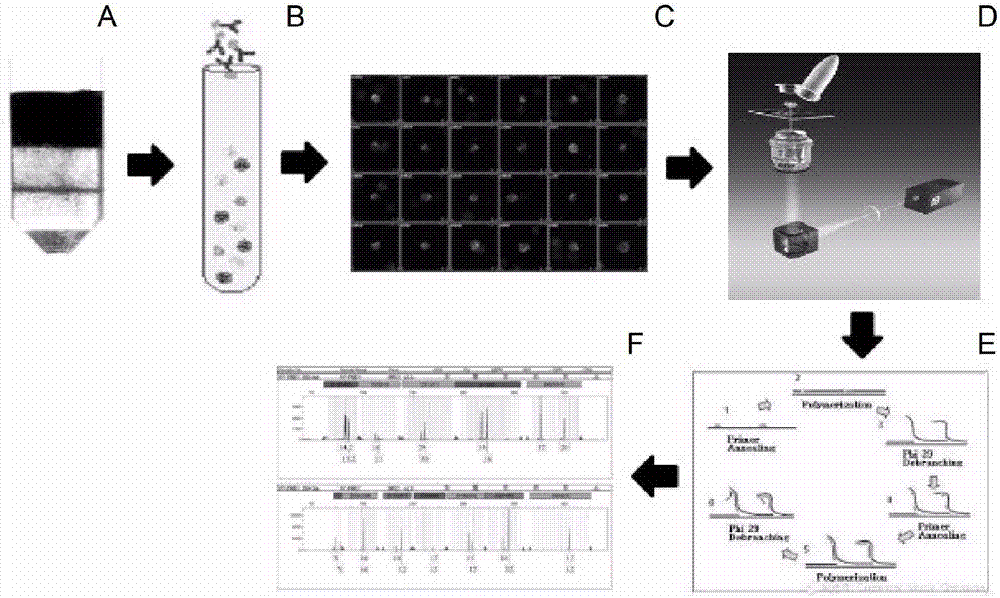
:亲权鉴定是指通过医学和遗传学等手段判别父母与子女的亲权关系,目前常用的是应用STR进行鉴定。时代在进步,需求在多样化,针对胎儿进行产前亲权鉴定的需求日益增多。自从PCR技术应用到生物检测领域,尤其是应用到STR基因座进行分析后,DNA提取便成为亲权鉴定中DNA多态性分析的关键环节,而DNA样品质量的好坏将直接关系到后续实验的成败。伴随高通量测序技术的快速发展,单核苷酸多态性(SNP)作为第三代遗传标记,越来越多地成为无创伤性产前亲权鉴定最新的检测手段。相对于STR,SNP在染色体中的分布更为广泛,数量更多,检测方法也更方便可靠。但这并不意味着二代测序技术能够即刻大范围应用于亲权鉴定:第一,目前二代测序的成本较高,不能被亲权鉴定应用广泛接受;第二,二代测序平台都不可避免地存在一定比例的错误率,技术解决方案还未完全成熟完整,达不到DNA数据库引入要求;最后,二代测序解读规则尚未制定,不能应用于全国实验室数据共享范围。因此,对已有STR数据库的充分应用成为目前无创伤性的产前亲权鉴定最经济实惠的检测方案。传统有创伤性的产前诊断技术如羊水穿刺、绒毛穿刺等由于需要从胎儿组织取样从而具有较高的流产风险,对母体和胎儿造成危害,尤其是对于高龄产妇而言更加严重。所以无创伤性产前诊断技术成为当今研究热点。胎儿有核红细胞(FetalNucleatedRedBloodCells,FNRBC)是一种单核细胞,于孕6周至分娩后几个月内持续存在于母体外周血中,细胞生命周期短、含有胎儿基因的全部遗传信息、便于遗传学和分子生物学分析。因此被认为是最好的产前诊断材料,从孕妇外周血中分离胎儿有核红细胞为无创伤性产前亲权鉴定开辟了新途径。近年来,许多研究都致力于胎儿有核红细胞的富集。但是由于胎儿有核红细胞在孕妇外周血中的数量极少,通常孕妇外周血中胎儿有核细胞与孕妇有核细胞的比例约为1:106,高效率和高纯度的分选一直是一个难题,从而导致DNA抽提困难,达不到检测输入量而影响STR扩增鉴定。为了解决这一问题,本发明涉及一种更佳的改进的无创产前亲权鉴定方法及其试剂盒,可以高效率和高纯度地成功分离胎儿有核细胞,同时创造性地将单细胞(pg,皮克)级的样本总量扩增至常规STR鉴定需要的纳克级(约150-150000个细胞DNA量),整个流程无需纯化及转管即可进行STR鉴定,同时可以防止纯化及转管带来的样本损失或污染,从而使得样本损失更小,污染更少。同时为了解决单细胞扩增偏向性的问题,本发明同时提供了一种改进优化的单细胞扩增方法,通过调节引物设计及配比,对定向区域片段进行相对富集,降低扩增偏向性,保证STR检测的成功率及准确度。本专利创造性地将密度梯度离心、免疫磁珠负选、免疫荧光、激光显微切割、单细胞扩增等改进优化的技术有机结合在一起形成系统鉴定方法,成功分离孕妇外周血中的胎儿有核红细胞,并将其成功应用于亲权鉴定中。相对于现有技术,该方法更高效、更纯净、无创伤、简单、实用、精准、损失少、成本低、方法重复性好,拓展了亲权鉴定的范围,同时提高了检测的精密度。技术实现要素:鉴于现有技术的不足,本发明旨在提供一种较佳的改进的无创产前亲权鉴定方法及其试剂盒,通过优化的密度梯度分离孕妇外周血中胎儿有核红细胞的方法,并结合激光显微切割和优化的单细胞扩增技术,将得到的胎儿基因组与母亲和疑似父亲的基因组进行对比,确定其亲权关系。对孕妇和胎儿创伤小、效率高,可以在孕早期实施的亲权鉴定方法,扩展了亲权鉴定的应用范围。需要指出,本发明的设计方案及其试剂盒,不仅可以用于亲权关系鉴定,也能够同时进行遗传疾病筛查和诊断等其它检测。而且,本方法仅需要使用目前市场上已有的亲权鉴定试剂盒就可以快速准确的判断样本的亲权关系,不需要进行高通量测序,也不需要根据样本不同挑选合适的单核苷酸位点。为实现上述目的及其他相关目的,本发明提供了一种新的无创产前亲权鉴定方法,所述方法包括如下步骤:(1)获取孕妇外周血样本;(2)对样本进行密度梯度离心操作;(3)对步骤(2)处理所得细胞液进行白细胞去除处理,获得相对富集的胎儿有核红细胞悬液;(4)对步骤(3)处理所得相对富集的胎儿有核红细胞悬液进行免疫荧光染色、固定封片、有核红细胞鉴定及捕获,获得单个有核红细胞;(5)对步骤(4)处理所得单个胎儿有核红细胞进行单细胞扩增;(6)步骤(5)处理所得扩增产物进行STR分型检测及亲权鉴定。需要指出,在进行步骤(2)之前,也可以采用由他人利用本领域所熟知的技术已经获取孕妇外周血样本。进一步地,步骤(2)中,所述密度梯度离心为双密度梯度离心,所述双密度具体为:1.077/1.095g/ml。进一步地,步骤(2)中,所述密度梯度离心处理完毕,为了进一步去除成熟红细胞,在细胞悬液中加入1/6的红细胞超聚溶液如HetaSep(STEMCELL)、6%羟乙基淀粉溶液等,37℃孵育15min,去除下层红细胞沉淀,得到纯净的有核细胞悬液。进一步地,步骤(2)中,所述密度梯度离心处理后所得相对富集的胎儿有核红细胞悬液密度为1.077~1.095g/ml。进一步地,步骤(2)中,所述密度梯度离心介质包括但不限于Ficoll(一种蔗糖-表氯醇聚合物),蔗糖,(N,N'-bis(2,3-dihydroxypropyl)-5-[N-(2,3-dihydroxypropyl)acetamido]-2,4-6-triiodo-isophthalamide),OPTIPrep(60%碘克沙醇溶液),Percoll(一种二氧化硅胶体颗粒悬浊液)。优选Percoll密度分离介质。市售的Percoll(GEHealthcareLifeSciences)主要由表面包被单层乙烯吡咯烷酮(PVP)的硅胶颗粒组成,直径15-30nm,对活细胞无毒性无刺激。Percoll的密度可根据需要调节至1.0-1.3g/ml之间,并且得到的分离溶液都是与细胞等渗的。本专利使用两种不同密度的percoll溶液叠加,有核红细胞则分布于两层percoll之间,可以在有效回收大多数目标细胞的同时去除成熟红细胞和母体细胞。需要说明,为了尽量减少母源细胞污染,同时回收大多数有核红细胞,本专利采用了双密度梯度离心的方法,去除密度很小的单核细胞,血小板及密度较大的成熟红细胞,有核红细胞则分布在两个密度之间。根据Percoll产品说明书配制密度分别为1.095和1.077的两种分离液。配制不同密度Percoll的溶液包括但不限于1xPBS缓冲液,0.9%氯化钠(生理盐水);密度梯度离心的密度包括但不限于1.070g/mL,1.077g/mL,1.084g/mL,1.085g/mL,1.095g/mL。进一步地,步骤(5)中,所述单细胞扩增方法包括如下步骤:细胞裂解;预扩增;终扩增。进一步地,所述细胞裂解的裂解液按照如下配制,其中包括第一引物。所述第一引物序列为如SEQIDNO:1所示,具体为:ATGACTGATCCTTGTGCTAGAGTGTACNNNNNNNN,其中所述NNNNNNNN为随机引物序列或定向富集序列。其中随机引物序列或定向富集序列N的长度可以为4~20nt,优选地为4~10nt,更优选地为6~8nt,需要说明上述NNNN表示的为随机引物序列结构,并非表示仅有8个碱基。所述第一引物的NNNNNNNN随机序列中,N=A/T/C/G;更优的,为了对某个基因座位点进行富集,可使用定向富集序列,此时NNNNNNNN序列是针对这个基因座上下游引物的3’端8个碱基序列,用于对这一区域进行定向富集;最优的,可以是随机序列和多个基因座定向富集序列的组合,随机序列用于对整个基因组DNA进行无偏向性的扩增,多个定向富集序列用于对基因座区域进行定向富集。进一步地,所述终扩增的终扩增缓冲液按照如下配制,其中包括第二引物。所述第二引物序列为如SEQIDNO:2所示,具体为:ATGACTGATCCTTGTGCTAGAGTGTAC。上述第二引物浓度为0.5-50μM,较优的为0.5-20μM,最优的为1-5μM。进一步地,步骤(3)中,所述白细胞去除采用免疫磁珠负选进行。进一步地,所述免疫磁珠包被的抗体包括但不限于以下一种或几种:CD34,CD46,CD55,CD4,CD8,CD100,CD175s,HLA-DR,CD29,CD31,CD35,CD44,CD45,CD45RB,CD47,CD59,CD14,CD15,CD81,CD99,CD108。进一步地,步骤(4)中,所述有核红细胞捕获采用激光显微切割。进一步地,步骤(5)中,所述单细胞扩增方法包括但不限于DOP-PCR(如GenomePlexSingleCellWholeGenomeAmplificationKit,PicoPLEXWGAKit)基于MDA的商业试剂盒(如REPLI-gSingleCellKit),MALBACSingleCellWGAKit,LinearAmplificationviaTransposonInsertion(LIANTI)。进一步地,步骤(6)中,所述STR分型检测采用人类基因组微卫星位点分型检测。进一步地,步骤(6)中,所述亲权鉴定试剂盒可以是以下任意一种,AB公司的IdentifilerTM、Direct、Plus、Sinofiler和Promega公司的21System、国产试剂盒DNA15Plus、AGCU17+1、GoldeneyeTM20A、阅微MR21ID等。最优的为21System法医检测试剂盒。第二方面,本发明还提供了一种适用于无创产前亲权鉴定的试剂盒,所述试剂盒包括:密度梯度离心介质、Percoll双密度梯度分离液、红细胞超聚溶液、免疫磁珠,进一步地,还包括说明书,说明书上记载着如上所述任一一种无创产前亲权鉴定方法。简而言之,本专利创造性地将密度梯度离心、免疫磁珠负选、免疫荧光、激光显微切割、单细胞扩增等改进的技术有机结合在一起形成系统鉴定方法,成功分离孕妇外周血中的胎儿有核红细胞,并将其成功应用于亲权鉴定中。相对于现有技术,该方法更高效、更纯净、无创伤、简单、实用、精准、损失少、成本低、方法重复性好,拓展了亲权鉴定的范围,同时提高了检测的精密度。附图说明图1是本发明实验方法具体流程图图2是一个较佳实施例的扫描筛选获得的胎儿细胞示例图图3是一个较佳实施例的单个细胞样本DMD1的STR峰形结果图图4是一个较佳实施例的单个细胞样本DMD2的STR峰形结果图图5是一个较佳实施例的单细胞扩增阴性对照样本N的STR峰形结果图图6是一个较佳实施例的父亲样本FB的血液基因组DNA扩增所得STR峰形结果图图7是一个较佳实施例的样本多余引物鉴定结果图具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,实施方式只是为了举例说明本发明,而非以任何方式限制发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。实验方案一、样本采集采集孕期12周的孕妇外周血16mL,常温保存在ACD抗凝管中(也可以是肝素抗凝管、EDTA抗凝管等具有抗凝血作用的血液采集管,优选的为ACD抗凝管),24小时内送至实验室进行有核红细胞富集和分离。同时收集孕妇怀孕期间的各种身体检查结果,用于辅助胎儿细胞的富集和计数;收集疑似父亲的血液或毛发或口腔上皮,提取DNA用于亲权分析。需要指出,在进行步骤二之前,也可以采用由他人利用本领域所熟知的技术已经获取的孕妇血液样品。二、密度梯度离心1.胎儿有核红细胞是未成熟的红细胞,其密度主要分布在1.065-1.110g/ml之间,且密度分布曲线呈现双峰值。为尽量减少白细胞污染,优选分离液密度为1.077/1.095g/ml,所有的淋巴细胞密度都小于1.077g/ml,使用这一密度可以去除大多数的淋巴细胞(母体)。2.密度梯度离心介质包括但不限于Ficoll(一种蔗糖-表氯醇聚合物),蔗糖,(N,N'-bis(2,3-dihydroxypropyl)-5-[N-(2,3-dihydroxypropyl)acetamido]-2,4-6-triiodo-isophthalamide),OPTIPrep(60%碘克沙醇溶液),Percoll(一种二氧化硅胶体颗粒悬浊液)。优选Percoll密度分离介质。市售的Percoll(GEHealthcareLifeSciences)主要由表面包被单层乙烯吡咯烷酮(PVP)的硅胶颗粒组成,直径15-30nm,对活细胞无毒性无刺激。Percoll的密度可根据需要调节至1.0-1.3g/ml之间,并且得到的分离溶液都是与细胞等渗的。本专利使用两种不同密度的percoll溶液叠加,有核红细胞则分布于两层percoll之间,可以在有效回收大多数目标细胞的同时去除成熟红细胞和大部分母体细胞。为了尽量减少母源细胞污染,同时回收大多数有核红细胞,我们采用了双密度梯度离心的方法,去除密度很小的单核细胞,血小板及密度较大的成熟红细胞,有核红细胞则分布在两个密度之间。根据Percoll产品说明书配制密度分别为1.095和1.077的两种分离液(分离液I和II)。配制不同密度Percoll的溶液包括但不限于1xPBS缓冲液,0.9%氯化钠(生理盐水);密度梯度离心的密度包括但不限于1.070g/mL,1.077g/mL,1.084g/mL,1.085g/mL,1.095g/mL。基于Percoll的双密度梯度离心法可以在富集外周血中绝大多数有核红细胞的同时去除尽量多的母体细胞,而使用单一密度的分离液(如淋巴细胞分离液密度为1.077g/mL)则会导致密度较大的有核红细胞在密度梯度离心过程中损失,降低了有核红细胞的检出率。3.取约8mL孕妇外周血,转移至50mL无菌离心管中,加入等体积1xPBS,轻轻摇晃混匀。4.将至少10mLPercoll分离液I转移至1%BSA润洗过的50mL离心管中,然后沿管壁慢慢加入至少7.5mLPercoll分离液II,使两种分离液形成明显的分层。最后再轻轻叠加稀释后的血液。此时总体积不宜超过40mL。5.将离心管放置于水平离心机中,配平,设置转速400-700g,优选地为600g;20℃离心10-30min,优选地为30min。6.离心后的,离心管中液体分为6层,从上至下分别为:血浆层,单核细胞层,Percoll分离液II,目标层,Percoll分离液I,红细胞沉淀。7.用移液枪将目标层细胞转移到新的50mL离心管中,尽量不要吸到下层红细胞。8.在实验过程中,成熟红细胞的存在会影响免疫荧光,导致非特异性染色。为了进一步解决该问题,本申请创造性地在密度梯度离心步骤后,为了进一步去除成熟红细胞,在细胞悬液中加入1/6的红细胞超聚溶液HetaSep(STEMCELL),37℃孵育15min,去除下层红细胞沉淀,得到纯净的有核细胞悬液。这种去除红细胞的方法原理是促使成熟红细胞形成串钱状的,增加沉降密度,相对于使用红细胞裂解液等方法,此方法对有核细胞损伤极小,且不会产生干扰免疫荧光染色的红细胞碎片。9.向离心管中加入1xPBS至40mL,500-800g,优选地为600g;水平离心5-30min,优选地为30min弃掉上清。三、去除白细胞1.向上一步的细胞沉淀中加入少量1xPBS,并将细胞全部转移至2mL离心管中,液体体积应小于1.5mL。2.取200μL免疫磁珠,静置于磁力架上2min,弃去上清液,加入250μL1xPBS,用移液器吹打混匀之后立即转移至上一步中的2mL离心管中,上下颠倒混匀。其中,免疫磁珠包被的抗体可以是抗CD45抗体包被的纳米磁珠与抗粒细胞抗体(Abcam,HIS48)包被的纳米磁珠的混合物,混合比例为1:0.3。使用这种磁珠混合体系可以去除99%的淋巴细胞和密度较大的粒细胞残留,有利于胎儿细胞的染色和鉴定。3.将离心管放置于混匀仪上,放置于2-8℃,颠倒混匀20分钟。4.将离心管置于磁力架上静置2-10min,期间用移液枪轻轻吹打混匀一次。将所有液体转移至新的50mL离心管中。5.添加1xPBS至40mL,500-800g水平离心5-10min,弃掉上清。重复洗三遍。6.加入50μL1xPBS重新悬浮细胞,转移至2mL离心管中。四、免疫荧光染色1.准备一支1.5mL离心管,加入1xPBS200μL,AlexaFluor-488标记的CD71抗体(0.5mg/mL)1μL,AlexaFluor-594标记的CD45抗体(0.5mg/mL)1μL,轻轻震荡混匀后全部转移到上一步的离心管中。其中,免疫荧光染色的阴性CD34,CD46,CD55,CD4,CD8,CD100,CD175s,HLA-DR,CD29,CD31,CD35,CD44,CD45,CD45RB,CD47,CD59,CD14,CD15,CD81,CD99,CD108中的一个或多个的混合物;阳性抗体CD71,CD147,CD235a(GPA),HBG,HBF,MMP14,MCT1,CD36中的一个或多个的混合物。需要说明,所述免疫磁珠包被的抗体包括但不限于以下一种或几种:CD34,CD46,CD55,CD4,CD8,CD100,CD175s,HLA-DR,CD29,CD31,CD35,CD44,CD45,CD45RB,CD47,CD59,CD14,CD15,CD81,CD99,CD108。2.震荡混匀后常温避光孵育20-60min,期间多次震荡混匀。3.孵育完成后加入1.5mL1xPBS,500-800g,优选地为600g;水平离心5-30min,优选地为30min,弃上清。4.重复上一步骤,弃掉上清至剩余约100μL液体,加入100μL固定液(0.1%-2%多聚甲醛溶液,优选地为1%),吹打混匀后离心至载玻片(带有2cmx2cm边框)上。五、固定和封片1.将载玻片放置于烘箱内,30-42℃,优选37度烘干载玻片。2.待烘箱自然降温至室温后,取出载玻片,加1xPBS覆盖细胞,浸润5min,用真空泵吸掉PBS缓冲液,然后再重复浸润两遍。3.吸去1xPBS,使载玻片自然风干,滴加5-10μL含有抗淬灭剂的DAPI(Sigma),轻轻覆盖盖玻片,使DAPI均匀覆盖整个边框内部。六、有核红细胞鉴定及捕获1.在显微镜下,胎儿有核红细胞应表现为以下形态学和荧光染色特征:细胞直径8-25μM,细胞核圆形或近圆形,细胞质无明显颗粒;在不同荧光通道下,有核红细胞呈现出CD45阴性而CD71阳性。2.将玻片置于荧光扫描显微镜下,按照设置的参数鉴定有核红细胞。3.利用激光显微切割系统将单个有核红细胞捕获至收集管中。4.收集的细胞直接用于扩增或暂时-20℃低温保存。七、单细胞扩增及STR分型激光显微捕获得到的单细胞样品可以直接用于单细胞扩增。本发明同时提供了一种改进优化的单细胞扩增方法,通过调节引物设计及配比,对定向区域片段进行相对富集,降低扩增偏向性,保证STR检测的成功率及准确度。步骤如下:1.细胞裂解:1.1按照如下表1配置细胞裂解液。将10μL细胞裂解液和0.5μL细胞裂解酶混和均匀,用于准备细胞裂解混合液。在每个单细胞样品中加入10μL细胞裂解液(固定的单细胞样品用PBS缓冲液重悬,体积不大于2μL)。其中10μM的第一引物为特制扩增引物。本发明设计方案,在进行细胞裂解步骤中,将扩增引物直接加入细胞裂解液中,从而减少操作步骤,避免污染;同时在微量起始情况下,尽可能减小反应体系,增加有效浓度,从而实现更好的扩增,即裂解体系加酶后可直接用于后续的扩增体系,实现单细胞操作一管式反应。表1所述第一引物序列为如SEQIDNO:1所示,具体为:ATGACTGATCCTTGTGCTAGAGTGTACNNNNNNNN,其中所述NNNNNNNN为随机引物序列或定向富集序列。其中随机引物序列或定向富集序列N的长度可以为4~20nt,优选地为4~10nt,更优选地为6~8nt,需要说明上述NNNN表示的为随机引物序列结构,并非表示仅有8个碱基。所述第一引物的NNNNNNNN随机序列中,N=A/T/C/G;更优的,为了对某个基因座位点进行富集,可使用定向富集序列,此时NNNNNNNN序列是针对这个基因座上下游引物的3’端8个碱基序列,用于对这一区域进行定向富集;最优的,可以是随机序列和多个基因座定向富集序列的组合,随机序列用于对整个基因组DNA进行无偏向性的扩增,多个定向富集序列用于对基因座区域进行定向富集。基因座定向富集序列举例如下表2:表2如上表2所示,若针对某一基因座如D19S433,则NNNNNNNN的序列为AATAAGAT和ACAGGTGG。以上表格仅用作示例,任一基因座的定向富集序列可由上述方法分析得到。上述第一引物浓度为0.5-50μM,较优的为0.5-20μM,最优的为1-5μM。上述引物和定向富集序列的比例可根据目的片段进行调整,定向富集序列的占比为0~50%,较优的为10~50%,最优的为10~20%。1.2需要说明,所述细胞裂解液成分包括但不限于以下一种或几种:50mMKAc,20mMTris-Ac,10mMMgAc,0.2%TritionX-100;也可以是1xPBS、1xThermopolbuffer、30mMTris-HCl、10mMTris-HCl;25mMEDTA;100mMNaCl;0.5%SDS、10mMTris-HCl;50mMKCl、10mMTris-HCl;100mMEDTA;0.5%SDS、30mMTris-HCl;10mMEDTA;1%SDS、30mMTris-HCl;2mMKCl,0.2%TritonX-100等缓冲溶液,最佳地为50mMKAc,20mMTris-Ac,10mMMgAc,0.2%TritionX-100。1.3混合均匀后离心,置于PCR仪上,50℃孵育2小时裂解细胞,80℃孵育10min使蛋白酶变性。2预扩增2.1按照如表3配比预扩增缓冲液:表3进一步地,所述DNA聚合酶包括但不限于以下一种或几种:ventDNA聚合酶、T7DNA聚合酶、BsuDNA聚合酶,大片段、T4DNA聚合酶、DNA聚合酶I,(Klenow)大片段、DNA聚合酶I(E.coli)、TherminatorTMDNA聚合酶、SulfolobusDNA聚合酶IV、phi29DNA聚合酶、Bst2.0DNA聚合酶、Bst2.0DNA聚合酶、BstDNA聚合酶,全长、BstDNA聚合酶、DeepVentRTMDNA聚合酶、VentR(exo–)DNA聚合酶、DNA聚合酶、热启动TaqDNA聚合酶、热启动TaqDNA聚合酶、TaqDNA聚合酶、热启动TaqDNA聚合酶、TaqDNA聚合酶大片段、TaqDNA聚合酶(提供不含镁离子的ThermoPolII缓冲液)、TaqDNA聚合酶(提供缓冲液)、热启动DNA聚合酶、DNA聚合酶、热启动FlexDNA聚合酶、超保真DNA聚合酶、热启动超保真DNA聚合酶、超保真DNA聚合酶、KAPAHiFiUracil+ReadyMix(2x)、PfuTurboCx热启动DNA聚合酶等一种或几种酶的组合。2.2.冰盒上配置预扩增混合物,4℃备用表4试剂体积预扩增缓冲液15μlNuclearfreewater补齐至30μL2.3冷却后瞬时离心,将样品转移到磁力架上,待样品澄清后弃去上清。用200ul的80%(vol/vol)的乙醇,清洗beads,弃去上清。2.4重复步骤3一次。2.5室温开盖等待,至乙醇充分挥发。加入30ul预扩增混合物重悬磁珠,混匀。2.6上述混合物放置于PCR仪上,按照下表5中的程序进行扩增。表5其中循环数设置部分,两倍体单细胞推荐6-8个循环,单倍体推荐8-10个循环,单染色体推荐10-12个循环。3终扩增3.1按照如下表6配比终扩增缓冲液:表6所述第二引物序列为如SEQIDNO:2所示,具体为:ATGACTGATCCTTGTGCTAGAGTGTAC。上述第二引物浓度为0.5-50μM,较优的为0.5-20μM,最优的为1-5μM。3.2在每个样品中加入30μL终扩增混合物(如下表7)。表7试剂体积终扩增缓冲液15μLNuclearfreewater补齐至30μL3.3混匀后置于PCR仪上,按照如下条件进行指数扩增。表8此步骤中的循环数设置部分,两倍体单细胞推荐16-18个循环,单倍体推荐18-20个循环,单染色体推荐20-22个循环。进一步地,所述DNA聚合酶包括但不限于以下一种或几种:ventDNA聚合酶、T7DNA聚合酶、BsuDNA聚合酶,大片段、T4DNA聚合酶、DNA聚合酶I,(Klenow)大片段、DNA聚合酶I(E.coli)、TherminatorTMDNA聚合酶、SulfolobusDNA聚合酶IV、phi29DNA聚合酶、Bst2.0DNA聚合酶、Bst2.0DNA聚合酶、BstDNA聚合酶,全长、BstDNA聚合酶、DeepVentRTMDNA聚合酶、VentR(exo–)DNA聚合酶、DNA聚合酶、热启动TaqDNA聚合酶、热启动TaqDNA聚合酶、TaqDNA聚合酶、热启动TaqDNA聚合酶、TaqDNA聚合酶大片段、TaqDNA聚合酶(提供不含镁离子的ThermoPolII缓冲液)、TaqDNA聚合酶(提供缓冲液)、热启动DNA聚合酶、DNA聚合酶、热启动FlexDNA聚合酶、超保真DNA聚合酶、热启动超保真DNA聚合酶、超保真DNA聚合酶、KAPAHiFiUracil+ReadyMix(2x)、PfuTurboCx热启动DNA聚合酶等一种或几种酶的组合。2.经过扩增,单细胞基因组被放大数十万倍。取少量扩增产物,用市场上的亲权鉴定试剂盒进行人类基因组微卫星位点分型检测,然后与母亲及疑似父亲的微卫星位点进行比较和分析,确定其亲权关系。亲权鉴定试剂盒可以是以下任意一种,AB公司的IdentifilerTM、Direct、lus、Sinofiler和Promega公司的21System、国产试剂盒DNA15Plus、AGCU17+1、GoldeneyeTM20A、阅微MR21ID等。最优的为21System法医检测试剂盒。本发明的流程图具体请见图1:A:双密度梯度离心;B:免疫磁珠负选;C:免疫荧光染色和全自动扫描;D:激光显微捕获;E:单细胞扩增;F:基于微卫星的亲权鉴定。实施例一1.收到一例孕妇外周血样品,按照上述方法进行有核红细胞的分离及鉴定,得到两个有核红细胞样本DMD1、DMD2,样本单细胞扩增中设置阴性对照组N,排除扩增中引入的污染。同时收集疑似父亲血液,获得基因组样本FB。如下图2所示是通过自动扫描筛选获得的胎儿细胞。胎儿细胞是表达CD71,不表达CD45,含有细胞核的细胞。2.对所得数据运用ID-X软件进行分析。单细胞扩增由于其DNA模板量非常低,其缺带、多带等现象经常发生,影子峰较常规扩增强,所以将分析方法的参数进行修改,将GlobalMinusStutterRatio修改为0.1,用于过滤主峰峰高10%以内的影子峰(减少一个重复单位);其余参数为默认设置。3.将下机数据运用ID-X软件进行自动分析,人工核对内标、Ladder、阴、阳性对照结果,确保每一内标峰正确、Ladder每个基因座的等位基因峰均在规定范围之内,等位基因命名正确无误、阳性对照分型结果正确,阴性对照无明显目标峰。人工核查样本的分型,删除影子峰和渗透峰、人工修正双尖峰和平头峰,得到峰图结果如下。4.其中,DMD1、DMD2为单个细胞样本STR峰形结果图,具体请见图3、图4,N为单细胞扩增阴性对照样本,具体请见图5。FB为父亲血液基因组DNA扩增所得STR峰形结果图,具体请见图6。5.由以上结果看来,两个有核红细胞样本经过本发明的扩增方案可有效获得STR分型结果。同时阴性对照-即无DNA的样本所得STR结果基本为噪音,虽有部分标识为目的条带,但通过峰形可排除影响,达到排除假阳性扩增的要求。将DMD1&2检测得到的位点进行合并,得到样本DMD相关基因座位点信息。将其与父本FB分型结果进行分析,检测结果如下表9:表9由上表可见,本次二联亲子鉴定共检测出了21个基因座,未出现任何矛盾基因座,本次检测父权指数达到730150.2270,可对亲子关系作出定论。实例二采取一例健康孕妇外周血液(怀孕13周)16ml,平均分为8组,即每组2ml外周血。取percoll原液9份与1.5MNaCl1份混合均匀作为贮存液。按照如下表10配制不同密度的percoll密度梯度分离溶液:表10percoll密度(g/ml)percoll贮存液0.9%NaCl1.065056.861.075040.521.0775031.771.0855023.631.0955015.491.118502.20然后使用8种不同的密度梯度分布模式进行离心分离和有核红细胞的富集鉴定,比较各组的有核红细胞获取数,白细胞数和成熟红细胞的污染情况。其中,白细胞数是通过将一小部分密度梯度分离的细胞的细胞核直接进行染色,对细胞核进行计数得到的。为了便于说明,将成熟红细胞的污染情况分为1-5个等级,其中等级1说明污染很小,不影响有核红细胞的鉴定,而等级5说明成熟红细胞的污染很严重,对目标细胞的分离和鉴定造成严重影响。不同密度梯度的结果如下表11:表11组别上层密度下层密度有核红细胞白细胞成熟红细胞残留等级11.061.11806.54E+06521.061.09512.39E+06331.0771.11823.34E+06441.0771.09531.56E+06251.0771.08513.23E+05161.071.07701.11E+05171.0851.09502.20E+05281.09526.50E+062对比结果显示,较大的下层密度(1.118g/ml)会导致成熟红细胞残留情况特别严重,这些无核的红细胞会对免疫荧光染色造成很大的影响。而下层密度过小又会导致污染获取目标细胞。上层密度太小会导致白细胞数较多,这些白细胞会增大免疫磁珠负选的压力,同时对LCM捕获单个目标细胞造成影响。在第8组中,1.095g/ml的percoll分离的成分中白细胞数太多。综上,第四组在白细胞数,成熟红细胞残留和有核红细胞获取等方面的结果好,因此本专利优选1.077/1.095g/ml作为分离有核红细胞的percoll介质密度。实例三收集13例怀孕8-17周的孕妇(单胎)外周血以及对应的父亲(其中8个确认为亲生父亲,5个不确定是亲子关系)的细胞样本,富集和分离血液中的胎儿有核红细胞,为了分析影响有核红细胞数量的因素,同时收集孕妇的年龄,体重(身体质量指数,BMI)和胎儿异常等信息。收集的胎儿有核红细胞进行单细胞扩增,得到的扩增产物与母亲基因组DNA,父亲基因组DNA比较,排除母亲来源的细胞,判断亲权关系。如下表12所示,在13例孕妇样本中,经过富集和分离,仅有1例(9周)没有检测到胎儿有核红细胞。12例样本中检测到的胎儿有核红细胞数量为1-36个(平均11.46个/样本)。在13个样本中,8个样本在检测前已确定亲子关系,有核红细胞的STR结果也验证了其亲子关系。另外5个样本不确定亲子关系,用胎儿细胞进行STR检测发现,有1例样本的胎儿和疑似父亲之间无亲子关系(排除率100%)。将胎儿有核红细胞数与孕妇年龄,孕周和孕妇身体质量指数做相关性分析,结果显示,在13例样品中胎儿有核红细胞的数量与三者没有明显的相关性。表12实施例四1.取人胚胎肺成纤维细胞wi38,胰酶消化后采用有限稀释法将细胞分选至200μlPCR管中,单个细胞每管共6管,分别命名为A1/A2/A3/B1/B2/B3。其中,A1-A3样品采用上述偏向性单细胞扩增方案进行扩增,定向富集序列如下表13所示;B1-B3采用随机引物系列,不加入定向富集序列。表132.对扩增产物进行磁珠纯化以去除多余随机引物,使用安捷伦2100高灵敏芯片对多余引物鉴定结果如下图7。基本没有小片段污染,表明引物已去除。3.使用SYBRGreen荧光染料real-time实时定量PCR方法对所得单细胞扩增产物分别进行TPOX、D5S818两个基因座的定量检测,同时加入GAPDH作为对照,结果如下表14所示:表14如上表所示,加入定向富集序列后,QPCRCt值有了明显变化,表明定向富集序列可对基因座区域进行有效的富集扩增,提高检测的灵敏度和准确性。以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本
技术领域:
中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。序列表<110>上海美吉生物医药科技有限公司<120>一种无创产前亲权鉴定方法及其试剂盒<160>2<170>SIPOSequenceListing1.0<210>1<211>35<212>DNA<213>人工序列(ArtificialSequence)<400>1atgactgatccttgtgctagagtgtacnnnnnnnn35<210>2<211>27<212>DNA<213>人工序列(ArtificialSequence)<400>2atgactgatccttgtgctagagtgtac27当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1