一种重组内切聚半乳糖醛酸酶及其基因pgaA与应用的制作方法
本发明属于基因工程领域,具体地说,涉及重组内切聚半乳糖醛酸酶及其应用。
背景技术:
果胶化学结构复杂,主要成分是半乳糖醛酸,是一种由d-半乳糖醛酸、l-鼠李糖、l-阿拉伯糖、d-半乳糖和d-木糖组成的酸性杂多糖。果胶的分类方法有很多,其中,根据果胶分子结构的不同可分为3类:(1)同型半乳糖醛酸寡聚糖(homogalaturonan,hg)(约占果胶的65%),是由半乳糖醛酸通过α-1,4糖苷键连接而成的聚合体,没有侧链,是平滑区;(2)鼠李半乳糖醛酸寡聚糖i型(rhamngalacturonantypei,rg-i),约占果胶的25%;(3)鼠李半乳糖醛酸寡聚糖ii型(rhamngalacturonantypeii,rg-ii)(约占果胶的10%)。
果胶低聚糖是第一个被发现的植物多糖,是由2~20个α-1,4-半乳糖醛酸残基聚合而成的功能性低聚糖,部分半乳糖醛酸的羧基发生甲酯化。果胶不彻底降解的产物就是果胶低聚糖,它是一种功能性低聚糖,是目前国内外的研究热点。
目前通过基因工程技术生产酶制剂已成为工业酶的主导。聚半乳糖醛酸酶(pg,ec3.2.1.15)是果胶酶的重要组成部分,属于糖苷水解酶gh28家族,作用底物是果胶和果胶酸(聚半乳糖醛酸)。根据其作用方式分为内切聚半乳糖醛酸酶(endopolygalacturonase,简称endo-pg)和外切聚半乳糖醛酸酶(exopolygalacturonase,简称exo-pg)。内切聚半乳糖醛酸酶的最适的底物是果胶酸,并以随机的方式切割,酶解产物主要是半乳糖醛酸三糖和四糖。外切聚半乳糖醛酸酶只能从非还原端切下半乳糖醛酸残基,酶解产物是半乳糖醛酸和半乳糖醛酸二糖。
技术实现要素:
本发明的目的是提供一种新的内切聚半乳糖醛酸酶编码基因、含有该基因的表达载体和表达该酶的工程菌。
本发明的另一目的提供一种上述重组内切聚半乳糖醛酸酶的应用,利用该重组内切聚半乳糖醛酸酶水解果胶来制备果胶低聚糖。
本发明首先获取genbank上已公布的黑曲霉内切聚半乳糖醛酸酶(pgaa)的氨基酸序列,然后根据宿主产朊假丝酵母的密码子偏好性,对密码子进行优化,从而得到了pgaa基因的新的核苷酸序列如seqidno.1所示,其结构基因全长1113bp,包含信号肽序列。
本发明的内切聚半乳糖醛酸酶基因pgaa其表达的内切聚半乳糖醛酸酶的氨基酸序列如seqidno.2所示,包含370个氨基酸,理论分子量为40.7kda。
重组内切聚半乳糖醛酸酶的表达方法,包括以下步骤:
(1)根据宿主菌的密码子偏好性,对获得的pgaa基因编码的氨基酸的密码子进行优化,从而到了pgaa基因的新的核苷酸序列;
(2)优化后的pgaa基因与表达载体pcugapgαal连接,构建重组质粒pcugapgαal-pgaa;
(3)重组质粒pcugapgαal-pgaa转化大肠杆菌,筛选出阳性克隆;
(4)重组质粒pcugapgαal-pgaa转化产朊假丝酵母,筛选阳性克隆,活化后保种,得到c.u-pgaa重组菌;
(5)比较筛选到的几株重组菌的内切聚半乳糖醛酸酶酶活,从中筛选酶活最高的一株;
(6)c.u-pgaa重组菌高密度培养,分离上清,即为重组内切聚半乳糖醛酸酶粗酶液。
本发明的内切聚半乳糖醛酸酶经sds-page分析,目的蛋白大小约为41kda,均与理论大小40.8kda相差不大。
与现有技术相比,本发明具有如下有益效果:本发明通过基因工程技术得到了一个新的内切聚半乳糖醛酸酶基因,将其进行重组表达后得到的重组酶具有较高的活性,可以高效催化果胶水解,产生果胶低聚糖,还可用于果汁澄清和葡萄酒的酿造中。本发明的内切聚半乳糖醛酸酶最适温度为60℃,最适ph为5.0,高密度培养168h后的酶活为180.9u/ml。本发明的内切聚半乳糖醛酸酶粗酶液在酶量为6mg/g底物,温度为60℃,ph为5.0的条件下水解果胶,当水解120min时的果胶低聚糖的质量有15.34μg,浓度为3.835μg/ml,果胶低聚糖的得率为27.17%。
附图说明
图1为内切聚半乳糖醛酸酶异源表达载体pcugapgαal-pgaa的构建。
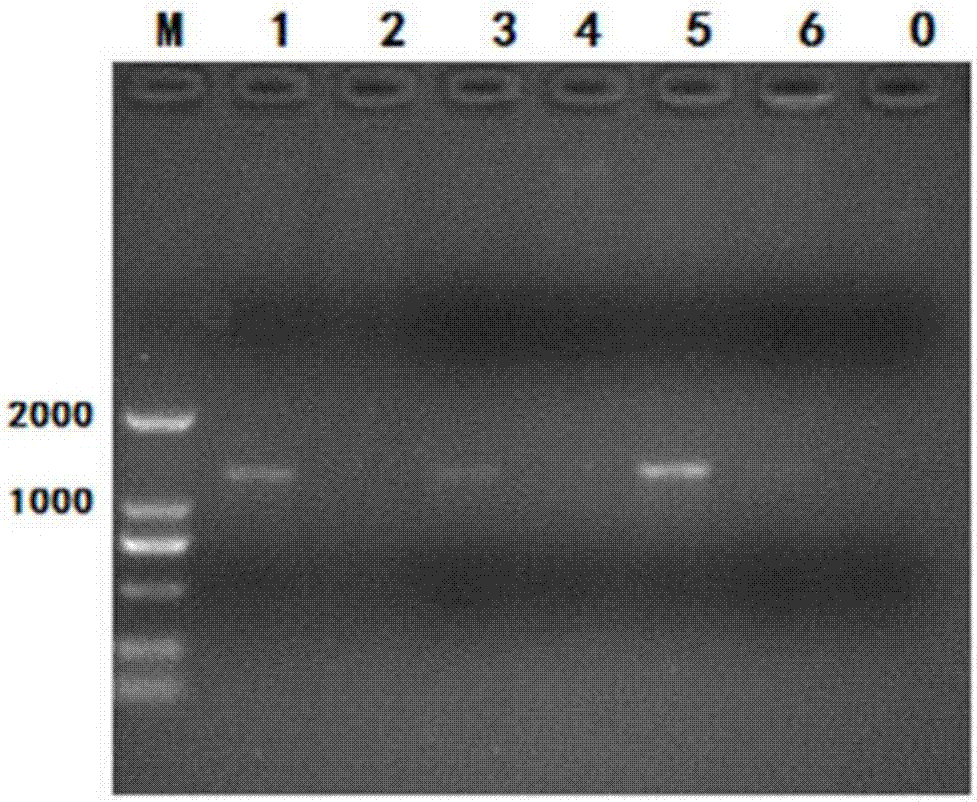
图2为重组载体pcugapgαal-pgaa转化大肠杆菌后阳性克隆子的鉴定。
其中,图2中,m为100~2000bpmarker,1~6为挑取的单菌落,0为阴性对照。
图3为重组载体pcugapgαal-pgaa转化产朊假丝酵母阳性克隆的筛选。
其中,图3中,m为100~2000bpmarker,1~3为挑取的单菌落,0为阴性对照。
图4为重组内切聚半乳糖醛酸酶sds-page电泳。
其中,图4中,m:10~170kda蛋白marker,1:重组产朊假丝酵母菌的胞内蛋白,2:重组产朊假丝酵母菌的上清液,3:含有pcugapgαal空载的重组产朊假丝酵母菌的胞外上清液,4:野生产朊假丝酵母菌的上清液。
图5为重组产朊假丝酵母的生长曲线和酶活曲线。
图6为重组内切聚半乳糖醛酸酶的最适温度曲线。
图7为重组内切聚半乳糖醛酸酶的最适ph曲线。
图8为重组内切聚半乳糖醛酸酶酶解果胶。
图9为半乳糖醛酸标准曲线。
具体实施方式
通过以下实施例进一步详细说明本发明,但应注意本发明的范围并不受这些实施例的限制
实验菌株与质粒:
1.大肠杆菌dh5α为本实验室保藏菌种;
2.产朊假丝酵母atcc22023购于广东省微生物菌种保藏中心;
3.整合表达载体pcugapgαal(含有产朊假丝酵母的gap启动子,g418抗性基因),由本实验室构建;
4.引物合成及测序由invitrogen公司完成。
培养基:
1.lb培养基:0.5%酵母提取物,1%胰蛋白胨,1%氯化钠,1.5%~2%琼脂粉(固体培养基)蒸馏水溶解后,121℃,高压灭菌20min,4℃保存。
2.含氨苄青霉素的lb培养基:在lb培养基中加入100mg/ml的氨苄青霉素钠,使其终浓度为100μg/ml。
3.含卡那霉素的lb培养基:在lb培养基中加入50mg/ml的卡那霉素,使其终浓度为50μg/ml。
4.ypd培养基:1%酵母提取物,2%胰蛋白胨,2%葡萄糖(先配成20%的葡萄糖,单独灭菌,使用前加入),蒸馏水溶解后,121℃高压灭菌20min,4℃保存。
5.含g418的ypd培养基:在ypd培养基中加入300mg/ml的g418母液,使其终浓度为300μg/ml。
6.ypdg培养基:1%酵母提取物,2%胰蛋白胨,0.5%葡萄糖,0.5%甘油,蒸馏水溶解后,121℃高压灭菌20min,4℃保存。
实施例1:重组内切聚半乳糖醛酸酶的重组表达
1.重组内切聚半乳糖醛酸酶pgaa的获取
参照ncbi中genbank上已公布的黑曲霉内切聚半乳糖醛酸酶基因(pgaa)编码的氨基酸序列。然后根据产朊假丝酵母的密码子偏好性,采用最高频率密码子对基因序列进行密码子优化。
为了方便后续的分子克隆,在上述序列5’端加入bsp119i酶切位点,在3’端加入xbai酶切位点,优化后的序列由通用生物系统(安徽)有限公司合成。
2.pgaa克隆进pcugapgαal表达载体
1)puc57-pgaa质粒的提取,参照美基质粒小量快速抽提试剂盒的操作说明。
2)质粒puc57-pgaa和pcugapgαal的双酶切。
用限制性内切酶bsp119i和xbai分别酶切puc57-pgaa质粒和pcugapgαal质粒,反应体系为50μl:
37℃水浴1h后,琼脂糖凝胶电泳分析酶切结果。
3)酶切产物的胶回收,根据美基生物公司的凝胶dna微量回收试剂盒回收酶切产物。
4)pgaa片段与质粒pcugapgαal片段的连接
将回收到的pgaa片段和载体pcugapgαal片段按照摩尔比为10:1的比例进行连接,连接体系为20μl:
22℃连接1h后,取出保存至-20℃,待后续转化大肠杆菌
5)重组载体pcugapgαal-pgaa转化大肠杆菌
参照《分子克隆实验指南(第三版)》制备大肠杆菌e.colidh5α感受态细胞。
a.取10μl连接产物加入到100μl感受态大肠杆菌中,轻轻吸打混匀,于冰上静置30min;
b.42℃水浴热激90s后,冰上静置5min;
c.加入900μllb液体培养基,37℃,130rpm复苏1h;
d.6,000×g离心5min后,倒弃大部分上清液,剩余约100μl用来重悬菌体;
e.将重悬液全部涂于含卡那霉素的lb固体培养基上,于37℃
恒温培养箱中倒置培养过夜。
6)重组载体pcugapgαal-pgaa转大肠杆菌阳性转化子的鉴定
待平板上长出转化子后,用无菌的牙签挑取少量菌体轻轻混于预先配置好的20μlpcr反应体系中进行鉴定。其中,阴性对照不含模板。反应体系为:
然后分装,每管20μl。反应条件为:
挑选一株阳性转化子,提取质粒后命名为pcugapgαal-pgaa,于-20℃保存。
3.重组质粒pcugapgαal-pgaa转化产朊假丝酵母
1)重组质粒pcugapgαal-pgaa的线性化
限制性内切酶saci单酶切重组质粒,使其线性化,反应体系为50μl:
37℃水浴1h后,琼脂糖凝胶电泳检测酶切结果,之后对酶切产物进行纯化回收,保存于-20℃,待后续转化产朊假丝酵母。
2)产朊假丝酵母感受态细胞的制备
a.产朊假丝酵母的活化:将产朊假丝酵母甘油菌以2%接种于5mlypd培养基中,30℃摇床培养约24h;
b.转接:将活化后的产朊假丝酵母再次以2%接种于5mlypd培养基中,培养过夜后,转接至50mlypd培养基中,使其初始od600为1.0,当菌的od600在3.0~5.0之间时,开始制备感受态细胞;
c.将菌液转移至预冷的无菌的50ml刻度离心管中,冰上放置10min后,4℃,4,800×g离心7min;
d.倒弃培养基,往离心管中加入8ml无菌水,1ml10×tebuffer,1ml1mliac,重悬菌体,30℃,85rpm摇45min;
e.之后加入350μl1mdtt,30℃,85rpm摇15min;
f.补加预冷的无菌水至50ml,4℃,4,800×g离心7min;
g.弃上清,加入3ml预冷的1m山梨醇溶液,轻轻吸打重悬菌体,4℃,4,800×g离心7min;
h.弃上清,加入100μl预冷的1m山梨醇重悬菌体,使细胞终浓度达到约为1×1010个/ml;
i.将产朊假丝酵母感受态细胞以每管40μl分装到预冷的1.5ml的离心管中,置于冰上待用。
3)产朊假丝酵母的电转化
a.向每管产朊假丝酵母感受态细胞中分别加入5μl(5~100ng)的线性化的质粒,轻轻混匀,转移至预冷的电转杯中,静置10min;
b.电压为1.7kv,电击5ms后,30s内加入1ml预冷的1m山梨醇溶液并混匀,静置10min;
c.在超净台中将电转杯中的菌液转移至无菌的4ml离心管中,加入1mlypd培养基并混匀;
d.30℃,170rpm复苏3h;
e.8,000×g离心3min后,倒弃大部分上清液,剩余100μl重悬菌体;
f.将菌体全部涂于含g418的ypd固体培养基上,30℃恒温培养箱倒置培养3-4d。
4)产朊假丝酵母阳性克隆的筛选
挑取3个单菌落用无菌的牙签分别接种于5ml含g418的ypd液体培养基中,待菌长到对数期时提取酵母基因组,通过pcr扩增鉴定阳性克隆;如图3。
进行pcr反应,反应体系为100μl
分装4管,反应条件为:
反应结束后,琼脂糖凝胶电泳检测pcr扩增结果,并保存电泳图,如图4。
实施例2:重组内切聚半乳糖醛酸酶的酶特性分析
1.重组内切聚半乳糖醛酸酶的蛋白质凝胶电泳(sds-page)分析
将阳性产朊假丝酵母重组菌以2%接种量接种于5ml含g418的ypd培养基中;30℃,200rpm培养24h后,转接至200ml的含g418的ypd培养基中,使其初始od600为0.1;培养96h后,8,000×g离心30min,分离菌体和上清;
用10k的超滤管4℃,5,000×g对上清液进行浓缩,浓缩100倍。对浓缩液进行蛋白定量及sds-page电泳分析。
1)配胶:
表1配置tris-甘氨酸sds-page所用溶液
2)样品处理:
蛋白样品800μg
5×loadingbuffer8μl
ddh2o补足至40μl
沸水煮1min后,8,000×g离心3min;
a.点样:蛋白样品上样量为10μl,蛋白marker上样量为8μl;
b.电泳:电压设置为100v,电泳3h;
c.切胶:将凝胶从胶板上取下来,放入考马斯亮蓝染色液中染色1h;
d.脱色:沸水浴约20min,至条带变清晰;
e.观察并保存:用凝胶成像仪观察条带并保存电泳图。
根据sds-page电泳结果(图4)显示,目的蛋白大小约为41kda,均与理论大小40.8kda相差不大。
2.重组产朊假丝酵母的生长曲线和酶活曲线
将产朊假丝酵母重组菌以2%接种量接种于5ml含g418的ypd培养基中,30℃,200rpm培养24h后,再按2%接种量转接至50ml新鲜的含g418的ypd培养基中,每12h取样1ml分别测菌体密度(od600)及上清中的内切聚半乳糖醛酸酶酶活。以时间为横坐标,分别以od600和酶活(u/ml)为纵坐标绘制重组菌的生长曲线及酶活曲线。
酶活检测采用dns法,其原理是在碱性条件下,二硝基水杨酸(dns)与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,该产物在煮沸条件下显棕红色,且在一定浓度范围内颜色深浅与还原糖含量成正比。步骤如下:
1)半乳糖醛酸标曲的制作:
配制1mg/ml的半乳糖醛酸标准溶液。取14支25ml的刻度试管,编号;按下表分别加入超纯水、半乳糖醛酸标准溶液、dns,混匀后,沸水浴10min,立即冷水冷却;待充分冷却后,加水定容至12.5ml;1号作为对照,在540nm波长下测其吸光度。以半乳糖醛酸含量为横坐标,以吸光度为纵坐标,绘制标准曲线,求得线性回归方程。
表2半乳糖醛酸标曲的制作
标准曲线如图9所示,od540与半乳糖醛酸含量有很好的线性关系,可以用于聚半乳糖醛酸酶的酶活检测。
2)重组内切聚半乳糖醛酸酶酶活检测
a.向刻度试管中加入1.9ml的磷酸氢二钠-柠檬酸缓冲液(ph5.0),2ml1%的多聚半乳糖醛酸钠溶液,0.1ml的待测酶液(已稀释到适量的倍数),使用灭火的酶液作为空白对照。混匀后,50℃水浴反应30min,每组做2个平行;
b.反应结束后,立即加入5ml的dns,沸水浴10min;
c.立即放入冷水中冷却,待冷却至室温时,加入超纯水定容至12.5ml,混匀;
d.转移至离心管中,10,000×g离心5min;
e.吸取上清,用分光光度计检测540nm波长下的吸光度。
内切聚半乳糖醛酸酶活力单位的定义为:在50℃,ph5.0的条件下,1ml酶液每分钟水解多聚半乳糖醛酸钠释放1μmol半乳糖醛酸所需的酶量为1个活力单位,以u/ml表示。计算公式为:
式中a:聚半乳糖醛酸酶酶活,u/ml;
m:根据标准曲计算出的生成的半乳糖醛酸质量,mg;1000/194:半乳糖醛酸的质量(mg)转化为摩尔数(μmol)的系数;
v:酶液体积,ml;
t:反应时间,min;
n:稀释倍数。
如图5所示:重组产朊假丝酵母在0h~6h处于延滞生长期,在6h~36h处于对数生长期,48h~60h处于稳定生长期,60h之后处于衰退生长期,48h时od600达到最大值为26.82。重组产朊假丝酵母的内切聚半乳糖醛酸酶酶活曲线与生长曲线的走势大致一致,重组内切聚半乳糖醛酸酶酶活在6h~84h处于增长状态,在84h时达到最高为48.46u/ml,84h之后酶活下降。
3.重组内切聚半乳糖醛酸酶的酶学特性分析
1)重组内切聚半乳糖醛酸酶的最适温度
在ph5.0的磷酸氢二钠-柠檬酸钠缓冲液中,测定不同温度下(30℃~70℃)内切聚半乳糖醛酸酶酶活。以最高酶活为100%,绘制温度与酶活关系曲线。
如图6所示,重组内切聚半乳糖醛酸酶在40℃~60℃时酶活力较高,60℃时酶活最高为46.43u/ml,
2)重组内切聚半乳糖醛酸酶的最适ph
在40℃,不同ph(3.0~7.0)的条件下的测定内切聚半乳糖醛酸酶酶活。以最高酶活为100%,绘制ph与酶活关系曲线。
如图7所示,内切聚半乳糖醛酸酶在ph4.0~7.0时具有较高的酶活力,在ph为5.0时酶活最高。
实施例3重组产朊假丝酵母菌的高密度培养
1.将重组产朊假丝酵母菌以2%的接种量接种于5ml含g418的ypd培养基中,培养24h;
2.待重组菌长到对数期,以2%转接到50ml含g418的ypd培养基中,培养过夜后,转接到150ml含g418的ypdg培养基中,使其初始od600为0.1,30℃,200rpm进行培养;
3.待甘油的含量低于0.5%时补加10%的甘油,使甘油含量为1%;
4.培养168h后,测od600;
5.4℃,5,000×g离心30min,收集上清液,测上清中蛋白浓度及内切聚半乳糖醛酸酶酶活。
酶活检测结果显示,经168h补料高密度培养后,重组内切聚半乳糖醛酸酶酶活为180.9u/ml。
实施例4:重组内切聚半乳糖醛酸酶酶解果胶
1)称取0.2g果胶,加入0.2ml重组内切聚半乳糖醛酸酶(酶量为6mg/g底物),补加ph5.0的磷酸氢二钠-柠檬酸钠缓冲液至10ml,在60℃,150rpm的摇床里进行酶解;
2)在不同时间点(0、15min、30min、60min、120min)取样,沸水浴10min灭活内切聚半乳糖醛酸酶后,以dns法测定酶解产物中果胶低聚糖的生成量。
3)计算果胶低聚糖得率:
式中a:吸光值对应的还原糖浓度,mg/ml;
v:酶解反应体积,ml;
m:酶解底物的质量,mg;
g:果胶中半乳糖醛酸的含量;
酶解结果如图8所示,在0~60min内果胶低聚糖增长速度较快,随后增长速度减缓;水解120h时的果胶低聚糖的质量有15.34μg,浓度为3.835μg/ml,果胶低聚糖的得率为27.17%。
序列表
<110>广东利世康低碳科技有限公司
<120>一种重组内切聚半乳糖醛酸酶及其基因pgaa与应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>1113
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgccttctgccaagcctttgttctgccttgcgaccctggccggtgccgctctggctgct60
cctgcgccttcccgcgtctccgacttcaccaagcggtccacctgcaccttcactgatgcg120
gccaccgcctccgagtgcaagacctcttgctccgacatcgtcctcaaggacatcaccgtc180
cctgctggtgagacccttaacctgaaggacctcaacgacggcaccactgtcaccttcgag240
ggaaccaccacctgggagtacgaggagtgggatggaccccttctccgtatctccggtaag300
gacatcaccgtgacccagtcctccgacgccgtcctcgacggcaacggcgccaagtggtgg360
gacggtgagggaaccaacggcggcaagaccaagcccaagttcttctacgcccacgacctc420
gacgactccaagatctccggtctttacatcaagaacacccccgtccaggccatctccgtc480
gagtctgacaacctcgtgttcgaggacgtcaccatcgacaacagcgacggtgactccgag540
ggcggtcacaacaccgacggtttcgacatcagcgagagtacctacatcaccatcaccggc600
gccaccgtcaagaaccaggacgactgcgtcgccatcaattctggtgagaacatctacttc660
tccggcggtacctgctccggcggtcacggtctctccatcggctccgacggtggccgcgac720
gacaacaccgtcaagaacgtcactttcatcgactcgactgtctccgactctgagaacggt780
gttcgcatcaagaccgtctacgacgctactggtactgtcgaggacatcacctactccaac840
atccagctctccggtatctccgactacggtatcgtcatcgagcaggactacgagaacggt900
gaccccactggtactccctccaacggtgttaccatctccgacgtcaccctcgaggacatc960
actggctcggttgactccgacgctgtcgagatctacatcctttgcggtgatggcagctgc1020
tctgactggaccatgtctggcattgacatcaccggcggtgagaccagcagcgattgcgag1080
aacgttccctctggtgcttcttgcgatcagtaa1113
<210>2
<211>370
<212>prt
<213>人工序列(artificialsequence)
<400>2
metproseralalysproleuphecysleualathrleualaglyala
151015
alaleualaalaproalaproserargvalseraspphethrlysarg
202530
serthrcysthrphethraspalaalathralasergluserlysthr
354045
sercysseraspilevalleulysaspilethrvalproalaglyglu
505560
thrleuasnleulysaspleuasnaspglythrthrvalthrpheglu
65707580
glythrthrthrtrpglutyrgluglutrpaspglyproleuleuarg
859095
ileserglylysaspilethrvalthrglnserseraspalavalleu
100105110
aspglyasnglyalalystrptrpaspglygluglythrasnglygly
115120125
lysthrlysprolysphephetyralahisaspleuaspaspserlys
130135140
ileserglyleutyrilelysasnthrprovalglnalaileserval
145150155160
gluseraspasnleuvalilegluaspvalthrileaspasnserasp
165170175
glyaspsergluglyglyhisasnthraspglypheaspileserglu
180185190
serthrtyrilethrilethrglyalathrvallysasnglnaspasp
195200205
cysvalalaileasnserglygluasniletyrpheserglyglythr
210215220
cysserglyglyhisglyleuserileglyservalglyglyargasp
225230235240
aspasnthrvallysasnvalthrpheileaspserthrvalserasp
245250255
sergluasnglyvalargilelysthrvaltyraspalathrglythr
260265270
valgluaspilethrtyrserasnileglnleuserglyileserasp
275280285
tyrglyilevalilegluglnasptyrgluasnglyaspprothrgly
290295300
thrproserasnglyvalthrileseraspvalthrleugluaspile
305310315320
thrglyservalaspseraspalavalgluiletyrileleucysgly
325330335
aspglysercysserasptrpthrmetserglyileaspilethrgly
340345350
glygluthrserseraspcysgluasnvalproserglyalasercys
355360365
aspgln
370
- 还没有人留言评论。精彩留言会获得点赞!