一种4-甲基伞形酮富集材料及其用途的制作方法
本发明提供了一种4-甲基伞形酮富集材料,该材料用于同时测定大肠杆菌和大肠埃希氏菌中,属于微生物检测技术领域。
背景技术
大肠菌群是衡量食品卫生状况、尤其是存在肠道致病菌潜在威胁的重要指标,因而也是几乎任何食品都必须检测的重要微生物项目。传统的检测方法基于发酵乳糖,产酸和产气,培养时间24-96h。但是由于大肠杆菌厌氧株的发现(applenvironmicrobiol.198243(6):1320–1329.),以产气作为鉴定依据在某种程度上就失去了意义。
大肠菌群测试更多采用测定β-半乳糖苷酶的方法来替代乳糖发酵试验,通过培养温度控制为44.5℃来抑制非肠道来源的其它具有β-半乳糖苷酶的格兰氏阴性菌生长。测定β-半乳糖苷酶常用的底物有4-甲基伞形酮-β-d-半乳糖苷(mugal)、5-溴-4-氯-3-吲哚-β-d-半乳糖苷(x-gal)、邻硝基酚-β半乳糖苷(onpg)等。当这些试剂中的半乳糖苷被大肠菌群产生的半乳糖苷酶水解后,产生荧光或颜色产物,从而实现大肠菌群的快速鉴别。大肠埃希氏杆菌同样作为卫生学指标来指示环境及样品是否有粪便污染。4-甲基伞形酮葡糖苷酸(mug)培养基用于大肠埃希氏杆菌快速检测。(gb/t4789.32-2002,gb/t5750.12-2006)。细菌的葡萄糖醛酸苷酶在碱性条件下,作用于4-甲基伞形酮-β-d葡萄糖醛酸苷(4-methylumbellifery-β-d-glucuronide简称mug)的β-葡糖醛酸苷键,使其水解,释放的4-甲基伞形酮在366nm紫外灯下产生蓝白色荧光。97%的大肠埃希氏杆菌、10%的沙门氏菌以及少量的志贺氏菌具有葡萄糖醛酸苷酶。1995年该方法被美国国家环境保护署采纳(codeoffederalregulations40,141.21protectionofenvironment)。有关大肠菌群具有β-半乳糖苷酶的特性,iso9308-1:2000已给予了明确的定义。近年来,大肠杆菌和大肠埃希氏菌的检测主要通过含有上述底物的平板显色检测,如:法国生物梅里埃公司、法国科马嘉公司、英国oxoid公司、北京陆桥技术有限责任公司、青岛海博生物技术有限公司及广东环凯生物技术有限公司等的相关产品。酶底物平板法自动化程度不高,阳性菌落计数繁琐且易因稀释不精确而出现计数误差。
美国idexx公司开发了一种基于计数盘的大肠杆菌和大肠埃希氏菌同时检测方法。水样与含两种显色/荧光底物的培养基粉末混合,倒入分为若干区室的定量盘内,密封培养。当稀释浓度合适,每个区室只有1个菌或0个菌。结果可以很方便跟mpn方法关联,使用该方法24小时以内可以实现大肠埃希氏菌和总大肠杆菌的快速检测。然而,上述方法对稀释度要求较高,当稀释不合理时,容易出现全板阳性或全板阴性无法计数,肠杆菌科一般生长较快,24小时实现定量时间还是显得略长,不能完全满足饮用水检测及环保执法的要求。鉴于上述需求,美国neogen公司开发了biolumix实时微生物荧光光电快速检测系统,通过溶液培养实时监测荧光及颜色变化,实现了大肠杆菌、大肠埃希氏菌及其他微生物无需稀释10小时内快速检测。快速培养-显色/荧光的方法无需样品稀释,容易做成在线自动化仪器,培养时间短,在环保领域具有较大的优势。然而水体卫生学指示菌检测通常总大肠杆菌及大肠埃希氏菌指标都需要检测,实际检测时需要两次培养测定。如两个检测的荧光/颜色底物同时加入一个培养管,颜色产物通常是较好的荧光淬灭剂会淬灭可能的荧光产生,不利于荧光结果的判读。
技术实现要素:
本发明提供了一种4-甲基伞形酮富集材料,对样品中通过该材料在培养管底部的引入,当培养管中加入大肠杆菌和大肠埃希氏菌各自的显色/荧光底物培养基培养时,可以实现一根培养管同时测定大肠杆菌和大肠埃希氏菌。
实现本发明上述目的所采用的技术方案为:
一种4-甲基伞形酮富集材料,所述富集材料为采用以下方法制备:将琼脂糖与naoh溶液和二甲基亚砜进行混合,其中琼脂糖:naoh:二甲基亚砜的质量比为1:0.2~5:1~10,将混合物置于恒温水浴条件下,边搅拌边加入卤代烃或卤代酸,琼脂糖与卤代烃或卤代酸的质量比为1:0.2~5,加入完毕后继续搅拌并恒温反应至反应结束,然后用丙酮和去离子水清洗,离心分离后干燥,即制得4-甲基伞形酮富集材料。
所述naoh溶液的浓度为40-200g/l。
所述恒温反应温度为38-70℃。
加入卤代烃或卤代酸完毕后以300rpm的速度搅拌并恒温反应。
反应结束后用丙酮和去离子水清洗5遍。
上述4-甲基伞形酮富集材料能够同时测定大肠杆菌和大肠埃希氏菌,包括以下步骤:取4-甲基伞形酮富集材料和琼脂糖,加入水后微波融化并搅拌均匀,然后将混合物转移至培养管的底部,在培养管中加入同时包含有大肠杆菌和大肠埃希氏菌各自的显色/荧光底物的培养基,然后接入样品进行培养,培养完毕后进行荧光检测,若样品中同时含有大肠杆菌和大肠埃希氏菌,则可以同时检测中两者的含量。
与现有技术相比,本发明所提供的技术方案具有以下优点:本发明中通过4-甲基伞形酮富集材料的制备,能够实现利用一根培养管来同时检测样品中的大肠杆菌和大肠埃希氏菌,检测结果准确,大大的节省了检测时间。
附图说明
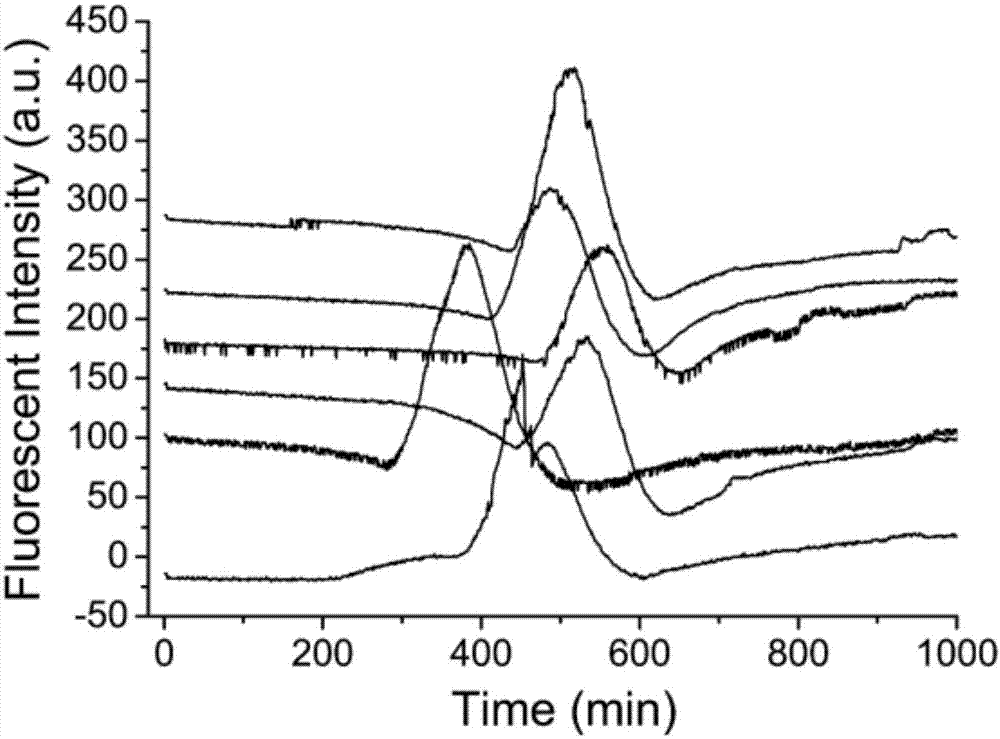
图1为本发明实施例1中的检测结果图;
图2为本发明实施例2中的检测结果图。
具体实施方式
下面结合具体实施例对本发明做详细具体的说明,但是本发明的保护范围并不局限于以下实施例。
实施例1
准确称取5g琼脂糖置于250ml三口圆底烧瓶中。加入60mlnaoh溶液(含naoh2.4g)和30ml二甲基亚砜然后置于38℃恒温水浴中缓慢搅拌搅拌速度同时慢慢加入5ml1-氯辛烷之后将搅拌速度提升至300rpm,恒温反应2h。反应结束后分别用丙酮、去离子水清洗琼脂糖5次,离心分离,干燥,待用。
取1g4-甲基伞形酮富集材料,4g琼脂糖,加入200ml水,微波炉融化琼脂糖,搅拌均匀,每个24孔板孔中加入500μl融化的上述琼脂糖混合物,凝固后加入75%乙醇灭菌后在超净台上吹至无明显水迹。使用colilert-18试剂无菌过滤,每孔加入2ml,接入稀释好浓度梯度的大肠埃希氏菌dh5α及耐热大肠杆菌atcc25922各100μl,44.5℃培养,底部360nm波长光激发,测定449nm荧光强度随时间变化。对照为未加琼脂糖24孔板,其余操作相同。
本实施例1中检测结果如图1所示,使用直接培养的colilert-18试剂监测大肠埃希氏菌dh5α和耐热大肠杆菌atcc25922混合培养449nm荧光变化。按出峰时间大肠埃希氏菌dh5α浓度依次为890000个/ml,89000个/ml,8900个/ml,890个/ml,89个/ml,耐热大肠杆菌atcc25922浓度依次为1120000个/ml,112000个/ml,11200个/ml,1120个/ml,112个/ml。
实施例2
准确称取5g琼脂糖置于250ml三口圆底烧瓶中。加入60mlnaoh溶液(含naoh2.4g)和30ml二甲基亚砜然后置于50℃恒温水浴中缓慢搅拌搅拌速度同时慢慢加入5ml6-氯己酸之后将搅拌速度提升至300rpm,恒温反应2h。反应结束后分别用丙酮、去离子水清洗琼脂糖5次,离心分离,干燥,待用。
取2g4-甲基伞形酮富集材料,3g琼脂糖,加入100ml水,微波炉融化琼脂糖,搅拌均匀,每个24孔板孔中加入500μl融化的上述琼脂糖混合物,凝固后加入75%乙醇灭菌后在超净台上吹至无明显水迹。使用下表培养基无菌过滤后每孔加入2ml,接入稀释好浓度梯度的大肠埃希氏菌dh5α及耐热大肠杆菌atcc25922各100μl,44.5℃培养。
接种好不同浓度大肠埃希氏菌及耐热大肠杆菌的24孔板放入酶标仪,底部360nm波长光激发,测定449nm荧光强度随时间变化。对照为未加琼脂糖24孔板,其余操作相同。
检测结果见图2,按出峰时间大肠埃希氏菌dh5α浓度依次为890000个/ml,89000个/ml,8900个/ml,890个/ml,89个/ml,按出峰时间耐热大肠杆菌atcc25922浓度依次为1120000个/ml,112000个/ml,11200个/ml,1120个/ml,112个/ml。
实施例3
准确称取5g琼脂糖置于250ml三口圆底烧瓶中。加入60mlnaoh溶液(含naoh4.8g)和30ml二甲基亚砜然后置于70℃恒温水浴中缓慢搅拌搅拌速度同时慢慢加入5ml1-氯庚烷之后将搅拌速度提升至300rpm,恒温反应2h。反应结束后分别用丙酮、去离子水清洗琼脂糖5次,离心分离,干燥,待用。
取3g4-甲基伞形酮富集材料,2g琼脂糖,加入200ml水,微波炉融化琼脂糖,搅拌均匀,每个24孔板孔中加入500μl融化的上述琼脂糖混合物,凝固后加入75%乙醇灭菌后在超净台上吹至无明显水迹。使用colilert-18试剂无菌过滤,每孔加入2ml,接入稀释好浓度梯度的大肠埃希氏菌dh5α及耐热大肠杆菌atcc25922各100μl,44.5℃培养,底部360nm波长光激发,测定449nm荧光强度随时间变化。对照为未加琼脂糖24孔板,其余操作相同。
实施例4
准确称取5g琼脂糖置于250ml三口圆底烧瓶中。加入60mlnaoh溶液(含naoh15g)和30ml二甲基亚砜然后置于38℃恒温水浴中缓慢搅拌搅拌速度同时慢慢加入5ml1-氯己烷之后将搅拌速度提升至300rpm,恒温反应2h。反应结束后分别用丙酮、去离子水清洗琼脂糖5次,离心分离,干燥,待用。
取4g4-甲基伞形酮富集材料,1g琼脂糖,加入200ml水,微波炉融化琼脂糖,搅拌均匀,每个24孔板孔中加入500μl融化的上述琼脂糖混合物,凝固后加入75%乙醇灭菌后在超净台上吹至无明显水迹。使用colilert-18试剂无菌过滤,每孔加入2ml,接入稀释好浓度梯度的大肠埃希氏菌dh5α及耐热大肠杆菌atcc25922各100μl,44.5℃培养,底部360nm波长光激发,测定449nm荧光强度随时间变化。对照为未加琼脂糖24孔板,其余操作相同。
- 还没有人留言评论。精彩留言会获得点赞!