一种隐孢子虫蛋白激酶的纯化方法与流程
本发明涉及生物技术领域,更具体地,涉及一种隐孢子虫蛋白激酶的体外重组蛋白的纯化方法。
背景技术:
隐孢子虫(cryptosporidium)是分布广泛、危害严重的腹泻病病原。隐孢子虫为顶复门的寄生原虫,包括70多个已知的虫种和基因型。以感染几乎所有的脊椎动物,导致以腹泻,尤其是幼龄动物持续性水样腹泻为主要症状的疾病。隐孢子虫对幼龄牛、羊和猪感染率很高(>30%),对一岁内家畜累计感染率为100%,同时是多国奶牛腹泻的主要病原。因此,该病对养殖业造成严重危害。
此外,隐孢子虫还是重要的人兽共患病原,是发展中国家儿童腹泻的二号病原。全球每年因腹泻致死的儿童病例中,10%由该病原引起。由于引起大规模疾病暴发,隐孢子虫是多数发达国家的法定传染病病原,也是多国(包括我国)水质标准中仅有的两个病原之一。由于对隐孢子虫的入侵机制了解有限,导致缺乏有效的隐孢子虫病药物。在治疗隐孢子虫病的潜在药物中,只有硝唑尼特(nitazoxanide)是美国fda批准的唯一药物,但该药物对免疫低下人群和动物无效。
蛋白激酶在顶复门原虫入侵和发育中起重要作用,但它们在隐孢子虫入侵中的作用并未得到系统研究。顶复门原虫具有保守的入侵机制。这期间细胞器蛋白的分泌、活化以及虫体对宿主细胞膜和免疫通路的修饰,都离不开蛋白激酶对蛋白的活化作用。因没有纯化得到隐孢子虫的蛋白,这些蛋白的功能还不能准确验证。
例如,钙依赖蛋白激酶cdpk(calcium-dependingproteinkinase)以及胰岛素降解酶(insulin-degradingenzymeoride;insulinprotease;insulysin;insulinase)被列为潜在的药物靶标。研究表明虫体形态的改变、细胞骨架的重排及其对宿主细胞的识别、附着、入侵和一些分泌蛋白的排放及虫体从宿主细胞的逃逸等过程,均与钙离子的作用密切相关。加工和激活这些蛋白并完成与宿主细胞的受体结合需要多种蛋白酶的协同作用,特别是金属蛋白酶的参与。
由于隐孢子虫蛋白激酶在体外表达过程中常出现片段化表达或表达过程中出现自切降解等情况,所以通过常规纯化方法难得到较纯的蛋白,且活性无法得到保证,影响后续蛋白功能及酶学的研究,也阻碍了隐孢子虫入侵机制的系统性研究。
技术实现要素:
本发明所要解决的技术问题是克服现有隐孢子虫蛋白激酶体外表达及纯化过程中的缺陷和不足,提供一种隐孢子虫蛋白激酶的纯化方法。
本发明的第一个目的是提供一种隐孢子虫蛋白激酶的纯化方法。
本发明的上述目的是通过以下技术方案给予实现的:
一种隐孢子虫蛋白激酶的纯化方法,包括如下步骤:
s1.制备诱导表达蛋白
s11.构建含隐孢子虫蛋白激酶基因的原核表达载体;
s12.将s11的原核表达载体转入表达宿主菌,挑取阳性克隆菌,保存;
s13.将s12挑取的阳性克隆菌经扩大培养至对数生长期后进行诱导表达;
s14.取s13诱导表达后的菌液,冷冻离心收集菌体,弃上清,重悬菌体,然后冰浴超声裂解菌体;
s15.取s14所得裂解液,低温离心分上清沉淀;
对于可溶性蛋白,取上清直接进行后续实验;
对于不可溶蛋白,将沉淀经尿素洗涤、溶解后,冷冻离心,取上清;
s16.取步骤s15中所得上清溶液用0.45μm的滤膜进行过滤,然后与ni柱在冰上孵育后,反复上柱若干次,然后经洗涤液充分洗涤后,用5倍柱体积的洗脱液收集目的蛋白;
s2.割胶回收纯化蛋白
s21.取s16所得蛋白溶液进行蛋白电泳,过程在冰上进行;电泳后蛋白胶经冰冷的kcl溶液染色5~10min;显影结束后根据蛋白marker在目的蛋白大小处切下乳白色蛋白条带,经去离子水水洗浸泡至无色;
s22.将s21中所得蛋白条带放入透析袋中,加入适量缓冲液(2ml/1ug),去除气泡,将透析袋横放在水平电泳仪并浸润在缓冲液中,4℃电泳30~60min,再调换电极,继续电泳2~3min;;
s23.将s22透析袋中所得蛋白溶液收集并放入新的透析袋中,加入缓冲液,再次透析,得到纯化后的隐孢子虫蛋白激酶。
发明人发现,隐孢子虫蛋白激酶在体外表达的过程中均存在片段化表达或表达过程中出现自切降解的情况,常规的蛋白纯化方法难以获得较纯且有活性的蛋白,会影响后续蛋白功能及酶学的研究。本发明通过割胶回收的方法解决了隐孢子虫蛋白激酶在体外表达中易出现的自切降解包涵体表达等问题,能够得到高纯度条带单一且具备酶学活性的重组蛋白,并且能够提高对难以表达、分子量较大蛋白的纯化效果。需要注意的是,步骤s21蛋白溶液进行蛋白电泳时,样品禁止高温煮沸,只需经sds上样缓冲液处理过即可。
优选地,所述隐孢子虫蛋白激酶包括但不限于cpcdpk1(隐孢子虫钙依赖蛋白激酶1)及cpcdpk9(隐孢子虫钙依赖蛋白激酶9)。
具体地,所述cpcdpk1基因的序列如seqidno:1所示;cpcdpk9基因的序列如seqidno:6所示。
优选地,所述cpcdpk1基因的扩增引物如seqidno:1~2所示。
优选地,所述cpcdpk9基因的扩增引物如seqidno:4~5所示。
优选地,步骤s11所述原核表达载体为pet-28a,表达宿主菌为大肠杆菌bl21。
优选地,步骤s13中菌体接种量为1%,诱导初始时菌体od600值在0.6~0.8之间,诱导表达的条件为终浓度0.2~0.4mm(优选0.3mm)的iptg,16~25℃,150~200rpm(优选180rpm)诱导4~6h(优选5h)。本发明通过低温诱导以及改善iptg浓度的方式,提高了表达蛋白的可溶性。
优选地,步骤s14具体为4℃离心收集菌体,8000rpm离心15min;用pbs重悬菌体(每200ml菌液加10mlpbs);超声裂解菌体,55%工作时长2s,暂停时长3s共时长15min。过程在冰浴中进行。裂解后的菌液4℃离心,12000rpm,30min。
优选地,步骤s15中,对于不可溶蛋白,具体步骤如下:取沉淀,用2m尿素进行洗涤;向沉淀中加入适量8m尿素进行溶解(500ml菌液加入40ml),先在冰浴中孵育2h,然后4℃过夜;4℃离心,12000rpm,30min,取上清;
更优选地,步骤s15中,对于不可溶蛋白,若尿素溶解液不挂柱,可采用梯度尿素洗脱的方法代替后续上柱洗脱步骤,具体步骤如下:
将沉淀用2m尿素溶液重悬,摇床孵育2h后,12000rpm,30min,弃上清,收集沉淀;
将收集得到的沉淀继续用4m尿素溶液重悬,摇床孵育2h后,12000rpm,30min,弃上清,收集沉淀;
将收集得到的沉淀继续用6m尿素溶液重悬,摇床孵育2h后,12000rpm,30min,弃上清,收集沉淀;
最后将沉淀用8m尿素重悬,摇床孵育过夜,12000rpm,30min,收集上清,进行跑胶验证。
优选地,步骤s16中ni柱纯化具体为先用5倍柱体积的去离子水,pbs分别润洗柱子;将ni柱加入滤后上清液中,冰上孵育2~3h;将上清液反复上柱3次,后续操作均在冰上进行;用pbs及低浓度咪唑的洗脱液进行充分洗脱,5倍柱体积的洗脱液收集目的蛋白。
优选地,s21所述kcl溶液的浓度为0.2~0.3m,温度为4℃。
优选地,s22中两次正反电泳的条件均为4℃,恒压100v。
优选地,s23中蛋白溶液与缓冲液的体积比为1:15~25(优选1:20)。
与现有技术相比,本发明具有以下有益效果:
本发明提供了隐孢子虫蛋白激酶的纯化方法,所述纯化方法通过低温诱导以及改善iptg浓度的方式,提高了表达蛋白的可溶性,同时通过割胶回收的方法解决了隐孢子虫蛋白激酶在体外表达中易出现的自切降解包涵体表达等问题,能够得到高纯度条带单一且具备酶学活性的重组蛋白,并且能够提高对难以表达、分子量较大蛋白的纯化效果。所纯化得到的蛋白能够进一步用于功能性分析研究,为解决隐孢子虫蛋白功能领域的诸多问题奠定基础。
附图说明
图1为实施例1扩增得到的cpcdpk1基因片段电泳结果。
图2为实施例1pet28a-cpcdpk1-bl21的验证结果。
图3为实施例1pet28a-cpcdpk1-bl21质粒诱导表达后蛋白电泳图。
图4为实施例1纯化得到的蛋白电泳图。
图5为实施例1纯化得到的蛋白的酶活测定结果。
图6为实施例2扩增得到的cpcdpk9基因片段电泳结果。
图7为实施例2pet28a-cpcdpk9-bl21的验证结果。
图8为实施例2pet28a-cpcdpk9-bl21质粒诱导表达后蛋白电泳图。
图9为实施例2纯化得到的蛋白电泳图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1
一种隐孢子虫钙依赖蛋白激酶1(cdpk1)蛋白的纯化方法,包括如下步骤:
1、cpcdpk1蛋白重组表达系统的构建
以隐孢子虫dna为模板,设计特异性扩增引物(seqidno:1~2),通过pcr扩增得到cpcdpk1基因片段(seqidno:3),扩增产物电泳图如图1所示。
将扩增得到的cpcdpk1基因片段与pet-28a质粒,经ecori和xhoi双酶切,酶切产物经纯化后用t4连接酶进行连接,得到cpcdpk1重组质粒,然后经平板涂布、挑取单克隆、pcr测序验证后确定重组质粒正确性,命名为pet28a-cpcdpk1。
2、质粒转导与重组蛋白表达
将pet28a-cpcdpk1质粒转入表达菌株bl21中,经划线培养,挑取单克隆,pcr验证后(图2),进行菌种保存,命名为pet28a-cpcdpk1-bl21。
将成功转入重组质粒的表达菌株转接至培养基中进行放大培养:配置500ml的lb培养基,经高压灭菌冷却后加入终浓度为50μg/ml的卡那霉素,挑取pet28a-cpcdpk1-bl21单菌落进行过夜摇瓶培养,其后按1%接种量接入500ml新鲜的含卡那抗生素的lb培养基中,使菌体生长至对数生长期。
当菌体生长至od600在0.6~0.8之间时,加入终浓度为0.3mm的iptg进行诱导表达,诱导条件25℃,200rpm,诱导5h;诱导表达的蛋白电泳结果如图3所示,表明目的蛋白在预期大小处有表达。
3、cpcdpk1蛋白的纯化
在4℃下离心收集pet28a-cpcdpk1-bl21菌体,8000rpm,15min,弃上清。用25mlpbs重悬菌体,超声裂解菌体至溶液澄清透明。超声工作时间约15min,过程在冰浴中进行。将裂解液在4℃,12000rpm,离心30min,收集上清,并用0.45μm的滤膜进行过滤。
上柱洗脱,此过程均在冰上进行:
使用1ml镍柱进行纯化。先用5倍柱体积的去离子水,pbs分别润洗柱子;然后将镍柱加入滤后上清液中,冰上孵育2~3h;将上清液反复上柱3次。样品与ni柱结合完全后,先用5倍柱体积的pbs洗涤柱子,然后依次用5倍柱体积的20mm咪唑溶液、40mm咪唑溶液、60mm咪唑溶液洗脱杂蛋白,最后用5倍柱体积的250mm咪唑溶液收集目的蛋白,得到约5ml左右的蛋白溶液。
4、目的蛋白割胶回收纯化
将收集得到的蛋白溶液按4:1的比例加入5×sds蛋白上样缓冲液,制样过程禁止高温煮沸。将所有样品加入蛋白胶孔中,在120v恒压条件下进行电泳60min。
电泳结束后,取出蛋白胶,用预冷至4℃,浓度为0.25m的kcl溶液对蛋白胶进行染色,染色时间5~10min。待蛋白条带清晰可见后,即可进行割胶。根据蛋白marker,用刀片截取在70kda大小处的乳白色蛋白条带,放至装有4℃去离子水的烧杯中,洗涤浸泡至无色。
5、电洗脱
将洗至无色的蛋白条带放入透析袋中,加入10mlpbs缓冲液,除去气泡,横放在水平电泳仪中,在4℃,100v恒压电泳40min,结束后调换电极,继续进行电泳2min。
6、透析
电泳结束后,将透析袋中的10ml蛋白溶液吸出装入新的透析袋中,将透析袋放入盛有200mlpbs的烧杯中,冰浴中透析1h后更换新鲜的透析液再透析1h。
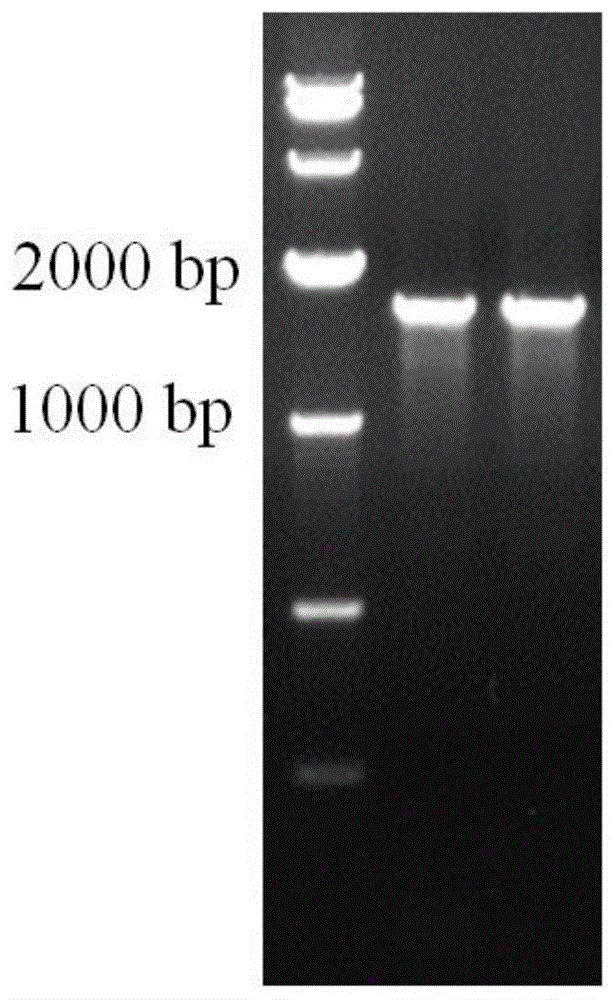
透析结束后,吸出透析袋中的10ml蛋白溶液,取80μl用于跑胶验证,蛋白电泳结果如图4所示,前三个泳道为未经割胶处理的蛋白样品,组后两道为经过割胶回收处理工艺后得到的纯化蛋白样品,表明此工艺方法能够很好的解决蛋白纯化过程中出现的降解等问题,极大的提高蛋白样品的纯度。余溶液分装至1.5ml离心管中并于-80℃冰箱进行保存。
7、酶活测定
(1)取上述纯化蛋白样品进行酶活检测,反应体系如表1所示:
表1cdpk1蛋白样品酶活检测反应体系
(2)配制100μl反应液,室温孵育15min。
(3)加入纯化蛋白样品,终浓度为10nm,快速混匀。
(4)在酶标仪上进行读数,波长340nm,读数间隔1min,总时长30min。
酶活测定结果见图5所示,结果表明此方法纯化蛋白激酶一类蛋白质,能够得到具有酶学活性的纯化蛋白,蛋白样品有用于进一步的功能性研究。
以上实施例通过本发明提供的蛋白纯化方法,解决了纯化过程中出现的条带不单一,蛋白不纯等问题。
实施例2
一种隐孢子虫钙依赖蛋白激酶9(cdpk9)蛋白的纯化方法,包括如下步骤:
1、cpcdpk9蛋白重组表达系统的构建
以隐孢子虫dna为模板,通过特异性引物(seqidno:4~5),通过pcr扩增得到cpcdpk9基因片段(seqidno:6),扩增产物电泳图如图6所示。
将扩增得到的cpcdpk9基因片段与pet-28a质粒,经ecori和xhoi双酶切,酶切产物经纯化后用t4连接酶进行连接,得到cpcdpk9重组质粒,然后经平板涂布、挑取单克隆、pcr测序验证后确定重组质粒正确性,命名为pet28a-cpcdpk9。
2、质粒转导与重组蛋白表达
将pet28a-cpcdpk9质粒转入表达菌株bl21中,经划线培养,挑取单克隆,pcr验证后(图7),进行菌种保存,命名为pet28a-cpcdpk9-bl21。
将成功转入重组质粒的表达菌株转接至培养基中进行放大培养:配置500ml的lb培养基,经高压灭菌冷却后加入终浓度为50μg/ml的卡那霉素,挑取pet28a-cpcdpk9-bl21单菌落进行过夜摇瓶培养,其后按1%接种量接入500ml新鲜的含卡那抗生素的lb培养基中,使菌体生长至对数生长期。
当菌体生长至od600在0.6~0.8之间时,加入终浓度为0.5mm的iptg进行诱导表达,诱导条件16℃,200rpm,诱导5h;诱导表达后的蛋白电泳结果如图8所示,前两个泳道分别为空载质粒对照及未诱导对照,最后一道为重组质粒,表明目的蛋白在130kda处有表达。
3、cpcdpk9蛋白的纯化
在4℃下离心收集pet28a-cpcdpk9-bl21菌体,8000rpm,15min,弃上清。用25mlpbs重悬菌体,超声裂解菌体至溶液澄清透明。超声工作时间约15min,过程在冰浴中进行。将裂解液在4℃,12000rpm,离心30min,弃上清,收集沉淀。
用40ml8m尿素溶解沉淀,并用超声助溶(超声时间8min),冰浴孵育2h后,4℃摇床孵育过夜。将溶解液在4℃,12000rpm,离心30min,收集上清,并用0.45μm的滤膜进行过滤。滤液经透析袋,用pbs透析后使用。
上柱洗脱,此过程均在冰上进行:
使用1ml镍柱进行纯化。先用5倍柱体积的去离子水,pbs分别润洗柱子;然后将镍柱加入滤后上清液中,冰上孵育2~3h;将上清液反复上柱3次。样品与ni柱结合完全后,先用5倍柱体积的pbs洗涤柱子,然后依次用5倍柱体积的20mm咪唑溶液、40mm咪唑溶液、60mm咪唑溶液洗脱杂蛋白,最后用5倍柱体积的250mm咪唑溶液收集目的蛋白,得到约5ml左右的蛋白溶液。
4、目的蛋白割胶回收纯化
将收集得到的蛋白溶液按4:1的比例加入5×sds蛋白上样缓冲液,制样过程禁止高温煮沸。将所有样品加入蛋白胶孔中,在120v恒压条件下进行电泳60min。
电泳结束后,取出蛋白胶,用预冷至4℃,浓度为0.25m的kcl溶液对蛋白胶进行染色,染色时间5~10min。待蛋白条带清晰可见后,即可进行割胶。根据蛋白marker,用刀片截取在70kda大小处的乳白色蛋白条带,放至装有4℃去离子水的烧杯中,洗涤浸泡至无色。
5、电洗脱
将洗至无色的蛋白条带放入透析袋中,加入10mlpbs缓冲液,除去气泡,横放在水平电泳仪中,在4℃,100v恒压电泳40min,结束后调换电极,继续进行电泳2min
6、透析
电泳结束后,将透析袋中的10ml蛋白溶液吸出装入新的透析袋中,将透析袋放入盛有200mlpbs的烧杯中,冰浴中透析1h后更换新鲜的透析液再透析1h。
透析结束后,吸出透析袋中的10ml蛋白溶液,取80μl用于跑胶验证蛋白电泳结果如图9所示,前四个泳道为未经割胶处理的蛋白样品,组后一道为经过割胶回收处理工艺后得到的纯化蛋白样品,表明此工艺方法能够很好的解决蛋白纯化过程中出现的片段化表达等问题;其余溶液分装至1.5ml离心管中并于-80℃冰箱进行保存。
序列表
<110>华东理工大学
华南农业大学
<120>一种隐孢子虫蛋白激酶的纯化方法
<130>yg18108756aa042
<141>2018-12-07
<160>6
<170>siposequencelisting1.0
<210>1
<211>30
<212>dna
<213>隐孢子虫(cryptosporidium)
<400>1
ccggaattcatgggaaatactgcagtaggg30
<210>2
<211>29
<212>dna
<213>隐孢子虫(cryptosporidium)
<400>2
ccgctcgagcctgacaaaattctgaagca29
<210>3
<211>1617
<212>dna
<213>隐孢子虫(cryptosporidium)
<400>3
atgggaaatactgcagtagggaatacaggaacaaggcttagagcaccagtagatgccgta60
gtaaacactactaataagaaagcacctgtaagtgaaaagccatctcaaccacaaatacca120
aacaaaacttctgatgttaaaaagggaggaactatgggaggagagagaggaagtgtaaca180
actggtatgtttgttcagagtggtagcgggacctttgcagaaaggtacaatattgtatgt240
atgcttggcaaaggttcttttggagaagttttgaaatgtaaagacagaatcactcaacaa300
gaatatgctgtcaaggttattaacaaagctagtgcaaagaacaaggatactagtacaatt360
ttgagagaagttgagcttttaaagaagcttgatcatccaaatattatgaagctattcgag420
attttggaagattcatctagcttctacattgtaggagagctttacacaggaggagaactc480
tttgatgaaattattaagagaaaaagatttagtgagcatgatgctgctagaattattaaa540
caagtattttcaggaattacttacatgcataaacataacattgtacatagagatttaaag600
ccagaaaacatacttttagagtctaaagaaaaagactgtgatattaaaattatagatttt660
ggattatcaacatgcttccagcaaaataccaagatgaaggatagaataggaacagcctac720
tatatagctccagaagttttgagaggtacttatgatgagaaatgtgatgtatggtcagct780
ggagtaattctatatattctcttatctggaacacctccattctatggaaaaaatgaatat840
gatattttgaagagagtcgagacaggaaagtatgcttttgaccttccacaatggagaact900
atttctgatgatgccaaggatttaataagaaagatgttaactttccatccttctttgaga960
attactgcaacacaatgtttagaacatccatggattcaaaaatattcaagtgagactcca1020
acaattagtgacttaccttcattagaatctgctatgacaaatattcgtcaattccaagca1080
gaaaagaaacttgctcaagcagctctactatatatggcaagtaaattgacaacattggac1140
gaaacaaagcaacttacagagatctttaggaagttagatactaataatgatggtatgtta1200
gatagagatgagctcgttcgtggttatcatgaatttatgagattgaaaggagtagattct1260
aattctttaattcagaatgaaggatcaacaatagaggatcaaattgatagcttaatgcca1320
ttgttagatatggatggatcgggttctatagaatattcagaatttattgcatctgcaata1380
gatagaacaattttgttgagtagagaaagaatggaaagagcttttaaaatgtttgataaa1440
gatggttctggtaagatttctacaaaggaactttttaaactcttttcccaggcagatagc1500
agtattcagatggaggagttggaatcaataattgaacaagttgacaacaataaggatggg1560
gaagtagactttaatgagtttgtagaaatgcttcagaattttgtcaggaatgaataa1617
<210>4
<211>25
<212>dna
<213>隐孢子虫(cryptosporidium)
<400>4
cgagctcaaaatgacagtagctacc25
<210>5
<211>23
<212>dna
<213>隐孢子虫(cryptosporidium)
<400>5
ccgctcgagatctagttggcttg23
<210>6
<211>3129
<212>dna
<213>隐孢子虫(cryptosporidium)
<400>6
aaaatgacagtagctacctcaagcaggaggaattcgaggagatctagcttatcttcagaa60
tctagcttgactagccatacatcctcaacaaagccaaaaaactcttatattcaaaagaat120
tcctcagtatcagggggtaatggcacatctcacaattgttatagccataaagggagatct180
ggaagtggttttggttccagttcttcgtatgaaaatagagcctatcttgtatcgggagga240
ggttcttgtattgggaataatactagtatgggtaatgctaatggaagtttattagcacca300
aatgttcaattggataatttaccctcagagagagtggggaatggttcccctaattgggca360
ctaagtgcagatgtttgcagcttaaaagattttaaggaactcatagaatgtaaaaatgag420
catgcagagtctgttttaagaaagtattctggtattaaaagtgtgaatggtgggagagga480
attagacaggttctagcttcaattgtacgtggatcgcgtacatcaaagaatcgaagttca540
tcagtagattcaggatcgtgtgggatggtatcctcttctacttcaacaacaacatcttct600
gcagcattggtttcaaatttgaatcgcaaaaatacaactggaggagatataaataatacg660
agaataaagattgaagatagcattgatggaaatggtactattattaatgataataatggt720
agcagcactagcaatagagaatgtaatatattaacaggacaacccattcaaaaagcaatt780
cttactcagagagatattatggaattaagaggaaaaatagataaagtattatcaacagaa840
gatagttttgtaagatcagcactacaatcttttcaacaatttgattttgatggagatgga900
aacttaacaattgaagaattattagatttattaacaacattaggagaacatttggcatta960
cctccaataaatagaaaagttgttgcaaatgaaataagtatacgtttgaattcaaagtta1020
acagttgatagtagtgcatcagagagcaaaatgttgataagttttccattctttctcaag1080
tattacttaagtgtattaacaacaattagacaaaaacatttcagttctgtgaaaattaat1140
ggagaattacaacagaataaagcaatacgtaagcatttagtacatgaagatgatattaat1200
gatttatatacatttcattatcagttaggaacaggaacttatggagaagtatttcttgta1260
actgaaaattatacaagacaaagaagagtgtgtaaaattgtggataaagtcaaatgtcgt1320
aggaaattggatgaaattgatcacgaggttgaaattttaaagcaattagatcatcctggc1380
cttgtacatatttacgaagtttacgaggatagactaaatttatattttatattggaattt1440
tgtgctggagggaatttatttcactctctacaagatgcaattcaatcaggatttcgattt1500
tctgaatttcatgtttcacgaataattcaacaaatactcttggcaatacgttatttgcac1560
ttgaagagggtagtacacaagaatttgaagcctcagaatatactcttaactaactctttc1620
gggagtggaaatacctcagttaagctcgttgattttggacttgctgaaattttttcatca1680
gatgaaataaatcttccagaactaactacttcaaatgtttctccttcacatttccattca1740
ccattaaaatccttacctctctcatcttcctcatcatcctcctatataacccaagatcat1800
atcaaaacccataatcaagctcaacctcaagcacagattcaaggacatacacataatacc1860
tccttatcttctatttccaaccaaaatcgtgcatctgaagaagggtatttgtttgctagt1920
gtggacgaagtcaccggcattcataagtccaactcaagccataattcaagtccaagttca1980
aactctagcttagctcaaaatcttcaccaagaagaatccttagcttcatatccaaagtac2040
ttggatttcacagccccagagttactcaaaggagaaactttctcctatagtcttgacgtg2100
tggtctgttggagttatcatgtattctgtcattactggacgccacccatttagtggcagg2160
tcacgagctgaaactaggcataatatctgcttcggaattcccgccatttctgaaattaca2220
tgcgtttcaaatgcatgcaagtcattattaggaaagttacttgagaaaaatccaagagaa2280
agaataacagtggatgaagctttaagccatgattggttttctatttcgcattccagttac2340
tgcgaagttgatatagggatgcctcttttagcccacttgaaagtttatacaagacagtca2400
gacttgagacatatattaattcatatgttatcccatcaattagcactagatacaactcaa2460
attaatatggcaaccagtgtttttaaatctcttgataccgataatgatggagtattatca2520
atttcagagttaggatctggcttacaaaaattaggtatttcatccagagaatcgtctatg2580
attattaaagctatggatattgatggtaatggaattatatcatatagtgaatttatcaca2640
gcttgtcatatttggagacgaaatgaaattagacagttaaaatctttctttatgaaaatt2700
gatcgaaataatcagggaaaaattactagagaagaatttaaacagttgcttaaggcacaa2760
aaatctaaattgctctcaaatattaccaaaagcttttcttctactaatgatgtcaattac2820
agaacaattcttccttcatctaatcaaggtgtatatactgaatgggattctgttctagat2880
gaaattgatactaatagagatggtcttatcgactggaaagaattctgtacttttattgtc2940
gattactttaatacttctagggaatctttgagggcatgttacaacaattcatctatatct3000
aatatttcttctactttttctattgatcctccatccgttgcagggctctcaaggagaaga3060
gattctggtatttgccccgttcaagaagctaaccagcaccctccccctcatccaagccaa3120
ctagattaa3129
- 还没有人留言评论。精彩留言会获得点赞!