一种病毒类疫苗种子的深度测序方法与流程
本发明属于生物技术领域,具体涉及一种病毒类疫苗种子的深度测序方法。
背景技术:
疫苗生产中,疫苗种子的基因序列信息和疫苗的传代稳定性是保证疫苗质量的关键指标。
使用深度测序方法检测疫苗种子或传代产物的基因序列信息时,现有的病毒类疫苗种子深度测序方法是采用聚合酶链式反应(pcr)方法扩增目标病毒,使用扩增产物建库测序,而pcr过程本身可造成结果偏差,影响实验结果。或采用不经扩增直接测序的方法,但直接测序所需的测序数据量极大,病毒基因的测序绝对数量少,测序成本极高。
技术实现要素:
为了解决现有技术存在的问题,本发明提供了一种病毒类疫苗种子的深度测序方法,具有样品需求量少,测序总成本低,测序平均深度较深的特点。
本发明的目的是提供一种病毒类疫苗种子的深度测序方法。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,所述方法包括以下步骤:
(1)将待测序样本进行离心,保留上清液;
(2)采用滤膜对步骤(1)得到的所述上清液进行过滤,形成滤过液;
(3)将步骤(2)得到的所述滤过液进行超速离心,除去上清液,保留沉淀;
(4)向步骤(3)得到的所述沉淀中加入纯水或缓冲液,使所述沉淀悬起,再加入酶,混合均匀并反应,形成处理后的样本;
(5)采用酚氯仿抽提法提取步骤(4)得到的所述处理后的样本中的核酸,然后建库,测序。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,其中,步骤(1)中,所述离心的转速为4000-15000转/分钟,所述离心的时间为5-90分钟。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,其中,步骤(2)中,所述滤膜的孔径为0.22-0.45μm。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,其中,步骤(3)中,所述超速离心的转速为20000-800000×g,所述超速离心的时间为2-8小时。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,其中,步骤(4)中,所述酶为dna酶和rna酶。所述dna酶的添加量为20-200u/ml,所述rna酶的添加量为1500-3000u/ml。
优选的,先加入dna酶酶解半小时,再加入rna酶酶解半小时。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,其中,步骤(5)中,采用酚氯仿抽提法提取所述处理后的样本中的核酸前,先用trizol对所述处理后的样本进行处理。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,进一步的,步骤(5)中,向所述处理后的样本中加入trizol,混匀后室温放置4-6min,加入氯仿,混匀后室温放置2-4min,然后离心;将上层无色水相转移至另外的离心管中(此步绝对不能吸入中间白膜层),加入异丙醇,室温放置8-12min,然后再次离心8-12min,弃去上清,得到rna胶样沉淀;用乙醇洗涤所述rna胶样沉淀,离心后去掉上清保留沉淀,室温放置10-15min,干燥,加入depc水溶解rna沉淀即可。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,更进一步的,向所述处理后的样本中加入2-4倍体积的trizol,剧烈震荡15s,并在室温放置5min,每0.75ml所述处理后的样本中加入0.2ml氯仿,剧烈振荡15s,室温放置3min,然后在4℃下12000×g离心15min使样品分为3层:上层为无色水相,下层为粉红色有机相,中间为白膜层。
优选的,加入向所述处理后的样本中加入3倍体积的trizol。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,更进一步的,所述trizol的添加量与所述处理后的样本的体积比为3:1。
根据本发明的具体实施方式的病毒类疫苗种子的深度测序方法,进一步的,将上层无色水相转移至depc处理过的1.5mlep管中,每0.75ml所述处理后的样本中加入0.5ml异丙醇,室温放置10min,而后在4℃下,12000×g离心10min,弃去上清,用75%乙醇洗涤rna胶样沉淀,在4℃下,7500×g离心5min,室温放置10-15min干燥,加入适量depc水溶解rna沉淀后-80℃保存。
与现有技术相比,本发明具有如下有益效果:
(1)本发明的病毒类疫苗种子的深度测序方法应用于疫苗生产中病毒类疫苗种子的序列测定,在建库步骤之前采用新的样品处理方法,结合了离心、过滤、超速离心和酶消化等步骤,经处理的样品不经pcr反应即可建库并深度测序,同时保证测序得到的总数据中,疫苗种子的基因比例较高(不少于90%),分析后的数据中疫苗种子的测序平均深度较深(不少于40000×);
(2)本发明具有样品需求量少,测序总成本低,数据中有效数据比例高,测序平均深度大、覆盖度高,测序结果无特异性引物干扰,偏倚小的特点。
附图说明
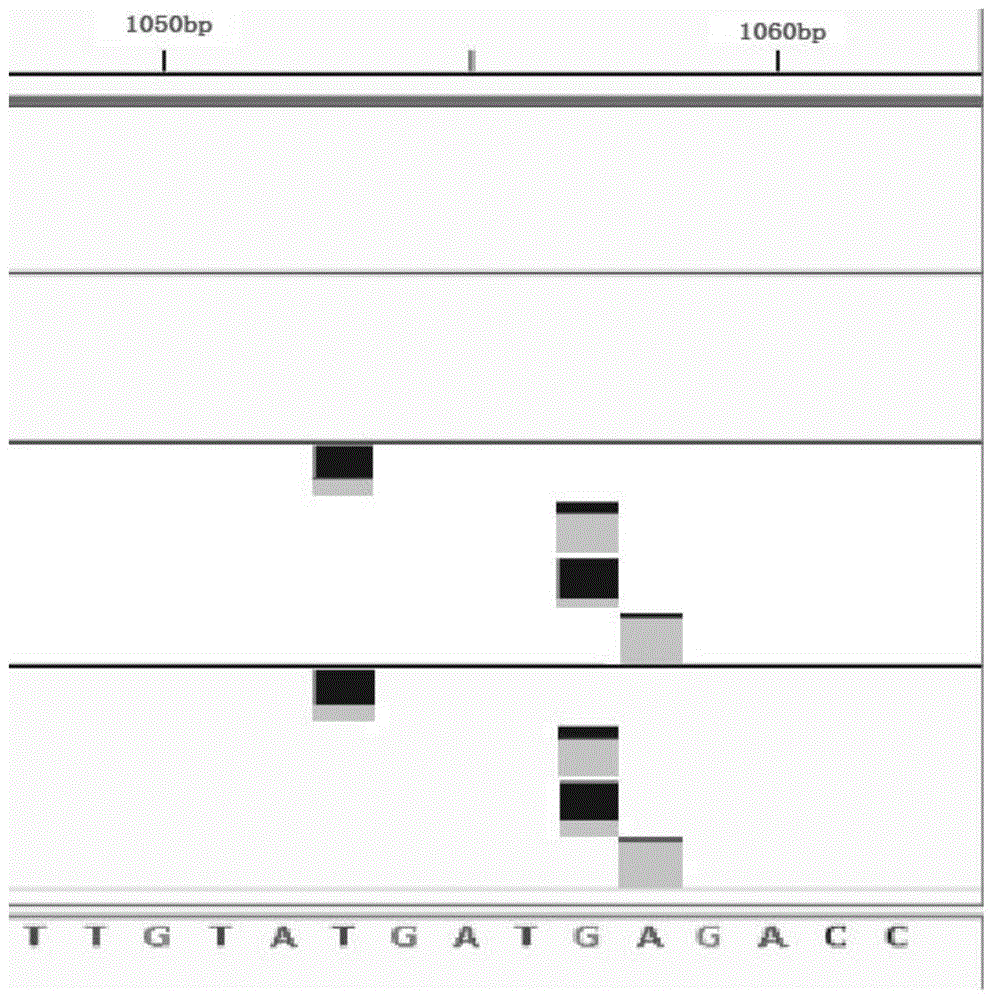
图1显示本发明的深度测序方法与pcr产物测序方法对轮状病毒llr进行测序,在引物结合区是否存在突变;
图2为显示本发明的深度测序方法与pcr产物测序方法对脊髓灰质炎病毒sabin3型进行测序,变异程度分析。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1
本实施例提供了一种病毒类疫苗种子的深度测序方法,所述方法包括以下步骤:
(1)将待测序样本进行离心,保留上清液;
(2)采用滤膜对步骤(1)得到的所述上清液进行过滤,形成滤过液;
(3)将步骤(2)得到的所述滤过液进行超速离心,除去上清液,保留沉淀;
(4)向步骤(3)得到的所述沉淀中加入pbs缓冲液,使所述沉淀悬起,再加入酶,混合均匀并反应,形成处理后的样本;
(5)采用酚氯仿抽提法提取步骤(4)得到的所述处理后的样本中的核酸,然后建库,测序。
实施例2
本实施例提供了一种病毒类疫苗种子的深度测序方法,所述方法包括以下步骤:
(1)将待测序样本进行4000转/分钟离心5分钟,保留上清液;
(2)采用孔径为0.45μm的滤膜对步骤(1)得到的所述上清液进行过滤,形成滤过液;
(3)将步骤(2)得到的所述滤过液进行20000×g超速离心8小时,除去上清液,保留沉淀;
(4)向步骤(3)得到的所述沉淀中加入纯水,使所述沉淀悬起,再加入80u/ml的dna酶进行酶解,然后添加2000u/ml的rna酶进行酶解,形成处理后的样本;
(5)向步骤(4)得到的所述处理后的样本中加入2-4倍体积的trizol,剧烈震荡15s,混匀后室温放置5min,每0.75ml所述处理后的样本中加入0.2ml氯仿,剧烈振荡15s,混匀后室温放置3min,然后4℃12000×g离心15min使样品分为3层:上层为无色水相,下层为粉红色有机相,中间为白膜层;将上层无色水相转移至另一depc处理过的1.5mlep管中,每0.75ml所述处理后的样本中加入0.5ml异丙醇,室温放置10min,然后在4℃下,12000×g离心10min,弃去上清,得到rna胶样沉淀;用75%的乙醇洗涤所述rna胶样沉淀,在4℃下,7500×g离心5min,室温放置13min,干燥,加入适量depc水溶解rna沉淀后-80℃保存,然后建库,测序即可。
实施例3
本实施例提供了一种病毒类疫苗种子的深度测序方法,所述方法包括以下步骤:
(1)将待测序样本进行15000转/分钟离心90分钟,保留上清液;
(2)采用孔径为0.22μm的滤膜对步骤(1)得到的所述上清液进行过滤,形成滤过液;
(3)将步骤(2)得到的所述滤过液进行800000×g超速离心2小时,除去上清液,保留沉淀;
(4)向步骤(3)得到的所述沉淀中加入纯水,使所述沉淀悬起,再加入80u/ml的dna酶进行酶解,然后添加2000u/ml的rna酶进行酶解,形成处理后的样本;
(5)向步骤(4)得到的所述处理后的样本中加入2倍体积的trizol,剧烈震荡15s,混匀后室温放置6min,每0.75ml所述处理后的样本中加入0.2ml氯仿,剧烈振荡15s,混匀后室温放置4min,然后4℃12000×g离心15min使样品分为3层:上层为无色水相,下层为粉红色有机相,中间为白膜层;将上层无色水相转移至另一depc处理过的1.5mlep管中,每0.75ml所述处理后的样本中加入0.5ml异丙醇,室温放置8min,然后在4℃下,12000×g离心8min,弃去上清,得到rna胶样沉淀;用75%的乙醇洗涤所述rna胶样沉淀,在4℃下,7500×g离心5min,室温放置10min,干燥,加入适量depc水溶解rna沉淀后-80℃保存,然后建库,测序即可。
实施例4
本实施例提供了一种病毒类疫苗种子的深度测序方法,所述方法包括以下步骤:
(1)将待测序样本进行10000转/分钟离心30分钟,保留上清液;
(2)采用孔径为0.22μm的滤膜对步骤(1)得到的所述上清液进行过滤,形成滤过液;
(3)将步骤(2)得到的所述滤过液进行150000×g超速离心6小时,除去上清液,保留沉淀;
(4)向步骤(3)得到的所述沉淀中加入纯水,使所述沉淀悬起,再加入80u/ml的dna酶进行酶解,然后添加2000u/ml的rna酶进行酶解,形成处理后的样本;
(5)向步骤(4)得到的所述处理后的样本中加入4倍体积的trizol,剧烈震荡15s,混匀后室温放置4min,每0.75ml所述处理后的样本中加入0.2ml氯仿,剧烈振荡15s,混匀后室温放置2min,然后4℃12000×g离心15min使样品分为3层:上层为无色水相,下层为粉红色有机相,中间为白膜层;将上层无色水相转移至另一depc处理过的1.5mlep管中,每0.75ml所述处理后的样本中加入0.5ml异丙醇,室温放置12min,然后在4℃下,12000×g离心12min,弃去上清,得到rna胶样沉淀;用75%的乙醇洗涤所述rna胶样沉淀,,在4℃下,7500×g离心5min,室温放置15min,干燥,加入适量depc水溶解rna沉淀后-80℃保存,然后建库,测序即可。
发明人采用本发明实施例4的方法对sabin1型脊髓灰质炎病毒疫苗进行测序,结果如表1。
表1脊髓灰质炎sabin1型病毒测序深度和覆盖度
在表1的测序结果中可见,采用本发明实施例4的方法得到的有效数据比例高达99%以上,测序平均深度大于40000;而同类研究只有0.33%左右,本发明方法是同类研究的约300倍。种子基因比例较高。而且采用本发明实施例4的方法对sabin1型脊髓灰质炎病毒疫苗进行测序,样品需求量仅需8ml,测序总数据量仅需2gb,说明本发明所采用的深度测序方法的样品需求量少,测序总成本低。
发明人采用本发明实施例3的方法对轮状病毒llr进行测序,在引物结合区存在突变结果如图1,然后和pcr产物测序比较,引物引起的位点变化,结果如表2。
表2llr无偏倚测序和pcr产物测序比较-引物引起的位点变化
由表2中可见,采用pcr产物测序方法,在引物结合区存在突变结果,因特异性引物干扰,突变频率大于1%的位点数有60个,大于90%的个数有12个,而本发明的深度测序方法无特异性引物干扰。
图1下面的几处标记为pcr方法在引物结合区的突变,说明pcr方法在引物结合区存在突变结果,图1上面的空白处为本发明的深度测序方法,说明本发明的深度测序方法不存在突变结果,证明本发明的深度测序方法无特异性引物干扰的特点。
发明人采用pcr产物测序方法和本发明的实施例2的深度测序方法对脊髓灰质炎病毒sabin3型进行测序,对毒力相关位点472nt进行分析,比较pcr方法和本发明的深度测序的重复中的变异程度,计算其变异系数,结果见图2和表3。
表3脊髓灰质炎病毒sabin3型的测序结果
由图2和表3可见,通过对pcr方法(图2中的左三条)和本发明深度测序方法(图2中的右三条)的重复中的变异程度,计算其变异系数,可见pcr方法的变异程度更大,表示扩增偏倚更大。
以上说明,(1)本发明的病毒类疫苗种子的深度测序方法应用于疫苗生产中病毒类疫苗种子的序列测定,在建库步骤之前采用新的样品处理方法,结合了离心、过滤、超速离心和酶消化等步骤,经处理的样品不经pcr反应即可建库并深度测序,同时保证测序得到的总数据中,疫苗种子的基因比例较高(不少于90%),分析后的数据中疫苗种子的测序平均深度较深(不少于40000×);
(2)本发明具有样品需求量少,测序总成本低,数据中有效数据比例高,测序平均深度大的特点。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!