使用嗜盐微生物从高盐环境中降解苯胺的制作方法
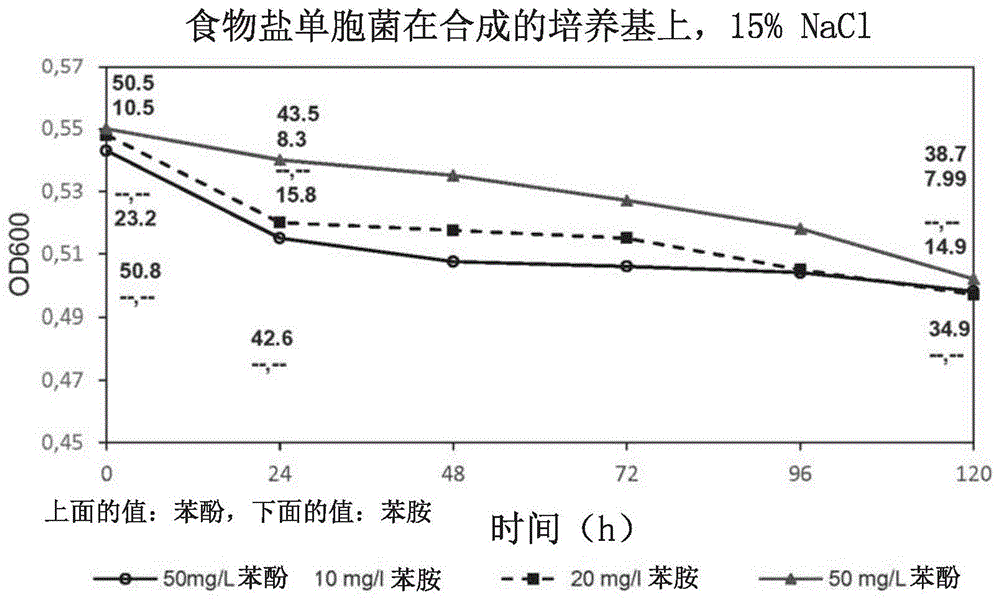
苯胺是主要的工业化学中间体,用于制造除草剂、显影剂、香料、医药、橡胶和染料。由于其在工业中的广泛使用,越来越多的苯胺被释放到土壤和水体中,对活有机体造成环境威胁和健康风险。若干物理和化学方法,例如吸附,臭氧化和电化学处理,被用于处理含苯胺的含盐残余物流。大多数提到的处理不能将含盐残余物流中的总有机碳含量降低到所需的最高水平。由于其成本效益和环境效益,开发可行的替代的生物方法的兴趣日益增加。高盐溶液是氯碱工艺的重要材料,氯碱工艺是电解nacl的工业过程。它是用于生产氯和氢氧化钠的技术。然而,需要非常纯的高盐溶液。因此,很难将回收的高盐废水用于氯碱工艺。例如,来自亚甲基二胺制备的高盐废水含有苯胺,其应在废水经受氯碱工艺之前除去。这同样适用于可在许多工业废水中发现的甲酸盐。例如,来自亚甲基二胺制备的高盐废水含有约300-500mg/l的甲酸盐,其必须除去,否则氯将被co2污染。先前报道了使用各种的假单胞菌属(pseudomonas)、丛毛平胞菌属(comamonas)、不动杆菌属(acinetobacter)、红球菌属(rhodococcus)、弗拉托菌属(frateuria)、莫拉菌属(moraxella)、代尔夫特菌属(delftia)、诺卡尔菌属(nocardia)和迪茨氏菌属(dietzia)的细菌种类对苯胺的生物降解。这些细菌在中等条件下生物降解苯胺(见下文)。此外,甲酸盐可被某些微生物细胞降解,例如,被酶如甲酸脱氢酶降解。然而,含有苯胺和/或甲酸盐的残余物流经常具有升高的盐度,并且高盐残余物流的处理代表了一个挑战,因为高盐浓度破坏了正常生物处理系统中存在的细菌代谢。此外,对高盐残留物流使用正常细菌需要事先稀释,以便用淡水(如果有的话)降低盐度。wo2013/124375公开了通过某些嗜盐微生物和/或卤代嗜碱性微生物降低总有机碳。woolard和irvine(1995)公开了在序批式反应器中处理高盐废水(woolard和irvine.treatmentofhypersalinewastewaterinthesequencingbatchreactor(在序批式反应器中处理高盐废水).waterresearch29.4(1995):1159-1168)。azachi等人(1995)公开了从在甲醛贮存地点收集的土壤中分离出耐盐性革兰氏阴性真细菌(azachi,m,等人.transformationofformaldehydebyahalomonassp.(通过嗜盐菌属转化甲醛)canadianjournalofmicrobiology41.6(1995):548-553)。schnell等人(1989)报道了使用desulfobacteriumd.anilini将苯胺厌氧降解为co2和nh3(schnell,s,等人(1989).anaerobicdegradationofanilineanddihydroxybenzenesbynewlyisolatedsulfate-reducingbacteriaanddescriptionofdesulfobacteriumaniline.archivesofmicrobiology,152(6),556-563)。guaxiazhang等人(2011)公开了从活性淤泥中分离出在2%nacl存在下能够降解苯胺的污泥根瘤菌属种(rhizobiumborborisp.)(zhang,gx,等人,rhizobiumborborisp.nov.,aniline-degradingbacteriaisolatedfromactivatedsludge.internationaljournalofsystematicandevolutionarymicrobiology61.4(2011):816-822)。junminli等人(2009)报道了耐受最高达6%nacl和3g/l苯胺的略微嗜盐的欧文氏菌属菌株hsa6。使用欧文氏菌属菌株hsa6在24小时后降解了浓度为0.5%的苯胺(li,j,等人,isolationandcharacterizationofanilinedegradationslightlyhalophilicbacterium,erwiniasp.strainhsa6.microbiologicalresearch165.5(2010):418-426)。jin等人(2012)公开了在碱性环境ph8.0和最高达6%的nacl中通过碱湖迪茨氏菌jq-an(dietzianatronolimnaeajq-an)生物降解苯胺。在乙酸盐存在下培养120小时后,87%的300mg/l苯胺被降解(jin,q,等人,biodegradationofanilineinanalkalineenvironmentbyanovelstrainofthehalophilicbacterium,dietzianatronolimnaeajq-an.bioresourcetechnology117(2012):148-154)。刘等人(2002)报道通过delfina属种an3在7天内降解最高达5000mg/l的苯胺(liu,z,等人,degradationofanilinebynewlyisolated,extremelyaniline-tolerantdelftiasp.an3.appliedmicrobiologyandbiotechnology58.5(2002):679-682)。f.j.o'neill等人(2000)表明细菌聚生体能够在0.2和4%nacl浓度及5至7的ph值下进行苯胺的好氧、发酵降解(260mg/l)(o’neill,fj,etal.bacterialgrowthonaniline:implicationsforthebiotreatmentofindustrialwastewater.waterresearch34.18(2000):4397-4409)。ahmed等人(2010)公开了金黄色葡萄球菌st1(staphylococcusaureusst1)具有最高达2000ppm苯胺的耐受性。优选的生长条件包括700ppm苯胺和葡萄糖的存在(ahmed,s,等人,isolationandcharacterizationofabacterialstrainforanilinedegradation.africanjournalofbiotechnology(2010)9.8)。oren等人(1992)表明硝基酚转化为氨基酚可通过haloanaerobiumpraevalens和sporohalobactermarismortui进行。在厌氧条件下观察到25ppm苯胺的降解(oren,a,等人,microbialdegradationofpollutantsathighsaltconcentrations.biodegradation3.2-3(1992):387-398)。campo等人(2011)涉及被芳族化合物污染的土壤中的活性淤泥。观察到最高达5mg/l苯胺的胺例如苯胺和mda的好氧生物降解(campo,p等人,aerobicbiodegradationofaminesinindustrialsalinewastewaters(工业盐水废水中的好氧生物降解胺).chemosphere85.7(2011):1199-1203)。艾默生等人(1994)报道了从被油卤水污染的土壤分离粉红色-色素沉着的嗜盐古菌菌,极嗜盐菌属d1227(haloferaxsp.d1227)。极嗜盐菌属d1227显示能够使用芳族底物作为生长的唯一碳源和能源(emerson,d,等人,haloferaxsp.d1227,ahalophilicarchaeoncapableofgrowthonaromaticcompounds(极嗜盐菌属d1227,一种能够在芳族化合物上生长的嗜盐古细菌).archivesofmicrobiology(微生物学档案)161.6(1994):445-452)。庄等人(2007)报道了通过在最小盐培养基(msm)上的选择性富集培养来分离降解苯胺的红球菌属菌株an5。通过红球菌属菌株an5生物降解苯胺的最佳条件是30℃和ph7.0(zhuang,r,等人isolationandcharacterizationofaniline-degradingrhodococcussp.strainan5(降解苯胺的红球菌属菌株an5的分离和表征)journalofenvironmentalscienceandhealthparta42.13(2007):2009-2016)。zhuang的综述(2010)总结了在含盐废水和土壤中通过嗜盐微生物去污的进展(zhuang,x,等人progressindecontaminationbyhalophilicmicroorganismsinsalinewastewaterandsoil(通过嗜盐微生物在含盐的废水和土壤中去污的进展).environmentalpollution(环境污染)158.5(2010):1119-1126)。关于有机污染物的去污的进一步综述由leborgne(leborgne等人,biodegradationoforganicpollutantsbyhalophilicbacteriaandarchaea(通过嗜盐细菌和古细菌生物降解有机污染物).journalofmolecularmicrobiologyandbiotechnology(分子微生物学和生物技术杂志)15.2-3(2008):74-92)公布。wyndham(1986)公开了乙酸钙不动杆菌(acinetobactercalcoaceticus)能够在大于16mm的苯胺浓度下生长(wyndham,rc,evolvedanilinecatabolisminacinetobactercalcoaceticusduringcontinuouscultureofriverwater(河水的连续培养期间乙酸钙不动杆菌中演化的苯胺分解代谢).appliedandenvironmentalmicrobiology(应用与环境微生物)51.4(1986):781-789)。fu和oriel(1998)报道了从极度嗜盐性极嗜盐菌属d1227(极嗜盐菌属d1227)中纯化龙胆酸1,2-双加氧酶。极嗜盐菌属d1227是第一种证明使用芳香族化合物作为生长的唯一碳源和能源的嗜盐古生菌(archeon)。对于龙胆酸1,2-双加氧酶的活性,最佳盐浓度、温度和ph分别为2mkcl或nacl、45℃和ph7.2(fu、w和oriel,p.gentisate1,2-dioxygenasefromhaloferaxsp.d1227.extremophiles(极端微生物)2.4(1998):439-446)。fu和oriel(1999)进一步报道了通过极嗜盐菌属d1227降解3-苯基丙酸(fu、w和oriel,p.degradationof3-phenylpropionicacidbyhaloferaxsp.d1227(通过极嗜盐菌属d1227降解3-苯基丙酸).extremophiles(极端微生物)3.1(1999):45-53)。fathepure(2014)简要综述了近期在高盐环境中微生物降解石油烃的研究。作者报道,halomonasalcanivorax属种、海杆菌属(marinobacter)、嗜盐古细菌属(haloarcula)和嗜盐杆菌属(halobacterium)的成员在已发表的文献中占主导地位。然而,尽管研究报道了多环芳烃(pah)通过种类不同的菌株降解,但对于高盐度环境中多环芳烃(pah)的命运知之甚少(fathepure,b.z.recentstudiesinmicrobialdegradationofpetroleumhydrocarbonsinhypersalineenvironments(高盐环境中石油烃的微生物降解的近期研究).theproceedingsfromhalophiles2013,theinternationalcongressonhalophilicmicroorganisms(嗜盐微生物国际会议).第5卷,第12期,frontiersmediasa,2015)。尽管有许多关于芳族化合物的微生物降解的报道,但在高盐浓度下苯胺的降解仍然是有限的。因此,当盐胁迫叠加污染胁迫时,在高盐浓度存在下降解或转化苯胺的微生物是非常重要的。特别地,非常需要用于降低高盐废水中苯胺含量的手段和方法。可将本发明所基于的技术问题视为提供符合前述需求的方法。所述技术问题通过权利要求和下文中表征的实施方案解决。有利地,在本发明的研究中发现,两种嗜盐微生物物种极嗜盐菌属d1227(atcc51408)和食物盐单胞菌(halomonasalimentaria)(dsm15356)在高盐度条件下有效降解苯胺。此外,示出了食物盐单胞菌(dsm15356)有效降解甲酸盐。先前报道了极嗜盐菌属d1227(极嗜盐菌属d1227)和食物盐单胞菌在某些芳族化合物上生长,然而,对于给定菌株,先前未报道关于苯胺(或甲酸盐)降解的研究。这些细胞从其高盐环境中活跃地降解苯胺。本发明的这些发现可应用于天然的和工业的残余物流。因此,本发明涉及一种降低包含高盐废水的组合物的苯胺含量的方法,所述方法包括以下步骤:(a)提供包含高盐废水和苯胺的组合物a,和(b)使组合物a与至少一种嗜盐微生物菌株的细胞接触,从而产生包含所述组合物a和所述至少一种嗜盐微生物菌株的细胞的组合物b。根据本发明方法的步骤(a),应提供包含高盐废水的组合物a。所述组合物a为包含所述高盐废水和苯胺的溶液。高盐废水优选是包含苯胺的工业废水,特别是包含苯胺的盐水。根据本发明方法的步骤(b),使组合物a与至少一种嗜盐微生物菌株的细胞接触。由此,产生包含组合物a(以及由此高盐废水和苯胺)和至少一种嗜盐微生物菌株(即该菌株的细胞)的组合物b。在本发明方法的一个实施方案中,通过将组合物a与细胞混合,使组合物a与细胞接触。根据本发明的方法,设想在步骤(b)中使组合物a与细胞接触不会使所得组合物b的体积显著增加(与组合物a的体积相比)。因此,组合物b的主要组分应为组合物a。因此,步骤(b)不会显著稀释组合物a。稀释因子优选低于1.2,更优选低于1.1,最优选低于1.05。此外,设想稀释因子低于1.03或1.02。本文使用的术语“稀释因子”优选是指组合物b的体积与组合物a的体积之比。换言之,组合物b包含基于组合物b的总体积计至少80重量%、更优选至少90重量%且最优选至少95重量%的组合物a(特别是由基于组合物b的总体积计至少80重量%、更优选至少90重量%且最优选至少95重量%的组合物a组成)。此外,设想组合物b包含基于组合物b的总体积计至少97重量%或98重量%的组合物a(特别是由基于组合物b的总体积计至少97重量%或98重量%的组合物a组成)。由于稀释因子可忽略不计,设想组合物a包含与组合物b相同或基本相同含量的苯胺和nacl(并且如果存在,相同或基本相同含量的甲酸盐)。高盐废水以及由此组合物a和组合物b应包含高浓度的nacl。本文提及的高浓度的nacl为基于废水或组合物的总体积计至少2%(w/v)的浓度。废水、组合物a或b可包含浓度高达nacl的饱和浓度的nacl,因为在本发明的研究中已经示出,即使在20.0%(w/v)的nacl浓度下,苯胺含量也降低。因此,浓度的上限原则上是nacl的饱和浓度。优选地,高浓度的nacl为基于组合物或废水(例如组合物b)的总体积计至少4%(w/v)、更优选至少6%(w/v)、甚至更优选至少8%(w/v)且最优选至少10%(w/v)的浓度的nacl。在另一个优选的实施方案中,高浓度的nacl为基于组合物或废水的总体积计至少12.5%(w/v)、特别是至少14%(w/v)的浓度。尽管高浓度nacl的上限原则上是nacl的饱和浓度,但是设想废水、组合物a或b包含浓度小于饱和浓度的nacl。优选地,废水、组合物a或组合物b中的nacl浓度小于23%(w/v)、更优选小于22%(w/v)、甚至更优选小于20%且最优选小于18%(w/v)nacl,还是基于组合物或废水的总体积计。因此,例如,nacl的浓度可为至少14%(w/v),特别是至少16%,但小于22%(w/v),特别是小于20%(w/v),基于(废水、组合物a或组合物b)的总体积计。在本发明的一个实施方案中,废水或组合物a或b包含浓度大于6%(w/v)的nacl,基于废水、组合物a或组合物b的总体积计。在各种工业废水中可以发现高浓度的nacl。在一个优选的实施方案中,高盐废水来自亚甲基二胺制备,以聚氨酯的预产物的形式。因此,本发明方法的步骤a)可包括从亚甲基二胺制备中分离高盐废水。高盐废水可能已经受先前的步骤。在一个实施方案中,已经用活性炭使高盐废水经受了纯化步骤,从而降低了toc含量。此外,废水可能已被过滤。此外,设想在进行本发明方法的步骤a)之前浓缩废水中的nacl浓度。用于浓缩含nacl的组合物的优选方法在本文其他地方描述。有利地,已经在本发明的上下文中示出,其中分析的微生物菌株能够降低高盐盐水的苯胺含量。因此,设想组合物a(和组合物b)包含苯胺。替代地或另外,组合物a(和组合物b)应包含甲酸盐,如所示的,菌株食物盐单胞菌(h.alimenteria)也能够降低高盐废水的甲酸盐含量。因此,组合物a(和组合物b)可包含苯胺和/或甲酸盐,特别是苯胺和甲酸盐。优选地,组合物a和/或组合物b包含的苯胺的量为至少0.5mg/l、更优选至少2mg/l且最优选至少5mg/l。此外,设想组合物a(或b)包含的苯胺的量为至少10mg/l、更优选至少20ml/l。更优选地,组合物a和/或组合物b包含的苯胺的量为大于2mg/l但小于200mg/l。甚至更优选地,组合物a(或b)包含的苯胺的量为2mg/l但不超过100mg/l。最优选地,组合物a(或b)包含的苯胺的量为至少5mg/l但不超过80mg/l。此外,设想组合物a和/或组合物b包含0.5至12mg/l苯胺。如上所述,与本发明有关的所述组合物可包含甲酸盐,例如如果使用菌株食物盐单胞菌的话。在这种情况下,组合物a和/或b优选包含的甲酸盐的量为大于25mg/l、特别是大于50mg/l。更优选地,组合物a(和/或b)包含的甲酸盐的量为大于50mg/l但小于2000mg/l。甚至更优选地,组合物a(和/或b)包含的甲酸盐的量为大于100mg/l但小于1000mg/l。最优选地,组合物a(和/或b)包含的甲酸盐的量为大于100mg/l但小于500mg/l。高盐废水以及由此组合物a和组合物b可包含另外的有机化合物,例如酚盐和/或mda(4,4'-亚甲基二苯胺)。在一个实施方案中,组合物a(或组合物b)包含0.1mg/l至10mg/lmda,特别是1至5mg/lmda,和/或2至100mg/l酚盐,特别是5至20mg/l酚盐。优选地,组合物a的总有机碳(“toc”)含量大于50mg/l,更优选大于60mg/l,甚至更优选大于60mg/l,且最优选大于65mg/l。此外,设想组合物a的toc(总有机碳)含量大于70mg/l,特别是大于70mg/l。优选地,组合物a可具有最高达1000mg/l和更高的总有机碳(“toc”)含量。根据本发明,应降低高盐度废水中的苯胺含量及任选地甲酸盐含量,以及由此分别降低组合物a和组合物b中的苯胺含量及任选地甲酸盐含量。本文所用的术语“降低”应指高盐度废水(或组合物a或b)中的苯胺含量(和任选地甲酸盐含量)的显著降低。优选地,该术语表示苯胺和/或甲酸盐含量(和任选地甲酸盐含量)降低了以下程度:分别在高盐废水、组合物a或组合物b中存在的苯胺总含量的至少30%、至少50%、至少70%或特别是至少90%或至少95%。优选地,在已经实施本发明的方法后,经处理的废水包含小于5mg/l、更优选小于2mg/l且最优选小于0.5mg/l的苯胺。还优选地,在已经实施本发明的方法后(特别地,如果已使用食物盐单胞菌),经处理的废水包含的甲酸盐的量为小于15mg/l,更优选小于10mg/l,最优选小于5mg/l。此外,设想完全消除苯胺含量(和任选地甲酸盐含量)。通过实施本发明的方法,toc含量也将降低(即除了苯胺含量和任选地甲酸盐含量之外)。优选地,经处理的废水的toc含量小于40mg/l,更优选小于30mg/l,最优选小于20mg/l(特别是在如本文其他地方所述的细胞分离后)。优选地,苯胺含量通过本文中结合本发明提及的至少一种嗜盐微生物菌株的细胞的存在并因此通过其活性而降低。甲酸盐含量优选通过食物盐单胞菌的存在而降低。优选地,所述苯胺含量通过所述细胞由所述细胞的降解来降低。通过稀释废水/组合物降低苯胺/甲酸盐的浓度不被认为是苯胺/甲酸盐含量的降低。因此,术语“降低苯胺含量”或“降低甲酸盐含量”不涵盖通过稀释组合物a或b来降低化合物浓度。优选地,至少一种嗜盐微生物菌株的细胞是食物盐单胞菌(dsm15356)细胞和/或极嗜盐菌属d1227(atcc51408)细胞。此外,设想组合物,即前述细胞的混合物。因此,在本发明的一个实施方案中,细胞是菌株食物盐单胞菌的细胞。在本发明的另一个实施方案中,细胞是极嗜盐菌属d1227菌株的细胞。所有三种菌株都是本领域众所周知的。菌株保存在公共收藏中,可以不受限制地订购:菌株极嗜盐菌属d1227已经以atcc编号51408保藏在attc(americantypeculturecollection,manassas,virginia,usa)中。“d1227”是菌株名称。该菌株例如由以下文献描述:emersond等人,haloferaxsp.d1227,ahalophilicarchaeoncapableofgrowthonaromaticcompounds(极嗜盐菌属,一种能够在芳香族化合物上生长的嗜盐古细菌).arch.microbiol.161:445-452,1994。该文献全文通过引证纳入本文。菌株食物盐单胞菌已经保藏在dsm(deutschesammlungvonmikroorganismenundzellkulturen,braunschweig,germany)中,dsm编号为15356。所述菌株例如由以下文献描述:yoon,j.h.,lee,k.c.,kho,y.h.,kang,k.h.,kim,c.j.,park,y.h.(2002).halomonasalimentariasp.nov.,isolatedfromjeotgal,atraditionalkoreanfermentedseafood.int.j.syst.evol.microbiol.52:123-130。该文献全文通过引证纳入本文。如本文其他地方所述,菌株食物盐单胞菌既能够降低高盐度废水的甲酸盐含量也能够降低高盐度废水的苯胺含量。因此,高盐废水、组合物a和/或组合物b可包含苯胺或甲酸盐,或者苯胺和甲酸盐。如何培养这些菌株是本领域众所周知的,例如,培养条件可例如从atcc和dsmz数据库评估。所述三种菌株的优选培养基组合物描述于实施例部分的实施例1中。在步骤b)中与组合物a接触的细胞(即与组合物a混合)应是有活力的,即活细胞。如何评估细胞是否有活力,可以通过众所周知的方法进行评估。当然,与组合物a混合的一定百分比的细胞可能不是有活力的。然而,技术人员会将其考虑在内。在一个实施方案中,将至少一种嗜盐微生物菌株的细胞悬浮液与组合物a混合。细胞优选地来自相应菌株的细胞的预培养。悬浮液应包含合适的底物(即碳源),尽管不是必需的,但细胞的预培养可在苯胺(和任选地甲酸盐,特别是如果使用食物盐单胞菌)的存在下进行,即,用于预培养的培养基可含有苯胺(和任选地甲酸盐)。本文提及的待混合(即与组合物a接触)的至少一种嗜盐微生物菌株的细胞的量,可由技术人员确定。待混合的细胞的量应允许苯胺含量和/或甲酸盐含量的足够降低。所述量例如取决于通过本发明的方法处理的组合物a的体积。一般而言,待处理的组合物a的体积越大,所使用的细胞的量应越大。技术人员考虑会考虑到这点。混合可在合适的容器中进行。在一个实施方案中,在生物反应器中进行混合。如本文所用的术语“生物反应器”是指其中严格控制条件以允许降低苯胺含量(和/或甲酸盐含量)的系统。在一个实施方案中,所述生物反应器是搅拌釜反应器。优选地,生物反应器由非腐蚀性材料例如不锈钢制成。生物反应器可具有任何尺寸,只要其可用于培养组合物b。优选地,生物反应器允许大规模降低高盐废水中的苯胺(和/或甲酸盐)含量。因此,设想生物反应器具有至少1、10、100、500、1000、2500或5000升的体积或任何中间体积。然而,还设想以低规模实施本发明的方法,例如用5至100ml的组合物b。组合物b可进一步包含培养基组分,其允许通过至少一种嗜盐微生物菌株的细胞降低苯胺含量(和/或甲酸盐含量)。所述培养基组分是本领域中众所周知的,并且包括例如nh4cl、kh2po4、na2so4、mgcl2(例如mgcl2*6h2o)、fecl3、mgso4、cacl2(例如cacl2*2h2o)、kbr和kcl。在一个实施方案中,组合物b包含磷源、氮源、硫源、钾源和/或镁源(作为培养基组分)。组合物b可进一步包含痕量元素,例如铁、铜、锌和钴。在一个实施方案中,在使组合物a与细胞接触后,即将组合物和细胞混合(如步骤(b)中所述)后,将培养基组分加入组合物b中。合适的培养基组分的选择可由技术人员毫不费力地进行。此外,技术人员可毫不费力地确定合适的培养基组分浓度。例如,以下培养基组分的以下浓度范围和浓度被认为是合适的。然而,本发明不限于上面提到的培养基组分和以下浓度范围。组合物b中的浓度:nh4cl:0.5至3g/l,例如1.5g/lkh2po4:0.05至0.5g/l,例如0.15g/lmgcl2*6h2o:0.5至3g/l,例如1.1g/lcacl2*2h2o:0.1至2g/l,例如0.55g/lkcl:0.5至3g/l,例如1.66g/lna2so4:0.5至1g/l,例如0.75g/l实施例2的表1中对极嗜盐菌属d1227以及实施例2的表2中对食物盐单胞菌详列了培养基组分的进一步优选浓度。在本发明的一个优选实施方案中,组合物b还包含底物。所述底物应允许至少一种嗜盐微生物菌株的生长。技术人员可毫不费力地评估底物是否允许菌株生长。例如,食物盐单胞菌的优选底物列于wang等人的表1中(internationaljournalofsystematicandevolutionarymicrobiology(2007),57(6),1222–1226),其全部内容通过引用纳入本文。。除苯胺(和/或甲酸盐)外,还应存在底物。优选地,另外的底物(即除苯胺(和/或甲酸盐)之外)的存在允许改善苯胺含量(和/或甲酸盐含量)的降低。优选将底物加入组合物b中。优选地,所述底物为(允许菌株生长的)碳水化合物,更优选地,所述底物为(允许菌株生长的)有机酸或糖,更优选地,底物选自丙三醇、乙酸盐、葡萄糖、蔗糖、乳酸盐、苹果酸盐、琥珀酸盐和柠檬酸盐。在一个特别优选的实施方案中,底物是丙三醇。优选地,如果培养以连续方法进行,则组合物b包含底物。底物应允许生物质以缓慢的速度生长,以便在连续模式下实现降解的稳定性。有利地,观察到当将其他底物、丙三醇连续加入组合物b——即含有组合物b的反应器中时,一旦细胞以其最大生长速率生长,苯胺的含量可以连续下降。底物的合适浓度或浓度范围可以由技术人员确定而无需进一步考虑。苯胺含量的降低(和/或甲酸盐含量的降低)以及因此本文提及的培养优选在碳限制下完成。因此,设想底物的浓度例如生长允许生物质以缓慢的速率生长。由此产生新鲜生物质允许苯胺(和/或甲酸盐)含量以连续方式降低。优选地,将底物以全部被细胞吸收的量加入组合物b中。因此,设想toc含量不会通过添加底物而增加。例如,设想组合物b中的底物、特别是上述底物的浓度为0.5g/l至10g/l,特别是0.5g/l至5g/l。在本发明的一个实施方案中,将其他培养基组分和/或合适的底物加入组合物b中,特别是在混合组合物a和至少一种嗜盐微生物菌株的细胞后。例如,其他培养基组分和/或合适的底物可在组合物b培养开始时或在组合物b培养期间(例如连续地或以脉冲的形式(aspulse))添加。当然,底物的浓度在培养期间会发生变化,因为底物会被组合物b所包含的细胞以一定的速率代谢。因此,底物浓度可能不恒定。然而,在培养期间可以添加额外的底物以补偿底物含量的下降。在使组合物a与细胞接触后,培养所得组合物b,以通过所述至少一种嗜盐微生物菌株的细胞使苯胺(和/或甲酸盐)含量降低。因此,本发明的方法优选包括培养组合物b的其他步骤(c)。在该培养步骤中,苯胺(和/或甲酸盐)含量降低。因此,本发明特别涉及一种降低包含高盐废水的组合物的苯胺含量(和/或甲酸盐含量)的方法,所述方法包括以下步骤:(a)提供包含高盐废水和苯胺的组合物a,(b)使组合物a与至少一种嗜盐微生物菌株的细胞接触,从而产生包含所述组合物a和所述至少一种嗜盐微生物菌株的细胞的组合物b,和(c)培养组合物b,从而降低组合物中苯胺(和/或甲酸盐)含量。组合物b的培养应在合适的条件下进行,即在允许通过本文提及的所述至少一种嗜盐微生物菌株的细胞来降低苯胺/甲酸盐含量的条件下进行。优选地,培养在生物反应器中进行。优选地,组合物b的培养(并因此降低苯胺/甲酸盐含量)在18℃至45℃的温度下进行,更优选在20℃至40℃的温度下进行,最优选在20℃至35℃的温度下进行。设想降低在恒定温度下进行。然而,也预料的是温度可能在培养期间改变。在本发明的一个优选实施方案中,在培养期间监测组合物b的温度。在本发明方法的一个优选实施方案中,搅拌组合物b(在培养期间)。优选地,组合物b在100rpm至700rpm的范围内、更优选在100rpm至500rpm的范围内且最优选在200rpm至400rpm的范围内搅拌。培养在好氧条件下进行。优选地,通过连续地向组合物b中添加空气或纯化的氧来维持好氧条件。优选地,组合物b的ph值范围为5.8至8.5,更优选6.0至8.0,最优选6.2至7.5。因此,培养优选在5.8至8.5的范围内、优选在6.2至7.5的范围内的ph值下进行。在一个优选的实施方案中,在培养期间监测组合物b的ph值。设想在培养期间ph值保持恒定。这可例如通过加入hcl实现。最佳温度范围和ph值范围可取决于用于降低苯胺/甲酸盐含量的嗜盐菌株。如果使用食物盐单胞菌的细胞,则培养优选在范围为6.5至8.5、特别是6.5至7.4的组合物b的ph值下进行。此外,设想培养优选在20℃至37℃的温度下进行,更优选在25℃至35℃的温度下进行。最佳温度约为30℃。如果是极嗜盐菌属d1227的细胞,则培养优选在范围为6.5至8.0、特别是6.8至7.5的组合物b的ph值下进行。此外,设想培养优选在20℃至40℃的温度下进行,更优选在25℃至37℃的温度下进行。最佳温度约为35℃。在培养步骤中生物质(即至少一种嗜盐微生物菌株的细胞)的浓度可以是允许降低苯胺含量(和/或降低甲酸盐含量)的任何浓度。例如,生物质浓度可以在0.2至10g/l的范围内,特别是在0.5至4.5g/l的范围内。对于250mg/l苯胺,最佳生物质浓度为1.6g/l。因此,还设想生物质浓度在1.3至1.9g/l的范围内。如上所述,本发明的方法优选大规模进行。因此,组合物b优选具有至少1、10、100、500、1000、2500或5000升的体积或任何中间体积。然而,本发明也设想更小的体积,例如至少5ml或100ml的体积(例如用于测试)。本发明的方法,特别是在本文中在本发明方法的步骤(c)中提及的培养,优选以分批方法、补料分批方法或连续方法进行,特别是以分批方法、补料分批方法或连续方法使用细胞截留(优选在生物反应器中)进行。因此,组合物b在分批、补料分批或连续条件下培养。术语“分批方法”优选地指培养细胞的方法,其中在培养方法开始时提供将最终用于培养细胞的所有组分,包括底物和其他培养基组分、组合物a以及细胞本身。分批方法优选地在某一时刻停止,并分离经处理的高温废水。如本文所用的术语“补料分批方法”是指培养细胞的方法,其中在培养方法开始后的某一时间向培养物提供另外的组分,例如另外的培养基组分和/或底物。补料分批培养优选地在某一时刻停止,并收获培养基中的细胞和/或组分,并分离经处理的高盐废水。在一个特别优选的实施方案中,本发明的方法以及因此如本文所提及的培养,使用如上所提及的底物(例如丙三醇或乙酸盐)以具有混合进料体系的连续培养法进行。在本发明前述方法的一个优选实施方案中,所述方法还包括从组合物b中分离至少一种嗜盐微生物菌株的细胞从而得到组合物c的步骤。从组合物b中分离细胞应在组合物b培养后,即在降低苯胺(和/或甲酸盐)含量后,作为步骤(d)。所得组合物c(在本文中也称为“经处理的废水”)应基本上不含至少一种嗜盐微生物菌株的细胞。换言之,组合物c不应包含细胞。从组合物b中分离细胞可通过认为合适的所有细胞截留方法来实现。例如,细胞的分离可通过离心、过滤或倾析来实现。优选地,通过过滤从组合物b中分离细胞。此外,细胞可固定在颗粒(bead)或固体支持物上,从而允许细胞从组合物b中分离。如果进行连续方法,则考虑将分离的细胞送回废水中。相应地,分离的细胞与组合物a或特别是组合物b接触。如果所述方法在生物反应器中进行,则生物反应器优选包括用于细胞截留的装置。优选地,生物反应器包括适于通过过滤将细胞从组合物b中分离的膜。所得组合物c,即经处理的废水,优选包含小于5mg/l的苯胺。更优选地,它包含小于2mg/l且最优选小于1mg/l的苯胺。还优选地,在已实施本发明的方法后经处理的废水的甲酸盐的量为小于15mg/l,更优选小于10mg/l,最优选小于5mg/l(特别是如果使用菌株食物盐单胞菌)。此外,组合物c优选具有小于40mg/l、更优选小于30mg/l且最优选小于20mg/l的toc含量。在本发明的一个优选实施方案中,所述方法还包括浓缩组合物c,从而得到组合物c*。该步骤将使经处理的废水中的nacl浓度增加,即nacl在组合物中是向上浓缩的(up-concentrated)。优选地,浓缩组合物c*包含浓度大于20.0%(w/v)的nacl,基于组合物a的总体积计,特别是浓度大于22%(w/v)。当用于氯碱工艺的进料物流时,这些nacl浓度是理想的浓度。根据本发明,组合物c的向上浓缩可为通过任何认为合适的方法进行的浓缩。优选的方法是反渗透、超滤和纳米过滤。在这些方法中,使用对过滤膜一侧的正渗透压。此外,可通过蒸发实现向上浓缩。如上所述,组合物a和b可包含浓度大于20%(w/v)的nacl。如果使用这些浓度,则原则上当使经处理的废水进行氯碱工艺时,可省略浓缩步骤。本文上面给出的定义和解释加以必要的变更适用于本发明的下述主题,特别是适用于下述本发明的制备氯和/或氢氧化钠的方法、适用于本发明的组合物、本发明的生物反应器和本发明的用途。本发明还涉及制备氯和氢氧化钠的方法,包括以下步骤:(i)提供根据本发明方法的组合物c或根据本发明方法的组合物c*,和(ii)使根据(a)的组合物进行氯化钠电解,从而产生氯和氢氧化钠。前述方法的步骤(i),即根据本发明的方法提供组合物c或根据本发明的方法提供组合物c*,优选包括用于降低高盐溶液中苯胺含量的方法的步骤。在一个实施方案中,通过以下步骤提供组合物c:(a)提供包含高盐废水和苯胺和/或甲酸盐的组合物a,(b)使组合物a与至少一种嗜盐微生物菌株的细胞接触,从而产生包含所述组合物a和所述至少一种嗜盐微生物菌株的细胞的组合物b,(c)培养组合物b,从而降低组合物中的苯胺含量和/或甲酸盐含量,以及(d)将至少一种嗜盐微生物菌株的细胞从组合物b中分离,从而提供组合物c。如果提供组合物c*,则步骤ii)优选包括浓缩组合物c从而提供组合物c*的其他步骤(e)。氯化钠的电解可以通过本领域众所周知的方法进行。优选地,电解为氯化钠的膜电解槽电解、特别是使用耗氧电极的膜电解,氯化钠的隔膜电解槽电解或氯化钠的汞电解槽电解。本发明还涉及如上文结合本发明方法所定义的组合物b。因此,本发明涉及包含高盐废水并且还包含苯胺(和/或本文其他地方描述的甲酸盐)以及至少一种嗜盐微生物菌株的细胞的组合物b。所述组合物还应包含nacl。结合本发明的用于降低苯胺和/或甲酸盐含量的方法,公开了苯胺的优选含量和/或进一步优选的nacl浓度。另外,组合物可包含如上所述的组分(例如其他培养基组分和/或合适的底物、苯酚、苯胺等)。优选的甲酸盐浓度也在其他地方描述。此外,本发明涉及包含至少1升本发明组合物b的生物反应器。此外,本发明涉及如本文所述的至少一种嗜盐微生物菌株的细胞用于降低高盐废水中的或包含所述废水的组合物a或b中的苯胺含量(和/或甲酸盐含量)的用途。特别地,本发明涉及至少一种嗜盐微生物菌株的细胞用于降低组合物b中的或特别是本文提及的组合物a中的苯胺含量(和/或甲酸盐含量)的用途。上文结合本发明的用于降低苯胺含量(和/或甲酸盐含量)的方法给出的定义和解释相应地适用于前述用途。因此,根据前述用途,优选地降低苯胺含量(和/或甲酸盐含量),如上文结合本发明的方法所描述的。附图说明:图1图表示出了在含有10和20mg/l苯胺的合成的培养基中在15%w/v的nacl浓度下通过菌株食物盐单胞菌降低苯胺。生物质降低且苯胺降解。在存在第二种底物的情况下,50mg/l苯酚仍未出现生物质浓度的增加。图2示出了在含有15%w/vnacl和20mg/l苯胺的合成的培养基中通过菌株极嗜盐菌属d1227进行的苯胺降解。培养48小时后,50%的苯胺被降解。示出了600nm下光密度的降低。在存在第二种底物的情况下,检测到50mg/l苯酚使生物质浓度增加并使苯酚和苯胺降低。图3使用耐盐细菌食物盐单胞菌的细胞在各种盐浓度(0至20%w/vnacl)下的苯胺降解。盐浓度越高,苯胺降解的比率越高。在18%w/v的nacl浓度下发生最佳的苯胺降解。图4该图表表明了使用嗜盐细菌极嗜盐菌属d1227的细胞在各种盐浓度(0至20%w/vnacl)下的苯胺降解。盐浓度越高,苯胺降解的比率越高。在>14%w/v的nacl浓度下发生最佳的苯胺降解。图5该系数图表示出了初始的苯胺浓度和nacl浓度两种因素对菌株食物盐单胞菌的苯胺降解的意义。在较低的盐浓度和苯胺浓度下,可观察到更好的去除。ph似乎对苯胺的去除没有意义。在所有nacl浓度下皆发生食物盐单胞菌的苯胺降解。图6该响应计数图表(responsecounterplot)示出了,对于菌株食物盐单胞菌,可在较低的初始苯胺浓度和较低的nacl浓度下发生最佳的苯胺降解。图7示出了在含有15%w/vnacl的工业残余培养基上的菌株食物盐单胞菌的甲酸盐摄取。甲酸盐降低,且生物质随时间增加。本说明书中引用的所有参考文献的全部公开内容以及本说明书中具体提及的公开内容均通过引证纳入本文。本发明仅仅是通过以下实施例来说明。无论怎样,不应以限制本发明范围的方式解释所述实施例。实施例实施例1:摇瓶实验中的苯胺降解菌株和培养基食物盐单胞菌(dsm15356)(在该研究中,食物盐单胞菌)野生型购自dsmz。用于接种物制备的摇瓶培养物在120rpm和30℃下在实验室培养箱(infors,switzerland)中在由dsmz建议的具有一些修改和以下组成(g/l)的no.514培养基上生长:酵母提取物5.0、柠檬酸fe(iii)0.1、nacl19.45、mgcl25.9、na2so43.24、cacl21.80、kcl0.55、nahco30.16、kbr0.08和痕量元素(以mg/l计)srcl234.0、h3bo322.0、na-硅酸盐4.0、naf2.40、(nh4)no31.60、na2hpo48.0;ph7.6。极嗜盐菌属d1227(atcc51408)(在该研究中d1227)购自美国模式培养物保藏所(americantypeculturecollection)。用于接种物制备的摇瓶培养物在170rpm和35℃下生长,其中使用以下培养基组成(g/l):(nh4)2so40.33、kcl6.0、mgcl2·6h2o12.1、mgso4·7h2o14.8、kh2po40.34、cacl2·2h2o0.36、nacl100.0、酵母提取物3.0、胰蛋白胨3.0;ph6.8。分析使用shimadzuuv/vis分光光度计在600nm下以12小时的间隔测量作为细胞生长指标的浊度。使用hplc测量培养物上清液中残余苯胺的浓度。hplc(thermo-fisher)方法使用acclaimpac-16-3μm柱(thermo-fisher)实施。使用乙腈、25mmkh2po4ph3.5和mq作为流动相,并用uv在190nm下完成检测。注入体积为5μl时,苯胺的定量限为1ppm。还可检测到更低浓度的苯胺。摇瓶中的苯胺摄取研究对于苯胺摄取研究,为每种菌株制备合成地确定成分培养基。培养基组成列出如下:组成量mg/100mlfeso4.7h2o136cuso4.5h2o100mncl2.4h2o50cocl2.2h2o44znso4.7h2o86表1:菌株极嗜盐菌属d1227的合成的确定成分培养基(上面表)和微量元素(下面表)组成组成量g/lnacl140mgcl25.90na2so43.24cacl21.80kcl0.55kbr0.08srcl234mgh3bo322mgna-硅酸盐4.0mgnaf2.4mg(nh4)no31.6mgna2hpo48.0mg苯胺99%5–100mg表2:菌株食物盐单胞菌的合成的确定成分培养基组成逐一对所述菌株进行研究以检查苯胺摄取。通过以3000rpm离心5分钟收获先前在复合培养基上生长的细胞。将细胞洗涤并溶于500ml摇瓶中,所述摇瓶含有100ml的它们各自的合成的确定成分培养基和15%w/vnacl,使用苯胺作为唯一碳源,并在先前提到的各自温度下和搅拌下进行培养。测量零小时od600并储存1ml样品用于hplc分析,作为零小时参比。监测苯胺上的生长和残留的苯胺浓度。本研究中使用的菌株d1227和食物盐单胞菌未能使用苯胺作为生长源,然而,随时间的推移残余苯胺浓度显示,根据初始苯胺浓度,在合成培养基和实际盐水上苯胺均完全从培养基中除去。在存在第二种底物的情况下,在这种情况下,用于d.1227的苯酚50至100mg/l使生物质浓度增加,并且检测到更好的苯胺降解。在更多实验中,在摇瓶和生物反应器中更详细地研究了苯胺的降解,以便能够控制其他工艺参数。实施例2:苯胺降解的最佳培养条件使用多变量实验设计的苯胺研究为了找到苯胺通过嗜盐菌株食物盐单胞菌降解的最佳条件,使用多变量方法设计实验。对于菌株食物盐单胞菌,进行部分析因设计的实验以评估三种因素(ph、初始苯胺浓度和nacl浓度)对三个参数(delta生物量、残余苯胺浓度和deltaph)的影响。下表3中给出了研究的因素及其范围:因素名称范围ph6.5至8.5苯胺浓度10至50mg/lnacl5至15%w/v表3:由食物盐单胞菌降解苯胺的因素和响应研究实验在摇瓶中在30℃和120rpm冲程下实施。以24小时的间隔测定生物质浓度的增加、ph变化和残余苯胺浓度。通过modde(统计工具)分析144小时后获得的测量值。在食物盐单胞菌的情况下,分别在5和10%w/v的较低nacl浓度下和较低ph下和10mg/l的苯胺浓度下观察到更好的苯胺降解。实施例3:各种盐浓度下的苯胺降解在摇瓶实验中,在含有30mg/l苯胺作为碳源的合成培养基中,在0至20%w/v的各种盐浓度下研究了三种不同菌株的苯胺降解。以24小时的间隔通过hplc测定残余苯胺浓度。对于菌株d1227,在nacl浓度高于10%时发生更佳的苯胺降解,其中最佳降解是在16%w/vnacl下。对于菌株食物盐单胞菌,在培养192小时后在18%w/vnacl下最佳苯胺降解为苯胺总含量的70%。实施例4:在摇瓶中通过食物盐单胞菌除去甲酸盐的实验在含有15%w/vnacl和270mg/l甲酸盐的实际盐水上进行甲酸盐研究。对于该实验,细胞预先在30℃下以120rpm的冲程在复合培养基(实施例1菌株和培养基部分中给出的组成)上生长。通过在3000rpm和25℃下离心5分钟收获来自细胞指数生长后期的细胞。洗涤细胞并再次悬浮在具有作为唯一碳源的甲酸盐和表2中给出的培养基组分的ph7.2的盐水中。以分光光度法测定零小时的生物质浓度,并通过hplc测定初始甲酸盐浓度。以24小时的间隔测定残余甲酸盐浓度和生物质浓度。获得的结果显示随时间的推移生物质浓度随甲酸盐的降低而轻微增加。获得的结果表明,甲酸盐被除去,并且在作为唯一的底物的甲酸盐上检测到轻微的生物质增加。实施例5:通过极嗜盐菌属d1227降解甲酸盐选择多变量设计的实验方法来检查极嗜盐菌属d1227的甲酸盐摄取。研究了甲酸盐浓度和nacl浓度两种因素(见表4)对甲酸盐摄取和生物质浓度的影响。在摇瓶中在具有作为唯一底物的甲酸盐和表1中给出的培养基组分的合成培养基上在ph6.8、温度35℃和150rpm冲程下实施实验。以24小时的间隔测定残余甲酸盐浓度和生物质。在培养长达168小时后获得的hplc结果表明,在实验过程中甲酸盐保持完整,并且在所有实验中生物质均显示出下降。可以得出如下结论:甲酸盐既不被极嗜盐菌属d1227降解也不被这些细胞作为能量源而吸收。在表5中给出了研究用于甲酸盐降解的嗜盐菌株和耐盐菌株的列表。因素名称研究范围nacl浓度10至20%w/v甲酸盐浓度0.25至1g/l表4表5实施例6:在另外的摇瓶实验中的苯胺降解研究了在各种盐浓度下另外的嗜盐菌株和耐盐菌株的苯胺降解。结果如下表6中所示。表6:用于苯胺降解研究的嗜盐菌株和耐盐菌株总结–结论:高盐废水经常包含苯胺和甲酸盐。苯胺是主要的工业化学中间体,用于制造除草剂、显影剂、香料、医药、橡胶和染料。使用若干种物理和化学方法,例如吸附、臭氧化和电化学处理,处理含苯胺的含盐残余物流。大多数提到的处理不能将含盐残余物流中的总有机碳含量降低到所需的最高水平。在本发明中,发现食物盐单胞菌细胞可降解高盐环境中的苯胺。此外,发现食物盐单胞菌细胞和极嗜盐菌属d1227可降解高盐环境中的苯胺和甲酸盐。本发明可涉及任何含苯胺的高盐水的以降低总有机碳含量为目的的最佳且有效的处理。本发明的另一方面包括残余物对价值的概念。一方面,富含大量不需要的有机污染物的高盐残余物流引起环境问题,另一方面其他工业方法例如膜电解对于作为前体的高质量的盐水的需要使得这些高盐残余物流的预处理绝对至关重要。本发明帮助实现这种廉价、快速且有效的预处理以满足膜电解制备氯和/或氢氧化钠的要求。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1