一种2-取代吲哚类化合物的合成方法与流程
本发明属于有机合成领域,特别涉及一种2-取代吲哚类化合物的合成方法。
背景技术:
吲哚类化合物是重要的有机原料和化工产品,具有各种各样的生理活性。作为医药、农药、染料、香料及其他精细化工产品的中间体,吲哚类化合物和其衍生物得到广泛应用,因此其合成一直是全球化学领域的重要内容之一。当前已经发展了很多方法来合成吲哚类化合物,如苯肼法、苯胺法、邻氨基乙苯法、邻氯甲苯法等,但这些方法均有各自的缺点,如需要两步反应导致收率低,合成需要催化剂不易得到,需要过渡金属催化,或者所用辅助原料复杂等。由于以上原因导致吲哚类化合物的合成收率不高,不易实现规模化制备,且污染环境。
本发明中目标产物类似化合物合成已有报道(a.b.smith,iii,m.visnick,j.n.haseltine,p.a.sprengeler,tetrahedron1986,42,2957-2969),具体路线如下:
该方法以2-甲基苯胺作为原料,经过两步反应得到2-取代吲哚化合物。此反应需要两步,且第二步反应温度需要-78℃,条件苛刻,较为局限,不易规模化制备,并且产率只有62%。
技术实现要素:
本发明的目的在于提供一种解决以上问题,合成方法简单、经济适用性更加广泛或适于规模化生产的2-取代吲哚类化合物的合成方法。
实现上述目的的技术方案如下:
一种2-取代吲哚类化合物的合成方法,式1所示的2-氟甲苯类化合物和式2所示的腈类化合物、强碱和铯盐添加剂,有机溶剂混合,反应合成式3所示的2-取代吲哚类化合物。
其中r1选自氢、卤素基、甲氧基、甲基、氮氮二甲基或苯基,r2选自氢、苯基或取代苯基,r3选自苯基、取代苯基、吡啶、氮甲基吲哚、萘、叔丁基,其中苯基的取代基选自甲基,叔丁基,甲氧基,三氟甲基,卤素基。本发明方法为一锅法生成吲哚类化合物,减少了反应步骤,从而可提高产物收率;本合成方法所用原料简单经济,不用使用过渡金属催化剂,更加经济与绿色环保;本发明中的r1、r2、r3可以为多种选择,适用性更广。
优选的,r1选自氢,苯基或单取代或多取代卤素基,优选的,r1选自氢,单取代或多取代卤素基;r2选自氢或苯基,r3选自苯基、对叔丁基苯基或2-萘基。
更加优选的,r1选自6-氯,3,6-二氟,3,4,5,6,-四氟。
优选的,r1为氢,r2为苯基,r3为苯基。
优选的,反应在惰性气体保护下进行。
优选的,式2所示的腈类化合物、式1所示的2-氟甲苯类化合物、强碱、铯盐添加剂的摩尔比为:4:1~12:2~12:4~8,反应温度为90℃~130℃。
优选的,反应温度为100℃~120℃。
优选的,反应温度为110℃。
优选的,强碱为二(三甲基硅基)氨基锂,二(三甲基硅基)氨基钾或二(三甲基硅基)氨基铯的一种或多种。
优选的,有机溶剂为环戊基甲基醚,二甲醚,四氢呋喃,1,4-二氧六环或异丙醚。
优选的,铯盐添加剂为氟化铯、三氟乙酸铯或碳酸铯或二(三甲基硅基)氨基铯。
优选的,铯盐添加剂为氟化铯。
优选的,惰性气体为氩气或氮气。
优选的,采用本发明方法,可以合成如下结构的2-取代吲哚类化合物:
在强碱和铯盐添加剂的存在下,2-氟甲苯的甲基去质子化,得到苄基金属中间体,然后苄基金属中间体进攻腈得到金属亚胺中间体。生成的金属亚胺中间体经过分子内snar(亲核芳得取代反应)环化和异构化,得到吲哚。
采用本发明的技术方案至少可以达到如下有益效果之一:
本发明提供一种新的取代吲哚的合成方法,该方法未用到过渡金属催化剂,因此更加经济,更适于工业普及;
本发明采用一锅法合成方法,由于反应步骤少,减少了原料的损失,提高了产物的产率;
本发明所需操作步骤较为简便,无需极端的升温或降温,更易于操作和控制;
本发明中的r1、r2、r3可以为多种选择,因此本发明方法适用性更加广泛,可以合成多种2-取代吲哚类化合物,对合成吲哚类化合物有着很重要的影响。
附图说明
图1~38分别为实施例1~38产物的核磁共振谱图
其中每一实施例产物的谱图中,a图为对应实施例产物的氢谱图,b图为对应实施例产物的碳谱图,c图为对应实施例产物的氟谱图。
具体实施方式
为了便于本领域技术人员理解,下面结合实施例对本发明的构思做进一步的说明。以下实施例的具体说明并非对本发明的限制,只是为了方便本领域技术人员理解本技术方案。说明书中所涉及的各种原料,均购自市场,二(三甲基硅基)氨基锂(aldrich,97%),二(三甲基硅基)氨基钾(aldrich,95%),氟化铯(aldrich,99%),其他药品等购自sigma-aldrich,acros,alfaaesar,tcichina,adamas-beta或者j&k.,核磁共振谱仪型号为布鲁克400兆。
实施例1
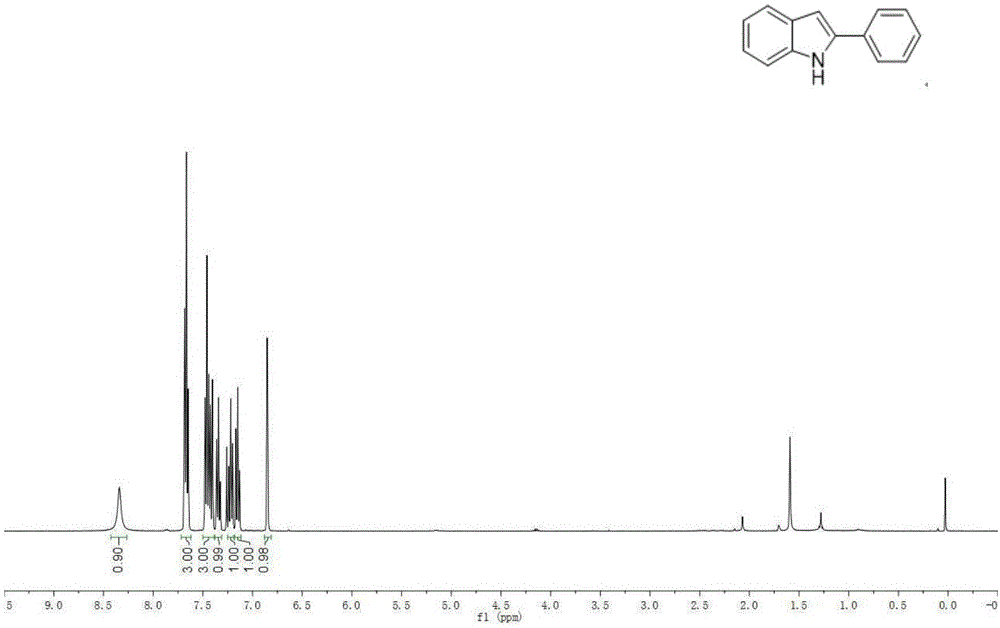
在手套箱中将二(三甲基硅基)氨基锂(66.8mg,0.4mmol)与氟化铯(30.4mg,0.2mmol)加入微波管中,加入0.4ml环戊基甲基醚,然后用微量注射器分别加入2-氟甲苯(66μl,0.60mmol)和苯甲腈(20μl,0.20mmol),加盖从手套箱取出,在110℃下回流12小时,冷却至室温,启盖并加三滴水淬灭反应,减压去除溶剂,粗产品柱层析分离(石油醚:乙酸乙酯=20:1),即可得2-苯基吲哚(34.7mg,90%yield)。产物的比移值rf=0.34(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图1a和图1b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.34(brs,1h),7.69–7.65(m,3h),7.48–7.40(m,3h),7.36–7.32(m,1h),7.26–7.20(m,1h),7.17–7.13(m,1h),6.85(d,j=2.1hz,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.0,136.9,132.5,129.4,129.2,127.8,125.3,122.5,120.8,120.4,111.0,100.1ppm.
变换实施例1中的原料、强碱、溶剂的比例,设计如下38组实验实施例,其中第1组实验即为实施例1,对应的产物的核磁共振谱图为图1。其余2-38各组产物的核磁共振谱图的序号对应相应的实施例的序号。
表中列出了1-38各实施例中r1、r2、r3以及对应的产物的结构式,最后一列列出了各实施例的产物的产率,并标示出了各实施例的具体实施条件,各实施例实施条件的具体含义如表格下方所示。
[a]腈类化合物(0.2mmol),二氟甲苯类化合物(0.6mmol),二(三甲基硅基)氨基锂(0.4mmol),氟化铯(0.2mmol),环戊基甲基醚(0.4ml)
[b]二(三甲基硅基)氨基锂(0.2mmol)与二(三甲基硅基)氨基钾(0.2mmol),其他跟条件[a]相同
[c]环戊基甲基醚(0.2ml),其他跟条件[a]相同
[d]腈类化合物(0.8mmol),二氟甲苯类化合物(0.2mmol),二甲醚(0.4ml),其他跟条件[a]相同
[e]二甲醚(0.2ml),其他跟条件[a]相同
[f]二(三甲基硅基)氨基锂(0.2mmol)与二(三甲基硅基)氨基钾(0.2mmol),氟化铯(0.3mmol),二甲醚(0.5ml),其他跟条件[a]相同
[g]环戊基甲基醚(0.2ml),其他跟条件[d]相同
[h]二(三甲基硅基)氨基钾(0.6mmol),氟化铯(0.3mmol),异丙醚(0.4ml),其他跟条件[a]相同
[i]1,4-二氧六环(0.2ml),其他跟条件[a]相同
[j]二(三甲基硅基)氨基锂(0.6mmol),氟化铯(0.4mmol),四氢呋喃(0.1ml),其他跟条件[a]相同
[k]二甲醚(0.4ml),其他跟条件[a]相同
[l]二甲醚(0.1ml),其他跟条件[a]相同
[m]四氢呋喃(0.2ml),其他跟条件[a]相同
以下为2-38各个实施例产物的1h和13c的核磁共振谱图(nmr)图谱数据结果以及部分产物的熔点mp、红外光谱图(ir)、高分辨质谱图(hrms)数据结果。
实施例2
用2,6-二氟甲苯(68μl,0.60mmol)代替实施例1中的2-氟甲苯,其余操作与实施例1相同,最终以81%的收率(34.1mg)得到4-氟-2-苯基-1h-吲哚,产物的比移值rf=0.17(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别如图2a和图2b所示,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.42(brs,1h),7.68–7.65(m,2h),7.49–7.44(m,2h),7.38–7.34(m,1h),7.20–7.18(m,1h),7.14–7.09(m,1h),6.91(dd,j=2.3,0.9hz,1h),6.84–6.79(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:156.5(d,j1c-f=247.9hz),139.4(d,j4c-f=11.2hz),138.0,132.0,129.3,128.2,125.4,122.9(d,j5c-f=7.7hz),118.6(d,j2c-f=22.5hz),107.1(d,j6c-f=3.6hz),105.2(d,j3c-f=19.0hz),96.0ppm。
实施例3
用2-氟-6-氯甲苯(68μl,0.60mmol)代替实施例1中的2-氟甲苯,其余操作与实施例1相同,最终以87%的收率(39.5mg)得到4-氯-2-苯基-1h-吲哚,产物的比移值rf=0.34(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别如图3a和图3b所示,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.38(brs,1h),7.65–7.61(m,2h),7.45–7.41(m,2h),7.35–7.31(m,1h),7.26–7.22(m,1h),7.13–7.06(m,2h),6.91–6.90(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.6,137.5,131.8,129.2,128.3,128.2,126.0,125.4,123.0,120.1,109.6,98.6ppm。
实施例4
实施例4所得产物的比移值rf=0.29(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图4a和4b,谱图数据为:,1hnmr(400mhz,cdcl3)δ:8.48(brs,1h),7.69–7.67(m,2h),7.48–7.45(m,2h),7.38–7.29(m,3h),7.07–7.03(m,1h),6.89–6.88(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.6,137.0,131.8,130.1,129.2,128.3,125.4,123.3,114.7,110.2,100.3ppm。
实施例5
实施例5所得产物的比移值rf=0.29(石油醚:乙酸乙酯=20:1),熔点mp136–138℃,产物的氢谱和碳谱核磁共振谱图分别为图5a和5b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.47(brs,1h),7.67–7.64(m,2h),7.55(d,j=7.5hz,1h),7.48–7.44(m,2h),7.38–7.33(m,2h),6.93(t,j=7.8hz,1h),6.78–6.77(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.3,135.6,133.8,131.7,129.8,129.2,128.3,125.3,123.7,111.0,103.5,87.3ppm.ir(neat):3432,3062,1602,1566,1486,1451,1179,904,753,685,492cm-1.hrms:calcdforc14h11in[m+h]+319.9936,found319.9939。
实施例6
实施例6所得产物的比移值rf=0.41(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图6a和6b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.35(brs,1h),7.70–7.67(m,2h),7.47–7.43(m,2h),7.35–7.31(m,1h),7.27–7.25(m,1h),7.12(t,j=7.5hz,1h),6.95–6.93(m,1h),6.87–6.86(m,1h),2.60(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:137.4,136.6,132.6,130.4,129.3,129.2,127.7,125.2,122.6,120.5,108.6,98.7,18.9ppm.
实施例7
实施例7所得产物的比移值rf=0.37(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图7a和7b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.37(brs,1h),7.66–7.64(m,2h),7.46–7.42(m,2h),7.34–7.30(m,1h),7.17–7.13(m,1h),7.05–6.98(m,2h),6.59–6.57(m,1h),4.00(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:153.4,138.2,136.6,132.5,129.1,127.6,125.1,123.3,120.1,104.5,100.1,97.3,55.5ppm。
实施例8
实施例8所得产物的比移值rf=0.29(石油醚:乙酸乙酯=20:1),熔点mp:80–82℃,产物的氢谱和碳谱核磁共振谱图分别为图8a和8b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.41(brs,1h),7.66–7.64(m,2h),7.44(t,j=7.6hz,2h),7.35–7,31(m,1h),7.16(t,j=7.8hz,1h),7.03–6.99(m,2h),6.60(d,j=7.5hz,1h),3.07(s,6h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:146.6,138.3,136.0,132.5,129.1,127.5,125.1,123.2,122.0,106.2,104.6,99.5,43.5ppm.ir(neat):3449,3081,1602,1578,1540,1507,1441,1359,1340,1224,755,493cm-1.hrms:calcdforc16h17n2[m+h]+237.1397,found237.1394.
实施例9
实施例9所得产物的比移值rf=0.48(石油醚:乙酸乙酯=10:1),产物的氢谱和碳谱核磁共振谱图分别为图9a和9b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.30(brs,1h),7.64–7.62(m,2h),7.46–7.42(m,2h),7.35–7.24(m,3h),6.95–6.90(m,1h),6.78–6.77(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:158.3(d,j1c-f=235.6hz),139.8,133.4,132.2,129.7(d,j3c-f=10.4hz),129.2,128.2,125.3,111.6(d,j3c-f=9.8hz),110.8(d,j2c-f=26.5hz),105.5(d,j2c-f=23.6hz),100.2(d,j4c-f=4.6hz)ppm.
实施例10
实施例10所得产物的比移值rf=0.30(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图10a和10b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.37(brs,1h),7.66–7.63(m,2h),7.59(d,j=2.0hz,1h),7.48–7.44(m,2h),7.37–7.30(m,2h),7.16–7.13(m,1h),6.77–6.76(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:139.4,135.2,132.0,130.5,129.2,128.3,126.0,125.4,122.7,120.1,112.0,99.7ppm.
实施例11
实施例11所得产物的比移值rf=0.20(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图11a和11b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.24(brs,1h),7.63–7.60(m,2h),7.43–7.39(m,2h),7.32–7.23(m,2h),7.09–7.08(m,1h),6.86–6.84(m,1h),6.75–6.74(m,1h),3.85(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:154.6,138.7,132.5,132.1,129.8,129.1,127.8,125.2,112.7,111.8,102.4,99.9,56.0ppm.
实施例12
实施例12所得产物的比移值rf=0.19(石油醚:乙酸乙酯=20:1),熔点mp:195-197℃,产物的氢谱和碳谱核磁共振谱图分别为图12a和12b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.39(brs,1h),7.85(s,1h),7.71–7.65(m,4h),7.48–7.43(m,6h),7.37–7.30(m,2h),6.89–6.88(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:142.6,138.7,136.5,134.0,132.4,129.9,129.2,128.8,128.0,127.5,126.5,125.3,122.4,119.3,111.2,100.4ppm.ir(neat):3444,1633,1546,1504,1460,1448,884,755,690,501cm-1.hrms:calcdforc20h16n[m+h]+270.1283,found270.1280.
实施例13
实施例13所得产物的比移值rf=0.36(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图13a和13b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.36(brs,1h),7.65–7.62(m,2h),7.55–7.52(m,1h),7.47–7.42(m,2h),7.36–7.31(m,1h),7.10–7.07(m,1h),6.93–6.87(m,1h),6.80–6.79(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:160.2(d,j1c-f=239.0hz),138.5(d,j6c-f=3.8hz),136.8(d,j4c-f=12.6hz),132.2,129.2,127.9,125.9,125.1,121.5(d,j5c-f=10.1hz),109.1(d,j3c-f=24.6hz),100.0,97.4(d,j2c-f=26.3hz)ppm.
实施例14
实施例14所得产物的比移值rf=0.35(石油醚:乙酸乙酯=20:1),熔点mp205.6–206.8℃,产物的氢谱和碳谱核磁共振谱图分别为图14a和14b,谱图数据为:1hnmr(400mhz,dmso-d6)δ:11.65(brs,1h),7.90–7.88(m,2h),7.70–7.60(m,4h),7.50–7.44(m,4h),7.35–7.31(m,3h),6.95–6.94(m,1h)ppm.13c{1h}nmr(101mhz,dmso-d6)δ:141.6,138.5,137.8,134.0,132.1,129.0,128.9,128.2,127.5,126.7,126.6,125.0,120.5,118.9,109.2,98.7ppm.ir(neat):3432,2908,2839,2058,1636,1488,1441,825,760,741,689cm-1.hrms:calcdforc20h16n[m+h]+270.1283,found270.1279.
实施例15
实施例15所得产物的比移值rf=0.60(石油醚:乙酸乙酯=20:1),熔点mp116–119℃,产物的氢谱和碳谱核磁共振谱图分别为图15a和15b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.51(brs,1h),7.70–7.67(m,2h),7.49–7.45(m,2h),7.41–7.34(m,2h),7.07–7.02(m,1h),6.95–6.90(m,1h),6.87–6.85(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:149.5(d,j1c-f=244.1hz),138.9,132.9(d,j5c-f=5.2hz),132.0,129.2,128.2,125.4,125.2(d,j3c-f=13.0hz),120.6(d,j4c-f=6.2hz),116.5(d,j6c-f=3.5hz),107.3(d,j2c-f=16.1hz),100.6(d,j7c-f=2.5hz)ppm.ir(neat):3438,3055,1604,1549,1506,1452,1248,1034,775,725,497cm-1.hrms:calcdforc14h11fn[m+h]+212.0876,found212.0879.
实施例16
实施例16所得产物的比移值rf=0.62(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图16a和16b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.50(brs,1h),7.72–7.69(m,2h),7.54–7.45(m,3h),7.39–7.35(m,1h),7.21–7.19(m,1h),7.08–7.04(m,1h),6.87–6.85(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.8,134.2,131.9,130.7,129.2,128.3,125.5,121.7,121.2,119.4,116.5,100.9ppm.
实施例17
实施例17所得产物的比移值rf=0.56(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图17a和17b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.22(brs,1h),7.72–7.70(m,2h),7.52–7.45(m,3h),7.37–7.33(m,1h),7.09–7.01(m,2h),6.86(d,j=2.1hz,1h),2.57(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:137.8,136.5,132.7,129.1,128.9,127.8,125.3,123.1,120.6,120.2,118.5,100.7,16.9ppm.
实施例18
实施例18所得产物的比移值rf=0.63(石油醚:乙酸乙酯=20:1),产物的氢谱、碳谱和氟谱的核磁共振谱图分别为图18a、18b和18c,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.60(brs,1h),7.69–7.66(m,2h),7.50–7.45(m,2h),7.40–7.36(m,1h),6.90(dd,j=2.4,3.2hz,1h),6.83–6.77(m,1h),6.71–6.65(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:152.2(dd,j4c-f=1.8hz,j1c-f=243.7hz),145.7(dd,j4c-f=2.8hz,j1c-f=239.8hz),138.9,131.4,129.3,128.6,126.7(dd,j2c-f=15.5hz,j3c-f=11.6hz),125.5,121.2(dd,j2c-f=25.2hz,j3c-f=5.4hz),106.9(dd,j2c-f=19.3hz,j3c-f=8.5hz),104.6(dd,j2c-f=22.3hz,j3c-f=7.1hz),96.8ppm.19fnmr(376mhz,cdcl3)δ:-127.7(d,j=22.4hz),-140.6(d,j=22.4hz)ppm.ir(neat):3457,3082,3037,1958,1635,1606,1548,1519,1488,1453,793,782,728cm-1.hrms:calcdforc14h10nf2[m+h]+230.0781,found230.0784.
实施例19
实施例19所得产物的比移值rf=0.62(石油醚:乙酸乙酯=20:1),熔点mp125–127℃,产物的氢谱、碳谱和氟谱的核磁共振谱图分别为图19a、19b和19c,谱图数据为1hnmr(400mhz,cdcl3)δ:8.46(brs,1h),7.63–7.60(m,2h),7.46–7.41(m,2h),7.36–7.32(m,1h),7.26–7.22(m,1h),6.96–6.89(m,1h),6.76(dd,j=2.2,3.3hz,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:146.4(dd,j1c-f=239.3hz,j2c-f=9.4hz),139.5(dd,j4=3.8hz,j5=1.5hz),137.5(dd,j1c-f=246.3hz,j2c-f=16.5hz),131.7,129.3,128.8(dd,j3c-f=8.7hz,j4c-f=5.0hz),128.3,125.9(dd,j3c-f=9.4hz,j4c-f=4.2hz),125.3,115.7(dd,j2c-f=8.1hz,j3c-f=4.2hz),110.3(dd,j2c-f=20.5hz,j3c-f=0.8hz),100.4ppm.19fnmr(376mhz,cdcl3)δ:-148.1(d,j=20.1hz),-160.7(d,j=20.4hz)ppm.ir(neat):3477,2905,2837,2046,1635,1521,1491,1450,811,760,727,686cm-1.hrms:calcdforc14h10nf2[m+h]+230.0781,found230.0779.
实施例20
实施例20所得产物的比移值rf=0.60(石油醚:乙酸乙酯=20:1),熔点mp125–127℃,产物的氢谱、碳谱和氟谱的核磁共振谱图分别为图20a、20b和20c,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.60(brs,1h),7.67–7.64(m,2h),7.51–7.46(m,2h),7.42–7.38(m,1h),6.26(dd,j=2.4,2.8hz,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:140.2,139.6(m),136.9(m),135.5(m),134.2(m),130.8,129.4,128.9,125.5,121.3(m),115.4(dd,j2c-f=20.2hz,j3c-f=4.0hz),96.6ppm.19fnmr(376mhz,cdcl3)δ:-149.9(d,j=3.2hz),-161.5,-165.3,-168.8(d,j=42.9hz)ppm.
实施例21
实施例21所得产物的比移值rf=0.39(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图21a和21b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.11(brs,1h),7.70(d,j=8.0hz,1h),7.37–7.26(m,7h),7.24–7.13(m,5h),7.08–7.04(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:136.0,135.2,134.2,132.8,130.3,128.9,128.8,128.7,128.3,127.8,126.4,122.8,120.6,119.8,115.1,111.0ppm.
实施例22
实施例22所得产物的比移值rf=0.38(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图22a和22b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.32(brs,1h),7.45(d,j=8.1hz,1h),7.35–7.21(m,11h),7.12–7.08(m,1h),2.03(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:137.9,135.9,134.6,133.9,133.0,131.7,130.4,129.7,128.9,127.6,127.3,126.9,126.0,122.7,120.3,120.1,114.9,110.9,20.3ppm.
实施例23
实施例23所得产物的比移值rf=0.38(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图23a和23b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.26(brs,1h),7.62–7.60(m,1h),7.54–7.52(m,2h),7.37–7.35(m,1h),7.24–7.09(m,4h),6.77–6.76(m,1h),2.38(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.2,137.8,136.8,129.8,129.7,129.4,125.2,122.2,120.6,120.3,110.9,99.5,21.4ppm.。
实施例24
实施例24所得产物的比移值rf=0.44(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图24a和24b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.32(brs,1h),7.66–7.60(m,3h),7.50–7.47(m,2h),7.42–7.40(m,1h),7.23–7.13(m,2h),6.83–6.82(m,1h),1.39(s,9h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:151.0,138.1,136.8,129.7,129.5,126.1,125.0,122.2,120.7,120.3,111.0,99.6,34.8,31.4ppm.
实施例25
实施例25所得产物的比移值rf=0.3(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图25a和25b,谱图数据为:1hnmr(400mhz,dmso-d6)δ:11.41(brs,1h),7.80–7.78(m,2h),7.49(d,j=7.8hz,1h),7.39–7.37(m,1h),7.08–6.96(m,4h),6.75–6.74(m,1h),3.80(s,3h)ppm.13c{1h}nmr(101mhz,dmso-d6)δ:158.8,137.8,137.0,128.9,126.4,125.0,121.1,119.7,119.3,114.4,111.1,97.4,55.2ppm.
实施例26
实施例26所得产物的比移值rf=0.56(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图26a和26b,谱图数据为:1hnmr(400mhz,dmso-d6)δ:11.76(brs,1h),8.06(d,j=8.1hz,2h),7.80(d,j=8.2hz,2h),7.57(d,j=7.9hz,1h),7.44(d,j=8.2hz,1h),7.17–7.13(m,1h),7.07–7.01(m,2h)ppm.13c{1h}nmr(101mhz,dmso-d6)δ:137.6,136.1,135.9,128.5,127.3(q,j2c-f=31.9hz),125.9(q,j3c-f=4.0hz),125.4,124.4(q,j1c-f=272.8hz),122.5,120.6,119.8,111.6,100.8ppm.
实施例27
实施例27所得产物的比移值rf=0.46(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图27a和27b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.25(brs,1h),7.65–7.59(m,3h),7.41–7.39(m,1h),7.24–7.20(m,1h),7.17–7.12(m,3h),6.77(d,j=2.1hz,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:162.5(d,j1c-f=248.6hz),137.1,136.9,129.4,128.8(d,j4c-f=3.3hz),127.0(d,j3c-f=8.1hz),122.5,120.8,120.5,116.2(d,j2c-f=21.8hz),111.0,100.0(d,j5c-f=1.3hz)ppm.
实施例28
实施例28所得产物的比移值rf=0.30(石油醚:乙酸乙酯=20:1),熔点mp298–300℃,产物的氢谱和碳谱核磁共振谱图分别为图28a和28b,谱图数据为:1hnmr(400mhz,dmso-d6)δ:11.61(brs,1h),7.98–7.95(m,2h),7.80–7.73(m,4h),7.56–7.47(m,3h),7.44–7.36(m,2h),7.13–7.09(m,1h),7.03–6.96(m,2h)ppm.13c{1h}nmr(101mhz,dmso-d6)δ:139.6,138.9,137.2,131.3,129.0,128.7,127.6,127.1,126.5,125.5,121.7,120.1,119.5,111.3,98.9ppm.oneresonancewasnotobservedduetooverlappingresonances.ir(neat):3447,2922,2851,1667,1600,1448,1420,1345,837,795,764,746cm-1.hrms:calcdforc20h16n[m+h]+270.1283,found270.1288.
实施例29
实施例29所得产物的比移值rf=0.27(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图29a和29b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.30(brs,1h),7.63–7.61(m,1h),7.36–7.30(m,2h),7.22–7.16(m,3h),7.13–7.09(m,1h),6.87–6.84(m,1h),6.81–6.80(m,1h),3.84(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:160.2,137.9,136.9,133.9,130.2,129.3,122.5,120.8,120.4,117.8,113.2,111.10,111.06,100.3,55.5ppm.
实施例30
实施例30所得产物的比移值rf=0.27(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图30a和30b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.36(brs,1h),7.67–7.64(m,1h),7.41–7.38(m,1h),7.24–7.20(m,1h),7.17–7.13(m,1h),6.84–6.82(m,3h),6.48–6.46(m,1h),3.87(s,6h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:161.3,137.9,136.8,134.4,129.2,122.6,120.8,120.4,111.1,103.7,100.5,99.7,55.6ppm.
实施例31
实施例31所得产物的比移值rf=0.51(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图31a和31b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.28(brs,1h),7.63(d,j=7.8hz,1h),7.42–7.31(m,4h),7.24–7.19(m,1h),7.15–7.11(m,1h),7.03–6.98(m,1h),6.83(d,j=2.2hz,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:163.4(d,j1c-f=247.0hz),137.0,136.7(d,j7c-f=2.9hz),134.7(d,j5c-f=8.2hz),130.8(d,j4c-f=8.5hz),129.2,123.0,121.0,120.8(d,j6c-f=2.9hz),120.6,114.6(d,j3c-f=21.4hz),112.2(d,j2c-f=23.0hz),111.1,101.0ppm.
实施例32
实施例32所得产物的比移值rf=0.41(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图32a和32b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.41(brs,1h),8.00–7.99(m,1h),7.87–7.76(m,4h),7.66–7.64(m,1h),7.51–7.44(m,2h),7.41–7.38(m,1h),7.23–7.12(m,2h),6.93–6.92(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:138.0,137.1,133.7,133.0,129.8,129.5,128.9,128.1,127.9,126.8,126.3,123.9,123.1,122.7,120.9,120.5,111.1,100.8ppm.
实施例33
实施例33所得产物的比移值rf=0.16(石油醚:乙酸乙酯=20:1),熔点mp206–208℃,产物的氢谱和碳谱核磁共振谱图分别为图33a和33b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.36(brs,1h),7.92–7.91(m,1h),7.65–7.56(m,2h),7.42–7.37(m,2h),7.20–7.10(m,3h),6.80(dd,j=1.0,2.1hz,1h),6.55(dd,j=0.9,3.2hz,1h),3.82(s,3h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:139.8,136.8,136.6,130.0,129.8,129.0,124.2,121.7,120.4,120.1,120.0,117.6,110.8,110.0,101.5,98.7,33.1ppm.ir(neat):3407,3100,2942,2217,1560,1449,1340,1266,1243,1147,1080,892,801,731cm-1.hrms:calcdforc17h15n2[m+h]+247.1235,found247.1238.
实施例34
实施例34所得产物的比移值rf=0.11(石油醚:乙酸乙酯=5:1),产物的氢谱和碳谱核磁共振谱图分别为图34a和34b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.95(brs,1h),8.66–8.65(m,2h),7.68–7.66(m,1h),7.57–7.55(m,2h),7.44–7.42(m,1h),7.28–7.24(m,1h),7.18–7.14(m,1h),7.06–7.05(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:150.5,139.7,137.6,134.7,128.9,123.9,121.5,120.9,119.3,111.4,103.0ppm.
实施例35
实施例35所得产物的比移值rf=0.27(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图35a和35b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.98(dd,j=0.8,2.3hz,1h),8.83(brs,1h),8.56(dd,j=4.8,1.6hz,1h),7.97–7.94(m,1h),7.65(d,j=8.0hz,1h),7.44–7.41(m,1h),7.39–7.36(m,1h),7.25–7.21(m,1h),7.17–7.13(m,1h),6.91–6.90(m,1h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:148.6,146.5,137.4,134.6,132.6,129.1,128.7,124.0,123.2,121.0,120.7,111.3,101.4ppm.
实施例36
实施例36所得产物的比移值rf=0.66(石油醚:乙酸乙酯=20:1),产物的氢谱和碳谱核磁共振谱图分别为图36a和36b,谱图数据为:1hnmr(400mhz,cdcl3)δ:7.96(brs,1h),7.61–7.58(m,1h),7.36–7.34(m,1h),7.19–7.10(m,2h),6.31–6.30(m,1h),1.43(s,9h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:148.9,135.9,128.6,121.2,120.1,119.7,110.5,97.1,31.9,30.4ppm.
实施例37
实施例37所得产物的比移值rf=0.28(石油醚:乙酸乙酯=10:1),产物的氢谱和碳谱核磁共振谱图分别为图37a和37b,谱图数据为:1hnmr(400mhz,cdcl3)δ:9.90(brs,1h),8.60–8.58(m,1h),7.55–7.39(m,8h),7.36–7.34(m,1h),7.27–7.23(m,1h),7.11–7.07(m,2h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:150.6,149.3,136.3,135.5,135.4,132.1,130.7,129.8,129.0,127.2,123.7,122.0,121.7,120.22,120.19,117.1,111.3ppm.ir(neat):3433,3205,3057,1591,1564,1495,1450,1329,1250,742,702cm-1.hrms:calcdforc19h15n2[m+h]+271.1235,found271.1232.
实施例38
实施例38所得产物的比移值rf=0.23(石油醚:乙酸乙酯=5:1),熔点mp200–202℃,产物的氢谱和碳谱核磁共振谱图分别为图38a和38b,谱图数据为:1hnmr(400mhz,cdcl3)δ:8.75–8.74(m,1h),8.68(brs,1h),8.53–8.51(m,1h),7.69–7.66(m,2h),7.48–7.38(m,5h),7.34–7.16(m,4h)ppm.13c{1h}nmr(101mhz,cdcl3)δ:148.8,148.6,136.4,135.7,134.5,130.6,130.2,129.1,129.0,128.7,126.8,123.6,123.5,120.9,120.1,116.8,111.2ppm.ir(neat):3140,3056,1598,1547,1508,1457,1251,1044,774,702cm-1.hrms:calcdforc19h15n2[m+h]+271.1235,found271.1232.
其他实施例如下所示:
实施例39
将实施例7中的式1的量更换为3mmol,式2的量更换为1mmol,cpme的量更换为1ml,二(三甲基硅基)氨基锂2mmol,氟化铯1mmol,其余的条件与实施例7相同,得到产物,收率为99%。
实施例40
将实施例7中的式1的量更换为3mmol,式2的量更换为1mmol,cpme的量更换为2ml,二(三甲基硅基)氨基锂2mmol,氟化铯1mmol,其余的条件与实施例7相同,得到产物,收率为87%。
实施例41
将实施例7中的式1的量更换为15mmol,式2的量更换为5mmol,cpme的量更换为5ml,二(三甲基硅基)氨基锂10mmol,氟化铯5mmol,其余的条件与实施例7相同,得到产物,收率为81%。
实施例42
将实施例3中的式1的量更换为15mmol,式2的量更换为5mmol,cpme的量更换为10ml,其余的条件与实施例3相同,得到产物,收率为81%。
实施例43
将实施例3中的式1的量更换为75mmol,式2的量更换为25mmol,cpme的量更换为50ml,其余的条件与实施例3相同,得到产物,收率为76%。
实施例44
将实施例10中的式1的量更换为5mmol,式2的量更换为20mmol,cpme的量更换为5ml,其余的条件与实施例10相同,得到产物,收率为80%。
实施例45
将实施例10中的式1的量更换为25mmol,式2的量更换为100mmol,cpme的量更换为25ml,其余的条件与实施例10相同,得到产物,收率为78%。
实施例46
将实施例11中的式1的量更换为15mmol,式2的量更换为5mmol,cpme的量更换为10ml,其余的条件与实施例11相同,得到产物,收率为55%。
实施例47
采用2-氟甲苯(0.15mmol),苯甲腈(0.1mmol),强碱二(三甲基硅基)氨基锂(0.1mmol),溶剂为环戊基甲基醚(1ml),三氟乙酸铯(0.1mmol),其他条件与实施例1相同,产物收率为2%。
实施例48
将实施例47中铯盐添加剂改为氟化铯(0.1mmol),其他条件不变,产物收率为46%。
实施例49
将实施例47中铯盐添加剂改为碳酸铯(0.1mmol),其他条件不变,产物收率为35%。
实施例50
在手套箱中将二(三甲基硅基)氨基铯也即cshmds(0.20mmol)加入微波管中,加入0.1ml环戊基甲基醚,然后用微量注射器分别加入2-氟甲苯(0.30mmol)和苯甲腈(0.10mmol),加盖从手套箱取出,在110℃下回流12小时,冷却至室温,启盖并加三滴水淬灭反应,减压去除溶剂,粗产品柱层析分离(石油醚:乙酸乙酯=20:1),即可得2-苯基吲哚,产率为88%。
实施例51
在手套箱中将二(三甲基硅基)氨基锂也即lihmds(0.20mmol)加入微波管中,加入0.1ml环戊基甲基醚,然后用微量注射器分别加入2-氟甲苯(0.30mmol)和苯甲腈(0.30mmol),加盖从手套箱取出,在90℃下回流12小时,冷却至室温,启盖并加三滴水淬灭反应,减压去除溶剂,粗产品柱层析分离(石油醚:乙酸乙酯=20:1),即可得2-苯基吲哚,产率为49%。
实施例52
将实施例51中的反应温度改为100℃,其他条件和原料不变,得到的产物产率为70%。
实施例53
将实施例51中的反应温度改为120℃,其他条件和原料不变,得到的产物产率为74%。
实施例54
将实施例51中的反应温度改为130℃,其他条件和原料不变,得到的产物产率为68%。
- 还没有人留言评论。精彩留言会获得点赞!