一种CAR-T细胞的制备方法与流程
本发明属于生物技术领域,涉及一种car-t细胞的制备方法。
背景技术:
癌症是由正常细胞组成,这些细胞经历了表观遗传转化而变成异常癌细胞。癌细胞能够表达与正常细胞表达不同的蛋白质和其他抗原。这些异常的肿瘤抗原可被人体先天免疫系统用于特异性靶向和杀死癌细胞。然而,癌细胞采用各种机制来阻止免疫细胞如t和b淋巴细胞成功靶向癌细胞。
人t细胞疗法依赖体外富集或修饰的人t细胞靶向和杀死受试者中的癌细胞。目前医学领域已经开发了各种技术来富集能够靶向肿瘤抗原的天然存在的t细胞的浓度或者遗传修饰t细胞以特异性靶向已知的癌症抗原。已证实这些疗法对肿瘤大小和患者存活具有有希望的效果。然而,难以预测给定的t细胞疗法是否会对每位患都者有效。
嵌合抗原受体t细胞疗法的出现是免疫治疗领域的一大突破性进展。car-t疗法是利用患者自身免疫细胞杀伤肿瘤细胞,是一种特异性杀伤肿瘤细胞的方法,该治疗方法通过提取患者外周血中的t淋巴细胞,再将提取的t淋巴细胞通过基因工程方法进行改造,改造后的t淋巴细胞具备强大的特异性识别肿瘤抗原的能力。
然而用于治疗剂量的car-t细胞由于受到制备方法的限制,制备出的car-t细胞处于分化的终末阶段,阳性率较低,导致回输的car-t细胞仅仅具有短期的效果,car-t细胞在体内存活时间较短导致疗法缺乏延续性。既往的car-t细胞制备方法产生易于耗竭且疗效的细胞产物。现今对于改善car-t细胞的制备方法存在改善空间。
因此,研发一种优化的car-t细胞的制备方法,提升car阳性率,延缓t细胞的终末分化,改善体内存活情况,具有广阔的应用前景和巨大的市场价值。
技术实现要素:
针对现有技术的不足及实际的需求,本发明提供一种car-t细胞的制备方法,所述方法在t淋巴细胞激活和慢病毒感染过程时添加akt抑制剂mk2206,得到的car-t细胞的car阳性率显著提升,其在体内的存活情况明显改善。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种car-t细胞的制备方法,所述方法包括如下步骤:
(1)分离外周血单个核细胞,得到t淋巴细胞;
(2)将步骤(1)的t淋巴细胞激活的同时加入akt抑制剂孵育培养;
(3)将包含嵌合抗原受体的慢病毒载体或慢病毒在akt抑制剂的作用下转导或感染步骤(2)孵育培养的t淋巴细胞,得到car-t细胞并进行增殖。
本发明中,发明人在长期的科研实践过程中,为提高car-t细胞的car表达阳性率并改善在体内的存活扩增情况,广泛摸索筛选有效的添加剂及添加时间,深入研究现有技术的论文及科研成果,发现阻滞细胞周期g1期与g2m期后,病毒生物学周期中的逆转录产物、2-ltr环和前整合体复合物总体数量显著提升,从而提升病毒转染效率;本发明检验了akt抑制剂对于t细胞g1期与g2m的阻滞情况后将这种方法运用于car-t细胞的制备,成功制备出了阳性率提升的car-t细胞;本发明建立的方法实现在体外检测到杀伤能力未受损的情况下,延缓细胞终末分化并提升了car的阳性率,car-t细胞在体内的存活情况更好,疗效肿瘤效果更佳,为car-t细胞的制备提供了新的思路和方法。
所述肿瘤包括结肠癌
优选地,步骤(1)所述分离的方法包括ficoll密度梯度离心法和/或percoll分层液法,优选为ficoll密度梯度离心法。
优选地,步骤(2)所述akt抑制剂包括a6730、b2311、124018、rx-0201、vqd-002、ly294002、akti-1、akti-2、akt抑制剂iii、akt抑制剂viii或mk-2206中的任意一种或至少两种的组合,优选为mk2206。
优选地,步骤(2)所述akt抑制剂的浓度为0.1-2μm,例如可以是0.1μm、0.2μm、0.3μm、0.4μm、0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1μm、1.2μm、1.4μm、1.5μm、1.6μm、1.8μm或2μm。
优选地,步骤(2)所述激活的方法为加入抗体磁珠活化刺激。
优选地,所述抗体包括cd3和/或cd28。
优选地,步骤(3)所述akt抑制剂包括6730、b2311、124018、rx-0201、vqd-002、ly294002、akti-1、akti-2、akt抑制剂iii、akt抑制剂viii或mk-2206中的任意一种或至少两种的组合,优选为mk2206。
优选地,步骤(3)所述akt抑制剂的浓度为0.1-2μm,例如可以是0.1μm、0.2μm、0.3μm、0.4μm、0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1μm、1.2μm、1.4μm、1.5μm、1.6μm、1.8μm或2μm。
优选地,步骤(3)所述转导的时间为激活后24-48h,例如可以是24h、26h、28h、30h、32h、34h、36h、38h、40h、42h、44h、46h或48h。
作为优选技术方案,一种car-t细胞的制备方法,具体包括如下步骤:
(1)ficoll密度梯度离心法分离外周血单个核细胞,得到t淋巴细胞;
(2)将步骤(1)的t淋巴细胞与cd3、cd28抗体偶联的磁珠相接触激活的同时加入0.1-2μm的akt抑制剂mk2206孵育培养;
(3)将包含嵌合抗原受体的慢病毒载体或慢病毒在0.1-2μm的akt抑制剂mk2206的作用下转导或感染步骤(2)孵育培养24-48h的t淋巴细胞,得到car-t细胞并进行增殖。
第二方面,本发明提供一种采用第一方面所述方法制备得到的car-t细胞。
与现有技术相比,本发明具有如下有益效果:
本发明提供的方法简洁高效,便于操作,能够显著提高car-t细胞的car阳性率并延缓t细胞向终末分化并改善在体内的存活情况,不影响t细胞的增殖能力,不损伤car-t细胞因子释放能力和car-t细胞杀伤能力,car-t体内存活较好,小鼠生存期明显延长。
附图说明
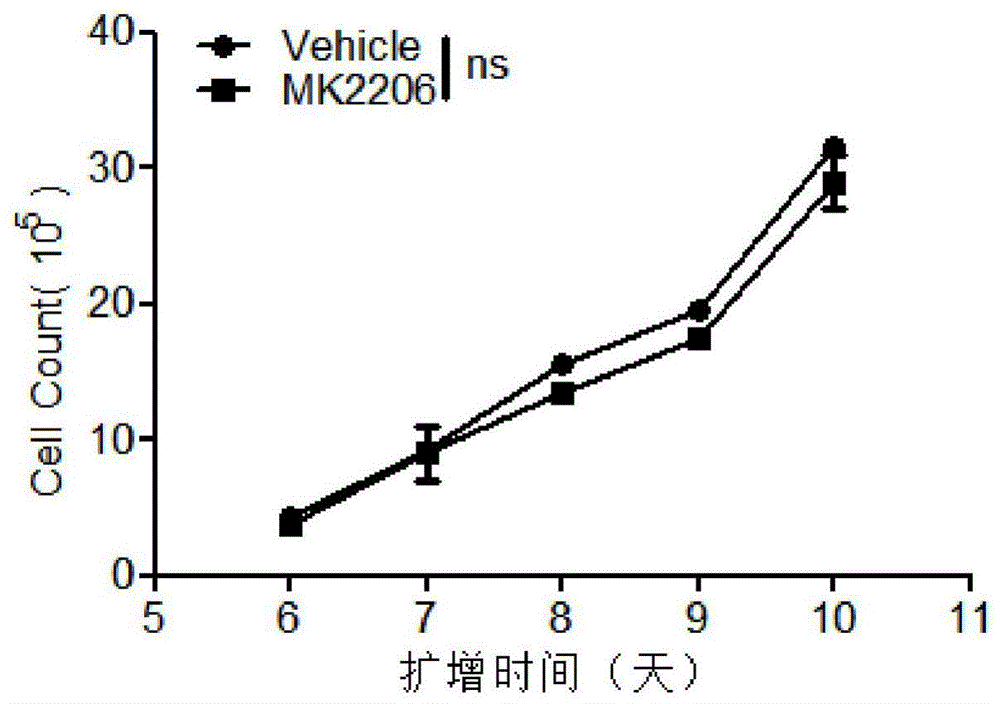
图1为本发明的体外用mk2206培养的t细胞的增殖结果图,纵坐标为细胞计数;
图2为本发明的体外用mk2206延缓car-t细胞终末分化结果图,mk2206显著提升了tcm细胞群的比例,图2左侧的流式细胞图的数值依次为:单独的il-2处理组:naive(21.8%)、tcm(19.4%)、tem(18.7%)、teff(40.8%);用il-2和mk2206的处理组:naive(20.3%),tcm(49.5%),tem(18.1%),teff(12.1%);
图3为本发明的体外用mk2206处理的car-t细胞car阳性率表达结果图,单独的il-2培养的培养物car阳性率为34.3%,用il-2和mk2206培养的car-t细胞的car阳性率表达明显提升至53.9%。
图4为本发明的体外检测mk2206处理的car-t细胞细胞因子释放能力结果图;
图5为本发明的rtca监测mk2206处理的car-t细胞体外杀伤能力结果图,纵坐标normalizecellindex表示靶细胞增殖情况,单独的il-2与用il-2和mk2206培养的car-t细胞对靶细胞的杀伤效果一致;
图6为本发明的用mk2206处理的car-t细胞疗效结果图;
图7为本发明的用mk2206处理的car-t细胞在体内存活情况图;
图8为本发明的car-t细胞治疗结肠癌细胞hct116转移瘤小鼠的生存期统计结果图,横坐标为跟踪时间(天),纵坐标为存活百分比(%)。
具体实施方式
为更进一步阐述本发明所采取的技术手段及其效果,以下结合附图并通过具体实施方式来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
实施例1体外用mk2206培养的t细胞的增殖
本实施例的目的是确定mk2206对t细胞的增殖的作用,通过细胞计数来评估mk2206对t细胞增殖的影响。
在第0天,向t细胞培养物中添加mk2206以后,在第5天撤去药物,通过细胞计数来评估mk2206对细胞增殖的影响,持续计数至第10天扩增结束,结果见图1;
由图1可知,mk2206处理未减弱t细胞的增殖,与未处理组相比无统计学意义。
实施例2体外用mk2206处理的car-t细胞延缓终末分化
用mk2206培养car-t细胞,在实验组中,通过添加含il-2和2μmmk2206的培养基,使用cd3,cd28抗体偶联的磁珠活化t细胞,在活化两天以后添加携带car序列的慢病毒,共培养10天。
在培养结束时,通过流式细胞术来评估car-t细胞cd45ra,ccr-7的表达,利用特异的cd45ra与ccr-7的抗体,用染色来确定细胞分化情况,结果见图2;
由图2可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞的中央记忆细胞群细胞比例显著升高。
实施例3体外用mk2206处理的car-t细胞显著提升car阳性率表达
对实施例2制备的car-t细胞,在病毒转导后继续培养至第10天,通过流式细胞术来评估car-t细胞car序列的表达,利用特异的抗car结构的抗体,用流式染色来确定car的表达,结果见图3;
由图3可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞的car阳性率表达明显提升。
实施例4体外检测mk2206处理的car-t细胞细胞因子释放能力
对如实施例2、3中所描述的mk2206处理的car-t细胞进行测试,体外利用elisa实验检测细胞因子ifn-gamma,granzymeb以评价分化较早的、car表达增高的car-t细胞细胞因子释放能力。
用相等的car-t细胞数量与靶细胞共孵育后收集上清,使用elisa实验检测细胞因子ifn-gamma、granzyme释放情况,结果见图4;
由图4可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞因子释放能力未受损。
实施例5rtca监测mk2206处理的car-t细胞体外杀伤能力
对如实施例2、3中所描述的mk2206处理的car-t细胞进行测试,以评价体外短期的杀伤能力是否受损。
用相等的car-t细胞数量与靶细胞共孵育,结果见图5;
由图5可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞杀伤能力未受损。
实施例6用mk2206处理的car-t细胞在体内具有改善疗效
对如实施例2、3所描述的用mk2206处理的car-t细胞进行测试,以评价延缓分化、阳性率增加是否与抗肿瘤活性相关。
在用il-2和mk2206培养之后,用相等的car-t细胞剂量(3*10^6个car-t细胞)尾静脉输注具有结肠癌细胞hct116全身转移的动物,两周后通过活体成像评价治疗效果,结果见图6;
由图6可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞治疗效果较好。
实施例7用mk2206处理的car-t细胞在体内具有改善存活的情况
对如实施例2、3所描述的用mk2206处理的car-t细胞进行测试,以评价分化较早、阳性率增加的car-t细胞在体内是否有改善存活情况。
用相等的car-t细胞剂量(3*10^6个细胞)输注结肠癌细胞hct116全身转移的小鼠,通过小鼠尾静脉采血,使用抗cd3的抗体检测小鼠体内car-t细胞的增殖情况,结果见图7所示;
由图7可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞存活情况较好。
实施例8用mk2206处理的car-t细胞显著延长了小鼠的生存期
对如实施例2,3所描述的用mk2206处理的car-t细胞进行测试,以评价分化较早、阳性率增加的car-t细胞在体内是否有改善的疗效。
用相等的car-t细胞剂量(3*10^6个细胞)输注结肠癌细胞hct116全身转移的小鼠,通过统计生存期比较疗效,结果见图8所示;
由图8可知,与用单独的il-2培养的培养物相比,用il-2和mk2206培养的car-t细胞治疗的小鼠生存期显著延长。
综上所述,本发明提供了一种car-t细胞的制备方法,所述方法在t淋巴细胞活化及慢病毒感染过程添加akt抑制剂mk2206,得到的car-t细胞的car阳性率显著提升,其在体内的存活情况明显改善,实现在体外检测到杀伤能力未受损的情况下,延缓分化与提升阳性率,car-t细胞在体内的存活状态更好,治疗效果更佳,具有广阔的应用前景和巨大的市场价值。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!