调控玉米雄穗构型的启动子、分子标记及其应用的制作方法
本发明涉及与玉米雄穗分枝数相关的dna序列,尤其涉及调控玉米雄穗构型的启动子序列及其突变体、分子标记和检测引物,本发明进一步涉及它们在玉米分子育种中的应用,属于调控玉米雄穗构型的启动子、其突变体及其应用领域。
背景技术:
雄穗是玉米重要的生殖器官,其影响玉米的冠层结构组成及光合产物的分配从而影响产量。雄穗生长在玉米植株顶端,其大小直接影响玉米群体中的通风透光情况(遮蔽光照可达6.5-28.8%);并且雄穗造成的过量的花粉散落(尤其是过大的雄穗),会造成下层叶片上粉尘的黏着而影响光合作用,影响“源”的供给。此外,雄穗也是重要的“库”器官,且发育比雌穗早,在营养竞争上明显比雌穗优越,而二者的竞争将直接影响玉米的收获产量。一般情况下,雄穗的大小与产量呈负相关,相关系数达-0.65,在产量形成总变异中其作用可高达37.4%;生产实际中也证实,玉米散粉后去雄可以显著提高玉米产量5.3-16.0%,反映了雄穗与产量之间的重要关系。
雄穗构型影响玉米的耐密植育种。研究发现过去几十年的玉米育种过程中玉米单株产量和杂种优势的提升并不明显,单产的增加更多的是由于种植密度和品种耐密性的持续增长。因此,提高品种耐密性和种植密度是提高玉米单产的关键。
密植条件下,玉米植株之间距离更近、竞争更加激烈。大的雄穗势必造成遮荫,影响光合作用,加剧与雌穗的营养竞争,浪费资源,从而直接影响产量。同时,大的雄穗也势必增加玉米植株的重心,造成“头重脚轻”的现象,增加玉米的倒伏风险,从而间接影响产量。过去几十年中玉米的雄穗大小经历了连续的高强度选择,特别是育种进程比较快的商业化育种单位,雄穗减小甚至超过36%,揭示了雄穗大小的改良对玉米耐密植育种的重要意义。
已有研究表明tsh4是调控玉米雄穗和雌穗发育的关键基因,但该基因的突变体会带来诸多不利的性状,无法直接应用到玉米的育种实践中。tsh4最早由美国冷泉港sarahhake实验室克隆和报道。tsh4编码一个受mir156调控的squamosa-promoterbindingprotein-like(spl)转录因子。该基因在花器官的边界建立和边界分生组织的命运决定方面发挥关键作用。该基因突变后可显著降低玉米雄穗分枝数,但同时也带来雄穗小花数减少,小花包被苞叶,雄穗和雌穗基部簇生苞叶,雌穗的穗行数紊乱,穗行数和穗粒数减少等对玉米生产不利的表型。研究发现,关键基因的表达调控而非功能的改变,会起到微调特定基因而达到改良目标性状、但不带来不利影响的目的。玉米经历了长期的自然和人工选择,很可能含有这种表达调控的变异资源,找到这种变异并开发出相应的分子标记将为特异的改良玉米的雄穗分枝数(但不影响其他农艺性状)起到极大的帮助作用。
技术实现要素:
本发明的目的之一是提供一种调控玉米雄穗构型的启动子序列;
本发明的目的之二是提供所述调控玉米雄穗构型的启动子序列的突变体;
本发明的目的之三是提供用作调控tsh4基因在玉米雄穗中表达的分子标记;
本发明的目的之四是提供一种检测所述分子标记的变异情况的检测引物;
本发明的目的之五是提供检测玉米中tsh4基因表达量的检测引物;
本发明的目的之六是将所述的启动子序列、其突变体、分子标记以及检测分子标记的变异情况的检测引物以及检测玉米中tsh4基因表达量的检测引物应用于玉米分子育种。
本发明的上述目的是通过以下技术方案来实现的:
本发明首先提供了一种调控玉米雄穗构型的启动子序列,其多核苷酸为(a)、(b)、(c)或(d)所示:
(a)seqidno.1所示的多核苷酸;或
(b)与seqidno.1的互补序列在严谨杂交条件能够进行杂交的多核苷酸;或
(c)与seqidno.1所示的多核苷酸至少有90%或以上同源性的多核苷酸;或
(d)在seqidno.1所示的多核苷酸的基础上进行一个或多个碱基的缺失、取代或插入所得到的突变体,且该突变体仍具有调控玉米雄穗构型的启动子功能或活性。
所述的启动子序列能够调控tsh4基因在玉米雄穗中的表达量变化。
在本发明的上下文中,术语“突变体”是含有变化的启动子,在所述启动子中,优选在基本保持启动子功能的同时缺失、添加和/或替代原始启动子的一个或多个核苷酸。例如,可以从启动子5’或3’末端缺失一个或多个碱基对以产生“截短的”启动子;也可以在启动子内部插入、缺失或替代一个或多个碱基对。在启动子片段的情况下,启动子的突变体可以包含影响与其可操作地连接的最小启动子转录的改变。可以通过例如标准dna诱变技术或通过化学合成变体启动子或其部分而产生变体启动子。突变体多核苷酸还包括合成来源的多核苷酸,例如采用定点诱变所得到的突变体,或者是通过重组的方法(例如dna改组)所得到的突变体,或者是通过自然选择所得到的突变体。
作为所述突变体的一种优选的实施方案,本发明提供了一种调控玉米雄穗构型的启动子的突变体,其多核苷酸序列如seqidno.2所示,该突变体是在indel_7_133209283_c/ct处缺少1bp的碱基插入,该突变体能够调控tsh4基因在玉米雄穗中的表达,表现出雄穗分枝数减少,但不带来其余不利的表型。
由此,indel_7_133209283_c/ct能够作为调控tsh4基因在玉米雄穗中表达的分子标记。
本发明进一步提供了用于检测indel_7_133209283_c/ct变异情况的检测引物;作为一种优选的实施方案,所述的用于检测indel_7_133209283_c/ct变异情况的特异性检测引物的核苷酸序列分别为seqidno.3和seqidno.4所示;采用所述特异性检测引物可对玉米品种中的indel_7_133209283_c/ct的变异情况进行检测,从而用于玉米的分子辅助育种。
本发明还进一步提供了用于检测tsh4基因表达量的特异性扩增引物及其在玉米育种中的应用,该特异性检测引物序列分别为seqidno.5和seqidno.6所示,应用该特异性检测引物可对玉米品种的tsh4基因表达量进行检测,进而为玉米育种提供参考。
进一步的,含有所述seqidno.1所述的启动子或seqidno.2所示的启动子的突变体的表达盒、含有该表达盒的重组植物表达载体、转基因细胞系和宿主菌均属于本发明的保护范围。
所述的重组植物表达载体是将所述表达盒与质粒或表达载体所构建得到的重组植物表达载体并且能够将所述表达盒转入植物宿主细胞、组织或器官中。
本发明的启动子或其突变体可以用于制备转基因植物。譬如,通过农杆菌介导、基因枪法等方法将含有所述启动子或其突变体的重组植物表达载体导入植物细胞、组织或器官中,再将该转化的植物细胞、组织或器官培育成植株,获得转基因植物。用于构建所述植物表达载体的出发载体可为任意一种用于农杆菌转化植物的双元载体或可用于植物微弹轰击的载体等。
为了实施本发明,制备和使用植物表达载体和宿主细胞的常规组合物和方法为本领域技术人员所熟知,具体方法可以参考例如sambrook等。
所述重组植物表达载体还可含有用于选择转化细胞的选择性标记基因。选择性标记基因用于选择经转化的细胞或组织。所述的标记基因包括:编码抗生素抗性的基因以及赋予除草化合物抗性的基因等。此外,所述的标记基因还包括表型标记,例如β-半乳糖苷酶和荧光蛋白等。
总之,可将本发明提供的启动子序列、该启动子序列的突变体、分子标记indel_7_133209283_c/ct以及检测indel_7_133209283_c/ct的变异情况的特异性检测引物以及检测tsh4基因表达量的特异性检测引物等应用于培育高产或耐密植的玉米新品种,尤其是应用在改良雄穗构型、提高玉米产量等方面。
作为参考,本发明提供了一种调控玉米的雄穗分枝数的方法,包括:用seqidno.1所示的启动子或seqidno.2所示的启动子的突变体调控tsh4基因在玉米中进行表达。
作为参考,本发明还提供了一种培育高产或耐密植的玉米新品种的方法,包括:(1)将tsh4基因连接在seqidno.2所示启动子的突变体的下游构成表达盒;将所述表达盒与植物表达载体连接构建得到重组植物表达载体;(2)将所构建的重组植物表达载体转化到玉米中;(3)筛选得到雄穗分枝数降低的转基因植物新品种;或进一步培育得到高产或耐密植的玉米新品种。
本发明中所述的转化方案以及将所述多核苷酸或多肽引入植物的方案可视用于转化的植物(单子叶植物或双子叶植物)或植物细胞的类型而变化。将所述多核苷酸或多肽引入植物细胞的合适方法包括:显微注射、电穿孔、农杆菌介导的转化、直接基因转移以及高速弹道轰击等。在特定的实施方案中,可利用多种瞬时转化法将本发明的表达盒提供给植物。利用常规方法可使已转化的细胞再生稳定转化植株(mccormicketal.plantcellreports.1986.5:81-84)。
本发明可用于转化任何植物种类,包括但不限于:单子叶植物或双子叶植物,优选是玉米。
本发明所提供的调控玉米雄穗构型的启动子或其突变体能够调控tsh4基因在玉米雄穗中的表达,其对改良玉米雄穗分枝数和株型具有重要意义,还可将其进一步应用于玉米新品种的选育。本发明还进一步提供了用作调控tsh4基因表达的分子标记indel_7_133209283_c/ct、检测所述分子标记indel_7_133209283_c/ct的变异情况的特异性检测引物以及检测玉米中tsh4基因表达量的特异性检测引物,这些均能直接应用于定向改良玉米的雄穗分枝数,对于玉米耐密植和高产新品种选育也具有重要的应用潜力。
本发明所涉及到的术语定义
除非另外定义,否则本文所用的所有技术及科学术语都具有与本发明所属领域的普通技术人员通常所了解相同的含义。虽然在本发明的实践或测试中可使用与本文所述者类似或等效的任何方法、装置和材料,但现在描述优选方法、装置和材料。
术语“多核苷酸”或“核苷酸”意指单股或双股形式的脱氧核糖核苷酸、脱氧核糖核苷、核糖核苷或核糖核苷酸及其聚合物。除非特定限制,否则所述术语涵盖含有天然核苷酸的已知类似物的核酸,所述类似物具有类似于参考核酸的结合特性并以类似于天然产生的核苷酸的方式进行代谢。除非另外特定限制,否则所述术语也意指寡核苷酸类似物,其包括pna(肽核酸)、在反义技术中所用的dna类似物(硫代磷酸酯、磷酰胺酸酯等等)。除非另外指定,否则特定核酸序列也隐含地涵盖其保守修饰的变异体(包括(但不限于)简并密码子取代)和互补序列以及明确指定的序列。特定而言,可通过产生其中一个或一个以上所选(或所有)密码子的第3位经混合碱基和/或脱氧肌苷残基取代的序列来实现简并密码子取代(batzer等人,nucleicacidres.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);和cassol等人,(1992);rossolini等人,molcell.probes8:91-98(1994))。
术语“同源性”指多核苷酸序列之间在百分比核苷酸位置同一性(即序列相似性或同一性)方面的相似性或百分同一性的水平。此处所用的术语同源性也指不同多核苷酸分子之间相似的功能特性的概念,例如具有相似功能的启动子可能具有同源的顺式元件。当多核苷酸分子在特定条件下特异性地杂交以形成双链体分子时,它们是同源的。在这些条件下(称为严谨杂交条件)一个多核苷酸分子可以用作鉴定共有同源性的另一个多核苷酸分子的探针或引物。
本发明中所述“严谨杂交条件”意指在所属领域中已知的低离子强度和高温的条件。通常,在严谨条件下,探针与其靶序列杂交的可检测程度比与其它序列杂交的可检测程度更高(例如超过本底至少2倍。严谨杂交条件是序列依赖性的,在不同的环境条件下将会不同,较长的序列在较高温度下特异性杂交。通过控制杂交的严谨性或洗涤条件可鉴定与探针100%互补的靶序列。对于核酸杂交的详尽指导可参考有关文献(tijssen,techniquesinbiochemistryandmolecularbiology-hybridizationwithnucleicprobes,"overviewofprinciplesofhybridizationandthestrategyofnucleicacidassays.1993)。更具体的,所述严谨条件通常被选择为低于特异序列在规定离子强度ph下的热熔点(tm)约5-10℃。tm为在平衡状态下50%与目标互补的探针杂交到目标序列时所处的温度(在指定离子强度、ph和核酸浓度下)(因为目标序列过量存在,所以在tm下在平衡状态下50%的探针被占据)。严谨条件可为以下条件:其中在ph7.0到8.3下盐浓度低于约1.0m钠离子浓度,通常为约0.01到1.0m钠离子浓度(或其它盐),并且温度对于短探针(包括(但不限于)10到50个核苷酸)而言为至少约30℃,而对于长探针(包括(但不限于)大于50个核苷酸)而言为至少约60℃。严谨条件也可通过加入诸如甲酰胺的去稳定剂来实现。对于选择性或特异性杂交而言,正信号可为至少两倍的背景杂交,视情况为10倍背景杂交。例示性严谨杂交条件可如下:50%甲酰胺,5×ssc和1%sds,在42℃下培养;或5×ssc,1%sds,在65℃下培养,在0.2×ssc中洗涤和在65℃下于0.1%sds中洗涤。所述洗涤可进行5、15、30、60、120分钟或更长时间。
本发明中所述的“多个”通常意味着2-8个,优选为2-4个;所述的“替换”是指分别用不同的氨基酸残基取代一个或多个氨基酸残基;所述的“缺失”是指氨基酸残基数量的减少,也即是分别缺少其中的一个或多个氨基酸残基;所述的“插入”是指氨基酸残基序列的改变,相对天然分子而言,所述改变导致添加一个或多个氨基酸残基。
术语“编码序列”:转录成rna的核酸序列。
术语“启动子”指多核苷酸分子,所述多核苷酸分子在其天然状态位于可读框(或蛋白质编码区)的翻译起始密码子上游或5’,并参与rna聚合酶ii及其它蛋白质(反式作用转录因子)的识别和结合以启动转录。
术语“植物启动子”是在植物细胞中有功能的天然或非天然启动子。组成型植物启动子在植物发育始终的大部分或所有组织中发挥功能。可以将任何植物启动子用作5’调节元件以用于调节与其可操作地连接的一种或多种特定基因的表达。当与可转录的多核苷酸分子可操作地连接时,启动子一般引起该可转录的多核苷酸分子的转录,其转录方式与该启动子通常连接的可转录的多核苷酸分子的转录方式类似。植物启动子可以包括通过操作已知启动子以产生人工、嵌合或杂合启动子而产生的启动子。这类启动子也可以通过例如向具有其自身部分或全部调节元件的活性启动子加入异源调节元件而组合了来自一个或多个启动子的顺式元件。
术语“顺式元件”指赋予基因表达全面控制的一方面的顺式作用转录调节元件。顺式元件可以起到结合调节转录的转录因子,反式作用蛋白质因子的作用。一些顺式元件结合超过一种转录因子,而且转录因子可以与超过一种顺式元件以不同的亲和力相互作用。
术语“可操作地连接”指第一个多核苷酸分子(例如启动子)与第二个可转录的多核苷酸分子(例如目的基因)连接,其中多核苷酸分子如此排列,从而第一个多核苷酸分子影响第二个多核苷酸分子的功能。优选地,两个多核苷酸分子是单个连续多核苷酸分子的部分,且更优选是临近的。例如,如果启动子在细胞内调节或介导目的基因的转录,则该启动子与目的基因可操作地连接。
术语“可转录的多核苷酸分子”指能够被转录为rna分子的任何多核苷酸分子。已知以使可转录的多核苷酸分子被转录为功能mrna分子的方式将构建体引入细胞的方法,所述功能mrna分子得到翻译并从而表达为蛋白质产物。为了抑制特定的目的rna分子的翻译,也可以构建能够表达反义rna分子的构建体。
术语“重组植物表达载体”:一种或多种用于实现植物转化的dna载体;本领域中这些载体常被称为二元载体。二元载体连同具有辅助质粒的载体是大多常用于土壤杆菌介导转化的。二元载体通常包括:t-dna转移所需要的顺式作用序列、经工程化处理以便能够在植物细胞中表达的选择标记物,待转录的异源性dna序列等。
术语“转化”:将异源性dna序列引入到宿主细胞或有机体的方法。
术语“表达”:内源性基因或转基因在植物细胞中的转录和/或翻译。
术语“重组宿主细胞株”或“宿主细胞”意指包含本发明多核苷酸的细胞,而不管使用何种方法进行插入以产生重组宿主细胞,例如直接摄取、转导、f配对或所属领域中已知的其它方法。外源性多核苷酸可保持为例如质粒的非整合载体或者可整合入宿主基因组中。宿主细胞可为原核细胞或真核细胞,宿主细胞还可为单子叶或双子叶植物细胞。
附图说明
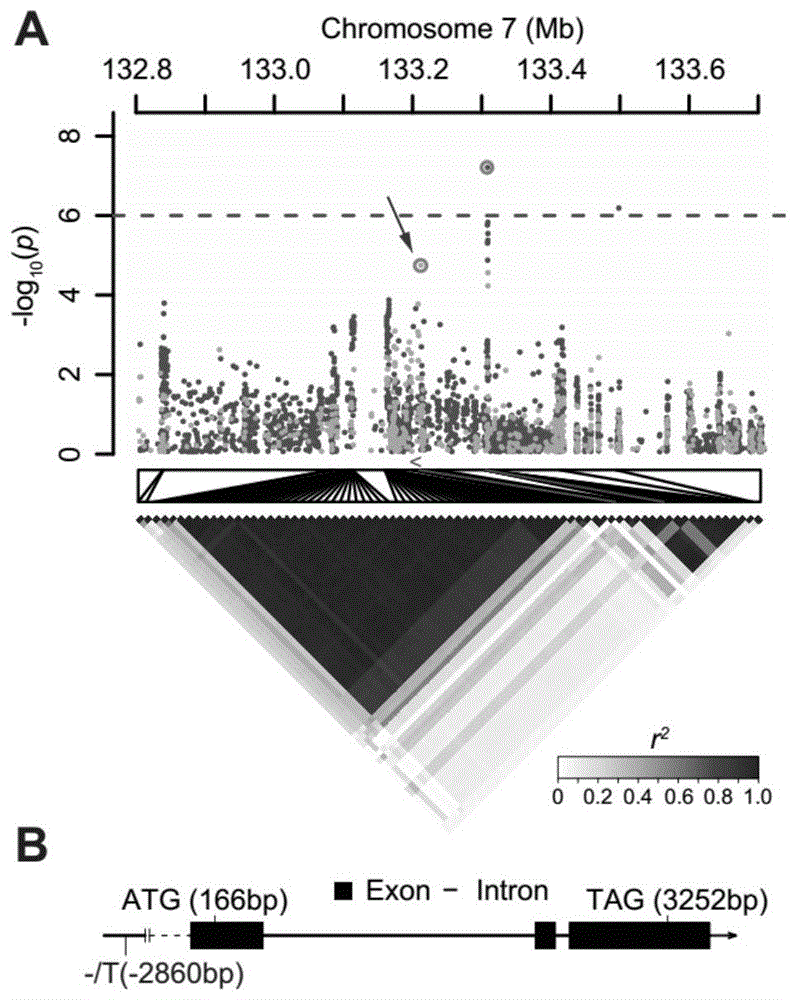
图1a为通过gwas方法得到indel_7_133209283_c/ct与玉米雄穗分枝数表型显著关联;b为tsh4的基因结构示意图;indel_7_133209283_c/ct位于tsh4基因上游2.86kb处的启动子区。
图2为12个不同类群的自交系在indel_7_133209283_c/ct处的变异情况。
图3a为indel_7_133209283_c/ct处不同变异类型自交系的雄穗表型;其中,indel_1和indel_0分别代表有和没有1bp的插入的基因型;b为图2a中自交系雄穗分枝数表型的统计;c为图2a中两种自交系的2mm雄穗中tsh4基因的表达分析。
图4为tsh4基因的crispr/cas9编辑载体的示意图。
图5a为tsh4的基因结构和crispr/cas9编辑载体对应的靶标序列的示意图;b为tsh4-mt突变体的检测示意图。
图6a为野生型材料和突变体tsh4-mt对应的雄穗表型图片;b为野生型材料和突变体tsh4-mt对应的雄穗表型的统计(n>10)。
图7a为indel_7_133209283_c/ct的两种等位变异对应表型的统计分析;b为indel_7_133209283_c/ct在玉米育种过程中的受选择分析;不同等位变异对应的颜色同图a。
具体实施方式
以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1indel_7_133209283_c/ct通过控制tsh4的基因表达调控玉米雄穗分枝数
1、indel_7_133209283_c/ct的发掘
利用350份玉米自交系的深度(>10×)重测序的数据结合已公布的玉米b73v3基因组,挖掘出了25,320,664单核苷酸多态性分子标记(snps)和4,319,510个插入缺失多态性分子标记(indel)。其中的indel标记中包括indel_7_133209283_c/ct。利用这些挖掘到的分子标记估算出350份玉米自交系的群体结构和亲缘关系,然后结合收集到的4个环境的雄穗分枝数的表型进行全基因组关联分析(gwas)。其中发现7号染色体上的snpchr7_133305039和indelindel_7_133209283_c/ct与玉米的雄穗分枝数显著关联(图1a)。并且这两个分子标记之间有显著的连锁不平衡(r2=0.53)。进一步研究发现indel_7_133209283_c/ct位于玉米雄穗发育调控基因tsh4的启动子区域(seqidno.2),距离tsh4基因编码区2.8kb(图1b)。
2、indel_7_133209283_c/ct所在基因组区域核苷酸序列的获得
根据indel_7_133209283_c/ct所在区域的b73v3基因组区域设计特异的扩增引物:
tsh4_indel_f:5'-cgctgtgcaatttcatcagt-3'(seqidno.3)
tsh4_indel_r:5'-tattcaatggcatcgtcaag-3'(seqidno.4)
对12个不同类群的玉米自交系进行扩增,获得了该区域的核苷酸序列和5该变异的准确信息(图2)。
3、indel_7_133209283_c/ct调控tsh4基因在玉米雄穗中的表达
将在indel_7_133209283_c/ct处含有1bp插入的自交系和不含有该1bp插入的自交系,分别种在田间,在其雄穗生长锥发育到2mm长时(该时期是雄穗发生分枝的关键时期),进行取样和液氮速冻。每15个2mm雄穗混合成一个样品,每个自交系取3个生物学重复。之后用trizol法提取rna,利用下述特异引物检测tsh4基因的表达量:
tsh4-f:5'-gcgcgatgaactggtccctgta-3'(seqidno.5)
tsh4-r:5'-acggcaaggtaaggcgcaca-3'(seqidno.6)
检测结果发现indel_7_133209283_c/ct处含有1bp插入的自交系雄穗中tsh4基因显著高表达(图3)。表明indel_7_133209283_c/ct可调控tsh4基因在玉米雄穗中的表达。
实施例2tsh4突变体tsh4-mt的构建及表型观察
1、tsh4的crispr/cas9编辑靶标序列的选择
首先,利用snapgeneviewer软件和tsh4的b73v3基因序列初步查找tsh4基因的靶标编辑序列。所获得的序列再与玉米的b73的其他基因组序列进行比对,以去除多拷贝和与其他基因组区域高度相似的序列。根据最终确定的靶标序列进一步设计sgrna,并通过rnafoldingform(http://unafold.rna.albany.edu/?q=mfold/rna-folding-form2.3)系统来进行二级结构的预测,最终选取设计了两个最优的靶标序列用于编辑tsh4基因(图5)。
2、tsh4的crispr/cas9基因编辑载体的构建
将人类中的hspcas9序列用商业化的in-
3、突变体tsh4-mt的获得
步骤2所得crispr/cas9载体通过农杆菌介导转化玉米自交系c01。用针对靶标序列设计的引物对t0代转化苗进行基因型检测,引物序列如下:
7588-11f:5’-cacgagccgttgacctactact-3’(seqidno.7)
7588-11r:5’-aaaagtgctccctccacatctc-3’(seqidno.8)
得到了dna片段删除的突变体tsh4-mt,其对应tsh4基因的突变情况如图5b。tsh4-mt表现出雄穗分枝数减少,雄穗小花数减少,小花包被苞叶,雄穗和雌穗基部簇生苞叶,部分雌穗的穗行数紊乱等表型(图6)。试验例1indel_7_133209283_c/ct的降低雄穗分枝数的等位变异在玉米育种历史中受到选择的试验
将此前收集的350份中国和美国的玉米自交系材料,根据中美的育种历史划分到不同的育种时期。然后调查indel_7_133209283_c/ct在不同育种时期的材料中,所发生的频率变化的规律;分析发现无1bp插入的等位变异(即对应为减少玉米雄穗分枝数的等位变异),随着玉米育种进程的推进频率逐步提高(图7),预示该等位变异在玉米育种过程中受到了选择,也反映了其在玉米育种中的应用潜力。
sequencelisting
<110>华南农业大学中国农业科学院生物技术研究所
<120>调控玉米雄穗构型的启动子、分子标记及其应用
<130>bj-2002-190211a
<160>8
<170>patentinversion3.5
<210>1
<211>462
<212>dna
<213>zeamaysl.
<400>1
tggaaagccaggggctgcaagttcaggaatgcttacactgccgctgtgcaatttcatcag60
tctcaggtcgatatccaaatatatctgatacatgatatggtatgtttggttcacctctag120
gcaaaactgcacctgacaaggcacactgcaatcagacgttgggtttttactaaagataag180
atccttgcccggccggagtagacaacaactcgatagtttcatgtgtgcccacactaataa240
gtaaacaatgtagtatcttccaactctcttttcaacagcaagtacaagtgtgtacaacca300
aatagttatataatgtgtggagttttaaggaagggtacttcggttccagttaggcaaaag360
ttgtttacaaaacccatatctaaaagtcttagaataagatccagagaaaagcacagtact420
tgacgatgccattgaatactgtactagctagctagcccctct462
<210>2
<211>461
<212>dna
<213>zeamaysl.
<400>2
tggaaagccaggggctgcaagttcaggaatgcttacactgccgctgtgcaatttcatcag60
tctcaggtcgatatccaaatatatctgatacatgatatggtatgtttggttcacctctag120
gcaaaactgcacctgacaaggcacactgcaatcagacgttgggtttttactaagataaga180
tccttgcccggccggagtagacaacaactcgatagtttcatgtgtgcccacactaataag240
taaacaatgtagtatcttccaactctcttttcaacagcaagtacaagtgtgtacaaccaa300
atagttatataatgtgtggagttttaaggaagggtacttcggttccagttaggcaaaagt360
tgtttacaaaacccatatctaaaagtcttagaataagatccagagaaaagcacagtactt420
gacgatgccattgaatactgtactagctagctagcccctct461
<210>3
<211>20
<212>dna
<213>artificalsequence
<400>3
cgctgtgcaatttcatcagt20
<210>4
<211>20
<212>dna
<213>artificalsequence
<400>4
tattcaatggcatcgtcaag20
<210>5
<211>22
<212>dna
<213>artificalsequence
<400>5
gcgcgatgaactggtccctgta22
<210>6
<211>20
<212>dna
<213>artificalsequence
<400>6
acggcaaggtaaggcgcaca20
<210>7
<211>22
<212>dna
<213>artificalsequence
<400>7
cacgagccgttgacctactact22
<210>8
<211>22
<212>dna
<213>artificalsequence
<400>8
aaaagtgctccctccacatctc22
- 还没有人留言评论。精彩留言会获得点赞!