一种苯酚类化合物邻位直接氟化的方法与流程
(一)技术领域
本发明涉及一种苯酚类化合物邻位直接氟化的方法。
(二)
背景技术:
苯酚是重要的基本有机原料,其许多下游产品涉及到众多领域,主要用于制造酚醛树脂、双酚a和己内酰胺。而苯酚的衍生物如卤代酚、硝基酚、烷基酚可用于医药、农药、油漆、染料、炸药、香料等的生产。苯酚类化合物广泛存在于自然界中,香料及许多天然产物中都含有苯酚结构。而传统对于苯酚类化合物修饰的方法为:首先对羟基进行保护,再在羟基的其他位点进行修饰,最后脱保护,实现修饰。这类方法条件比较苛刻,而且方法步骤多,反应收率低,这些存在的问题大大的降低了对于苯酚类化合物修饰研究的进展。因此,设计出一种更为简单高效、经济环保的方法是相当必要的。
(三)
技术实现要素:
本发明的目的是提供一种苯酚类化合物邻位直接氟化的新方法,其催化剂廉价易得且环境友好、反应条件温和、位点选择性高,反应高效,而且只需一步便可制得氟化苯酚类衍生物。
本发明采用的技术方案是:
一种苯酚类化合物邻位直接氟化的方法,所述方法包括:式(1a)所示苯酚类化合物与氟化试剂在溶剂中,在光催化剂和光源的作用下于室温下进行反应,反应完全后反应混合物经分离纯化得到式(2a)所示氟化苯酚类化合物;
所述氟化试剂为下列之一:n-氟代双苯磺酰胺(nfsi),1-氯甲基-4-氟-1,4-重氮化二环2.2.2辛烷双(四氟硼酸)盐(selectfluor),1-氟吡啶四氟硼酸盐(n-fluoropyridinium);
所述溶剂为下列之一:乙腈,水,醋酸水溶液,二氯甲烷,二甲基亚砜,1,2-二氯乙烷;
所述光催化剂为下列之一:三联吡啶氯化钌六水合物([ru(bpy)3]cl2),三(2-苯基吡啶)合铱([ru(bpy)3]cl2),荧光素(fluorescein),罗丹明b(rhodamineb),罗丹明(rhodamine6g),曙红y(eosiny);
所述光源为下列之一:蓝光、绿光、黄光;
所述苯酚类化合物、氟化试剂与光催化剂的物质的量之比为1:1~3:0.05~0.1;
其中r为h、卤素、硝基、c1~c7烷基或c1~c7烷氧基。
优选的,所述r为h、氟、溴、氯、甲基、酯基、羟基、甲氧基或乙酰基。
具体的,所述氟化苯酚类化合物为下列之一:
苯酚类化合物、氟化试剂与光催化剂的物质的量之比优选为1:1.5:0.05。
所述氟化试剂优选为1-氯甲基-4-氟-1,4-重氮化二环2.2.2辛烷双(四氟硼酸)盐。
所述光催化剂优选为曙红y。
所述溶剂优选为10%醋酸水溶液。
具体的,所述分离纯化方法如下:反应混合物中加入饱和nacl水溶液,用二乙酸乙酯烷萃取,取有机层经过无水硫酸钠干燥、过滤、常温下旋转蒸除溶剂,即得粗品;将粗品进行硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:10的溶液为流动相,tlc跟踪收集rf值为0.3~0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式(2a)所示氟化苯酚类化合物。
本发明的有益效果主要体现在:本发明提供了一种有机光催化苯酚直接氟化的方法,操作过程简单,原料都已商品化容易得到,光催化剂廉价易得且环境友好,反应条件温和,位点选择性高,反应高效,只需一步便可制得氟化苯酚类衍生物。
(四)附图说明
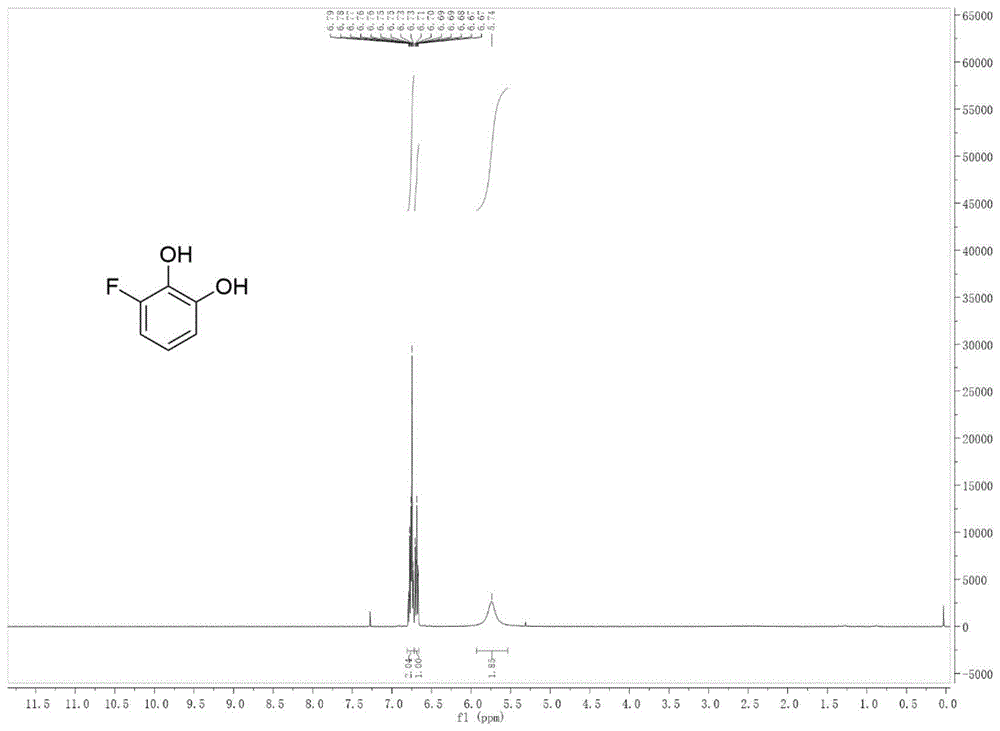
图1为化合物2a-1的核磁氢谱;
图2为化合物2a-1的碳谱;
图3为化合物2a-1的氟谱;
图4为化合物2a-2的核磁氢谱;
图5为化合物2a-2的碳谱;
图6为化合物2a-2的氟谱;
图7为化合物2a-3的核磁氢谱;
图8为化合物2a-4的核磁氢谱;
图9为化合物2a-5的核磁氢谱;
图10为化合物2a-6的核磁氢谱;
图11为化合物2a-7的核磁氢谱;
图12为化合物2a-8的核磁氢谱;
图13为化合物2a-9的核磁氢谱;
图14为化合物2a-10的核磁氢谱;
图15为化合物2a-11的核磁氢谱;
图16为化合物2a-12的核磁氢谱。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:化合物2a-1的制备
将1mmol对3-氟苯酚加入4ml的10%(v/v)醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3~0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-1所示的化合物纯品100mg(收率70%),其核磁氢谱、碳谱、氟谱参见图1~图3。1hnmr(500mhz,cdcl3)δ7.09(tt,j=4.6,3.0hz,2h),7.06–7.01(m,1h),5.58(s,1h).13cnmr(126mhz,cdcl3)δ156.41(s),130.79(s),123.93(s),122.79(s),118.83(s),114.27(s).19fnmr(376mhz,cdcl3)δ-133.85(d,j=6.6hz).hrms(esi+):calculatedforc6h4brfo:[m+h]+190.9430,found190.9433.
实施例2:化合物2a-2的制备
将1mmol对苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-2所示的化合物纯品90mg(收率77%),其核磁氢谱、碳谱、氟谱参见图4~图6。1hnmr(500mhz,cdcl3)δ7.13(dt,j=8.2,1.4hz,1h),7.03(ddd,j=9.9,8.4,1.4hz,1h),6.83(td,j=8.3,5.5hz,1h),5.55(s,1h).13cnmr(126mhz,cdcl3)δ152.34(s),150.40(s),140.62(d,j=14.7hz),124.76(d,j=3.5hz),120.32(d,j=7.7hz),114.81(d,j=18.3hz).19fnmr(471mhz,cdcl3)δ-134.62(s).hrms(esi+):calculatedforc6h4clfo:[m+h]+146.9935,found146.9931.
实施例3:化合物2a-3的制备
将1mmol2-叔丁基苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-3所示的化合物纯品120mg(收率73%),其核磁氢谱参见图7。1hnmr(500mhz,dmso)δ9.33(s,1h),7.06–6.93(m,2h),6.72(td,j=8.0,5.6hz,1h),1.35(s,9h).13cnmr(126mhz,dmso)δ151.20(s),143.02(d,j=14.6hz),138.80(s),121.55(d,j=2.5hz),118.45(d,j=7.6hz),113.15(d,j=19.0hz),29.28(s).19fnmr(376mhz,dmso)δ-136.65(s).hrms(esi+):calculatedforc10h13fo:[m+h]+169.0950,found169.0944.
实施例4:化合物2a-4的制备
将1mmol间甲基苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-4所示的化合物纯品96mg(收率76%),其核磁氢谱参见图8。1hnmr(500mhz,cdcl3)δ6.81–6.72(m,2h),6.69(ddd,j=9.9,7.6,2.3hz,1h),5.74(s,2h).13cnmr(126mhz,cdcl3)δ152.45(s),150.56(s),145.46(d,j=3.9hz),131.51(s),120.22(d,j=8.8hz),111.36(d,j=2.8hz),107.75(d,j=18.4hz).19fnmr(471mhz,cdcl3)δ-138.61(s).hrms(esi+):calculatedforc6h5fo2:[m+h]+129.0274,found129.0271.
实施例5:化合物2a-5的制备
将1mmol对溴苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-5所示的化合物纯品130mg(收率68%),其核磁氢谱参见图9。1hnmr(500mhz,cdcl3)δ7.25(dd,j=10.0,2.3hz,1h),7.21–7.12(m,1h),6.91(t,j=8.9hz,1h),5.44(s,1h).13cnmr(126mhz,cdcl3)δ151.87(s),149.95(s),142.85(d,j=14.0hz),127.94(d,j=3.7hz),119.12(s),118.95(s),118.59(d,j=2.2hz),111.62(d,j=8.1hz).19fnmr(471mhz,cdcl3)δ-137.33(s).hrms(esi+):calculatedforc6h4brfo:[m+h]+190.9430,found190.9433.
实施例6:化合物2a-6的制备
将1mmol对氯苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-6所示的化合物纯品125mg(收率85%),其核磁氢谱参见图10。1hnmr(500mhz,cdcl3)δ7.11(dd,j=10.3,2.4hz,1h),7.03(ddd,j=8.7,2.3,1.4hz,1h),6.95(t,j=8.9hz,1h),5.39(s,1h).13cnmr(126mhz,cdcl3)δ151.65(s),149.74(s),142.29(d,j=14.1hz),125.04(dd,j=12.7,6.3hz),118.05(d,j=2.4hz),116.34(s),116.17(s).19fnmr(471mhz,cdcl3)δ-137.42(s).hrms(esi+):calculatedforc6h4clfo:[m+h]+146.9935,found146.9931.
实施例7:化合物2a-7的制备
将1mmol2-溴-苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-7所示的化合物纯品140mg(收率74%),其核磁氢谱参见图11。1hnmr(500mhz,cdcl3)δ7.11(dd,j=10.3,2.4hz,1h),7.03(ddd,j=8.7,2.3,1.4hz,1h),6.95(t,j=8.9hz,1h),5.39(s,1h).13cnmr(126mhz,cdcl3)δ151.65(s),149.74(s),142.29(d,j=14.1hz),125.04(dd,j=12.7,6.3hz),118.05(d,j=2.4hz),116.34(s),116.17(s).19fnmr(471mhz,cdcl3)δ-137.42(s).hrms(esi+):calculatedforc6h4clfo:[m+h]+146.9935,found146.9931.
实施例8:化合物2a-8的制备
将1mmol2-氯苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-8所示的化合物纯品112mg(收率77%),其核磁氢谱参见图12。1hnmr(500mhz,cdcl3)δ7.27(dt,j=8.2,1.4hz,1h),7.07(ddd,j=9.8,8.3,1.3hz,1h),6.78(td,j=8.2,5.3hz,1h).13cnmr(126mhz,cdcl3)δ127.69(d,j=3.5hz),121.09(d,j=7.5hz),115.45(d,j=18.4hz).19fnmr(471mhz,cdcl3)δ-133.77(s).hrms(esi+):calculatedforc6h4brfo:[m+h]+190.9430,found190.9433.
实施例9:化合物2a-9的制备
将1mmol邻苯二酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-9所示的化合物纯品60mg(收率47%),其核磁氢谱参见图13。1hnmr(500mhz,cdcl3)δ6.81–6.72(m,2h),6.69(ddd,j=9.9,7.6,2.3hz,1h),5.74(s,2h).13cnmr(126mhz,cdcl3)δ152.45(s),150.56(s),145.46(d,j=3.9hz),131.51(s),120.22(d,j=8.8hz),111.36(d,j=2.8hz),107.75(d,j=18.4hz).19fnmr(471mhz,cdcl3)δ-138.61(s).hrms(esi+):calculatedforc6h5fo2:[m+h]+129.0274,found129.0271.
实施例10:化合物2a-10的制备
将1mmol3-甲氧基苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-10所示的化合物纯品122mg(收率86%),其核磁氢谱参见图14。1hnmr(500mhz,cdcl3)δ6.95(dd,j=10.3,9.1hz,1h),6.55(dd,j=7.3,3.0hz,1h),6.35(dt,j=9.0,3.3hz,1h),3.75(s,3h).13cnmr(126mhz,cdcl3)δ156.33(s),146.92(s),145.08(s),144.29(d,j=15.8hz),115.52(d,j=19.7hz),105.13(d,j=6.4hz),103.28(s),55.71(s).19fnmr(376mhz,cdcl3)δ-150.96(d,j=10.3hz).hrms(esi+):calculatedforc7h7fo2:[m+h]+143.0430,found143.0432.
实施例11:化合物2a-11的制备
将1mmol对乙酰基苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-11所示的化合物纯品88mg(收率57%),其核磁氢谱参见图15。1hnmr(500mhz,meod)δ7.75–7.63(m,2h),6.98(t,j=8.6hz,1h),4.86(s,1h),2.52(s,3h).13cnmr(126mhz,meod)δ198.42(d,j=1.9hz),153.46(s),151.78–151.45(m),130.65(d,j=4.7hz),127.31(d,j=2.9hz),118.32(d,j=2.9hz),116.97(d,j=19.2hz),26.25(s).19fnmr(376mhz,meod)δ-138.68(s).hrms(esi+):calculatedforc8h7fo2:[m+h]+155.0430,found155.0433.
实施例12:化合物2a-12的制备
将1mmol4-甲酸甲酯苯酚加入4ml的10%醋酸水溶液中,向其中加入1.5mmolselectfluor,0.05mmoleosiny,室温下12w蓝光照射反应6小时,反应结束后,反应液中加入饱和nacl水溶液,用二氯甲烷萃取,取有机层经过无水硫酸钠干燥、过滤、减压蒸干,即得化合物粗品。将化合物粗品进硅胶柱层析,以乙酸乙酯和石油醚的体积比为1:9的溶液为流动相,tlc跟踪收集rf值为0.3-0.5的洗脱液,收集得到的洗脱液经减压除去溶剂,干燥,得到式2a-12所示的化合物纯品93mg(收率59%),其核磁氢谱参见图16。1hnmr(500mhz,cdcl3)δ7.78(dt,j=4.2,2.0hz,2h),7.05(dt,j=12.4,2.5hz,1h),6.20(s,1h),3.91(s,3h).13cnmr(126mhz,cdcl3)δ166.21(s),151.42(s),149.52(s),148.15(d,j=14.2hz),127.10(d,j=3.2hz),122.95(d,j=6.0hz),117.24(s),117.07(d,j=2.2hz),52.27(s).19fnmr(471mhz,cdcl3)δ-139.71(s).hrms(esi+):calculatedforc8h7fo3:[m+h]+171.0379,found171.0379。
- 还没有人留言评论。精彩留言会获得点赞!