基于CRISPR技术对大肠杆菌基因进行定点突变的方法与流程
本发明涉及生物技术领域,特别涉及基于crispr技术对大肠杆菌基因进行点突变的方法。
背景技术:
目前对大肠杆菌进行染色体水平上靶基因的改造有如下两种方法:一是利用其自身reca同源重组系统编码的重组蛋白介导dna发生同源重组;二是通过引入外源重组酶λ-red或recet提高同源重组效率。上述两种均是通过dna分子发生双交换实现对靶基因的编辑。这些传统的大肠杆菌同源重组技术通常需要外源性辅助质粒以及筛选标记基因,对靶基因进行敲除及插入等实验操作,但当对靶基因进行点突变等更加精准的操作时,这些重组技术存在重组效率低、流程繁琐等缺点,想要大规模应用仍然面临巨大的挑战。
crispr/cas系统改造的碱基编辑器,是目前对核酸碱基进行点突变应用较为广泛的方法,作为一种新型基因编辑工具,该技术仍存在脱靶率高、编辑窗口局限等问题。
技术实现要素:
本发明的目的是提供一种将大肠杆菌传统的基因编辑技术与crispr-cas9技术相结合,快速、高效的实现大肠杆菌靶基因定点突变的方法。
第一方面,本发明要求保护一种对大肠杆菌基因组中靶基因进行定点突变的方法。
本发明所要求保护的对大肠杆菌基因组中靶基因进行定点突变的方法,可包括如下步骤:
(a)利用自身所携带的同源重组系统将大肠杆菌基因组中靶基因替换为抗性标记基因,得到所述靶基因被敲除同时带有所述抗性标记基因的重组大肠杆菌;
(b)利用crispr/cas9系统和λ-red同源重组系统,将(a)中所述重组大肠杆菌基因组中的所述抗性标记基因替换为带有突变位点的所述靶基因。
在步骤(a)中,所述重组大肠杆菌可按照包括如下步骤的方法获得:将重组载体a导入大肠杆菌感受态细胞,经培养、筛选获得所述重组大肠杆菌。
所述重组载体a为含有dna片段a的重组质粒;所述dna片段a自5’端到3’端依次为所述靶基因的上游同源臂、所述抗性标记基因,以及所述靶基因的下游同源臂。
进一步地,所述重组载体a为将所述dna片段a克隆到pkov质粒中后所得。
更进一步地,所述重组载体a为将pkov质粒的noti和bamhi酶切位点之间的小片段替换为所述dna片段a后所得的重组质粒。
在步骤(b)中,利用crispr/cas9系统和λ-red同源重组系统,将所述重组大肠杆菌基因组中的所述抗性标记基因替换为带有突变位点的所述靶基因,可通过向所述重组大肠杆菌中导入重组载体b和载体c来实现。
所述重组载体b为含有dna片段b1和dna片段b2的重组质粒;所述dna片段b1为针对所述抗性标记基因的sgrna识别区域序列(即间隔序列spacer对应的编码序列);所述dna片段b2自5’端到3’端依次为所述靶基因的上游同源臂、带有所述突变位点的所述靶基因,以及所述靶基因的下游同源臂。
所述载体c为用于表达cas9蛋白和λ-red重组酶的质粒。
进一步地,所述重组载体b为将所述dna片段b1和所述dna片段b2克隆到psgkp-km质粒后所得。
更进一步地,所述重组载体b为在psgkp-km质粒的两个bsaⅰ酶切位点之间插入前文所述dna片段b1,使用bamhⅰ单酶切之后,连接前文所述dna片段b2后所得的重组质粒。
在本发明的具体实施方式中,所述载体c具体为pcaskp-apr质粒。
在所述方法中,所述抗性标记基因可为氨苄抗性基因(amp基因),也可为其他抗性基因。
在本发明的具体实施方式中,所述抗性标记基因具体为pmad质粒中携带的amp基因。所述靶基因为yjjw基因(seqidno.1)。相应的,所述dna片段a的核苷酸序列如seqidno.2所示。seqidno.2的第1-1038位为大肠杆菌基因组中yjjw基因的上游同源臂;seqidno.2的第2005-2941位为大肠杆菌基因组中yjjw基因的下游同源臂;seqidno.2的第1039-2004位为amp基因序列。所述dna片段b1的核苷酸序列如seqidno.3所示。所述dna片段b2的核苷酸序列如seqidno.4所示。seqidno.4的第1-1017位为大肠杆菌基因组中yjjw基因的上游同源臂;seqidno.4的第1882-2798位为大肠杆菌基因组中yjjw基因的下游同源臂;seqidno.4的第1018-1881位为带有突变位点的yjjw基因序列。
第二方面,本发明要求保护如下任一物质:
(i)成套载体i,由前文所述重组载体a、所述重组载体b和所述载体c组成。
(ii)成套载体ii,由前文所述重组载体a和所述重组载体b组成。
(iii)成套载体iii,由前文所述重组载体a和重组载体b’组成;所述重组载体b’将前文所述重组载体b中的所述dna片段b2删除后所得的重组质粒。
(iv)载体iv,为前文所述重组载体b或(iii)中所述的重组载体b’。
(v)试剂盒,含有大肠杆菌,以及所述(i)至所述(iv)中任一。
第二方面,本发明要求保护第二方面中所述物质在对大肠杆菌基因组中靶基因进行定点突变中的应用。
在本发明的具体实施方式中,所述大肠杆菌具体为大肠杆菌cgmcc1.1280。
本发明将传统与现代基因编辑技术相结合,建立一种能够对大肠杆菌靶基因实现定点突变的方法。首先,利用大肠杆菌自身所携带的同源重组系统,实现amp基因与靶基因的替换,成功将amp序列插入宿主基因组中同时靶基因被敲除;然后,设计可以识别amp基因的spacer序列以及带有靶基因定点突变的同源修复臂,利用crispr/cas9系统的靶向切割特性,实现对dna双链的切割,借助λ-red同源重组系统,实现靶基因的定点突变。结果显示,利用该方法,既成功实现了大肠杆菌d7yjjw的第24位碱基t到c的改变,又获得了大肠杆菌d7yjjw的敲除菌株,借助质粒自身蔗糖致死和温度敏感的特性将质粒成功消除。本发明建立了一种高效、简单的将大肠杆菌自身重组系统与crispr系统相结合的靶基因定点突变方法。该过程建立的重组质粒psgkp-km-spacer,可以应用于其它靶基因的定点突变,一方面,大大缩短了实验操作;另一方面,为后续实现大量靶基因定点突变研究奠定了基础。
附图说明
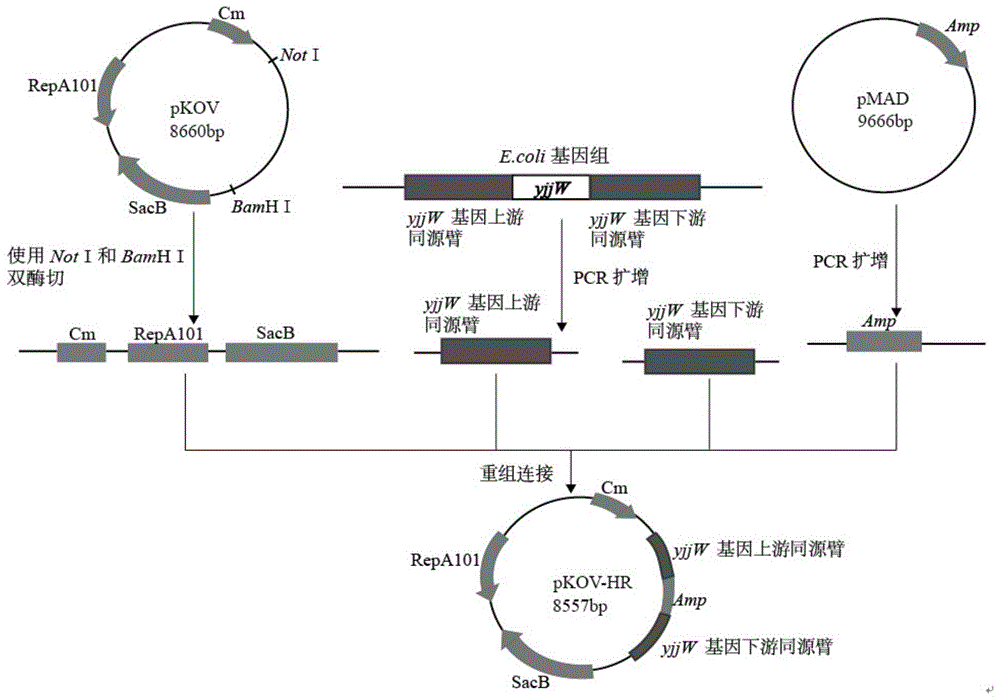
图1为pkov-hr重组质粒的构建示意图。
图2为psgkp-km-spacer-hr重组质粒的构建示意图。
图3为实验流程图。
图4为pkov-hr重组质粒构建琼脂糖凝胶电泳图。a中,1-2:yjjw基因下游同源臂pcr产物条带;3-4:yjjw基因上游同源臂pcr产物条带。b中,1-4:氨苄基因pcr产物条带。c中,1-5:yjjw基因上、下游同源臂、氨苄基因与pkov质粒连接后,三片段pcr产物条带。m:dna分子量标准。
图5为敲除菌株pcr验证。1-3:引物d7-f/amp-rpcr产物条带用于验证氨苄基因是否成功插入宿主基因组。m:dna分子量标准。
图6为敲除菌株测序结果。
图7为重组质粒psgkp-km-spacer-hr构建琼脂糖凝胶电泳图。a中,1-2:引物spacerf/rpcr产物条带。b中,1-2:vet2-f/rpcr产物条带。c中,1-2:引物yjjw2-f/mut-rpcr产物条带;3-4:mut-f/yjjw2-rpcr产物条带。d中,1-2:引物mut-f/rpcr产物条带。m:dna分子量标准。
图8为点突变菌株验证pcr。1-3:引物d7-f/rpcr产物条带;4-6:引物d7-f/amp-rpcr产物条带。m:dna分子量标准。
图9为yjjw点突变菌株测序结果。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、基于crispr技术对大肠杆菌基因组中靶基因进行两步法定点突变
一、材料
1、菌株和质粒
本发明所使用的菌株和质粒详细信息见表1所示。
表1本发明所用菌株和质粒
[1]wangy,wangs,chenw,songl-q,zhangy,shenz,yuf,lim,jiq.preciseandefficientgenomeeditinginklebsiellapneumoniaeusingcrispr-cas9andcrispr-assistedcytidinedeaminase.appliedandenvironmentalmicrobiology2018,84(23):e01834-18.psgkp-km和pcaskp-apr公众可从申请人处获得,进可用于重复本发明实验使用,不得他用。
2、引物
本发明所用的引物见表2。
表2本发明中使用的引物
注:yjjw1-u-f/r、amp-f/r、yjjw1-d-f/r、yjjw2-f/r这四对引物中小写碱基序列表示pcr产物与所要连接片段的一部分同源序列,大写碱基序列为与pcr模板互补结合的序列;mut-f/r引物中的大写碱基为yjjw点突变的碱基,小写碱基序列为与pcr模板互补结合的序列。
二、方法
第一步:大肠杆菌靶基因与amp替换的敲除实验
1、重组质粒的构建
以敲除大肠杆菌d7(d7是发明人自己编号,即为大肠杆菌cgmcc1.1280,下同)基因组的yjjw基因(seqidno.1)为例,该部分实验利用的是大肠杆菌自身的同源重组系统,所采用的是pkov质粒,该质粒含有蔗糖致死和温度敏感基因,最适培养温度为30℃,用于敲除的pkov重组质粒构建如下:首先使用notⅰ/bamhⅰ双酶切pkov质粒,获得线性化的质粒片段。然后以大肠杆菌d7基因组为模板,分别以yjjw1-u-f/yjjw1-u-r和yjjw1-d-f/yjjw1-d-r为引物扩增得到yjjw的上、下游同源臂,其中上游同源臂的5’端和下游同源臂的3’端通过引物分别引入线性化质粒两端(notⅰ、bamhⅰ)的一段同源序列,用于与线性化质粒片段的连接。以pmad质粒基因组为模板,使用amp-f/amp-r引物扩增氨苄基因片段,氨苄基因片段的两端分别含有与上下游同源臂的3’和5’端的同源序列,然后利用重组试剂盒将上下游同源臂、氨苄基因片段和线性化质粒片段进行连接,并取7μl的连接液热激转化至e.colidh5α感受态细胞中,30℃过夜培养,将长出的单菌落提质粒基因组进行pcr验证并测序,将验证正确的重组质粒命名为pkov-hr,该质粒构建示意图如图1所示。
2、敲除菌株的获取
采用电击法将上述构建好的重组质粒pkov-hr转化至大肠杆菌d7感受态细胞中,涂布在含有氨苄和氯霉素抗性的平板上,30℃过夜培养,然后挑取部分单菌落继续涂布至双抗平板,42℃过夜培养,因为该质粒含有温度敏感基因,在高温培养条件下,含有同源修复臂的重组质粒会与宿主基因组发生同源重组。接着从42℃培养的平板上挑取部分单菌落涂布至含有氨苄抗性的5%蔗糖平板上,30℃过夜培养,用于质粒的消除,采用96孔板挑取单菌落分别接种至含有氨苄和氯霉素抗性的液体lb培养基中,最后筛选在氨苄抗性培养基中生长同时在氯霉素抗性培养基中不生长的菌落,提基因组pcr验证并且测序,获得靶基因敲除同时带有氨苄抗性的大肠杆菌d7δyjjw::ampr。具体操作流程如图3所示。
第二步:大肠杆菌靶基因定点突变实验
本发明的定点突变实验,是在上一步敲除实验的基础上进行的,采用crispr-cas9双质粒体系实现对靶基因的定点突变,其中psgkp-km质粒带有sgrna序列以及蔗糖致死基因(sacb),同时作为连接spacer和同源修复臂的载体质粒,pcaskp-apr质粒用于表达cas9蛋白和λ-red重组酶,带有温度敏感基因(repa101)。
1、重组质粒的构建
以上一步敲除实验获得的大肠杆菌d7δyjjw::ampr基因组为模板,设计可以识别amp基因的20个碱基spacer序列(5’-aaaagggaataagggcgaca-3’,http://www.rgenome.net/),在spacer序列的5’端加上与psgkp-km质粒bsaⅰ酶切位点同源的四个碱基(5’tagt-),用于spacer与psgkp-km质粒的连接,然后将合成的spacer序列磷酸化处理,使用t4dna连接酶将磷酸化的spacer与线性化的(bsaⅰ)psgkp-km质粒连接,获得psgkp-km-spacer质粒。采用重叠延伸pcr的方法获得含有定点突变(t->c)的yjjw基因的片段(yjjw定点突变位点的选择是根据前期大肠杆菌和金黄色葡萄球菌互作培养过程中采用统计学方法所筛选出的)同时带有yjjw基因的上、下游同源修复臂,将重叠延伸pcr获得的完整片段与使用bamhⅰ单酶切线性化的psgkp-km-spacer质粒连接。吸取7μl的连接液通过热激法转化至大肠杆菌dh5α感受态细胞中,涂平板30℃过夜培养获得单菌落,进行pcr验证和测序验证,将验证正确的psgkp-km重组质粒命名为psgkp-km-spacer-hr,该质粒构建示意图如图2所示。
2、定点突变菌株的获取
首先制备已将pcaskp-apr质粒电激转化至d7δyjjw::ampr细胞中的大肠杆菌感受态细胞,在制备感受态细胞的过程中需要添加阿拉伯糖来诱导cas9蛋白和λ-red重组酶的表达。然后将psgkp-km-spacer-hr重组质粒电激转化至上述感受态细胞中,涂布至添加阿拉伯糖同时带有卡那和安普霉素抗性的平板上,30℃过夜培养,挑取单菌落涂布至含有安普霉素抗性和5%蔗糖的平板上,30℃过夜培养,使用96孔板挑取单菌落分别接种至无抗性、含有氨苄青霉素和卡那霉素抗性三种液体lb培养基中,筛选带有氨苄青霉素和卡那霉素抗生素培养基中不生长的菌落,说明该菌株极有取可能发生了同源重组并且重组质粒已被消除,提基因组进行pcr并且测序验证,验证结果正确的即为大肠杆菌定点突变菌株d7yjjw-24。由于pcaskp-apr带有温度敏感基因,将该菌株在42℃高温条件下过夜培养,用于pcaskp-apr质粒的消除。该部分的具体操作流程如图3所示。
三、结果与分析
1、敲除实验
(1)重组质粒的构建
分别以大肠杆菌d7基因组、pmad质粒基因组为模板,各自以yjjw1-u-f/yjjw1-u-r、yjjw1-d-f/yjjw1-d-r和amp-f/amp-r为引物pcr,扩增得到两端带有同源序列的上、下游同源臂和氨苄片段(图4中a和b),通过重组试剂盒将这三条片段与线性化的pkov质粒相连,获得重组质粒pkov-hr。重新设计落在质粒上的引物vet1-f/vet1-r对重组质粒进行pcr验证,如图4中c所示,pcr产物(3167bp)条带在3000bp左右,初步确定上述三片段已经与线性化的质粒相连,随机挑选了三个无非特异性条带并且条带较亮的pcr产物送测序,测序结果显示用于敲除的重组质粒pkov-hr已构建成功。
pkov-hr质粒的结构描述:将pkov质粒的notⅰ和bamhⅰ酶切位点之间的小片段替换为seqidno.2所示dna片段后所得的重组质粒。seqidno.2的第1-1038位为大肠杆菌基因组中yjjw基因的上游同源臂;seqidno.2的第2005-2941位为大肠杆菌基因组中yjjw基因的下游同源臂;seqidno.2的第1039-2004位为amp基因序列。
(2)敲除菌株的获取
将pkov-hr质粒电激转化至大肠杆菌d7感受态细胞中,经过30℃—42℃—30℃一系列温度培养之后,重组质粒会与宿主基因组发生同源重组,将yjjw基因替换为ampr基因,随机挑选了44株菌分别接种至正常、带有氨苄和氯霉素抗性的培养中,其中有24株菌在氨苄培养基中生长,同时在氯霉素培养基中不生长,初步说明这24株菌为重组子,并且重组质粒已被消除,使用d7-f/amp-r引物(pcr产物为上游同源臂和氨苄片段)pcr验证阳性克隆,22株菌能用该引物成功扩增出目的条带(2255bp),部分菌株的pcr结果如图5所示,重组效率达到50%,说明这些菌株已经成功完成了氨苄基因的替换,实现了目的基因的敲除,同时测序结果如图6所示,已经成功获得了带有ampr的敲除菌株。
2、点突变实验
(1)重组质粒的构建
首先将spacer与载体质粒相连,spacer-f/spacer-r引物的pcr产物测序结果显示,spacer已经成功连接在载体质粒上(图7中a),获得psgkp-km-spacer。在此基础上以大肠杆菌d7基因组为模板,使用yjjw2-f/yjjw2-r和mut-f/mut-r引物进行重叠延伸pcr(图7中c和d),获得带有上、下游同源臂的yjjw定点突变片段,通过重组试剂盒(天根easygeno快速重组克隆试剂盒货号:vi201-02)将该片段与线性化的psgkp-km-spacer质粒相连,如图7中b所示,vet2-f/vet2-r引物pcr产物的条带在3000bp左右,说明同源修复臂已经与载体质粒相连,同时测序结果也显示重叠延伸pcr成功实现了yjjw基因的定点突变。说明已成功获得带有识别氨苄序列的spacer及同源修复臂的重组载体质粒psgkp-km-spacer-hr。
psgkp-km-spacer-hr载体的结构描述:将seqidno.3所示dna片段(对应的可识别氨苄基因的spacer序列)插入到psgkp-km质粒的两个bsaⅰ酶识别位点之间,同时将seqidno.4所示dna片段插入到psgkp-km质粒的bamhⅰ酶识别位点处后得到的重组质粒。seqidno.4的第1-1017位为大肠杆菌基因组中yjjw基因的上游同源臂;seqidno.4的第1882-2798位为大肠杆菌基因组中yjjw基因的下游同源臂;seqidno.4的第1018-1881位为带有突变位点的yjjw基因序列。
(2)定点突变菌株的获取
将重组质粒psgkp-km-spacer-hr电转化至事先制备好的含有pcaskp-apr质粒的d7δyjjw::ampr感受态细胞中,30℃过夜培养,从上述平板挑取单菌落涂布至带有安普霉素抗性的5%蔗糖平板上,30℃过夜培养,从该平板挑取36株菌分别接种至无抗性、带有氨苄青霉素抗性、和带有卡那霉素抗性的液体lb培养基中,最后成功筛选到了27株菌在抗性培养基中均不生长,说明psgkp-km-spacer-hr重组质粒已成功消除,提取27株菌的基因组进行pcr验证,结果显示,这27株菌使用d7-f/amp-r引物(pcr产物为上游同源臂和氨苄片段)均未扩增出任何条带,初步认定这些菌均发生了同源重组修复并且已经失去了氨苄抗性,重组效率可达到75%,此外这27株菌中有17株菌使用d7-f/d7-r引物(pcr产物为yjjw基因上游同源臂、yjjw基因点突变片段、yjjw基因下游同源臂)成功扩增出了目的条带(3053bp),部分菌株pcr结果如图8所示,随机挑选4株菌的pcr产物送测序,部分测序结果如图9所示,结果显示,这4株菌的yjjw基因均实现了预期的定点突变,成功获得了我们所需的突变株,将该菌株在42℃高温条件下过夜培养,挑取单菌落到带有安普霉素抗性的培养基中不生长,说明pcaskp-apr已成功消除,提取基因组pcr测序验证,结果显现该突变株未发生回复突变。
四、结论与讨论
本研究以大肠杆菌yjjw为例,结合crispr/cas9基因编辑技术,探究出一个适用于大肠杆菌靶基因点突变的方法。最初,我们对大肠杆菌靶基因的点突变利用的是其自身所带有的同源重组系统,但结果显示其重组效率低,不能高效筛选到所需的重组子。因此,在此基础上我们采用crispr/cas9现代基因编辑技术,利用psgkp-km/pcaskp-apr双质粒进行靶基因的点突变,结果显示,该系统大大提高了菌株发生同源重组的效率,其重组效率可以达到75%,成功获得了靶基因点突变菌株,实现了传统与现代基因编辑技术的结合。除此之外,我们所构建的带有可以识别ampspacer序列的psgkp-km-spacer质粒,还可以实现对其它基因组上带有amp菌株的基因编辑,只需改变同源修复片段,就可以快速实现对我们前期研究获得的影响大肠杆菌和金黄色葡萄球菌互作显著基因的编辑,通过进一步验证实验,更深入了解物种互作的遗传机制。同时,在其它一些原核生物中需要对多数基因进行点突变时,该方法编辑效率高并且节省时间,具有参考价值。
综上所述,我们建立了一种crispr/cas9系统介导的快速、简单和高效的大肠杆菌基因点突变方法,将传统与现代基因编辑技术相结合,为大肠杆菌基因编辑的研究提供了有效的工具。对验证实验室前期通过遗传统计模型得到的与大肠杆菌和金黄色葡萄球菌互作相关基因的功能,奠定了科学理论以及实践基础。
<110>北京林业大学
<120>基于crispr技术对大肠杆菌基因进行定点突变的方法
<130>gncln200169
<160>4
<170>patentinversion3.5
<210>1
<211>864
<212>dna
<213>artificialsequence
<400>1
tcacaaatacagcgccggaaatattaaccggctcaccccgcgcacctttaatgcatcagc60
caacggctcaacgtcttccggcgtggcgctcgcccagctttgcgcctcgccatacacgcc120
gtgggcatgaaacgcgttcaggcgtaccggaacatcgccgagtcccttgataaacgccgc180
cagttcttcgatgtgttgcaaataatccacctggccagggattaccagcaaacgcagttc240
cgccagcttgccgcgctctgccagcaagtagatgctgcgcttaatctgctgattatcgcg300
tccggttaattgttgatgacattcgctcccccacgctttgagatcgagcatcgcgccgtc360
gcacaccgggagtaatttttcccagccggtttcgctcaacataccgttactgtccaccag420
gcaggtgaggtggcgcagttgcggatcgtttttgatagcagtaaacagcgccactacaaa480
cggcagttgggtcgtggcttcgccgccgcttaccgttatcccttcaataaacagcaccgc540
tttgcggacatggctaagcacttcgtccacgctcatggattgcgccattggcgtggcatg600
ttgcggacacatcttcaggcaggtatcacactgctcgcagaccacagcgttccacagcac660
tttgccgtcaacaatctgcaacgcctgatgcggacactgtggcacgcactctccgcaatc720
attgcagcgtcccatcgtccacggattgtgacagtttttgcagcgcagattgcagccctg780
caaaaacagagccagacgactgcctggcccgtcaacgcaggagaaggggataatcttact840
gactaaagcgcatctgctgttcat864
<210>2
<211>2941
<212>dna
<213>artificialsequence
<400>2
gtacccggggatcgcggccgccggtgggggagatcggtctggatctcttcggcgacgatc60
cgcaatttgagaggcagcagtggttactcgacgaacaactgaaactggcgaaacgctacg120
atctgccggtgatcctgcattcacggcgcacacacgacaaactggcgatgcatcttaaac180
gccacgatttgccgcgtgctggtgttgtccacggattttctggcagccagcaacaggctg240
aacggtttgtacagctgggctacaaaatcggcgtaggcggtactatcacctatccacgcg300
ccagtaaaacccgcgatgtcaccgcaaaattaccgctggcatcgttgttgctggaaaccg360
acgcgccggatatgccgctcaacggctttcaggggcagcctaaccgaccggaacaggctg420
tgcgggtgtttgacgtgctttgcgagttgcgcccggaaccagaagatgagattgccgaag480
tgttgcttaataatacgtatgcgttgtttagcgttagtgggtagtttacccttcgtaggc540
agcatccggcagtcggcgcataatgcctgatgcgacgcttgtcgcgtcttatcatgccta600
caggtttgtgccgaaccgtaggccggataaggcgttcacgccgcatccggcagttggcgc660
acaatgcctgatgcgacgcttgacgcgtcttatcatgcctacaagtctgtgccgaaccgt720
aggccggataaggcgttcacgccgcatccggcagtcggcgcataatgcctgatgcgacgc780
ttgtcgcgtcttatcatgcctacaggtttgtgccgaaccgtaggccggataaggcgttca840
cgccgcatccggcagttggcacacaatgcctgatgcgacgctgacgcgtcttatcatgcc900
tacaagtctgtgccgaaccgtaggccggataaggcgttcacgccgcatccggcagtcggc960
gcataatgcctgatgcgacgctgacgcgtcttatcagacctacaagtctgtgccgaaccg1020
taggccgtatccggcatgcgcggaacccctatttgtttatttttctaaatacattcaaat1080
atgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaag1140
agtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgcctt1200
cctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgggt1260
gcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgc1320
cccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtatta1380
tcccgtgttgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgac1440
ttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaa1500
ttatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacg1560
atcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgc1620
cttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacg1680
atgcctgcagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactcta1740
gcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctg1800
cgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtggg1860
tctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatc1920
tacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggt1980
gcctcactgattaagcattggtaaggcttatcacgcgcggctggcgttccagaatacgag2040
tgttgcgtgcggcttcttcgcccagccaggtggtgttggtgcgtgaaccttcggcgcgat2100
atttttctaagtccgacaaacgtaccatataaccggtaacgcgaaccagatcgttaccgc2160
tgacattggcggtaagttcacgcattccggctttaaaggcaccgaggcaaagctgtacca2220
gtgcctgcgggttacgtttgatggtttcgtcgagcgtcagaatgtcgctgatgccggaat2280
aataataagcatgatgcggggcgacagtttgcagatgggtgatcggatctggctcatcgc2340
catacggcaaacgcgcgcccggcgtggtgccaatatcggaactgatccccgactgtgcgt2400
gtaacatggcgcgtttttgccatccatatttcacgggggtattggcgacaaactccgcca2460
gttgcgcgctgatgcgataacccacttcatttgcggcggcttctttaccgtaacgtgcgg2520
caatcccttctttctcacacagcaagttaaccgcttccgccagcccatacatgccaaaca2580
ttggcacaaaacgttcagggttaatcagcccttctttcaccaggaagctattctcaaaga2640
agtgtgattgttgatagaggaattcacaccgcgcatcgatgatggcgatctgctgctggc2700
agtagtgcggtagagtgcgcgtaaagaagtcatccagcgattcgctgcgctcggcaatgg2760
ctttcaggttaaggcgtaccagcgtgctgccaccacccgccagcggcagtgagttgtaac2820
agctcacaatcccgtagcccccttttgtgaaaattttatcatgcaccggaccgttggcga2880
tgtgcggtttgctacattcacagatgttcttcgccacttccggatcctctagagtcgacc2940
g2941
<210>3
<211>20
<212>dna
<213>artificialsequence
<400>3
aaaagggaataagggcgaca20
<210>4
<211>2798
<212>dna
<213>artificialsequence
<400>4
cggtgggggagatcggtctggatctcttcggcgacgatccgcaatttgagaggcagcagt60
ggttactcgacgaacaactgaaactggcgaaacgctacgatctgccggtgatcctgcatt120
cacggcgcacacacgacaaactggcgatgcatcttaaacgccacgatttgccgcgtgctg180
gtgttgtccacggattttctggcagccagcaacaggctgaacggtttgtacagctgggct240
acaaaatcggcgtaggcggtactatcacctatccacgcgccagtaaaacccgcgatgtca300
ccgcaaaattaccgctggcatcgttgttgctggaaaccgacgcgccggatatgccgctca360
acggctttcaggggcagcctaaccgaccggaacaggctgtgcgggtgtttgacgtgcttt420
gcgagttgcgcccggaaccagaagatgagattgccgaagtgttgcttaataatacgtatg480
cgttgtttagcgttagtgggtagtttacccttcgtaggcagcatccggcagtcggcgcat540
aatgcctgatgcgacgcttgtcgcgtcttatcatgcctacaggtttgtgccgaaccgtag600
gccggataaggcgttcacgccgcatccggcagttggcgcacaatgcctgatgcgacgctt660
gacgcgtcttatcatgcctacaagtctgtgccgaaccgtaggccggataaggcgttcacg720
ccgcatccggcagtcggcgcataatgcctgatgcgacgcttgtcgcgtcttatcatgcct780
acaggtttgtgccgaaccgtaggccggataaggcgttcacgccgcatccggcagttggca840
cacaatgcctgatgcgacgctgacgcgtcttatcatgcctacaagtctgtgccgaaccgt900
aggccggataaggcgttcacgccgcatccggcagtcggcgcataatgcctgatgcgacgc960
tgacgcgtcttatcagacctacaagtctgtgccgaaccgtaggccgtatccggcatgtca1020
caaatacagcgccggaaatactaaccggctcaccccgcgcacctttaatgcatcagccaa1080
cggctcaacgtcttccggcgtggcgctcgcccagctttgcgcctcgccatacacgccgtg1140
ggcatgaaacgcgttcaggcgtaccggaacatcgccgagtcccttgataaacgccgccag1200
ttcttcgatgtgttgcaaataatccacctggccagggattaccagcaaacgcagttccgc1260
cagcttgccgcgctctgccagcaagtagatgctgcgcttaatctgctgattatcgcgtcc1320
ggttaattgttgatgacattcgctcccccacgctttgagatcgagcatcgcgccgtcgca1380
caccgggagtaatttttcccagccggtttcgctcaacataccgttactgtccaccaggca1440
ggtgaggtggcgcagttgcggatcgtttttgatagcagtaaacagcgccactacaaacgg1500
cagttgggtcgtggcttcgccgccgcttaccgttatcccttcaataaacagcaccgcttt1560
gcggacatggctaagcacttcgtccacgctcatggattgcgccattggcgtggcatgttg1620
cggacacatcttcaggcaggtatcacactgctcgcagaccacagcgttccacagcacttt1680
gccgtcaacaatctgcaacgcctgatgcggacactgtggcacgcactctccgcaatcatt1740
gcagcgtcccatcgtccacggattgtgacagtttttgcagcgcagattgcagccctgcaa1800
aaacagagccagacgactgcctggcccgtcaacgcaggagaaggggataatcttactgac1860
taaagcgcatctgctgttcatggcttatcacgcgcggctggcgttccagaatacgagtgt1920
tgcgtgcggcttcttcgcccagccaggtggtgttggtgcgtgaaccttcggcgcgatatt1980
tttctaagtccgacaaacgtaccatataaccggtaacgcgaaccagatcgttaccgctga2040
cattggcggtaagttcacgcattccggctttaaaggcaccgaggcaaagctgtaccagtg2100
cctgcgggttacgtttgatggtttcgtcgagcgtcagaatgtcgctgatgccggaataat2160
aataagcatgatgcggggcgacagtttgcagatgggtgatcggatctggctcatcgccat2220
acggcaaacgcgcgcccggcgtggtgccaatatcggaactgatccccgactgtgcgtgta2280
acatggcgcgtttttgccatccatatttcacgggggtattggcgacaaactccgccagtt2340
gcgcgctgatgcgataacccacttcatttgcggcggcttctttaccgtaacgtgcggcaa2400
tcccttctttctcacacagcaagttaaccgcttccgccagcccatacatgccaaacattg2460
gcacaaaacgttcagggttaatcagcccttctttcaccaggaagctattctcaaagaagt2520
gtgattgttgatagaggaattcacaccgcgcatcgatgatggcgatctgctgctggcagt2580
agtgcggtagagtgcgcgtaaagaagtcatccagcgattcgctgcgctcggcaatggctt2640
tcaggttaaggcgtaccagcgtgctgccaccacccgccagcggcagtgagttgtaacagc2700
tcacaatcccgtagcccccttttgtgaaaattttatcatgcaccggaccgttggcgatgt2760
gcggtttgctacattcacagatgttcttcgccacttcc2798
- 还没有人留言评论。精彩留言会获得点赞!