一种苯并呋喃并吲哚类化合物、其制备和应用的制作方法
本发明属于精细化工与有机电致发光显示技术领域,更具体地,涉及一种苯并呋喃并吲哚类化合物、其制备和应用。
背景技术:
苯并呋喃并吲哚是非常重要的一类有机化合物,其在药物化学(如钾通道开放剂)、有机发光二极管(如绿色有机电致发光材料)等领域有着重要的应用前景。虽然化学家们发展了一些合成苯并呋喃吲哚类化合物的方法,但依然存在很大的局限性,难以从简单原料出发,高效制备苯并呋喃并吲哚。目前,已知的合成方法主要有两种:第一种是先通过suzuki偶联反应将苯并呋喃-3-硼酸与邻碘硝基苯偶联,然后三苯基膦催化硝基还原再关环得到苯并呋喃并吲哚。[a)hametal.heterocycliccompoundsasorganiclight-emittingdevicematerials.[p].kr2015124924.2015-11-06.b)hametal.aromaticcompoundaselectroluminescenthostordopantfororganiclightemittingdevice.[p].kr2015058080.2015-05-28.]但是该方法原料具有限制性,且前一步使用昂贵的pd催化剂,后一步则存在原子经济性低,高能耗,使用毒性溶剂等缺点。第二种是以吲哚酮为前体,强碱催化3位芳基化,在噻吩-2-甲酸亚铜催化下关环得到苯并呋喃并吲哚。[sattar,m.etal.transition-metal-freechemoselectiveoxidativec-ccouplingofthesp(3)c-hbondofoxindoleswitharenesandadditiontoalkene:synthesisof3-aryloxindoles,andbenzofuro-andindoloindoles.chemasianj2017,12(7),734-743.]但是该方法吲哚酮底物受限,且目标产物产率仅有30%左右。
有机电致发光二极管(organiclight-emittingdiodes,oleds)作为一种新型的显示技术,具有自发光、宽视角、低能耗、效率高、色彩丰富、响应速度快、适用温度范围广、低驱动电压、可制作柔性可弯曲与透明的显示面板等独特优点,可以应用在平板显示器和新一代的照明上。因而吸引了众多研究者的关注与追捧。
现有的oled显示装置通常包括:基板、基板上的阳极、阳极上的空穴传输层、空穴传输层上的有机发光层、有机发光层上的电子传输层、电子传输层上的阴极。工作时电子和空穴在有机发光层中复合,产生激子,激子以1:3的比例分布在有机发光分子的单重态和三重态。激子从单重态或三重态跃迁回基态实现发光。
对于纯有机热活化延迟荧光(thermallyactivateddelayedfluorescence,tadf)材料,通过巧妙地分子设计,可使得分子具有较小的最低单三重能级差,这样三重态激子可以通过反向系间窜跃回到单重态,再通过辐射跃迁至基态而发光,从而同时利用单重态和三重态激子,实现100%的oleds理论内量子效率。
对于tadf材料,快速的反向系间窜跃常数以及高的光致发光量子效率是制备高效率oleds的必要条件。目前,具备上述条件的红光、绿光tadf材料已有不少相关报道。但是对于tadf蓝光材料,尤其是tadf深蓝光材料的报道少之又少。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明提供了一种苯并呋喃并吲哚类化合物、其制备和在蓝光tadf材料中的应用,本发明提供的一种如式(i)所示的苯并呋喃并吲哚类化合物,其具有显著的蓝光tadf特性,且合成效率高。
为实现上述目的,按照本发明的一个方面,提供了一种苯并呋喃并吲哚类化合物,具有如式(i)所示的结构式:
其中,r1选自氢、取代或未取代的c5-50的芳基、取代或未取代的c2-50的杂环芳基、取代或未取代的c1-30的烷基、取代或未取代的c1-30的烷氧基、取代或未取代的c6-30的芳氧基、取代或未取代的c1-30的烷硫基、取代或未取代的c5-30的芳硫基、取代或未取代的c5-30的环烯烃基、取代或未取代的c1-30的烷氨基、取代或未取代的c5-30的芳氨基、羟基、氨基、烯基、炔基、羧酸基、酯基、酰胺基、氰基、硝基、磺酰基、卤素;
n为1-4的整数,且当n≥2时,各r1相同或不同;
r2选自氢、取代或未取代的c1-30的烷基、取代或未取代的c1-30的烷硫基、取代或未取代的c1-30的烷胺基、取代或未取代的c2-30的杂环烷基、取代或未取代的c2-50的杂芳基、取代或未取代的c6-50的芳基、取代或未取代的c6-30的芳氧基、取代或未取代的c6-30的芳硫基、取代或未取代的c6-30的芳胺基、取代或未取代的c6-30的芳硅基、酯基、酰胺基、磺酰基、叔丁氧羰基;
r3选自氢、酯基、羰基、酰胺基;
r4选自氢、酯基、羰基、酰胺基、卤素、羟基、氨基;
r5选自氢、酯基、羰基、酰胺基、卤素、羟基、氨基;
r6选自氢、取代或未取代的c5-50的芳基、取代或未取代的c2-50的杂环芳基、取代或未取代的c1-30的烷基、取代或未取代的c6-30的芳硅基、取代或未取代的c5-30的环烯烃基、羰基。
按照本发明的另一个方面,提供了一种所述的化合物的制备方法,包括如下步骤:
(1)以吲哚类化合物和对苯酚类化合物为底物,以lewis酸为催化剂,在有机溶剂中、氧化剂存在条件下反应,反应结束后分离提纯,即得如式c所述的苯并呋喃并吲哚类化合物;其中,式c所示的苯并呋喃并吲哚类化合物结构式如下:
式c中取代基r1、r2、r3、r4和r5同式(i)中的r1、r2、r3、r4和r5;
(2)以式c所示的苯并呋喃并吲哚类化合物为原料,制备得到式(i)所示的苯并呋喃并吲哚类化合物。
优选地,所述吲哚类化合物具有如式a所示的结构:
式a中,r1、r2和n同式(i)中的r1、r2和n。
优选地,所述对苯酚类化合物具有如式b所示的结构:
式b中,r3、r4和r5同式(i)中的r3、r4和r5。
优选地,所述吲哚类化合物和对苯酚类化合物的投料摩尔比为0.01~10:1。
优选地,所述lewis酸催化剂为铜催化剂和/或钴催化剂。
优选地,所述铜催化剂为cu(otf)2、cu(ch3cn)4pf6、cucl2、cubr2、cui2、cu(phen)cl2、cu(oac)2、cu(acac)2和cui中的一种或多种;
所述的钴催化剂为cocl2、cobr2、coi2、co(oac)2和co(acac)2中的一种或多种。
优选地,所述氧化剂选自空气、氧气、pida、pifa、氧化银、h2o2、fecl3和mno2。
优选地,所述有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、四氢呋喃、2-甲基四氢呋喃、乙醚、二甲基乙二醚、1,4-环氧六烷、1,3-环氧六烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、c4-12的饱和烷烃、c3-12的氟代或者氯代烷烃、苯、甲苯、二甲苯、三甲苯、二甲亚砜、n,n-二甲基乙酰胺、丙酮、n-甲基吡咯烷酮、乙腈、c3-12的饱和烷基腈中的一种或几种的组合。
优选地,所述反应的反应温度为-78℃~80℃;反应时间为1小时~120小时。
优选地,步骤(1)所述分离提纯具体包括以下步骤:以蒸馏、冷冻干燥、吹气或减压旋转蒸发法除去反应中的有机溶剂;然后经柱层析分离后,得到如式c所示的苯并呋喃并吲哚类化合物。
按照本发明的另一个方面,提供了一种所述的苯并呋喃并吲哚类化合物的应用,用作蓝色tadf材料。
优选地,所述的苯并呋喃并吲哚类化合物用作深蓝色tadf材料。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,能够取得下列有益效果:
(1)本发明提出了一种如式(i)所示的苯并呋喃并吲哚类化合物,其具有显著的蓝光tadf特性,且合成效率高。
(2)本发明提供的式(i)所示的苯并呋喃并吲哚类化合物其制备时以吲哚类化合物、对苯酚类化合物为原料,氧气/空气为氧化剂,在lewis酸催化下制备苯并呋喃并吲哚类化合物的,由此解决现有技术制备苯并呋喃并吲哚类化合物使用昂贵的pd催化剂,且原子经济性低,高能耗,使用毒性溶剂,底物受限、产率低等的技术问题。
(3)本发明所涉及的苯并呋喃并吲哚类化合物的制备中主要原料为2,3位无取代基的吲哚类化合物和对苯酚类化合物。这些原料均为商品化试剂,价格低廉,容易获取,并且无需特别处理即可应用于反应制备。
(4)本发明所涉及的催化剂为廉价的铜、钴催化剂,相比于之前偶联反应使用钯催化剂是一个重要改进,铜和钴的催化剂对环境的容忍度高,在潮湿环境下也可正常使用,而钯催化剂催化的偶联反应则需要无水、无氧、惰性气体保护的条件下使用。
(5)本发明一些实施例中,可直接使用不加任何处理的空气作为氧化剂,与常规氧化剂相比,具有来源广泛、无成本、安全无毒、绿色无污染、无需后处理等优点。
(6)本发明使用的溶剂范围较广,并且优选实施例中可实现在乙醇中高效制备,这与之前只能用有毒溶剂邻二氯苯为反应溶剂大有不同,可使反应更加绿色无害,保护了操作人员的身体健康,同时避免了废弃毒性溶剂的后处理,进一步降低反应成本。
(7)本发明优选实施例中反应的温度相比于之前的方法,从170℃降为0℃,可以极大地降低反应的能耗,降低反应的成本。
(8)本发明所涉及的反应条件具有良好的官能团容忍性和底物普适性,取代基可以为烷基、烷氧基、氰基、酯基、硝基、卤素等。
(9)本发明的方法实现了从简单原料高效、绿色直接得到苯并呋喃并吲哚的目的,该方法效率高、成本低、步骤简化、绿色化,可广泛用于制备包含苯并呋喃并吲哚结构单元的化合物。
附图说明
图1为实施例1所得目标产物的核磁共振氢谱。
图2为实施例2所得目标产物的核磁共振氢谱。
图3为实施例3所得目标产物的核磁共振氢谱。
图4为实施例4所得目标产物的核磁共振氢谱。
图5为实施例1所得目标产物在不同溶剂中的激发光谱。
图6为实施例1所得目标产物在不同溶剂中的荧光光谱。
图7为实施例1-4所得目标产物在乙腈中的荧光光谱。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明提供的一种苯并呋喃并吲哚类化合物,具有如式(i)所示的结构式:
其中,r1选自氢、取代或未取代的c5-50的芳基、取代或未取代的c2-50的杂环芳基、取代或未取代的c1-30的烷基、取代或未取代的c1-30的烷氧基、取代或未取代的c6-30的芳氧基、取代或未取代的c1-30的烷硫基、取代或未取代的c5-30的芳硫基、取代或未取代的c5-30的环烯烃基、取代或未取代的c1-30的烷氨基、取代或未取代的c5-30的芳氨基、羟基、氨基、烯基、炔基、羧酸基、酯基、酰胺基、氰基、硝基、磺酰基、卤素;n为1-4的整数,且当n≥2时,各r1相同或不同。取代基r1所连接的苯环上有4个位点可以被取代,当至少有2个位点被r1取代时,多个r1之间可以相同也可以不同。
作为r1所代表的取代或未取代的c5-50的芳基,优选为取代或未取代的c6-20的芳基,进一步优选为苯基、萘基、蒽基、芘基、苯并芘基。
作为r1所代表的取代或未取代的c2-50的杂环芳基,优选为取代或未取代的c5-20的杂环芳基,进一步优选为呋喃基、吡咯基、吡啶基、吲哚基、咔唑基、嘧啶基、哒嗪基、三嗪基、咪唑基、噁唑基、噻唑基、噻二唑基、喹啉基、异喹啉基。
作为r1所代表的取代或未取代的c1-30的烷基,优选为取代或未取代的c1-10的烷基,进一步优选为甲基、乙基、丙基、异丙基、正丁基、异丁基、戊基、异戊基、新戊基。
作为r1所代表的取代或未取代的c1-30的烷氧基,优选为取代或未取代的c1-10的烷氧基,进一步优选为甲氧基、乙氧基。
作为r1所代表的取代或未取代的c6-30的芳氧基,优选为取代或未取代的c6-20的芳氧基,进一步优选为苯氧基、苄氧基。
作为r1所代表的取代或未取代的c1-30的烷硫基,优选为取代或未取代的c1-10的烷硫基,进一步优选为甲硫基、乙硫基。
作为r1所代表的取代或未取代的c5-30的芳硫基,优选为取代或未取代的c6-20的芳硫基,进一步优选为苯硫基、苄硫基。
作为r1所代表的取代或未取代的c5-30的环烯烃基,优选为取代或未取代的c5-10的环烯烃基,进一步优选为环戊烯基、环戊二烯基、环己烯基、环己二烯基。
作为r1所代表的取代或未取代的c1-30的烷氨基,优选为取代或未取代的c1-10的烷氨基,进一步优选为甲氨基、二甲氨基、乙氨基、二乙胺基。
作为r1所代表的取代或未取代的c5-30的芳氨基,优选为取代或未取代的c6-20的芳氨基,进一步优选为苯氨基、二苯氨基、三苯氨基。
r2选自氢、取代或未取代的c1-30的烷基、取代或未取代的c1-30的烷硫基、取代或未取代的c1-30的烷胺基、取代或未取代的c2-30的杂环烷基、取代或未取代的c2-50的杂芳基、取代或未取代的c6-50的芳基、取代或未取代的c6-30的芳氧基、取代或未取代的c6-30的芳硫基、取代或未取代的c6-30的芳胺基、取代或未取代的c6-30的芳硅基、酯基、酰胺基、磺酰基、叔丁氧羰基;
作为r2所代表的取代或未取代的c1-30的烷基,优选为取代或未取代的c1-10的烷基,进一步优选为甲基、乙基、丙基、异丙基、正丁基、异丁基、戊基、异戊基、新戊基。
作为r2所代表的取代或未取代的c1-30的烷硫基,优选为取代或未取代的c1-10的烷硫基,进一步优选为甲硫基、乙硫基。
作为r2所代表的取代或未取代的c1-30的烷胺基,优选为取代或未取代的c1-10的烷氨基,进一步优选为甲氨基、二甲氨基、乙氨基、二乙胺基。
作为r2所代表的取代或未取代的c2-30的杂环烷基,优选为取代或未取代的c5-10的杂环烷基,进一步优选为四氢呋喃基、哌啶基。
作为r2所代表的取代或未取代的c2-50的杂芳基,优选为取代或未取代的c5-20的杂芳基,进一步优选为呋喃基、吡咯基、吡啶基、吲哚基、咔唑基、嘧啶基、哒嗪基、三嗪基、咪唑基、噁唑基、噻唑基、噻二唑基、喹啉基、异喹啉基。
作为r2所代表的取代或未取代的c6-50的芳基,优选为取代或未取代的c6-20的芳基,进一步优选为苯基、萘基、蒽基、芘基、苯并芘基。
作为r2所代表的取代或未取代的c6-30的芳氧基,优选为取代或未取代的c6-20的芳氧基,进一步优选为苯氧基、苄氧基。
作为r2所代表的取代或未取代的c6-30的芳硫基,优选为取代或未取代的c6-20的芳硫基,进一步优选为苯硫基、苄硫基。
作为r2所代表的取代或未取代的c6-30的芳胺基,优选为取代或未取代的c6-20的芳氨基,进一步优选为苯氨基、二苯氨基、三苯氨基。
作为r2所代表的取代或未取代的c6-30的芳硅基,优选为取代或未取代的四苯硅基。
r3选自氢、酯基、羰基、酰胺基;
r4选自氢、酯基、羰基、酰胺基、卤素、羟基、氨基;
r5选自氢、酯基、羰基、酰胺基、卤素、羟基、氨基;
r6选自氢、取代或未取代的c5-50的芳基、取代或未取代的c2-50的杂环芳基、取代或未取代的c1-30的烷基、取代或未取代的c6-30的芳硅基、取代或未取代的c5-30的环烯烃基、羰基。
作为r6所代表的取代或未取代的c5-50的芳基,优选为取代或未取代的c6-20的芳基,进一步优选为苯基、萘基、蒽基、芘基、苯并芘基。
作为r6所代表的取代或未取代的c2-50的杂环芳基,优选为取代或未取代的c5-20的杂环芳基,进一步优选为呋喃基、吡咯基、吡啶基、吲哚基、咔唑基、嘧啶基、哒嗪基、三嗪基、咪唑基、噁唑基、噻唑基、噻二唑基、喹啉基、异喹啉基。
作为r6所代表的取代或未取代的c1-30的烷基,优选为取代或未取代的c1-10的烷基,进一步优选为甲基、乙基、丙基、异丙基、正丁基、异丁基、戊基、异戊基、新戊基。
作为r6所代表的取代或未取代的c6-30的芳硅基,优选为取代或未取代的四苯硅基。
作为r6所代表的取代或未取代的c5-30的环烯烃基,优选为取代或未取代的c5-10的环烯烃基,进一步优选为环戊烯基、环戊二烯基、环己烯基、环己二烯基。
上述的取代或未取代的芳基指未取代的芳基或可带有一个或多个取代基的芳基。所述取代基不以任何方式限定,常见的取代基如芳基、杂环芳基、烷基、酯基、氰基、硝基、酰胺基、磺酰基、烷氧基和卤素等。所述芳香基上可带有这些取代基中的一种或多种,当具有多个取代基时,这多个取代基可以相同或不同。
上述的取代或未取代的杂环芳基指未取代的杂环芳基或可带有一个或多个取代基的杂环芳基。所述取代基不以任何方式限定,常见的取代基如芳基、杂环芳基、烷基、酯基、氰基、硝基、酰胺基、磺酰基、烷氧基和卤素等。所述杂环芳香基上可带有这些取代基中的一种或多种,当具有多个取代基时,这多个取代基可以相同或不同。
本发明还提供了一种该苯并呋喃并吲哚类化合物的制备方法,以吲哚类化合物和对苯酚类化合物为底物,以lewis酸为催化剂,在有机溶剂中、氧化剂存在条件下反应,反应结束后分离提纯,即得如式c所述的苯并呋喃并吲哚类化合物;其中,式c所示的苯并呋喃并吲哚类化合物结构式如下:
式c中取代基r1、r2、r3、r4和r5同式(i)中的r1、r2、r3、r4和r5;
(2)以式c所示的苯并呋喃并吲哚类化合物为原料,制备得到式(i)所示的苯并呋喃并吲哚类化合物。
一些实施例中,所述吲哚类化合物具有如式a所示的结构:
式a中,r1、r2和n同式(i)中的r1、r2和n。
一些实施例中,所述对苯酚类化合物具有如式b所示的结构:
式b中,r3、r4和r5同式(i)中的r3、r4和r5。
上述制备方法步骤(1)反应式可表示如下:
其中,式a化合物代表吲哚类化合物,式b化合物代表对苯酚类化合物,式c代表本发明式(一)所示的苯并呋喃并吲哚类化合物。其中,本发明采用的吲哚类化合物为2,3位无取代基的吲哚类化合物。
步骤(2)以式c所示的苯并呋喃并吲哚类化合物为原料,制备得到式(i)所示的苯并呋喃并吲哚类化合物,可表示如下:
步骤(2)即为将式c中的酚羟基转化为-or6基团,可以通过采用醚化、酯化等常规的反应方法(如浓硫酸/加热条件)进行转化。
一些实施例中,所述吲哚类化合物和对苯酚类化合物的投料摩尔比为:0.01~10:1,优选为0.1~5:1,进一步优选为1:3~3:1。
一些实施例中,所述以lewis酸为催化剂,所述lewis酸催化剂为铜催化剂和/或钴催化剂,所述铜催化剂包括一价或二价的铜化合物,可以为cu(otf)2、cu(ch3cn)4pf6、cucl2、cubr2、cui2、cu(phen)cl2、cu(oac)2、cu(acac)2和cui中的一种或多种;所述的钴催化剂为二价钴化合物,可以为cocl2、cobr2、coi2、co(oac)2和co(acac)2中的一种或多种。
一些实施例中,所述氧化剂选自空气、氧气、pida、pifa、氧化银、h2o2、fecl3和mno2,优选为空气或氧气。
一些实施例中,所述有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、四氢呋喃、2-甲基四氢呋喃、乙醚、二甲基乙二醚、1,4-环氧六烷、1,3-环氧六烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、c4-12的饱和烷烃、c3-12的氟代或者氯代烷烃、苯、甲苯、二甲苯、三甲苯、二甲亚砜、n,n-二甲基乙酰胺、丙酮、n-甲基吡咯烷酮、乙腈、c3-12的饱和烷基腈中的一种或几种的组合。
一些实施例中,所述反应的反应温度为-78℃~80℃,优选为-20℃~60℃;反应时间为1小时~120小时,优选为6~72小时。
一些实施例中,步骤(1)所述分离提纯具体包括以下步骤:
以蒸馏、冷冻干燥、吹气或减压旋转蒸发法除去反应中的有机溶剂;然后经柱层析分离后,得到如式c所示的苯并呋喃并吲哚类化合物。
本发明还提供了一种所述的苯并呋喃并吲哚类化合物的应用,用作蓝色tadf材料。
本发明提出了以吲哚类化合物、对苯酚类化合物为原料,氧气/空气为氧化剂,在铜、钴的lewis酸催化下制备苯并呋喃并吲哚类化合物的新方法。该方法具有原料价廉、易得、操作简单、条件温和绿色、底物适用范围广、产率高等优点,为具有苯并呋喃并吲哚结构单元的药物分子和有机电致发光分子提供了一种高效、绿色的合成方法。
本发明提供了一种制备苯并呋喃并吲哚类化合物的绿色环保且高效的新方法并发现了一种基于苯并呋喃并吲哚的蓝色tadf材料。本发明优选实施例中先将2,3位无取代基的吲哚类化合物、对苯酚类化合物、铜催化剂、钴催化剂一起溶于有机溶剂中,然后以空气或氧气为氧化剂,在0℃到80℃下搅拌反应,反应后分离提纯,即得苯并呋喃并吲哚类化合物。该方法条件温和,底物普适性好,绿色环保,产率高,所制备的苯并呋喃吲哚类化合物,可以应用于药物化学、有机合成化学、有机太阳能电池、有机薄膜晶体管和有机发光二极管(oled)等领域中。基于苯并呋喃并吲哚的有机电致发光化合物具有较好的热稳定性、高蓝光发光效率和高发光纯度,可以作为蓝光tadf材料用于制作电致发光器件。
以下为实施例:
下面结合实施例进一步描述本发明,以下实施例中氧化剂以1atm的o2为例,钴催化剂以cocl2为例,铜催化剂以cu(otf)2为例,有机溶剂以95%的乙醇为例,但不以任何方式限制本发明的保护范围。
实施例1:
1-羧酸甲酯-2-羟基苯并呋喃[2,3-b]吲哚的制备
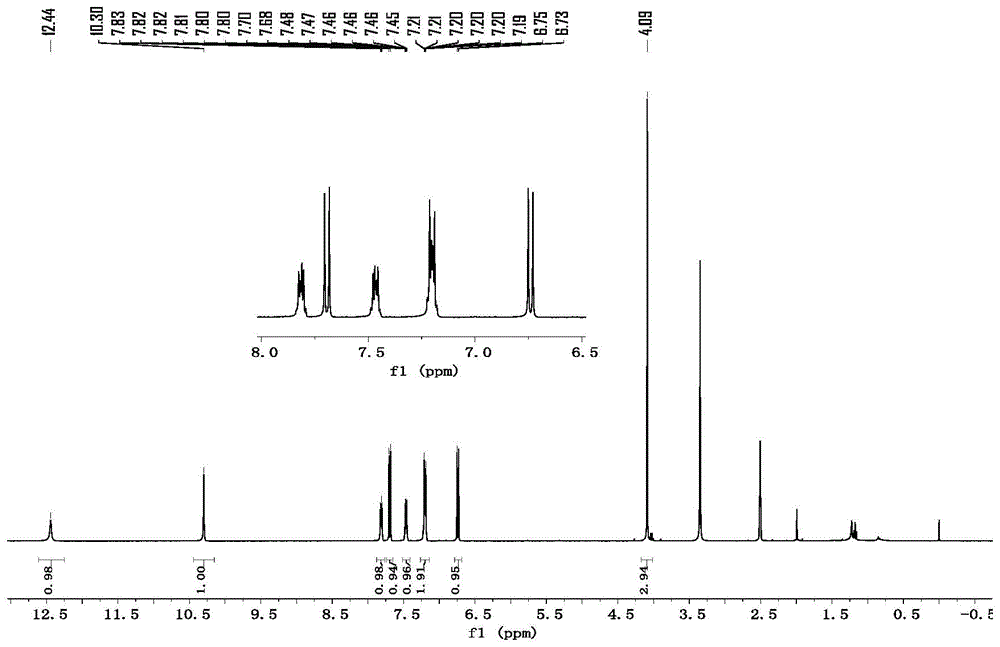
在一个25ml的样品瓶中加入2-羧酸甲酯对苯酚(0.2mmol,1.0equiv.),吲哚(0.2mmol,1.0equiv.),cocl2(1.3mg,5mol%),cu(otf)2(7.3mg,10mol%)和磁子,用橡胶塞封口后,抽真空后再充入o2,以注射器转移4ml95%的乙醇于密封的样品瓶中,再将瓶内气氛与1atm的o2相通,反应在40℃下搅拌48h后,恒温30℃以空气泵吹气1小时除去溶剂,剩余物通过柱层析硅胶纯化,洗脱液从石油醚/乙酸乙酯20∶1到5∶1梯度洗脱。收集目标产物,分离产率为91%。图1为实施例1所得目标产物的核磁共振氢谱。
1hnmr(400mhz,chloroform-d)δ11.10(s,1h),8.48(s,1h),8.05-7.87(m,1h),7.59(d,j=8.9hz,1h),7.50-7.42(m,1h),7.34-7.29(m,2h),6.83(d,j=8.9hz,1h),4.27(s,3h).
hrms(esi):c16h11no4[(m+na)+]:calcd.:281.27;found:281.02.
图5为实施例1所得目标产物在不同溶剂中的激发光谱。目标产物在不同溶剂中的浓度均为2*10-5mol/l,可以看出制备的目标产物在不同溶剂中的吸收峰位置与吸收强度相差极大,总体表现为溶剂极性越大,吸收峰红移。
图6为实施例1所得目标产物在不同溶剂中的荧光光谱。目标产物在不同溶剂中的浓度均为2*10-5mol/l,可以看出制备的目标产物在不同溶剂中的荧光发射峰位置随溶剂极性增大而逐渐红移,表现出来正的溶剂化显色效应,符合tadf材料的荧光特性。
表1为实施例1所得目标产物在不同溶剂中表现出来的cie坐标数据表。
表1
从表1可以看出在极性较小的二氯甲烷与甲苯中,实施例目标产物1的光致荧光cie坐标中的y值均接近于0.06,符合美国电视委员会(usnationaltelevisionsystemscommittee,ntsc)规定的深蓝光材料标准cie坐标y<0.08,非常接近欧洲广播联盟(europeanbroadcastingunion,ebu)规定的深蓝光材料发射光谱的cie坐标y<0.06。通过对于此类化合物中的取代基结构进行调控可以进一步降低cie坐标y值,这可通过图7得到证实。
实施例2:
1-羧酸甲酯-2-羟基-8-溴苯并呋喃[2,3-b]吲哚的制备
在一个25ml的样品瓶中加入2-羧酸甲酯对苯酚(0.2mmol,1.0equiv.),6-溴吲哚(0.2mmol,1.0equiv.),cocl2(1.3mg,5mol%),cu(otf)2(7.3mg,10mol%)和磁子,用橡胶塞封口后,抽真空后再充入o2,以注射器转移4ml95%的乙醇于密封的样品瓶中,再将瓶内气氛与1atm的o2相通,反应在40℃下搅拌48h后,恒温30℃以空气泵吹气1小时除去溶剂,剩余物通过柱层析硅胶纯化,洗脱液从石油醚/乙酸乙酯20:1到5:1梯度洗脱。收集目标产物,分离产率为75%。图2为实施例2所得目标产物的核磁共振氢谱。
1hnmr(400mhz,chloroform-d)δ11.05(s,1h),10.68(s,1h),7.76(d,j=8.7hz,1h),7.59–7.53(m,2h),7.35(dd,j=8.7,1.9hz,1h),6.79(d,j=8.9hz,1h),4.21(s,3h).
hrms(esi):c16h10brno4[(m+na)+]:calcd.:360.16;found:360.08.
实施例3:
1,9-二羧酸甲酯-2-羟基苯并呋喃[2,3-b]吲哚的制备
在一个25ml的样品瓶中加入2-羧酸甲酯对苯酚(0.2mmol,1.0equiv.),5-羧酸甲酯吲哚(0.2mmol,1.0equiv.),cocl2(1.3mg,5mol%),cu(otf)2(7.3mg,10mol%)和磁子,用橡胶塞封口后,抽真空后再充入o2,以注射器转移4ml95%的乙醇于密封的样品瓶中,再将瓶内气氛与1atm的o2相通,反应在40℃下搅拌48h后,恒温30℃以空气泵吹气1小时除去溶剂,剩余物通过柱层析硅胶纯化,洗脱液从石油醚/乙酸乙酯20:1到5:1梯度洗脱。收集目标产物,分离产率为60%。图3为实施例3所得目标产物的核磁共振氢谱。
1hnmr(400mhz,dmso-d6)δ12.96(s,1h),10.63(s,1h),8.56(d,j=1.7hz,1h),7.84(dd,j=8.4,1.7hz,1h),7.76(d,j=8.9hz,1h),7.55(d,j=8.4hz,1h),6.79(d,j=8.9hz,1h),4.16(s,3h),3.89(s,3h).
hrms(esi):c18h13no4[(m+na)+]:calcd.:339.30;found:339.07.
实施例4:
1-羧酸甲酯-2-羟基-9-苄氧基苯并呋喃[2,3-b]吲哚的制备
在一个25ml的样品瓶中加入2-羧酸甲酯对苯酚(0.2mmol,1.0equiv.),5-苄氧基吲哚(0.2mmol,1.0equiv.),cocl2(1.3mg,5mol%),cu(otf)2(7.3mg,10mol%)和磁子,用橡胶塞封口后,抽真空后再充入o2,以注射器转移4ml95%的乙醇于密封的样品瓶中,再将瓶内气氛与1atm的o2相通,反应在40℃下搅拌48h后,恒温30℃以空气泵吹气1小时除去溶剂,剩余物通过柱层析硅胶纯化,洗脱液从石油醚/乙酸乙酯20:1到5:1梯度洗脱。收集目标产物,分离产率为86%。图4为实施例4所得目标产物的核磁共振氢谱。
1hnmr(400mhz,chloroform-d)δ11.04(s,1h),8.32(s,1h),7.62–7.54(m,2h),7.51(d,j=7.1hz,2h),7.43(t,j=7.3hz,2h),7.37(d,j=7.3hz,1h),7.33(d,j=8.7hz,1h),6.99(dd,j=8.7,2.5hz,1h),6.81(d,j=8.8hz,1h),5.21(s,2h),4.18(s,3h).
hrms(esi):c23h17no4[(m+na)+]:calcd.:387.39;found:387.16。
图7为实施例1-4所得目标产物在乙腈中的荧光光谱,可以看出具有不同电子效应的取代基(式(i)中r1位置的取代基)可以改变此类苯并呋喃并吲哚类化合物的荧光特性。并且取代基的种类基本不会对荧光光谱发射峰位置产生太大影响,即对于光的颜色影响有限,不会脱离蓝光材料的范畴。同时观察到吸电子基会使得目标产物的光致荧光cie坐标y值进一步降低,使化合物成为符合双重标准的深蓝光材料。
实施例5-22:
通过上述实施例1所述方法得到下表2所示的目标产物。
实施例23:
在一个25ml的样品瓶中加入实施例5所得目标产物(0.2mmol,1.0equiv.),fe(clo4)3(0.25mol%)和磁子,再加入5ml乙酸为溶剂。在室温下搅拌反应16个小时,反应完成后,再加入10%碳酸氢钠溶液进行中和。混合物用二氯甲烷萃取,分离有机相,并减压蒸干。剩余物通过柱层析硅胶纯化,得到目标产物。
表2实施例5-23的反应物、产物和收率
测试表明,实施例5至实施例23制备得到的苯并呋喃并吲哚类化合物均能够用作蓝光材料。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 吲哚-3-甲醇的合成方法
- 吲哚-3-甲醇及其二聚体在制备防治增殖性血管疾病药物中的应用的制作方法
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物在制备防治肾纤维化药物中的应用的制作方法
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物在制备防治肺纤维化药物中的应用的制作方法
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物在制备治疗老年痴呆药物中的应用的制作方法
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物在制备治疗骨质疏松药物中的应用的制作方法
- 减轻吲哚-3-甲醇及其衍生物不良反应的药物组合物的制作方法
- 吲哚-3-原醇在制备防治实验性肺纤维化药物中的应用的制作方法
- 吲哚三甲醇或其二聚体在制备治疗骨髓抑制药物中的应用的制作方法
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物在制备治疗糖尿病药物中的应用的制作方法