一种调控番茄抗坏血酸积累的基因及应用的制作方法
[0001]
本发明属于基因工程技术领域,尤其涉及一种调控番茄抗坏血酸积累的slf-box基因及应用。
背景技术:
[0002]
目前,f-box是由大约50个氨基酸组成的蛋白motif,主要作用是作为蛋白与蛋白之间的结合位点,首先被发现参与构成scf(skip1-cullin-f-box)泛素e3连接酶复合体,特异性的结合底物然后启动依赖泛素蛋白酶复合体途径的降解过程(kipreos and pagano 2000)。f-box蛋白在真核生物中广泛存在,其中拟南芥全基因组测序发现至少1000个f-box蛋白,水稻中也已有687个f-box基因被鉴定出来(xu et al 2009)。基因序列的差异导致其具有不同的功能,在植物中f-box在遗传上控制许多至关重要的过程,主要包括胚胎发生、植物体内激素(eth、auxin、ga、ja等)的信号转导与调控、幼苗发育、花器官形成、衰老等过程(lechner et al 2006)。最近的研究表明,f-box蛋白在植物的逆境反应以及相关代谢物的合成调控方面也发挥重要作用(feder et al 2015;lyzenga and stone 2012)。
[0003]
吲哚-3-乙酸(iaa或auxin)参与植物生长发育的诸多过程,是第一个被证实通过scf复合体途径进行信号转导的植物激素。f-box蛋白transport inhibitor response 1(tir1)是scf复合体的一部分,其通过靶向特定aux/iaa蛋白来启动依赖泛素蛋白酶复合体途径的降解来介导生长素依赖的转录调控(gray et al 2001)。aux/iaa蛋白作为阻遏蛋白通过结合和阻断auxin response factor(arf)转录因子转录激活生长素诱导基因的表达发挥作用(dharmasiri and estelle 2004)。f-box蛋白家族tir1和afb2通过促进aux/iaa转录阻遏物的降解影响生长素的信号转导,另外两个f-box蛋白家族成员afb4和afb5也可作为生长素受体起作用,且表现出明显的生长素特异性(prigge et al 2016)。
[0004]
光在植物生长发育中非常重要,影响植物体内很多的生理生化代谢过程以及相关的基因表达,高等植物中光信号转导和生物钟节律也受到f-box蛋白的调控。an等人通过比对拟南芥中max2(more axillary growth2)基因,在苹果中找到一个f-box蛋白mdmax2,研究发现在苹果愈伤组织中超量表达mdmax2可提高花青素的积累,拟南芥中mdmax2的异位表达显示光形态发生表型,包括增加花青素含量和下胚轴长度减少,进一步的研究表明,mdmax2通过影响生长素和其他植物激素信号转导促进植物光形态发生,苹果愈伤组织和拟南芥中超量表达mdmax2相比对照表现出对盐和干旱胁迫更强的耐受性(an et al 2016)。
[0005]
高等植物花的发育由一个abc模型来控制,即花的发育由三类基因来控制。研究显示某些f-box蛋白可以调控花的发育。高等植物中鉴定的第一个f-box蛋白是拟南芥中的ufo(unusual floral organs)基因,ufo作为调控因子正调控花发育b类基因ap3,ufo功能的丧失会影响花发育的很多方面(ni et al 2004)。ddf1(dwarf and deformed flower 1)是在水稻中鉴定出来的f-box蛋白,ddf1定位在细胞核内,几乎在所有的营养组织和生殖组织中均可表达。在ddf1-1突变体中,营养生长、生殖生长均表现异常且除了小穗所有器官显著变小,ddf1通过调节细胞分裂和细胞扩张来控制花器官的大小(duan et al 2012)。
[0006]
植物自交不亲和是植物中普遍存在的一种生物现象,研究证实s位点在植物自交不亲和过程中发挥着重要作用。li等研究矮牵牛花粉发育s2、s3时期,通过转录组预测找到179个f-box蛋白,其中17个slf(s-locus f-box proteins)蛋白,参与形成scf
slf
复合体,在植物的自交不亲和性过程中发挥作用(li et al2016)。
[0007]
最近的研究表明,f-box蛋白在植物生理生化过程以及相关物质的代谢调控方面也发挥着重要功能。feder等人在甜瓜中通过rna-seq研究柚皮苷查耳酮(黄色类黄酮色素)在果皮中的积累,鉴定了一个含有kelch结构域的f-box蛋白基因cmkfb,起能够通过负调控方式影响柚皮苷查尔酮色素的积累。另外代谢物分析表明下游类黄酮与柚皮苷查耳酮一起累积,而cmkfb表达将生化通量转向香豆素和一般苯丙素类。在番茄中超量表达cmkfb也表现出与香瓜中类似的一种类黄酮积累的结果。这些结果表明cmkfb作为转录后调控因子通过泛素化途径影响类黄酮代谢通量(feder et al 2015)。f-box蛋白col1(coronatine insensitive 1)是ja受体的重要组分,通过特异作用jasmonate zim-domain(jaz)蛋白启动蛋白酶体降解过程,影响ja信号转导。jaz互作的转录因子,如helix-loop-helixs(bhlhs)mybs和ein/eil,参与激活ja介导的激素响应。myb305已被鉴定可作为金鱼草花中类黄酮代谢和烟草中淀粉合成的调控因子,研究表明在烟草中ntcoi1通过在ntmyb305上游发挥功能,并在植物初级碳水化合物代谢和相关性生理过程中发挥重要作用(wang et al 2014)。
[0008]
f-box所编码的氨基酸在n端具有一个含有40-50个氨基酸的f-box结构域。该模体位于n端附近,f-box序列与人类(skp2和fbx4)和拟南芥(ore9、sleepy1、fkf1、ufo和son1)几个已知f-box蛋白显示出一定的同源性,它们作为scf(skp1-cul1-f-box)泛素e3连接酶复合体的成员,参与识别包含被激活泛素的e2蛋白以及需泛素化的目标底物(zhang et al 2009)。许多f-box蛋白在c端区域含有未知功能域duf295,但它们被猜测可能参与目标底物的识别与结合(gagne et al 2002)。
[0009]
综上所述,现有技术存在的问题是:抗坏血酸对人体也有着非常重要的作用,且人体自身不能合成抗坏血酸,只能通过含抗坏血酸含量高的水果蔬菜获取。目前,对主要的模式作物如拟南芥等,研究人员对于抗坏血酸的合成代谢研究已经取得很大进展,抗坏血酸在高等植物中的合成途径已经基本确定,但是关于调控因子影响植物抗坏血酸含量方面进展较少。
[0010]
(1)现有技术中,asa调控机制还并不清楚,没有利用番茄f-box转基因材料进行功能研究。在高等植物中抗坏血酸合成主要有4条途径,分别是:d-甘露糖/l-半乳糖途径、半乳糖醛酸途径、肌醇途径和古洛糖途径。关于抗坏血酸在植物体内的生物合成已经报道很多,且相关途径的关键酶基因也已经被鉴定和克隆,但是关于抗坏血酸在植物体内的合成调控研究进展还比较少。现有报道的抗坏血酸调控因子仅仅局限于erf98、hz24和csn5b等,且主要集中在模式植物拟南芥中。重要的园艺作物番茄中抗坏血酸合成代谢的调控因子研究亟需深入。
[0011]
解决上述技术问题的难度:抗坏血酸的合成是由多基因控制的,f-box是否参与抗坏血酸的合成?f-box基因家族成员多,具体那个基因会参与调控抗坏血酸的合成?f-box是通过哪个合成途径调控抗坏血酸合成?这些都是未知的问题。
[0012]
解决上述技术问题的意义:番茄果实中asa含量高,且由于在人类饮食中番茄是常
见的蔬果,提高番茄抗坏血酸含量有重要的意义。人类由于确实抗坏血酸合成的能力,必须从新鲜水果蔬菜中摄取抗坏血酸。番茄中调控抗坏血酸积累的机理研究处于起步阶段。因此,全面了解抗坏血酸的生物合成途径及相关的调控过程,进而更有效的提高番茄中抗坏血酸的水平显得尤为重要。
技术实现要素:
[0013]
针对现有技术存在的问题,本发明提供了一种调控番茄抗坏血酸积累的f-box基因及应用。
[0014]
本发明是这样实现的,一种调控番茄抗坏血酸积累的基因,为slf-box基因,dna为seq id no:1。基因登录号为(genbank:solyc01g111920)gtggtaaggagatttttaggaggaaaagaacccgcaatggttgacccgtataccggcccaaaagaagcttgaacatctggtccaggtgtcaatggcagaagctatttccgggaagcatctgctgtgatttgcactgcactcaaaattatatatgtataaatctctcatcaccattcnaagaatccatcatcaatctacggttactgtaacagtaatggccgaatggtctcaacttcccagagaactcgttgaactcatttccaaacacctttccaccgaaactgatttcctccgtttccgttccgtttgctcatcatggcgttcctctcttcctcctaaaccctacccgtcttccctttcccgttttcccattctccccaatgacggcatcgctgaaaatagctggggttttaaactctccaaatcacccctctaccttatccatccacctaatcaaactaataaccatggatggatcatcaagctcgatcgcgaaaatccacagaggatgcgtttattcaatcctctttccagatcccaatgcaaaccccttcctcctgatttccccaagattttggattcctcgcaatacccaattcgcgaattgtgccatgagtatactcttcagtttataaagtaccgacccagggctagttccattgccgatgctgggaatctctacatggaaaaagtcgctgtgcgtatggaaaagaatgggtttgtgctattgacaattcatgtttctgggaaattggtgatgtttagatctggtgataccaagtggtctattgttgatgagtcatctttgccttacgatgatgtcattatgaaagatgagaacttttatgctgttgataatactggtaagggagtgcttgttaaattgaaccctgggacagcgccagaattacaagttgttgctcattctgtgtttgggggagataaaaagttccttgtggagtcttgtggtgaccttttaatggttgacaagtatttgagtattgggcctgaagatgatcttggatacaatgagactgttgagttttacgaggaatttgattgctacatgagcgaaaggacggttaagttcaaagtttataagttggatggagatatgcagaggtgggttgaggtcaattgtttggaagataggatgttgtttgtgggggataattgtacattttctgctttggtctccgagcttgattctgggtgtaaagggaactgtatactcttctcggatctgtttttctgcagcaccgaggatgatggaggattctggaagcatcacggcattggtgtgtttagtttggaaaatggcagcatttgtcctataaattgttgccgtggctatgccgagttgttttggcctcctcctccttggatttgttctcctccaactattgatgctgagctgaatgagctgaaaatctaattctcttggaacttgacggggaataaaaagaaactagctagccagagctgatcatatgctggacttctttaaactgtacatatggttttcttcggaaattgacatttcgctcaaggtttaagtccttatgtggcattgactggcacaaataaatgaaccaagttgttaaaactattttcattgacagtattatggtaaagaaacaaagatcttcatgtgttcgtttctttactaaatgtggttcacataaatttcacctttcttattttaagaacagttgcagctaaccagcagcaacatatgattaccagtcattcaatggagaattatttgagc。
[0015]
本发明的另一目的在于提供一种利用所述调控番茄抗坏血酸积累的f-box基因编码的蛋白,所述蛋白的氨基酸序列为seq id no:2。
[0016]
falhsklymykslitixrihhqstvtvtvmaewsqlprelveliskhlstetdflrfrsvcsswrsslppkpypsslsrfpilpndgiaenswgfklsksplylihppnqtnnhgwiikldrenpqrmrlfnplsrsqckplppdfpkildssqypirelcheytlqfikyrprassiadagnlymekvavrmekngfvlltihvsgklvmfrsgdtkwsivdesslpyddvimkdenfyavdntgkgvlvklnpgtapelqvvahsvfggdkkflvescgdllmvdkylsigped
dlgynetvefyeefdcymsertvkfkvykldgdmqrwvevncledrmlfvgdnctfsalvseldsgckgncilfsdlffcsteddggfwkhhgigvfslengsicpinccrgyaelfwppppwicspptidaelnelki(phe ala leu his ser lys leu tyr met tyr lys ser leu ile thr ile xaa arg ile his his gln ser thr val thr val thr val met ala glu trp ser gln leu pro arg glu leu val glu leu ile ser lys his leu ser thr glu thr asp phe leu arg phe arg ser val cys ser ser trp arg ser ser leu pro pro lys pro tyr pro ser ser leu ser arg phe pro ile leu pro asn asp gly ile ala glu asn ser trp gly phe lys leu ser lys ser pro leu tyr leu ile his pro pro asn gln thr asn asn his gly trp ile ile lys leu asp arg glu asn pro gln arg met arg leu phe asn pro leu ser arg ser gln cys lys pro leu pro pro asp phe pro lys ile leu asp ser ser gln tyr pro ile arg glu leu cys his glu tyr thr leu gln phe ile lys tyr arg pro arg ala ser ser ile ala asp ala gly asn leu tyr met glu lys val ala val arg met glu lys asn gly phe val leu leu thr ile his val ser gly lys leu val met phe arg ser gly asp thr lys trp ser ile val asp glu ser ser leu pro tyr asp asp val ile met lys asp glu asn phe tyr ala val asp asn thr gly lys gly val leu val lys leu asn pro gly thr ala pro glu leu gln val val ala his ser val phe gly gly asp lys lys phe leu val glu ser cys gly asp leu leu met val asp lystyr leu ser ile gly pro glu asp asp leu gly tyr asn glu thr val glu phe tyr glu glu phe asp cys tyr met ser glu arg thr val lys phe lys val tyr lys leu asp gly asp met gln arg trp val glu val asn cys leu glu asp arg met leu phe val gly asp asn cys thr phe ser ala leu val ser glu leu asp ser gly cys lys gly asn cys ile leu phe ser asp leu phe phe cys ser thr glu asp asp gly gly phe trp lys his his gly ile gly val phe ser leu glu asn gly ser ile cys pro ile asn cys cys arg gly tyr ala glu leu phe trp pro pro pro pro trp ile cys ser pro pro thr ile asp ala glu leu asn glu leu lys ile 435)。
[0017]
本发明的另一目的在于提供一种利用所述调控番茄抗坏血酸积累的slf-box基因构建的表达载体,所述表达载体为pgbkt7,该载体来源为美国bd clontech公司。
[0018]
本发明的另一目的在于提供一种所述表达载体的构建方法,所述表达载体的构建方法包括:
[0019]
以番茄a57叶片cdna为模板进行pcr扩增,得到f-box基因全长orf,连接到中间载体peasy-b上,通过热击转化入大肠杆菌,扩繁后菌液pcr检测并挑选条带大小正确的单克隆测序验证;测序正确的抽取其质粒,并用ecori和sali对pgbkt7空质粒和peasy-b重组载体质粒进行双酶切回收将回收的基因片段通过t4 dna连接酶连接到线性pgbkt7载体上,构建pgbkt7-f-boxbox重组质粒;将连接产物通过热激转入大肠杆菌,并用含50mg/l spec抗性的平板涂皿筛选单克隆,挑选单克隆在50mg/l spec液体lb中,37℃200r/min摇床上扩繁,菌液pcr检测后挑选正确抽提质粒用于下一步酵母的转化。
[0020]
本发明的另一目的在于提供一种所述调控番茄抗坏血酸积累的slf-box基因在番茄抗坏血酸含量测定上的应用,所述在番茄抗坏血酸含量测定上的应用包括总抗坏血酸含量的测定和还原态抗坏血酸含量的测定;
[0021]
总抗坏血酸含量的测定包括:
[0022]
取上清20μl于酶标板中,加入20μl,5mm的dtt,离心混匀后置于37℃反应20min;
[0023]
向反应溶液中加入10μl 0.5%的nem溶液,离心混合后室温下放置1min;
[0024]
加入80μl the color reagent,离心混匀后于37℃反应1h,在550nm波长下测定其吸光值;
[0025]
所述还原态抗坏血酸含量测定包括:
[0026]
取上清20μl于酶标板中,加入30μl磷酸缓冲液;
[0027]
加入80μl the color reagent,离心混匀后于37℃反应1h,在550nm波长下测定其吸光值。绘制标准曲线:用抗坏血酸标样配置成初始浓度为1mg/ml的标准溶液,用6%的三氯乙酸按浓度稀释成不同浓度的溶液,按照还原态抗坏血酸测定方法分别在550nm波长下测定其吸光值,绘制成标准曲线。
[0028]
本发明的另一目的在于提供一种所述调控番茄抗坏血酸积累的f-box基因在叶绿素含量测定上的应用,所述在叶绿素含量测定的应用包括:
[0029]
用液氮取样并将样品于液氮中研磨至粉状,称取粉状样品定量至0.2g于2ml离心管中;
[0030]
向离心管中加入1.5ml浓度为80%的丙酮溶液,并立即混匀并置于黑暗处使样品充分抽提1h;
[0031]
将试管置于离心机离心,12000r/min,10min;
[0032]
吸取200μl上清于酶标板中,用酶标仪在波长646nm和663nm下分别测定样品吸光值;
[0033]
使用叶绿素浓度计算公式计算叶绿素含量;
[0034]
叶绿素浓度(mg/ml)=17.32a
646
+7.18a
663
,a表示相关波长下的吸光值。
[0035]
本发明的另一目的在于提供一种所述调控番茄抗坏血酸积累的slf-box基因在丙二醛含量测定上的应用,所述在丙二醛含量测定上的应用包括:
[0036]
用液氮取样并将样品于液氮中研磨至粉状,称取粉状样品定量0.2g于10ml离心管中;
[0037]
向试管中加入3ml浓度为5%的三氯乙酸(tca)溶液,立即混匀溶液并抽提30min;
[0038]
将样品置于离心机离心,3000r/min,10min;
[0039]
吸取2ml上清溶液转移至新的10ml离心管中,并向试管中加入2ml浓度为0.67%的tba溶液;将上述样品混匀置于沸水浴30min,待溶液冷却后离心;
[0040]
吸取200μl上清液体于酶标板中,用酶标仪在波长450nm,532nm和600nm处分别测定吸光值;
[0041]
使用丙二醛浓度计算公式计算含量;
[0042]
mda(μm/l)=6.45(a
532-a
600
)-0.56a
450
,a为吸光值。
[0043]
0.67%tba配置;称取0.67g硫代巴比妥酸,然后加水至100ml。
[0044]
本发明的另一目的在于提供一种所述调控番茄抗坏血酸积累的slf-box基因在番茄叶片h2o2荧光染色鉴定上的应用,所在番茄叶片h2o2荧光染色鉴定上的应用包括:
[0045]
收集mv处理一周的番茄叶片,置于50ml离心管中并加入25μm h2dcfda浸泡,置于黑暗环境15min,然后用20mm,ph 6.0的磷酸钾缓冲液冲洗;将番茄不同株系叶片分别制作
临时切片,进行可视化荧光信号apotome鉴定。
[0046]
本发明的另一目的在于提供一种所述调控番茄抗坏血酸积累的f-box基因在gmp酶活测量上的应用,所述在gmp酶活测量上的应用包括:
[0047]
1)酶液提取
[0048]
将样品置于液氮中研磨成粉状,定量抽取0.2g于10ml预冷离心管中;立即加入1.5ml 4℃预冷的提取液;将样品置于冰冻离心机离心,7500r/min,4℃,5min,上清为粗酶提取液;
[0049]
2)gmp酶活测定:
[0050]
gmp的酶活力采用外加无机焦磷酸酶的比色方法测定。将准备好的粗酶提取液稀释20倍;吸取10μl稀释后的提取液于酶标板中,向酶标板加入90μl反应液于30℃,反应30min;待反应完成后,向反应体系中加入100μl显示试剂;将酶标板放入酶标仪设置650nm波长下测量光的吸收;gmp酶活结果用u/30min/g fw表示;
[0051]
粗酶提取液组分:50mmol/l tris(ph 7.5);20%甘油;1mmol/l edta;5mmol/l dtt;1%pvp。反应液组分:50mmol/l tris(ph7.5);8mmol/l mgcl2;100μmol/l gtp;100μmol/l甘露糖-1-磷酸-na;1mmol/l dtt;0.1units ml-1
无机焦磷酸化酶;
[0052]
显色试剂组分:0.03%(w/v)绿孔雀石;0.2%(w/v)钼酸铵;0.05%triton-x-100。
[0053]
本发明的另一目的在于提供一种所述调控番茄抗坏血酸积累的f-box基因在galur酶活测定上的应用,所述在galur酶活测定上的应用包括:
[0054]
1)取植物组织样品于液氮中研磨成粉末,称取0.2g于提前预冷的2ml离心管中,向离心管中加入50mm磷酸缓冲液,于4℃,4000r/min离心30min,收集上清液即为酶提取液,低温保存备用;
[0055]
2)取10μl酶液与290μl反应液混合,加入酶标板中;记录340nm的吸光值变化。
[0056]
综上所述,本发明的优点及积极效果为:slf-box对番茄抗坏血酸积累有调控作用。本发明是拟南芥中f-box为信息探针,在番茄unigene数据库中搜索同源性最高且具有相同保守结构域的unigene命名为slf-box。在番茄中对slf-box做转基因功能验证,并从生理生化和分子水平分析slf-box的功能及调控模式。主要分析结果如下:
[0057]
本发明通过转基因植株进行功能鉴定,确定slf-box特异性地通过d-man/l-gal途径调控番茄抗坏血酸含量。在转基因超量株系、干涉株系叶片和绿熟果实以及红熟果实中,相比于对照抗坏血酸含量分别表现出负调控关系,即超量表达slf-box减少抗坏血酸积累,干涉株系抗坏血酸积累增多,且呈显著性差异。
[0058]
本发明利用qpcr检测了阳性转基因株系叶片中与抗坏血酸合成、代谢及转运相关基因的表达情况,结果显示在番茄中抑制slf-box的表达可使甘露糖/l半乳糖合成途径中大部分基因上调表达,超量表达slf-box则结果相反;抑制slf-box的表达可使大部分代谢相关基因下调表达,对转运相关基因的表达水平影响不大,但是超量表达slf-box之后对代谢相关基因影响不大,却可明显抑制转运相关基因的表达。
[0059]
本发明slf-box对番茄抗坏血酸含量的调控随着光照呈现周期性变化。通过48小时的光周期实验发现,进入黑暗环境后slf-box的基因表达量不断上升,与此对应,抗坏血酸的含量逐渐降低,在光照下抗坏血酸含量高于黑暗条件。
[0060]
本发明干涉slf-box的表达可提高番茄对氧化逆境的抗性。抗坏血酸通过一系列
生理生化反应清除活性氧,保护植物免受一些逆境胁迫所带来的伤害。利用甲基紫精(mv)喷施处理人为地创造氧化胁迫逆境,观察逆境处理后叶绿素和丙二醛含量的变化研究slf-box对植株抗氧化能力的影响。对不同株系喷施mv后,与对照ac相比slf-box转基因干涉材料的叶绿素含量上升、丙二醛含量下降,表明抗氧化胁迫能力提高。
[0061]
本发明对番茄抗坏血酸合成途径关键酶gmp和galur的酶活力测定。结果显示干涉slf-box表达可提高番茄植株中gmp酶活力;超量表达slf-box可在一定程度降低番茄植株中galur的酶活力,干涉slf-box表达不能改变galur酶活力。
[0062]
本发明构建了f-box完整片段的pgbkt7钓饵表达载体,经验证重组钓饵载体pgbkt7-f-box没有自激活活性,且对宿主菌y187没有毒性抑制现象。用重组钓饵质粒对文库进行mating,得到约400个杂交菌斑,pcr检测后随机选取条带具有特异性的片段进行测序。
[0063]
本发明测序结果经sgn数据库比对后,表明共有45个有效基因信息。随后选取了10个基因构建了pgadt7表达载体进行点对点验证,结果筛选出4个互作蛋白,其中skp1是scf(skp1-cul1-f-box)复合物中一个关键的骨架蛋白,说明f-box是作为scf泛素连接酶复合体的一个组成成分,通过泛素降解来调控asa代谢的。
[0064]
通过酵母钓库及点对点验证,显示slf-box发挥功能可能通过其保守结构域f-box构成泛素e3连接酶scf复合体发挥作用。对转基因株系做泛素表达水平检测发现,超量表达slf-box之后,泛素表达水平有上调趋势,与之对应的是抗坏血酸含量的下降。初步表明f-box蛋白slf-box通过泛素-蛋白酶复合体途径调控番茄中抗坏血酸的合成。
附图说明
[0065]
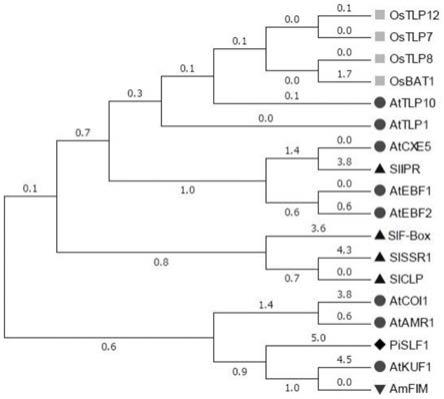
图1是本发明实施例提供的不同植物f-box结构域蛋白序列的系统进化树图。
[0066]
图2是本发明实施例提供的番茄不同组织中slf-box的组织表达谱分析(a)及番茄不同组织中总抗坏血酸含量(b)。
[0067]
图3是本发明实施例提供的超量(a)及干涉(b)转基因株系中slf-box的表达分析图。
[0068]
图4是本发明实施例提供的slf-box超量及干涉转基因株系叶片(a)及果实(b)asa含量测定图。
[0069]
图5是本发明实施例提供的slf-box在转基因株系(oe、ri)和野生型(ac)果实不同时期的表达以及不同株系果实发育各个阶段的asa含量图。
[0070]
图6是本发明实施例提供的slf-box转基因株系叶片中asa合成相关基因的表达分析图。
[0071]
图7是本发明实施例提供的slf-box转基因株系叶片中asa代谢相关基因的表达分析图。
[0072]
图8是本发明实施例提供的slf-box转基因株系叶片中asa转运相关基因的表达分析图。
[0073]
图9是本发明实施例提供的slf-box转基因株系及野生型发芽种子在1/2ms培养基及含有100mm nacl的1/2ms培养基上生长两周后的表型(a)及相对主根长差异(b)图。
[0074]
图10是本发明实施例提供的slf-box在昼夜节律中的作用图。
[0075]
图11是本发明实施例提供的slf-box在植物氧化胁迫中的作用图。
[0076]
图12是本发明实施例提供的dab染色检测h2o2的积累图。
[0077]
图13是本发明实施例提供的番茄叶片h2dcfda染色鉴定h2o2图。
[0078]
图14是本发明实施例提供的转基因番茄株系叶片中gmp酶活力的分析图。
[0079]
图15是本发明实施例提供的转基因番茄株系叶片中galur酶活力的分析图。
[0080]
图16是本发明实施例提供的转基因植株泛素表达水平检测图。
[0081]
图17是本发明实施例提供的pgbkt7-f-box重组载体的自激活检测图。
[0082]
图18是本发明实施例提供的点对点互作验证图。
[0083]
图18中:a:skp1+slf-box;
[0084]
b:solyc06g065840+slf-box;
[0085]
c:solyc01g087240+slf-box;
[0086]
d:bat3+slf-box;
[0087]
阳性对照:pgbkt7-53+pgbkt7-t;阴性对照:pgbkt7-lam。
[0088]
图19是本发明实施例提供的slf-box互作基因表达量测定图。
具体实施方式
[0089]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0090]
现有技术中,asa调控机制还并不清楚,没有利用番茄f-box转基因材料进行功能研究。
[0091]
针对现有技术存在的问题,本发明提供了一种调控番茄抗坏血酸积累的f-box基因及应用,下面结合附图对本发明作详细的描述。
[0092]
本发明实施例提供一种调控番茄抗坏血酸积累的基因,dna为seq id no:1。
[0093]
本发明提供一种利用所述调控番茄抗坏血酸积累的f-box基因编码的蛋白,所述蛋白的氨基酸序列为seq id no:2。
[0094]
本发明提供一种利用所述调控番茄抗坏血酸积累的f-box基因构建的表达载体,所述表达载体为pgbkt7,dna序列为seq id no:3。
[0095]
本发明提供一种所述表达载体的构建方法,所述表达载体的构建方法包括:
[0096]
以番茄a57叶片cdna为模板进行pcr扩增,得到f-box基因全长orf,连接到中间载体peasy-b上,通过热击转化入大肠杆菌,扩繁后菌液pcr检测并挑选条带大小正确的单克隆测序验证;测序正确的抽取其质粒,并用ecori和sali对pgbkt7空质粒和peasy-b重组载体质粒进行双酶切回收将回收的基因片段通过t4 dna连接酶连接到线性pgbkt7载体上,构建pgbkt7-f-box重组质粒;将连接产物通过热激转入大肠杆菌,并用含50mg/l spec抗性的平板涂皿筛选单克隆,挑选单克隆在50mg/l spec液体lb中,37℃200r/min摇床上扩繁,菌液pcr检测后挑选正确抽提质粒用于下一步酵母的转化。
[0097]
下面结合具体实施例对本发明作进一步描述。
[0098]
实施例
[0099]
1、植物材料:
[0100]
番茄材料为(solanum lycopersicum)常规品系ac(本实验室保存),用于基因克隆及遗传转化。ac春季盆栽,坐果成熟后收集成株的根、茎、叶、花及不同发育时期的果实样品用液氮速冻,保存在-70℃超低温冰箱,用于分析f-box的组织表达模式。
[0101]
2、番茄抗坏血酸含量测定分析:
[0102]
番茄中抗坏血酸含量的测定需要测定两种形态的抗坏血酸:总抗坏血酸含量和还原态抗坏血酸含量。
[0103]
2.1).取样时期保持一致,用液氮速冻保存样品,在液氮中研磨成粉状并称取后放入2ml的离心管中(一般新鲜叶片取0.1-0.2g,果实中由于水分含量较多取0.3-0.4g),加入1ml冰上预冷的6%的三氯乙酸(tca),震荡混匀。
[0104]
2.2).待测样品于冰上抽提15min,4℃,8500r/min,离心15min。
[0105]
在本发明实施例中,总抗坏血酸含量测定包括:
[0106]
2.3).取上清20μl于酶标板中,加入20μl,5mm的dtt(溶于0.4m,ph7.4的磷酸缓冲溶液),离心混匀后置于37℃反应20min。
[0107]
2.4).向反应溶液中加入10μl 0.5%的nem溶液,离心混合后室温下放置1min。
[0108]
2.5).加入80μl the color reagent,离心混匀后于37℃反应1h,在550nm波长下测定其吸光值。
[0109]
在本发明实施例中,还原态抗坏血酸含量测定包括:
[0110]
2.6).取上清20μl于酶标板中,加入30μl磷酸缓冲液(ph7.4,浓度0.4m)。
[0111]
2.7).加入80μl the color reagent,离心混匀后于37℃反应1h,在550nm波长下测定其吸光值。绘制标准曲线:用抗坏血酸标样配置成初始浓度为1mg/ml的标准溶液,用6%的三氯乙酸(tca)按浓度稀释成不同浓度的溶液,按照还原态抗坏血酸测定方法分别在550nm波长下测定其吸光值,绘制成标准曲线。
[0112]
在本发明实施例中,试剂配制包括:6%三氯乙酸(tca):称取30g三氯乙酸固体,溶于水中,定容至500ml;0.4m,ph7.4的磷酸缓冲液(pbs):称取38ml,0.4m的kh2po4溶液与162ml,0.4m的k2hpo4溶液混合即可;5mm的dtt:称取0.0077g的dtt溶于10ml,0.4m的pbs中;0.5%nem:称取0.25g的nem溶于50ml水中;the color reagent:取2.75倍体积的a溶液(31%h3po4,4.6%tca,0.6%fecl3)与1倍体积的b溶液(1g联吡啶溶于25ml 70%乙醇)混匀即可(现配现用)。
[0113]
3、幼苗期盐胁迫下的生长实验:
[0114]
从超量及干涉材料中,各选取2个种子饱满的t2代纯合转基因株系及对照a57番茄种子,经过消毒后,接种于1/2ms培养基上,待2-3d后选取发芽长势一致的种子,并且接种于含有0mm、100mm nacl的1/2ms培养基上,每处理三次重复,每个重复6株,置于25℃光照培养室培养,两周后进行表型观察,并测定主根长。
[0115]
4、转基因材料氧化处理
[0116]
抗坏血酸是高等植物体内最重要的抗氧化剂,所以研究上通常用植物的抗氧化能力反应体内抗坏血酸水平。甲基紫精(mv)又名百草枯,常常被用来模拟氧化逆境。将slf-box转基因超量干涉植株以及对照材料播种于绿化间,待植株生长一个月时间后取长势一致的各株系材料处理前浇足水分。配置浓度为75μm的mv溶液,喷施处理植株材料,每天喷施一次连续两天;另一组喷施相同体积的水为对照,每一组处理三株材料。喷施mv一周后观察
植株表型,拍照记录,并测定材料处理后叶绿素和丙二醛(mda)的含量,并取叶片做dab染色实验分析转基因材料活性氧水平。
[0117]
5、叶绿素含量测定包括:
[0118]
5.1)用液氮取样并将样品于液氮中研磨至粉状,称取粉状样品定量至0.2g于2ml离心管中。
[0119]
5.2)向离心管中加入1.5ml浓度为80%的丙酮溶液,并立即混匀并置于黑暗处使样品充分抽提1h。
[0120]
5.3)将试管置于离心机离心,12000r/min,10min。
[0121]
5.4)吸取200μl上清于酶标板中,用酶标仪在波长646nm和663nm下分别测定样品吸光值。
[0122]
5.5)使用叶绿素浓度计算公式计算叶绿素含量。
[0123]
叶绿素浓度(mg/ml)=17.32a
646
+7.18a
663
,a表示相关波长下的吸光值。
[0124]
6、丙二醛(mda)含量测定:
[0125]
6.1)用液氮取样并将样品于液氮中研磨至粉状,称取粉状样品定量0.2g于10ml离心管中。
[0126]
6.2)向试管中加入3ml浓度为5%的三氯乙酸(tca)溶液,立即混匀溶液并抽提30min。6.3)将样品置于离心机离心,3000r/min,10min。
[0127]
6.4)吸取2ml上清溶液转移至新的10ml离心管中,并向试管中加入2ml浓度为0.67%的tba溶液。
[0128]
6.5)将上述样品混匀置于沸水浴30min,待溶液冷却后离心。
[0129]
6.6)吸取200μl上清液体于酶标板中,用酶标仪在波长450nm,532nm和600nm处分别测定吸光值。
[0130]
6.7)使用丙二醛浓度计算公式计算含量。
[0131]
mda(μm/l)=6.45(a
532-a
600
)-0.56a
450
,a为吸光值。
[0132]
0.67%tba配置;称取0.67g硫代巴比妥酸,然后加水至100ml即可。
[0133]
7、dab染色
[0134]
1)取mv和水处理过的番茄离体叶片浸泡于浓度为1mg/ml的dab溶液(ph3.8),将材料置于常温黑暗环境24h处理。
[0135]
2)将叶片取出转移至含有96%的乙醇三角瓶中,并置于沸水浴10min,以便去除叶绿素。
[0136]
3)弃除乙醇溶液,向三角瓶中加入适量干净的96%的乙醇浸泡叶片,直到浮色脱去(可将脱色的叶片保存在96%的乙醇溶液中)。
[0137]
4)观察脱色后叶片上活性氧爆发。
[0138]
8、番茄叶片h2o2荧光染色鉴定:
[0139]
植物体内h2o2的生成可通过2’,7
’-
二氯二氢荧光素乙酰乙酸(h2dcfda)或3,3
’-
二氨基联苯胺(dab)染色进行鉴定。
[0140]
收集mv处理一周的番茄叶片,置于50ml离心管中并加入25μm h2dcfda浸泡,置于黑暗环境15min,然后用20mm,ph 6.0的磷酸钾缓冲液冲洗。将番茄不同株系叶片分别制作临时切片,使用蔡司可视化荧光信号apotome显微镜(激发,488nm;发射,525nm)。
[0141]
9、抗坏血酸合成途径底物饲喂处理番茄叶片:
[0142]
选取转基因株系及对照ac总共五个株系长势相同苗龄为六周的植株,每个株系选取5棵植株并用打孔器选取总共20个叶片。将打好的叶片放在浓度为5mm总量为20ml的底物溶液中,底物分别为葡萄糖、半乳糖醛酸、肌醇;以水为阴性对照,并将纯asa用水配成相同浓度作为阳性对照。将所有处理叶片置于实验室玻璃温室中培育24h,处理结束后,用ddh2o洗涤各组叶片三次,用滤纸轻轻干燥后置于2ml离心管然后保存于液氮中,留存用于测量处理后的抗坏血酸含量。
[0143]
10、抗坏血酸合成途径底物饲喂处理番茄果实:
[0144]
取相同大小的番茄绿熟、破色期果实,从植株茎中切下处理材料番茄果实,并将其浸在浓度为5mm总量为20ml的底物溶液中,底物分别为葡萄糖、半乳糖醛酸、肌醇;以水为阴性对照,并将纯asa用水配成相同浓度作为阳性对照。在实验室玻璃温室中培育24h。在培育结束后,将茎从果实上分离,并且用ddh2o洗涤果实三次,用滤纸轻轻干燥。从果实中取出样品进行各种分析。
[0145]
11、gmp酶活测量:
[0146]
1)酶液提取
[0147]
将样品置于液氮中研磨成粉状,定量抽取0.2g于10ml预冷离心管中;立即加入1.5ml 4℃预冷的提取液;将样品置于冰冻离心机离心,7500r/min,4℃,5min,上清为粗酶提取液。
[0148]
2)gmp酶活测定:
[0149]
gmp的酶活力采用外加无机焦磷酸酶的比色方法测定。将准备好的粗酶提取液稀释20倍;吸取10μl稀释后的提取液于酶标板中,向酶标板加入90μl反应液于30℃,反应30min;待反应完成后,向反应体系中加入100μl显示试剂;将酶标板放入酶标仪设置650nm波长下测量光的吸收值(gmp酶活可以通过无机磷酸盐浓度的增加表示,计算酶活时用30min反应时间内特定波长下光吸收值变化0.01表示为1个酶活力单位)。gmp酶活结果用u/30min/g fw表示。
[0150]
粗酶提取液组分:50mmol/l tris(ph 7.5);20%甘油;1mmol/ledta;5mmol/l dtt;1%pvp。反应液组分:50mmol/l tris(ph7.5);8mmol/l mgcl2;100μmol/l gtp;100μmol/l甘露糖-1-磷酸-na;1mmol/l dtt;0.1units ml-1
无机焦磷酸化酶。显色试剂组分:0.03%(w/v)绿孔雀石;0.2%(w/v)钼酸铵;0.05%triton-x-100。
[0151]
12、galur酶活测定:
[0152]
1)取植物组织样品于液氮中研磨成粉末,称取0.2g于提前预冷的2ml离心管中,向离心管中加入50mm磷酸缓冲液(ph 7.2,含2mm edta,2mm dtt,20%甘油和pvpp),于4℃,4000r/min离心30min,收集上清液即为酶提取液,低温保存备用。
[0153]
2)取10μl酶液与290μl反应液混合(含50mm磷酸缓冲液ph7.2,2mm edta,0.1mm nadph,30mm d-半乳糖醛酸和2mm dtt),加入酶标板中。
[0154]
记录340nm的吸光值变化。
[0155]
13、酵母双杂交筛选与番茄f-box互作蛋白
[0156]
1)pgbkt7钓饵载体的构建
[0157]
以番茄a57叶片cdna为模板进行pcr扩增,得到f-box基因全长orf,连接到中间载
体peasy-b上,通过热击转化入大肠杆菌,扩繁后菌液pcr检测并挑选条带大小正确的单克隆测序验证。测序正确的抽取其质粒,并用ecori和sali对pgbkt7空质粒和peasy-b重组载体质粒进行双酶切回收。将回收的基因片段通过t4 dna连接酶连接到线性pgbkt7载体上,构建pgbkt7-f-box重组质粒。将连接产物通过热激转入大肠杆菌,并用含50mg/l spec抗性的平板涂皿筛选单克隆,挑选单克隆在50mg/l spec液体lb中,37℃200r/min摇床上扩繁,菌液pcr检测后挑选正确抽提质粒,用于下一步酵母的转化。
[0158]
2)基因的生物信息学分析及筛选
[0159]
mating一周后筛选杂交菌斑,利用t7及3
′
ad通用引物进行菌落pcr检测后,随机选取条带大小不一具有特异性的片段进行测序。通过sgn数据库在线对pcr产物测序结果进行单基因和开放阅读框的查找,蛋白质的结构域和功能通过ncbi数据库预测;通过http://linux1.softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc在线针对比对所得的完整基因序列及有效片段的氨基酸序列进行亚细
[0160]
胞定位预测。
[0161]
14、f-box与筛选基因点对点验证
[0162]
1)pgadt7载体的构建
[0163]
本发明利用重组法构建pgadt7重组载体,基因扩增特异引物利用primer5设计,正反向引物序列5'端分别酶加切位点ndei、xhoi,以番茄a57幼嫩叶片cdna为模板,利用phanta高保真酶pcr扩增片段,得到筛选基因的全长orf,电泳凝胶检测条带大小正确后将pcr产物切胶回收,同时将pgadt7质粒用ndei、xhoi进行双酶切,之后用重组酶将基因回收片段与线性载体进行重组,构建重组载体。将重组产物热激转入大肠杆菌,用含50mg/l spec的抗性平板筛选单克隆,挑选单克隆在50mg/l spec液体lb中,37℃200r/min摇床上扩繁,菌液pcr检测后挑选正确抽提质粒,用于下一步酵母的共转。
[0164]
2)共转酵母
[0165]
用于点对点验证互作时酵母转化所用酵母感受态菌株为ah109,共转酵母只是所加质粒换为pgbkt7
-“
钓饵”和pgadt7-特异基因重组质粒各18μl,且要用sd/-leu/-trp酵母缺陷型培养基进行涂皿。
[0166]
表1.cdna插入序列预测
[0167][0168]
在本发明实施例中,图1是本发明实施例提供的不同植物f-box结构域蛋白序列的系统进化树图。
[0169]
图2是本发明实施例提供的番茄不同组织中slf-box的组织表达谱分析(a)及番茄不同组织中总抗坏血酸含量(b)。
[0170]
图3是本发明实施例提供的超量(a)及干涉(b)转基因株系中slf-box的表达分析图。
[0171]
图4是本发明实施例提供的slf-box超量及干涉转基因株系叶片(a)及果实(b)asa含量测定图。
[0172]
图5是本发明实施例提供的slf-box在转基因株系(oe、ri)和野生型(ac)果实不同时期的表达以及不同株系果实发育各个阶段的asa含量图。
[0173]
图6是本发明实施例提供的slf-box转基因株系叶片中asa合成相关基因的表达分析图。
[0174]
图7是本发明实施例提供的slf-box转基因株系叶片中asa代谢相关基因的表达分析图。
[0175]
图8是本发明实施例提供的slf-box转基因株系叶片中asa转运相关基因的表达分析图。
[0176]
图9是本发明实施例提供的slf-box转基因株系及野生型发芽种子在1/2ms培养基及含有100mm nacl的1/2ms培养基上生长两周后的表型(a)及相对主根长差异(b)图。
[0177]
图10是本发明实施例提供的slf-box在昼夜节律中的作用图。
[0178]
图11是本发明实施例提供的slf-box在植物氧化胁迫中的作用图。
[0179]
图12是本发明实施例提供的dab染色检测h2o2的积累图。
[0180]
图13是本发明实施例提供的番茄叶片h2dcfda染色鉴定h2o2图。
[0181]
图14是本发明实施例提供的转基因番茄株系叶片中gmp酶活力的分析图。
[0182]
图15是本发明实施例提供的转基因番茄株系叶片中galur酶活力的分析图。
[0183]
图16是本发明实施例提供的转基因植株泛素表达水平检测图。
[0184]
图17是本发明实施例提供的pgbkt7-f-box重组载体的自激活检测图。
[0185]
图18是本发明实施例提供的点对点互作验证图。
[0186]
图中:a:skp1+slf-box;
[0187]
b:solyc06g065840+slf-box;
[0188]
c:solyc01g087240+slf-box;
[0189]
d:bat3+slf-box;
[0190]
阳性对照:pgbkt7-53+pgbkt7-t;阴性对照:pgbkt7-lam。
[0191]
图19是本发明实施例提供的slf-box互作基因表达量测定图。
[0192]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1