含新型沙克乳酸杆菌CVL-001菌株或其培养液的用于改善、预防或治疗骨病或代谢性疾病的组合物
在科学技术信息通信部的支持下,本发明通过项目2018R1A2B3004143完成,上述项目的研究管理专业机构为韩国研究财团,研究项目名称为“中级研究员支持项目”,研究技术名称为“对于病原体感染的Nod2介导细胞/组织特异性防御系统相关研究”,主管机构为韩国全南大学产学协力团,研究期间为2018年3月1日~2022年2月28日。本申请要求2019年2月26日向韩国专利局提交的韩国专利申请第10-2019-0022670号、第10-2019-0022671号及在2020年2月3日向韩国专利局提交的韩国专利申请第10-2020-0012763号的优先权,通过引用将上述专利申请的全部公开内容并入本说明书。本发明涉及新型沙克乳酸杆菌(Lactobacillussakei)CVL-001菌株及其分离方法,更详细地涉及从泡菜分离并鉴定的新型沙克乳酸杆菌CVL-001菌株。并且,本发明涉及包含沙克乳酸杆菌CVL-001菌株或其培养液的用于改善、预防或治疗骨病或代谢性疾病的组合物,更详细地涉及包含保藏号为KCTC13816BP的新型沙克乳酸杆菌CVL-001菌株或其培养液的组合物针对骨病或代谢性疾病的改善效果、预防效果或治疗效果。
背景技术:
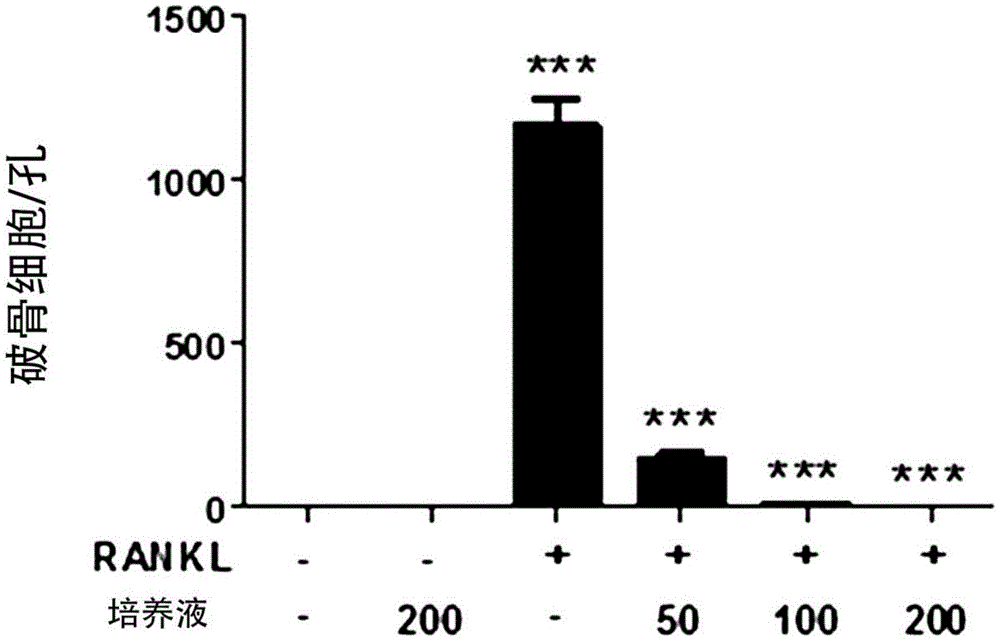
在如泡菜等传统发酵食品中大量存在的乳酸菌在人体的消化系统中共生的同时起到将纤维质及复合蛋白质分解为重要的营养成分的作用,使得肠道pH值维持在酸性来抑制大肠杆菌或梭状芽孢杆菌(Chlostridiumsp.)等有害菌的繁殖,因此,不仅具有改善腹泻、便秘的作用,而且,具有合成维生素并降低血胆固醇等作用。尤其,乳酸菌具有与肠黏膜和上皮细胞强力结合的特性,因此,对调节肠道功能有着莫大的帮助。并且,乳酸菌可通过促进巨噬细胞(macrophage)的增殖来提高巨噬细胞对肠道有害细菌的识别能力、杀菌能力,并且,可通过促进免疫相关物质的分泌来增强免疫效果。(Gabrielaperidgonetal.JoffoodProtection53:404-411,1990:Katsumasasatoetal.,MicrobiolImmunol.,32(7):689-698,1998)乳酸杆菌属微生物为进行纯种发酵或混合发酵的乳酸杆菌,属于在乳制品或蔬菜的发酵过程中常见的菌。最近,正在积极研究将乳酸杆菌属微生物开发为益生菌、食品添加剂等。最近,正在集中研究肠道微生物(GM,gutmicrobiota)对于健康及疾病的重要性。肠道微生物由包含基因总数为人类基因组的150倍的大量细菌组成。肠道微生物在出生时即可获得,虽然属于被区分的一个独立实体(distinctentity),但可被视为一种多细胞生物,与人类基因组共同进化且以多种方式与其宿主进行交流并产生影响。肠道微生物的组成可通过多个环境因素调节,例如,饮食治疗及抗生素治疗。通过肠道微生物生成的分子可能有益,也可能有害,对肠道中的内分泌细胞、肠神经系统、肠道通透性及免疫系统产生影响。被扰乱的微生物组成与肠道内外的各种炎症条件有关,例如,克罗恩病、溃疡性大肠炎、风湿性关节炎、多发性硬化症、糖尿病、食物过敏、湿疹及哮喘、肥胖症及代谢综合症等。更年期的女性会出现多种闭经症状,具体地,随着雌激素的减少,因钙从骨骼中流失而导致骨骼的质量下降且骨骼上的孔洞增多,从而因骨质流失等而导致骨质疏松症等的发病率增加,由于闭经期过后的后期变化需经过一段时间才会出现症状,因此,常发生无法轻易自觉的情况。根据韩国保健福祉部国民健康统计数据显示,在30岁以上的骨质疏松症患病率中,男性为1%,而女性为9%,女性的患病率高达男性的9倍。骨质疏松症引起的骨折属于主要健康问题,在健康管理系统上将产生巨大的经济负担。在西方国家中,骨质疏松症引起骨折的风险较高(女性约为50%,男性约为20%),并且,骨折明显与致死率及发病率有关。皮质骨(corticalbone)约占人体骨骼的80%,多项研究表明,皮质骨为骨强度的主要决定因素,因此,也是易感性骨折的主要决定因素。65岁以后的骨质流失主要是以皮质骨的损失所引起的,而并非松质骨的损失引起(Lancet,2010,5月15日;375(9727):1729-36)。骨骼由形成骨的成骨细胞(OBs)及吸收骨的破骨细胞(OCLs)重塑而成。巨噬细胞集落刺激因子(MCSF)不仅可提高破骨细胞的前体细胞增殖率和存活率,而且,可上调破骨细胞中的核因子-κB(RANK)的受体激活剂的表达。其致使核因子KB受体活化因子配体(RANKL)结合并引发诱导破骨细胞形成的信号级联反应。RANKL的影响可被骨保护素(OPG)抑制,OPG是对RANKL的引导受体。并且,随着最近经济的快速发展和饮食生活的西方化,因遗传、环境因素等引起的肥胖症及糖尿病等代谢性疾病呈增加的趋势。因此,最近对可预防及治疗其物质进行研究的同时需要开发多种功能食品。肥胖症在全世界范围内的患病率正在逐渐增加,并且,由于肥胖症引起的代谢相关并发症,针对肥胖症的治疗也备受瞩目。当前使用的肥胖症治疗剂通过诱导饱腹感来抑制食欲或减少脂肪的吸收,从而致使体重减少。饱腹感可通过在去甲肾上腺素或血清素的神经接合点增加这种神经递质的浓度来诱导,或者,也可通过刺激血清素受体或肾上腺素能受体来诱导。但是,用于治疗肥胖症的药物与其效果相比具有严重的副作用,因此,当前急需开发具有优秀的抗肥胖作用且低副作用的新作用机制的物质。技术实现要素:技术问题为此,本发明人从全国各地收集的泡菜试样中通过分离及鉴定,分离出了新型沙克乳酸杆菌(Lactobacillussakei)菌株,经确认,从泡菜分离的沙克乳酸杆菌菌株和其培养液具有抑制破骨细胞分化、改善骨质疏松症、抑制脂肪细胞分化及抑制体重增加的效果。因此,本发明的目的在于,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株。本发明的再一目的在于,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的培养液。本发明的另一目的在于,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的分离方法,包括培养泡菜提取物的培养步骤。本发明的还有一目的在于,提供具有改善、预防或治疗骨病或代谢性疾病的活性的保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株。本发明的又一目的在于,提供具有改善、预防或治疗骨病或代谢性疾病的活性的保藏号为KCTC13816BP,具有改善、预防或治疗骨病或代谢性疾病的活性的沙克乳酸杆菌CVL-001菌株的培养液。本发明的又一目的在于,提供用于预防或治疗骨病或代谢性疾病的药学组合物,包含保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的培养液。本发明的又一目的在于,提供用于改善骨病或代谢性疾病的食品组合物,包含保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的培养液。本发明的又一目的在于,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株在改善、预防及治疗骨病或代谢性疾病中的用途。解决问题的方案本发明涉及包含新型沙克乳酸杆菌(Lactobacillussakei)CVL-001菌株、其分离方法、沙克乳酸杆菌CVL-001菌株或其培养液的用于改善、预防或治疗骨病或代谢性疾病的组合物。本发明人通过培养泡菜提取物来分离菌株,从中筛选革兰氏阳性且过氧化氢酶阴性的菌株来分离沙克乳酸杆菌CVL-001菌株,经确认,上述菌株或其培养液具有抑制破骨细胞的分化并治疗骨病的效果,而且,将其向因高脂肪饮食肥胖症诱导小鼠口服给药的结果,观察到体重增加受到抑制且血糖水平下降。以下,进一步详细说明本发明。根据本发明的一实施方式,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株。上述菌株可具有SEQIDNO:1所示的16S核糖体RNA序列。根据本发明的再一实施方式,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的培养液。上述菌株可具有SEQIDNO:1所示的16S核糖体RNA序列。根据本发明的另一实施方式,提供保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的分离方法,包括培养泡菜提取物的培养步骤。上述泡菜提取物可以是通过磨碎泡菜并过滤而成的泡菜磨碎液,例如,可以是通过向上述泡菜磨碎液添加水并稀释的泡菜液,但并不限定于此。上述培养步骤可包括:第一培养步骤,培养泡菜提取物;以及第二培养步骤,培养从上述第一培养步骤中分离的菌株。为了鉴定乳酸菌,而可以在添加0.5%至2%的碳酸钙或0.004%至0.006%的溴甲酚紫(bromocresolpurple)的培养基中执行上述第一培养步骤,例如,可在添加有碳酸钙的培养基中执行,但并不限定于此。上述第一培养步骤可在20℃至32℃的温度条件下执行36小时至60小时,例如,可在30℃的温度条件下执行48小时,但并不限定于此。此后,可分离形成透明环的菌株并将其应用于第二培养步骤。上述第二培养步骤中可以通过在分离的菌株中筛选革兰氏阳性菌株并培养。具体地,可以从上述分离的菌株中筛选革兰氏阳性且过氧化氢酶阴性菌株作为乳酸菌并培养。上述第二培养步骤可在20℃至32℃的温度条件下执行12小时至36小时,例如,可在30℃的温度条件下执行24小时,但并不限定于此。根据本发明的还有一实施方式,提供具有改善、预防或治疗骨病的活性的保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株。上述菌株可以是从泡菜中分离的,但并不限定于此。根据本发明的又一实施方式,提供具有改善、预防或治疗骨病的活性的保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株的培养液。根据本发明的又一实施方式,提供用于预防或治疗骨病的药学组合物,包含保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株或其培养液。上述骨病可选自由骨质疏松症(osteoporosis)、骨转移癌(bonemetastaticcancer)、骨软化症(osteomalacia)、佝偻病、纤维性骨炎、无动力性骨病、代谢性骨病及牙周病组成的组,例如,上述骨病可以为骨质疏松症,但并不限定于此。上述培养液可以是通过培养沙克乳酸杆菌CVL-001菌株并去除菌株后获得的培养上清液、其浓缩物、其分馏物或其冷冻干燥物。上述培养液可通过培养沙克乳酸杆菌CVL-001菌株12小时至30小时、12小时至24小时、18小时至30小时或18小时至24小时获得,例如,可通过培养22小时至26小时获得,但并不限定于此。至于培养时间,以24小时为起点,当培养时间为24小时以上时,培养时间并不会对破骨细胞分化抑制活性表现出显著的依赖性提升效果。可利用Alpha-MEM培养基培养上述沙克乳酸杆菌CVL-001菌株。具体地,基础(BME,BasalMediaEagle)培养基是通过对细胞生长所需的必要营养素及无机盐类和维生素类的研究结果获得的培养基,以当前广泛使用的MEM和DMEM作为基本组成成分的培养基,最小必需培养基(MEM,MinimumEssentialMediaEagle)培养基相比于BME具有更高的氨基酸浓度且为了CO2/NaHCO3的缓冲作用而包含厄尔盐(Earle'ssalts)。根据细胞种类也可使用还添加有非必需氨基酸的培养基和包含汉克盐(Hank’ssalts)来代替厄尔盐的培养基。由于AlphaMEM(MEM,Alphamodification)额外添加有氨基酸和维生素等,因此,可用于动物细胞的DNA转化。上述组合物中包含的培养液的浓度为50μl/ml至400μl/ml、50μl/ml至350μl/ml、50μl/ml至300μl/ml、50μl/ml至250μl/ml、100μl/ml至400μl/ml、100μl/ml至350μl/ml、100μl/ml至250μl/ml、150μl/ml至400μl/ml、150μl/ml至350μl/ml、150μl/ml至300μl/ml、150μl/ml至250μl/ml、180μl/ml至400μl/ml、180μl/ml至350μl/ml或180μl/ml至300μl/ml,例如,上述组合物中包含的培养液的浓度可以为180μl/ml至250μl/ml,但并不限定于此。上述培养液的pH值为6.5至8.5、6.5至8.0、6.5至7.5、7.0至8.5或7.0至8.0,例如,pH值可以为7.0至7.5,但并不限定于此。在培养液中,乳酸菌随着生长产生乳酸等代谢物而可能被酸化,这相当于不适合细胞培养的pH值范围。基于这一点,最适合细胞培养的pH值为7.4。上述骨病的预防及治疗可通过抑制破骨细胞分化来实现,但并不限定于此。根据本发明的又一实施方式,提供用于预防或治疗代谢性疾病的药学组合物,包含保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株或其培养液。上述代谢性疾病可以为选自由肥胖症、糖尿病、高血压、高脂血症、心血管疾病及高胰岛素血症组成的组中的一种以上。上述食品组合物中包含的沙克乳酸杆菌CVL-001菌株的浓度为5×105CFU/ml至5×1012CFU/ml、5×106CFU/ml至5×1011CFU/ml、5×107CFU/ml至5×1010CFU/ml,例如,上述食品组合物中包含的沙克乳酸杆菌CVL-001菌株的浓度可以为5×108CFU/ml至5×109CFU/ml,但并不限定于此。上述培养液可通过培养沙克乳酸杆菌CVL-001菌株12小时至30小时、12小时至24小时、18小时至30小时或18小时至24小时获得,例如,上述培养液可通过培养沙克乳酸杆菌CVL-001菌株22小时至26小时获得,但并不限定于此。至于培养时间,以24小时为起点,当培养时间为24小时以上时,培养时间并不会对抑制体重增加或减少血糖树脂表现出显著的依赖性提升效果。上述培养液可以是通过培养沙克乳酸杆菌CVL-001菌株并去除菌株后获得的培养上清液、其浓缩物、其分馏物或其冷冻干燥物。上述培养液的pH值为6.5至8.5、6.5至8.0、6.5至7.5、7.0至8.5或7.0至8.0,例如,上述培养液的pH值可以为7.0至7.5,但并不限定于此。在培养液中,乳酸菌随着生长产生乳酸等代谢物而可能被酸化,这相当于不适合细胞培养的pH值范围。基于这一点,最适合细胞培养的pH值为7.4。本发明的药学组合物可用作包含药学有效量的沙克乳酸杆菌CVL-001菌株培养液和/或药学上可接受的载体的药学组合物。在本说明书中,术语“药学有效量”是指足以实现上述沙克乳酸杆菌CVL-001菌株培养液的功效或活性的量。本发明的药学组合物中所包含的药学上可接受的载体为配制时通常使用的,包括乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油等,但并不限定于此。除上述成分之外,本发明的药学组合物还可包括润滑剂、润湿剂、甜味剂、调味剂、乳化剂、悬浮剂、防腐剂等。本发明的药学组合物可通过多种途径施用于包括人在内的哺乳动物。给药方式可以为通常使用的所有方式,例如,可通过口服、皮肤、静脉、肌肉、皮下等途径进行给药,优选地,可以使用口服给药。本发明的药学组合物的合适剂量根据配制方法、给药方式、患者的年龄、体重、性别、病态、饮食、给药时间、给药途径、排泄速度及反应敏感性等因素产生变化,通常,熟练的医生可容易确定并开出具有所期望的治疗效果或预防效果的剂量。本发明的药学组合物通过本发明所属
技术领域:
的普通技术人员容易实施的方法并利用药学上可接受的载体和/或赋形剂进行配制,由此,可被配制成单位剂量形态或放入多剂量容器来制备。在此情况下,制剂可以为油性介质或水性介质中的溶液、悬浮液或乳化液的形态,或者,可以为浸膏剂、粉末、颗粒、片剂、胶囊或凝胶(例如,水凝胶)的形态,并且,还可包括分散剂或稳定剂。根据本发明的又一实施方式,提供用于改善骨病的食品组合物包含保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株或其培养液。上述骨病可以为选自由选自由骨质疏松症、骨转移癌、骨软化症、佝偻病、纤维性骨炎、无动力性骨病、代谢性骨病及牙周病组成的组,例如,上述骨病可以为骨质疏松症,但并不限定于此。上述培养液可以是通过培养沙克乳酸杆菌CVL-001菌株并去除菌株后获得的培养上清液、其浓缩物、其分馏物或其冷冻干燥物。上述培养液可通过培养沙克乳酸杆菌CVL-001菌株12小时至36小时、12小时至30小时、12小时至24小时、18小时至36小时、18小时至30小时或18小时至24小时获得,例如,上述培养液可通过培养培养沙克乳酸杆菌CVL-001菌株22小时至26小时获得,但并不限定于此。上述组合物中包含的培养液的浓度为20μl/ml至400μl/ml、20μl/ml至350μl/ml、20μl/ml至300μl/ml、20μl/ml至250μl/ml、50μl/ml至400μl/ml、50μl/ml至350μl/ml、50μl/ml至300μl/ml、50μl/ml至250μl/ml、100μl/ml至400μl/ml、100μl/ml至350μl/ml、100μl/ml至300μl/ml、100μl/ml至250μl/ml、150μl/ml至400μl/ml、150μl/ml至350μl/ml、150μl/ml至300μl/ml、150μl/ml至250μl/ml、180μl/ml至400μl/ml、180μl/ml至350μl/ml或180μl/ml至300μl/ml,例如,上述组合物中包含的培养液的浓度可以为250μl/ml,但并不限定于此。上述培养液的pH值为6.5至8.5、6.5至8.0、6.5至7.5、7.0至8.5或7.0至8.0,例如,上述培养液的pH值可以为7.0至7.5,但并不限定于此。上述骨病改善可通过抑制破骨细胞分化来实现,但并不限定处此。根据本发明的又一实施方式,提供用于改善代谢性疾病的保健功能食品组合物,包含保藏号为KCTC13816BP的沙克乳酸杆菌CVL-001菌株或其培养液。上述代谢性疾病可以为选自由肥胖症、糖尿病、高血压、高脂血症、心血管疾病及高胰岛素血症组成的组中的一种以上。上述保健功能食品组合物中包含的沙克乳酸杆菌CVL-001菌株的浓度为5×105CFU/ml至5×1012CFU/ml、5×106CFU/ml至5×1011CFU/ml或5×107CFU/ml至5×1010CFU/ml,例如,上述保健功能食品组合物中包含的沙克乳酸杆菌CVL-001菌株的浓度可以为5×108CFU/ml至5×109CFU/ml,但并不限定于此。上述培养液可通过培养沙克乳酸杆菌CVL-001菌株12小时至36小时、12小时至30小时、12小时至24小时、18小时至36小时、18小时至30小时或18小时至24小时获得,例如,上述培养液可通过培养沙克乳酸杆菌CVL-001菌株22小时至26小时获得,但并不限定于此。上述培养液可以是通过培养沙克乳酸杆菌CVL-001菌株并去除菌株后获得的培养上清液、其浓缩物、其分馏物或其冷冻干燥物。上述培养液的pH值为6.5至8.5、6.5至8.0、6.5至7.5、7.0至8.5或7.0至8.0,例如,上述培养液的pH值可以为7.0至7.5,但并不限定于此。当将本发明的食品组合物用作食品添加物时,可直接添加上述食品组合物或与其他食品及食品成分一同使用,可根据通常使用的方法适当使用。通常,当制造食品或饮料时,相对于原料,本发明的食品组合物的添加量可以为15重量百分比以下,优选地,10重量百分比以下。对于上述食品的种类并不特别限制。作为一例,可添加上述物质的食品有肉类、香肠、面包、巧克力、糖果类、点心类、饼干类、披萨、拉面、其他面类、口香糖类、冰淇淋等乳制品、各种汤品、饮料、茶、液剂、酒精饮料、维生素复合剂等,包括所有通常意义上的食品。上述饮料可包含各种调味剂或天然碳水化合物等作为额外成分。上述天然碳水化合物可使用如葡萄糖或果糖的单糖类、如麦芽糖或蔗糖的二糖类、如糊精或环糊精的天然甜味剂及如糖精或阿斯巴甜的合成甜味剂。上述天然碳水化合物的比例可通过所属
技术领域:
的普通技术人员的选择适当确定。除此之外,本发明的食品组合物可包含各种营养剂、维生素、电解质、调味剂、着色剂、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体增稠剂、pH调节剂、稳定剂、防腐剂、甘油、酒精、碳酸饮料中使用的碳酸化剂等。除此之外,本发明的食品组合物可包含用于制造天然果汁、果汁饮料及蔬菜饮料的果肉。这种成分可单独使用或组合使用。这种添加剂的比例也可通过所属
技术领域:
的普通技术人员适当选择。发明的效果本发明涉及新型沙克乳酸杆菌CVL-001菌株及其分离方法,由于上述菌株为可从泡菜分离出的乳酸菌,因此,可将其有效用作益生菌或食品添加剂。并且,本发明涉及包含沙克乳酸杆菌(Lactobacillussakei)CVL-001菌株或其培养液的用于改善、预防或治疗骨病或代谢性疾病的组合物,从泡菜分离的沙克乳酸杆菌菌株和其培养液具有抑制破骨细胞分化、改善骨质疏松症、抑制脂肪细胞分化及抑制体重增加等效果,因此,可有效改善、预防或治疗骨质疏松症或肥胖症等疾病。附图说明图1a为示出沙克乳酸杆菌(Lactobacillussakei)CVL-001菌株培养液抑制破骨细胞分化效果的图片。图1b为示出沙克乳酸杆菌CVL-001菌株培养液抑制破骨细胞分化效果的图表。图2为示出沙克乳酸杆菌CVL-001菌株培养液的破骨细胞分化诱导蛋白质的磷酸化抑制效果的蛋白质印迹结果的图片。图3为示出沙克乳酸杆菌CVL-001菌株培养液的破骨细胞分化诱导基因的表达抑制效果的图表。图4为示出在诱导骨质疏松症的小鼠模型中因沙克乳酸杆菌CVL-001菌株及其培养液引起的骨密度增加效果的图表。图5为示出对于沙克乳酸杆菌CVL-001培养液的脂肪细胞分化的抑制效果的图表。图6为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株引起的体重抑制效果随时间变化的图表。图7为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株引起的各实验组的副睾丸脂肪重量减少效果的图表。图8为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株培养液引起的体重抑制效果随时间变化的图表。图9为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株培养液引起的各实验组的副睾丸脂肪重量减少效果的图表。图10为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株培养液引起的各实验组的糖耐量实验的血糖下降效果的图表。图11为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株引起的各实验组的糖耐量实验的血糖下降效果的图表。图12为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株培养液引起的各实验组的胰岛素耐量试验的血糖下降效果的图表。图13为示出在高脂肪饮食实验组中因沙克乳酸杆菌CVL-001菌株引起的各实验组的胰岛素耐量试验的血糖下降效果的图表。具体实施方式本发明涉及具有改善、预防或治疗骨病或代谢性疾病的活的保藏号为KCTC13816BP的沙克乳酸杆菌(Lactobacillussakei)CVL-001菌株。最佳实施方式以下,通过实施例进一步详细说明本发明。但是,以下实施例仅用于例示本发明,本发明的范畴并不限定于以下实施例。在本说明书全文内容中,除非另有说明,否则为了表示特定物质的浓度使用的“%”具有如下含义,即,固体/固体为(重量/重量)%、固体/液体为(重量/体积)%、液体/液体为(体积/体积)%。实施例1.分离菌株从全国各地收集刚腌制的泡菜,将收集到的泡菜在6±0.5℃的温度条件下保存0周~5周并将其用作分离乳酸菌的泡菜试样。将500g的上述泡菜通过手动搅拌器(handblender,HanilCo,Korea)进行磨碎,并通过向用无菌纱布过滤的泡菜液添加无菌水来以101至107倍依次进行稀释。由此,最终分离出稀释107倍的泡菜涂抹培养基。将稀释的泡菜液涂在添加2%的碳酸钙(CaCO3)的MRS培养基(DifcoCo.,France),在30℃的温度条件下培养48小时后分离出形成透明环的菌株。针对分离出的上述菌株执行革兰氏染色(Gramstrainkit,BDCo.,USA)和过氧化氢酶试验(BiomerieuxCo.,France)来将革兰氏阳性且过氧化氢酶阴性的菌落临时确认为乳酸菌。将分离出的上述乳酸菌株接种到MRS液体培养基后,在30℃的温度条件下培养24小时并添加甘油(glycerol),使浓度为25%(v/v),来制备甘油原液(stock),并在-70℃的温度条件下保存备用。实施例2.鉴定乳酸菌株通过16S核糖体RNA碱基序列分析对最终筛选出的沙克乳酸杆菌(Lactobacillussakei)CVL-001进行鉴定。将分离出的菌株进行纯水分离后,以MRS板(plate)状态用冷藏快递送到Solgent公司(韩国大田)进行委托,使用27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)的通用引物集(universalprimerset)执行16S核糖体RNA碱基序列分析。通过上述沙克乳酸杆菌CVL-001菌株的16S核糖体RNA编码碱基序列确定共1439bp的碱基序列,结果如表1所示。表1基于执行的上述碱基序列,通过Blast程序(Blastprogram,http://www.ncbi.nlm.nhi.gov)以注册信息(GeneBank数据库)为对象执行碱基序列的同源性检测。结果,与沙克乳酸杆菌LZ217(LactobacillussakeiLZ217)具有99%的同源性,由此,最终鉴定为沙克乳酸杆菌LZ217。综合以上结果,即,分析形态学特征、糖代谢能力及16S核糖体RNA碱基序列的结果,将甘露醇(mannitol)生成能力及在泡菜液内的存活率(主导率)优异的沙克乳酸杆菌CVL-001菌株鉴定为沙克乳酸杆菌LZ217。结果,将分离出的菌株命名为沙克乳酸杆菌(Lactobacillussakei)CVL-001,并于2019年2月19日,以保藏号KCTC13816BP保藏在韩国典型培养物保藏中心,地址是:韩国,全罗北道,井邑市,立新街181号,韩国生命工学研究院(KRIBB)(56212)。实施例3.制备沙克乳酸杆菌CVL-001菌株培养液为了制备用于细胞处理的培养液,在alpha-MEM培养基中培养沙克乳酸杆菌CVL-00124小时,随后,通过离心分离分离出上清液并将pH至调节至7.4。实施例4.评估沙克乳酸杆菌CVL-001菌株培养液对于破骨细胞分化的抑制效果在12孔板(wellplate)中以2×105/孔的密度培养小鼠巨噬细胞24小时,更换成添加有胎牛血清(FBS,fetalbovineserum)、1%的青霉素-链霉素(PS,Penicillin-Streptomycin)、巨噬细胞集落刺激因子(M-CSF,macrophagecolonystimulatingfactor)的培养基后,处理培养液(50μl/ml、100μl/ml、200μl/ml)2小时。随后,用100ng/ml的核因子KB受体活化因子配体(RANKL,Receptoractivatorofnuclearfactorkappa-Βligand)处理并反应24小时,并以与上述相同方法进行6天的分化。接着,向作为破骨细胞的细胞化学标志酶的抗酒石酸酸性磷酸酶(TRAP,Tartrateresistanceacidphosphatase)添加显色底物来对核进行染色,并观察具有三个以上核的多核细胞并进行图像化。用RANKL处理巨噬细胞时,巨噬细胞与RANK相结合而分化成TRAP阳性细胞。若通过如RANKL、TNF-α的炎症因子刺激TRAP阳性细胞,则细胞融合而分化成多核TRAP阳性细胞。参照图1a、1b及表2可以确认,当用RANKL处理巨噬细胞时,破骨细胞的分化有所增加,通过培养液处理导致破骨细胞的数量浓度依赖性地显著减少。由此,可确认到沙克乳酸杆菌CVL-001培养液具有抑制破骨细胞的分化的效果。表2RANKL--++++培养液-200-50100200破骨细胞的数量(平均)001165151100实施例5.评估沙克乳酸杆菌CVL-001菌株培养液对破骨细胞分化诱导蛋白质表达的抑制效果本实施例的目的在于,确认在用RANKL及培养液处理小鼠巨噬细胞的情况下促分裂原活化蛋白激酶(MAPK,mitogen-activatedproteinkinase)及NF-kB信号传导机制。在12孔板(wellplate)中以4×105/孔的密度培养小鼠巨噬细胞24小时。更换成添加有胎牛血清、1%的青霉素-链霉素、巨噬细胞集落刺激因子的培养基后,用沙克乳酸杆菌CVL-001菌株培养液(100μl/ml)处理2小时。随后,用100ng/ml的RANKL处理并反应0分钟、5分钟、15分钟及30分钟。去除培养基并利用蛋白质裂解缓冲液(Proteinlysisbuffer)提取蛋白质后,通过定量从SDS聚丙烯酰胺凝胶中分离30ug的蛋白质。将蛋白质转移到膜后,使用第一抗体、第二抗体(p-jnk(CellSignalingTechnology,#9251S))、p-p38(CellSignalingTechnology,9211S)、p-ERK(santacruz,sc-7383)、Ikbalpha(CellSignalingTechnology,9242S)、p-p65(CellSignalingTechnology,3031S)依次处理,使用底物试剂盒(BIO-RAD,ECLsolutiondetectionkit)表达,并使用机械(化学发光成像仪(Chemidoc))进行测定。RANKL与RANK相结合并通过TRAF6增加MAPK及NF-KB蛋白质表达,诱导多种转录因子的增加来促进破骨细胞的分化。因此,针对这种机制,通过蛋白质印迹(westernblotting)确认作为MAPK蛋白质的ERK、JNK、p38的磷酸化(phosphorylation),从而确认沙克乳酸杆菌培养液是否能够抑制破骨细胞的分化。结果,确认到用RANKL处理后第5分钟及第15分钟MAPK蛋白质的磷酸化有所增加,且用培养液处理后JNK、P38及ERK的磷酸化有所减少。并且,IkBα(alpha)的分解受到抑制,p65的磷酸化受到抑制。在图2中可确认到,沙克乳酸杆菌培养液通过抑制JNK、P38及ERK的磷酸化来抑制破骨细胞的分化。实施例6.评估沙克乳酸杆菌培养液对破骨细胞分化诱导基因表达的抑制效果通过用沙克乳酸杆菌培养液处理小鼠巨噬细胞,利用实时(Real-time)PCR仪确认与破骨细胞分化机制有关的基因TRAP、DC-STAMP、CathepsinK、NFATc的基因表达(geneexpression)。在12孔板中以1×105/孔的密度培养骨髓来源的巨噬细胞(BMDMs,bonemarrow-derivedmacrophages)24小时。用未添加有胎牛血清且仅添加有1%的青霉素-链霉素的培养基处理1小时后,用100μl/ml的沙克乳酸杆菌培养液处理2小时。随后,用RANKL处理并反应24小时。通过与上述相同方法进行3天的分化后,利用TRIzol溶液分离细胞内的RNA,并基于RNA定量值利用RT混合液(premix)合成互补脱氧核糖核酸(cDNA)。通过引物并利用实时PCR扩增合成的互补脱氧核糖核酸。所使用的引物为MouseTRAP、DC-STAMP、CathepsinK、NFATc1,与作为对照组(Control)基因的GAPDH比较相对量。用RANKL处理巨噬细胞时,巨噬细胞与RANK相结合而分化成TRAP阳性的多核破骨细胞。并且,使得在分化成破骨细胞的过程中尤为重要的转录因子NFATc1活化,使得参与破骨细胞分化机制(osteoclastogenesis)的TRAP、CathepsineK、DC-STAMP的表达增加。参照图3及表3,可确认到通过RANKL处理增加的TRAP、DC-STAMP、CathepsinK、NFATc1的表达因沙克乳酸杆菌培养液的处理而减少。由此可见,可通过减少转录因子NFATc1的活性,进而减少与破骨细胞分化机制有关的基因TRAP、DC-STAMP、CathepsinK的表达来抑制破骨细胞的分化。表3实施例7.通过小鼠卵巢切除手术来诱导骨质疏松症的动物模型在22±2℃的温度、50±10%的相对湿度及以12小时明暗周期的条件下,在塑料笼中饲养小鼠C57BL/6雌性(7周龄)。在切除卵巢之前,使得小鼠在相同环境中生存约1周程度,以适应饲养条件。通过肌内注射舒泰(zoletil)和隆朋(rumpun)进行麻醉后,对卵巢手术部位进行剃毛并消毒。在切开约1cm的皮肤后,沿着子宫确认卵巢并使用缝合线结扎卵巢后切除双侧卵巢,注意不要损伤其他器官。切除卵巢后,将各个器官重新定位到腹腔内并用缝合线进行缝合。从第10日起,持续8周施用治疗物质。乳酸菌给药组的制备:预培养及主培养沙克乳酸杆菌后,以1×107个细胞/ml、1×108个细胞/ml及1×109个细胞/ml计算来口服给药。培养液给药组的制备:预培养和主培养沙克乳酸杆菌后,以1×107个细胞/ml、1×108个细胞/ml及1×109个细胞/ml计算。而且,将其在MRS培养基中稀释10倍并在30℃的温度条件下培养24小时。随后,使用离心分离器使菌沉淀后,收集作为培养液的上清液来将pH至调节至7.4,并口服给药200μl。以如下方式设置实验组。C57BL/6小鼠:80只①G1:未切除卵巢对照组(sham)、10只、给药MRS培养基(对照组)②G2:未切除卵巢对照组、10只、给药培养液③G3:未切除卵巢对照组、10只、给药乳酸菌(Lactobacillussakei)1×109个细胞/ml④G4:切除卵巢实验组(OVX)、10只、给药MRS培养基⑤G5:切除卵巢实验组、10只、给药培养液(1/4稀释)⑥G6:切除卵巢实验组、10只、给药培养液(1/2稀释)⑦G7:切除卵巢实验组、10只、给药培养液(原液)⑧G8:切除卵巢实验组、10只、给药乳酸菌1×107cell/ml⑨G9:切除卵巢实验组、10只、给药乳酸菌1×108cell/ml⑩G10:切除卵巢实验组、10只、给药乳酸菌1×109cell/ml实施例8.评估给药沙克乳酸杆菌乳酸菌及其培养液对骨质疏松症诱导小鼠的骨密度的影响利用微计算机断层扫描技术(micro-CT,micromicrocomputedtomography)测定骨密度,因此,相比于之前的纯放射线拍摄光片或计算机断层扫描,可提供高分辨率的影像资料。实验结束后,用福尔马林固定小鼠腿后,委托韩国大邱庆北先进医疗产业振兴财团实验动物中心进行骨密度分析。众所周知,切除卵巢的小鼠因缺乏雌激素而导致骨密度减少。因此,切除卵巢的小鼠动物模型广泛用于骨质疏松症的研究。参照图4及表4可确认到,切除卵巢的小鼠组G4的骨密度相比于对照组(Sham)显著减少。另一方面,沙克乳酸杆菌菌株及其培养液浓度依赖性地增加骨密度。尤其,经确认,给药培养液原液的组G7和给药高浓度菌的组G1)能够恢复到相当于未切除卵巢的对照组的骨密度水平。表4实施例9.从泡菜分离的沙克乳酸杆菌CVL-001培养液对于抑制脂肪细胞分化效果的实验(体外,invitro)9-1.制备沙克乳酸杆菌CVL-001培养液为了制备沙克乳酸杆菌CVL-001培养液,在DMEM培养基中培养1×108CFU/ml的沙克乳酸杆菌CVL-001菌株24小时,随后,通过离心分离分离出上清液并将pH至调节至7.4。9-2.利用未分化的前脂肪细胞株3T3-L1的脂质分化向DMEM培养基中添加10%的小牛血清(BCS,Bovinecalfserum)及1%的青霉素-链霉素,通过继代培养从ATCC(Americantypeculturecollection,USA)购买的3T3-L1前脂肪细胞(preadipocytecell)来维持。将接种(seeding)于板(plate)后密度达到100%时记为-2天,继续培养两天来使得在板中培养的所有细胞处于G1细胞周期阻滞(arrest)状态。第0天添加IBMX(3-isobutyl-1-methylxanthine)、地塞米松(Dexamethasone)和胰岛素(Insulin,MDI)开始分化。第2天更换成仅包含胰岛素的培养基。第4天开始,每隔2天更换一次包含10%的胎牛血清(FBS,Fetalbovineserum)的培养基并进行培养直到分化。9-3.评估沙克乳酸杆菌CVL-001培养液对脂肪细胞分化的抑制效果(油红O染色)当将培养基组成成分更换为胎牛血清而并非小牛血清(BCS,Bovinecalfserum)时,诱导脂肪细胞分化。在12孔板(wellplate)以5×105个细胞/well的密度一同接种3T3-L1细胞与添加有10%的胎牛血清、1%的青霉素-链霉素的培养基。在细胞生长至100%密度之日起经过两天后,第0天用培养液(12.5%、25.0%及50.0%)处理2小时并用脂肪细胞分化诱导物质MDI处理。通过在DMEM(培养液)+胎牛血清(10%)+青霉素-链霉素(1%)培养基(media)中培养1×108cfu/ml浓度的沙克乳酸杆菌(L.sakei)24小时来制备培养液,利用DMEM培养基执行培养液的稀释。第2天更换培养基并用培养液(12.5%、25.0%及50.0%)处理两小时后,用胰岛素处理。第4天更换培养基并用培养液(12.5%、25.0%及50.0%)处理。直到以两天的间隔进行分化为止,反复执行相同过程。若观察到分化的脂肪细胞,则更换成4%的福尔马林并固定细胞10分钟来进行染色。使用D.W清洗两次后,以6:4的比例混合放入油红O染色试剂与D.W,随后,将脂肪细胞染色30分钟。使用D.W清洗,利用显微镜进行观察后,通过用100%异丙醇(isopropanol)处理来提取油红O并在510nm吸光度下进行测定来定量分析分化程度。参照图5及表5可确认到,若向3T3-L1细胞生长培养基添加MDI,则分化为脂肪细胞。通过本研究结果确认到,当用MDI处理3T3-L1细胞时,脂肪细胞的分化有所增加,并且,脂肪细胞的数量通过培养液处理浓度依赖性地显著减少。表5培养液(%)-12.525.050.0脂肪细胞分化程度5.70524.14102.09222.0940由此,可确认到沙克乳酸杆菌CVL-001培养液能够抑制脂肪细胞的分化。实施例10.用于确认改善肥胖症效果的肥胖症小鼠动物模型的制备(体内,invivo)10-1.制备沙克乳酸杆菌CVL-001活菌制备用于处理小鼠的活菌。具体地,在固体培养基(MRSagar)以30℃的温度条件培养24小时后,收集单菌落(singlecolony)并在液体培养基(MRSbroth)中进行预培养。预培养在5ml培养基(media)中以150rpm、30℃的条件下执行24小时,随后,稀释10倍并在相同条件下进行3小时的主培养。为了统一菌数量,利用分光光度计(spectrophotometer)将浓度调节成与磷酸盐缓冲盐溶液相同,以便在吸光度600nm的条件下得出0.6的O.D值。这意味着在这种条件下乳酸菌含量达0.89×109CFU/ml。考虑到需对每只小鼠对象给药200μl(1×108CFU/mouse,1×109CFU/mouse),通过以3000RPM进行离心分离15分钟来制备活菌培养基(media)。10-2.制备沙克乳酸杆菌CVL-001培养液将包含本培养结束的沙克乳酸杆菌的MRS培养基稀释10倍并在30℃、150rpm的条件下培养24小时。随后,通过以3000RPM进行离心分离15分钟来分离上清液,并将pH至调节至7.4。使用0.45um薄膜滤纸进行过滤后,保存在4℃的温度条件下。10-3.沙克乳酸杆菌CVL-001菌株及培养液针对抗肥胖症的效果实验(体内)向7周龄的C57BL/6雄性小鼠给药活菌(每天一次,200μl/对象)、培养液(每天一次,200μl/对象)并给予高脂肪饮食。随后,以每2周测量体重。第11周测血糖,第14周通过剖检采血并测量器官的重量。菌株使用实验中所使用的组的信息如下:G1:对照组(ControlGroup,给予正常饮食(Normaldiet)),磷酸盐缓冲盐溶液(PBS,phosphatebufferedsaline),口服给药(n=6)G2:对照组,沙克乳酸杆菌109,口服给药(n=6)G3:高脂肪组(HighFatGroup,给予高脂肪饮食),磷酸盐缓冲盐溶液,口服给药(n=8)G4:高脂肪组,沙克乳酸杆菌108,口服给药(n=8)G5:高脂肪组,沙克乳酸杆菌109,口服给药(n=8)培养液使用实验中所使用的组的信息如下:G1:对照组(给予正常饮食)MRS,口服给药(n=6)G2:对照组,培养液(原液),口服给药(n=6)G3:高脂肪组(给予高脂肪饮食)MRS,口服给药(n=8)G4:高脂肪组培养液(1/2稀释),口服给药(n=8)G5:高脂肪组培养液(原液),口服给药(n=8)实施例11.针对从泡菜分离的沙克乳酸杆菌CVL-001菌株及其培养液的使用效果的实验(体内)11-1.确认因沙克乳酸杆菌CVL-001菌株或培养液产生的体重变化(体内)众所周知,当对小鼠口服给予由60%的脂肪组成的高脂肪饮食时,相比于给予正常饮食的小鼠,体重会有所增加。因此,通过高脂肪饮食肥胖症诱导小鼠动物模型广泛用于肥胖症疾病研究。参照图6可以确认,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中,体重显著增加。尤其,经确认,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001菌株的数量为108和109的组G4、G5中,体重显著降低。表6参照图7及表6可以确认,相比于正常饮食组G1,在给予高脂肪饮食的组G3中,副睾丸脂肪重量显著增加,在同时给予高脂肪饮食和菌株109的组G5中,副睾丸脂肪重量显著减少。参照图8可以确认,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中,体重显著增加。尤其,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001培养液原液的组G5中,体重显著减少。另一方面,给药1/2培养液的组G4未能抑制因高脂肪饮食诱导的体重增加。表7参照图9及表7可以确认,相比于正常饮食的组G1,在给予高脂肪饮食的组G3中,副睾丸脂肪重量显著增加,在同时给予高脂肪饮食和培养液原液的组G5中,副睾丸脂肪重量显著减少。11-2.评估沙克乳酸杆菌CVL-001菌株和培养液的给药对肥胖症诱导小鼠的空腹血糖的影响(空腹血糖检测)从实验前一天下午9点开始直到次日9点为止,使小鼠维持12小时的空腹,随后,进行血糖检测。众所周知,给予高脂肪饮食的小鼠动物模型在空腹期间的血糖维持非常高的水平。因此,将各实验组在与上述10-3相同条件下进行,表8及表9分别示出了给药菌株组和给药培养液组。表8如表8所示,在本实施例中,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中空腹血糖维持非常高的水平。尤其,相比于G3,在分别以不同浓度给药高脂肪饮食和沙克乳酸杆菌CVL-001菌株的组G4、G5中,血糖水平有所减少,表现出与给予正常饮食的组G1类似的水平。表9如表9所示,在本实施例中,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中空腹血糖维持相当高的水平。尤其,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001培养液原液的组G5中,血糖水平有着减少的倾向,表现出与给予正常饮食的组G1类似的水平。11-3.评估沙克乳酸杆菌CVL-001菌株和培养液的给药对肥胖症诱导小鼠的糖耐量影响(葡萄糖耐量试验)针对各实验组,在与上述10-3相同条件下进行,从实验前一天下午9点开始直到次日9点为止,使小鼠维持12小时的空腹后进行测量。准备包含通过0.2um过滤装置(filteration)杀菌的10%的葡萄糖(Glucose)的磷酸盐缓冲溶液,并对各个对象腹腔给药(27号无菌针)2mg(glucose/g.volume(μl)=bodyweight(g)×20。将小鼠重新放入笼中,以0分钟、30分钟、60分钟、90分钟及120分钟的间隔测量血糖。血糖检测通过尾部采血进行,结果如表10、表11、图10及图11所示。表10参照表10及图10可以确认,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中,血糖维持较高水平。尤其,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001培养液原液的组G5中,血糖在第30分钟显著减少。另一方面,在给药1/2培养液的组G4中未能抑制因高脂肪饮食诱导的血糖增加。表11参照表11及图11观察到,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中,血糖维持较高。尤其,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001菌株的数量为108和109的组G4、G5中,虽然血糖有所减少,但并未观察到显著差异。11-4.沙克乳酸杆菌CVL-001菌株和培养液的给药对肥胖症诱导小鼠的胰岛素耐量试验的影响(InsulinToleranceTest)针对各实验组,在与上述10-3相同条件下进行,从实验前一天下午9点开始直到次日1点为止,使小鼠维持4小时的空腹后进行测量。准备2mg/ml的胰岛素(稀释HCI,将pH至调节至3的D.W溶液),并对各个对象腹腔给药(27号无菌针)2mg(0.03846mg/kg.Volume(μl)=Bodyweight(g)×20。将小鼠重新放入笼中,以0分钟、30分钟、60分钟、90分钟及120分钟的间隔测量血糖。血糖检测通过尾部采血进行。表12参照表12及图12可以确认,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中,血糖维持较高。尤其,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001培养液原液的组G5中,血糖在90分钟及120分钟显著减少。另一方面,相比于G3,在给药1/2培养液的组G4中,血糖有所减少。表13参照表13及图13可以确认,相比于给予正常饮食的组G1,在给予高脂肪饮食的组G3中,血糖维持较高。尤其,相比于G3,在同时给予高脂肪饮食和沙克乳酸杆菌CVL-001菌株的数量为108和109的组G4、G5中,血糖在除0分钟外的所有时间段均显著减少。产业上的可利用性本发明涉及新型沙克乳酸杆菌(Lactobacillussakei)CVL-001菌株及其分离方法,更详细地涉及从泡菜分离并鉴定的新型沙克乳酸杆菌CVL-001菌株。并且,本发明涉及包含沙克乳酸杆菌CVL-001菌株或其培养液的用于改善、预防或治疗骨病或代谢性疾病的组合物,更详细地涉及包含保藏号为KCTC13816BP的新型沙克乳酸杆菌CVL-001菌株或其培养液的组合物针对骨病或代谢性疾病的改善效果、预防效果或治疗效果。序列表<110>Industry-UniversityCooperationFoundationChonnamUniversity<120>含新型沙克乳酸杆菌CVL-001菌株或其培养液的用于改善、预防或治疗骨病或代谢性疾病的组合物<130>PP200015<150>KR10-2019-0022670<151>2019-02-26<150>KR10-2019-0022671<151>2019-02-26<150>KR10-2020-0012763<151>2020-02-03<160>3<170>KoPatentIn3.0<210>1<211>1439<212>DNA<213>未知<220><223>沙克乳酸杆菌(Lactobacillussakei)CVL-00116SrRNA<400>1gcagtcgaacgcactctcgtttagattgaaggagcttgctcctgattgataaacatttga60gtgagtggcggacgggtgagtaacacgtgggtaacctgccctaaagtgggggataacatt120tggaaacagatgctaataccgcataaaacctaacaccgcatggtgtagggttgaaagatg180gtttcggctatcactttaggatggacccgcggtgcattagttagttggtgaggtaaaggc240tcaccaagaccgtgatgcatagccgacctgagagggtaatcggccacactgggactgaga300cacggcccagactcctacgggaggcagcagtagggaatcttccacaatggacgaaagtct360gatggagcaacgccgcgtgagtgaagaaggttttcggatcgtaaaactctgttgttggag420aagaatgtatctgatagtaactgatcaggtagtgacggtatccaaccagaaagccacggc480taactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggatttattgg540gcgtaaagcgagcgcaggcggtttcttaagtctgatgtgaaagccttcggctcaaccgaa600gaagtgcatcggaaactgggaaacttgagtgcagaagaggacagtggaactccatgtgta660gcggtgaaatgcgtagatatatggaagaacaccagtggcgaaggcggctgtctggtctgt720aactgacgctgaggctcgaaagcatgggtagcaaacaggattagataccctggtagtcca780tgccgtaaacgatgagtgctaggtgttggagggtttccgcccttcagtgccgcagctaac840gcattaagcactccgcctggggagtacgaccgcaaggttgaaactcaaaggaattgacgg900gggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttacca960ggtcttgacatcctttgaccactctagagatagagctttcccttcggggacaaagtgaca1020ggtggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgag1080cgcaacccttattactagttgccagcatttagttgggcactctagtgagactgccggtga1140caaaccggaggaaggtggggacgacgtcaaatcatcatgccccttatgacctgggctaca1200cacgtgctacaatggatggtacaacgagttgcgagaccgcgaggtttagctaatctctta1260aaaccattctcagttcggattgtaggctgcaactcgcctacatgaagccggaatcgctag1320taatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtc1380acaccatgagagtttgtaacacccaaagccggtgaggtaacccttcggggagccagccg1439<210>2<211>20<212>DNA<213>人工序列<220><223>沙克乳酸杆菌(Lactobacillussakei)16SrRNA正向引物<400>2agagtttgatcctggctcag20<210>3<211>19<212>DNA<213>人工序列<220><223>沙克乳酸杆菌(Lactobacillussakei)16SrRNA反向引物<400>3ggttaccttgttacgactt19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1