用于评估组合物在减少癌症治疗剂对皮肤的影响方面的功效的方法与流程
用于评估组合物在减少癌症治疗剂对皮肤的影响方面的功效的方法
1.本技术要求2019年12月19日提交的美国临时申请序列号62/950,624的优先权,该申请的内容据此全文以引用方式并入本文。
技术领域
2.本发明涉及评估癌症治疗剂产生皮肤相关的副作用的可能性的方法。本发明还涉及用于评估组合物在减少癌症治疗剂对皮肤的影响方面的功效的方法。
背景技术:
3.靶向增殖性细胞的肿瘤治疗经常与皮肤型药物不良反应(cadr)相关。cadr涉及45%-100%的接受激酶抑制剂的患者并且可能显著影响患者的生活质量。图1a-图1f是示出此类皮肤型不良反应的示例的照片,包括瘙痒(图1a);干燥、片状、开裂的皮肤(图1b);红疹(图1c);阳光过敏(图1d);面部发红(图1e);和过度干燥的手(图1f)。
4.cadr常常导致剂量改变或药物中断,从而干扰治疗方案。
5.肿瘤药物损害角质细胞增殖并破坏它们的分化。参见下表1和图2,该图是示出健康皮肤和由于使用肿瘤药物导致的受损皮肤的图。
6.表1
[0007][0008]
表皮由复层上皮组成,主要由角质细胞构成。它为宿主提供抵御外部环境(包括病原体)侵袭的第一道防线,并且通过控制经皮水分流失速率来防止脱水。这一屏障高度依赖于角质层中的基底层细胞至终末角化细胞的角质细胞分化过程。肿瘤治疗主要使用激酶抑制剂靶向增殖细胞。由于表皮上皮通常包括增殖性细胞,因此假设它也变成此类疗法的靶是合理的[1],由于表皮分化缺陷、皮肤平衡改变和屏障功能障碍,可能导致皮肤型药物不良反应(cadr)的过程[2]。
[0009]
各种生长因子受体的酪氨酸激酶抑制剂(tki)靶成员,如表皮生长因子(egf)、血管内皮生长因子(vegf)和血小板衍生生长因子(pdgf)以及人egf受体2(her2)的受体。肿瘤中这些途径的过度活化导致细胞增殖、血管生成和遗传异常的增加、以及细胞凋亡的抑制[3,4]。最初对tki有反应的患者将在治疗开始后9至13个月内因突变而产生抗性,需要转换
治疗方案以解决此类突变的出现[5,6]。在21世纪初开发了第一代tki之后,开发了第二代和第三代药物以阻止肿瘤细胞中的突变出现。尽管与标准化学疗法相比,t790m突变的出现有助于改善无进展生存期并减少cadr,但第三代egfri不可逆地抑制egfr[7,8]。
[0010]
慢性tki治疗还可以直接影响表皮基底水平的增殖性角质细胞,降低细胞生长速率、细胞迁移并促进细胞凋亡、细胞附着、角质细胞分化和促炎性细胞因子表达[9,10]。在这种情况下,导致的表皮结构破坏和皮肤屏障功能障碍可能与临床上观察到的皮疹、瘙痒、干燥、手足皮肤反应、指甲和毛发变化相关。此类cadr也与疼痛和继发感染相关,在45%-100%的接受tki的患者中出现,并且可能显著影响患者的生活质量[5]。皮肤病学家和肿瘤学家都进行医学检查来了解症状的性质和严重程度以及受影响的体表面积对预防发展成更严重的症状是必要的。可能需要剂量调整或者甚至药物中断,从而导致对肿瘤治疗方案的干扰[11]。然而矛盾的是,治疗期间皮疹的出现与患者的更好生存期相关[12]。
[0011]
授予laboratoires expanscience的美国专利10,092,495公开了一种用于治疗皮肤癌的方法,该方法包括施用有效量的至少一种c7糖或其衍生物。
[0012]
授予laboratoires expanscience美国专利10,175,230公开了一种用于评估c7糖或其衍生物在预防和/或治疗受试者的皮肤屏障的至少一种缺陷方面的有效性的方法。
[0013]
授予laboratoires expanscience的美国公开申请20190242880公开了用于评估制剂用于防止脱水对儿童皮肤的影响的体外功效的方法。
[0014]
本发明的目的是递送用于综合治疗方法的解决方案,旨在改善生活质量并且为经历药物治疗的患者提供最佳药物治疗结果。
技术实现要素:
[0015]
由于egfr途径对表皮角质细胞至关重要,因此假设靶向癌的表皮生长因子受体抑制剂(egfri)也影响这些细胞并因此干扰表皮结构形成和皮肤屏障功能是合理的。
[0016]
为了测试这一假设,在新的3d微表皮组织培养模型中评估在治疗相关浓度(3nm、10nm、30nm、100nm)下,egfri和血管内皮细胞生长因子受体抑制剂(vegfri)对人角质细胞的增殖和分化标志物的影响。
[0017]
egfri直接影响基底角质细胞生长,导致组织尺寸减小并将角质细胞从增殖性表型转换到分化性表型,如通过ki67染色减少和丝聚蛋白、桥粒芯糖蛋白-1与内披蛋白表达增加所证明的。这些影响导致皮肤屏障受损,其可以在重建的人表皮模型中观察到,该模型显示经皮水分流失速率降低。另一方面,主要靶向vegfr的pan-激酶抑制剂几乎不影响角质细胞分化,而是促进增殖性表型。
[0018]
这一研究有助于在用egfri治疗期间对临床上观察到的cadr的机制理解。这些体外结果表明,通过直接影响角质细胞生长和屏障功能的egfri的特定作用模式。
[0019]
肿瘤治疗,尤其是egfri,直接影响基底角质细胞生长,导致组织尺寸减小并将角质细胞从增殖性表型切换到分化性表型。此类过程导致屏障受损和皮肤损伤。
[0020]
据信支持皮肤屏障可以帮助改善治疗相关的皮疹/病症。
[0021]
本发明的目的是递送用于综合治疗方法的解决方案,旨在改善生活质量并且为经历药物治疗的患者提供最佳药物治疗结果。
[0022]
根据本发明,使用能够在功能上重新产生由于肿瘤治疗而引起的屏障损害的重建
人表皮(rhe)模型用于测试可以消除癌症制剂对皮肤屏障结构和功能的影响的组合物。图3a是模型的照片,并且图3b是示出对屏障功能和生物分子标志物的评估的图。
[0023]
为了评估此类治疗分子对表皮的影响,在3天期间在激酶抑制剂的存在以及高钙浓度下使角质细胞生长,以诱导角质细胞分化并产生3d分层分化表皮。通过不同的角质细胞标志物评估药物对表皮发育的影响,包括:
[0024]-ki-67,一种在增殖细胞中广泛表达并且在静止细胞中不存在的蛋白[13];
[0025]-丝聚蛋白,一种与角蛋白纤维结合并且是终末分化的标志物的长丝相关蛋白[14];
[0026]-桥粒芯糖蛋白-1,一种细胞桥粒的组分并且是在所有表皮层中在基底层上方表达的分化标志物[15];和
[0027]-内披蛋白,一种在棘层和颗粒层中表达的早期分化标志物和表皮角化包膜的蛋白质前体[16]。
附图说明
[0028]
图1a-图1f是示出此类皮肤型不良反应的示例的照片,包括瘙痒(图1a);干燥、片状、开裂的皮肤(图1b);红疹(图1c);阳光过敏(图1d);面部发红(图1e);和过度干燥的手(图1f)。
[0029]
图2是示出健康皮肤和由于使用肿瘤药物导致的受损皮肤的图。
[0030]
图3a是重建人表皮(rhe)模型的照片,并且图3b是示出对屏障功能和生物分子标志物的评估的图。
[0031]
图4a至图4f是示出阿法替尼减少表皮尺寸并增加皮肤分化标志物的图。用3nm、10nm、30nm的阿法替尼治疗微表皮。通过定量组织体积、肌动蛋白表达强度以及内披蛋白、丝聚蛋白和桥粒芯糖蛋白-1表达的强度与定位来评估微表皮生理。*p《0.05,**p《0.01,***p《0.001。
[0032]
图5a和图5b是示出阿法替尼对细胞活力(图5a)和细胞凋亡(图5b)的影响的图。a)在暴露于阿法替尼后,角质细胞活力降低。b)阿法替尼尼不诱导角质细胞的细胞凋亡。将角质细胞暴露于每个所示条件24小时。百分比表示与溶媒相比的相对效果。1μm的星形孢菌素用作阳性对照并且对应于100%细胞凋亡。事后新复极差法检验(dunett’s test)*p《0.05,****p《0.0001。
[0033]
图6是示出rhe皮肤屏障功能在阿法替尼治疗的第2天恶化的图。通过测量经皮水分流失的速率来评估皮肤屏障功能。将凡士林在rhe上局部施用作为阴性对照,并且将rhe上的0.5%sds溶液局部暴露用作阳性对照。
[0034]
图7是示出在用阿法替尼治疗后restorative skin therapy itch relief balm和restorative skin therapy oat repairing cream对皮肤屏障功能的影响图。
具体实施方式
[0035]
材料和方法
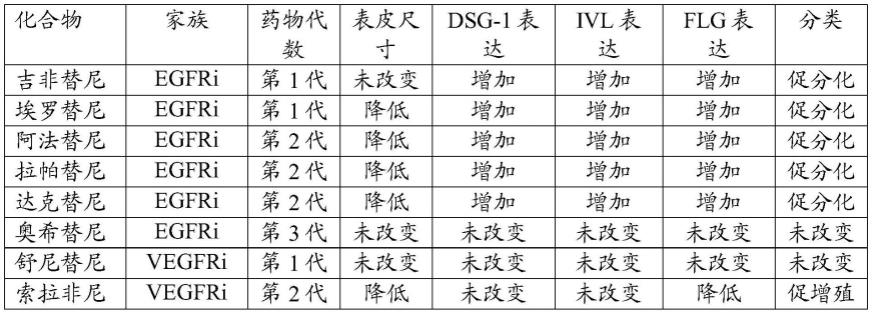
[0036]
测定游离血浆药物浓度
[0037]
选择在治疗相关浓度(3-100nm)下的体外药物暴露范围,而不是先前在文献中使用的微摩尔至毫摩尔范围[17,18]。这些浓度似乎与研究治疗对表皮的长期影响更相关。使用公开的研究,鉴定了在健康患者中单次日推荐剂量的药物后血浆中的最大药物浓度。使用c
max
血浆浓度和血浆中游离级分的百分比来鉴定或计算游离级分对血浆蛋白的百分比。根据该研究tki的血浆蛋白结合范围为0.3%至5%。埃罗替尼的最高游离血浆浓度(80nm;togashi等人,2010),达克替尼的最低游离血浆浓度(0.42nm;giri等人,2015)。egfri平衡离解常数(kd)已经由klaeger等人报告[19]。可以比较本研究中使用的egfri。egfri药物效力范围是从具有2nm kd的阿法替尼至具有2,164nm kd的第一代药物埃罗替尼(表2)。令人惊讶地是,与第二代药物如阿法替尼、拉帕替尼和达克替尼相比,egfri第三代药物奥希替尼的效力未降低。使用文献比较vegfri kd。
[0038]
表2
[0039][0040]
vegfri和egfri的生物和活性数据。从由网站drugcentral.org提供的信息来编译生物效应数据(在2019年11月登入)。此处存在的“主要皮肤影响”是由fda不良事件报告系统报告的最频繁的皮肤型不良反应。nsclc:非小细胞肺癌。此处在文献中报告了在单次剂量施用之后人的药物kd和血浆浓度的测定。来自klaeger等人,2017的数据用于比较egfri的药物kd。在文献中将游离的血浆药物级分测定为纳摩尔等级的浓度。
[0041]
药物制备
[0042]
用溶解于dmso中的10mm原液制备在施用单次剂量后对应于血浆相关浓度(3nm、10nm、30nm、100nm)的所选药物,且药物浓度为1μm。因此,对于1μm的最高浓度,最终dmso浓度为0.01%。溶媒由与药物处理相同的dmso体积构成。对乙酰氨基酚在相同比例的dmso中用作阴性对照。
[0043]
皮肤屏障功能的评估
[0044]
药物对皮肤屏障功能的影响是通过使用tw 24(courage+khazaka electronic gmbh,germany)在skinethic
tm
重建人表皮(rhe)模型(episkin,里昂,法
国)上测量经皮水分流失(tewl)速率来评估的。这个仪器允许在rhe上同时进行24个测量。在培养箱中,在33℃下分析tewl。在1小时tewl稳定之后进行测量,并且进行5分钟平均tewl测量。进行一式三份的实验,并将结果归一化为对照的tewl的100%。在rhe的表面处添加在pbs中0.5%的sds以损坏表皮结构并因此提高tewl(阳性对照)。凡士林是一种高度疏水性烃,是拒水的并且不溶于水,使用其阻止rhe表面处的水分蒸发(阴性对照)。将阿法替尼添加到培养基中,浓度为100nm,并且每2天或每3天重新添加以模拟慢性药物暴露。dmso在溶媒中以相同比例使用。
[0045]
skinethic
tm
rhe(episkin,里昂,法国)是来自正常人类角质细胞的体外重建人表皮,该人类角质细胞在化学限定的培养基中,在气-液界面处的惰性聚碳酸酯过滤器上培养。这个模型存在于不同的成熟阶段。这个模型在组织学上类似于体内人表皮。参见https://www.episkin.com/skinethic%20rhe。
[0046]
在培养皮肤样品中的经皮水分流失测量
[0047]
tw 24是一种在多达24个孔中同时测量培养的组织组(带培养基的板中的孔)的水分蒸发的装置。参见https://www.courage-khazaka.de/en/16-wissenschaftliche-produkte/alle-produkte/159-tewitro-e。
[0048]
episcreen
tm
方案
[0049]
将来自青少年白种人供体(cellntec,瑞士)的人表皮角质细胞(hpek)培养在烧瓶中的增殖培养基中。将角质细胞在第6代接种到episcreen
tm
(abzena,剑桥,英国)板中,该板含有胶原蛋白1涂覆的盘状微图案(cytoo,格勒诺布尔,法国)。在四小时后洗脱未附连的细胞,并且添加高钙培养基以诱导角质细胞分化。在第二天,用筛选化合物处理角质细胞,并添加0.3μm曲古抑菌素a作为内部阳性对照。在处理三天后,将微表皮用10%福尔马林溶液固定30分钟,然后用0.1%triton透化。进行几种免疫染色:肌动蛋白(acti-stain 555,phdh1,cytoskeleton)、细胞核(hoechst,h3570,invitrogen)、以及每孔所关注的一种生物标志物(抗内披蛋白(hpa055211,sigma)、抗丝聚蛋白(hpa030189,sigma)或抗桥粒芯糖蛋白-1(hpa022128,sigma))。在4℃下添加抗体过夜,然后在室温下用二抗,即抗兔488(711-545-152,jackson),染色2小时。
[0050]
图像采集和分析
[0051]
使用operetta hcs平台(perkin elmer,沃尔瑟姆,马萨诸塞州,美国),利用x10物镜以共焦模式,在6μm步骤中,在2μm至44μm的八个z平面中采集每个孔的图像,在3个通道的每一个中进行采集:肌动蛋白、细胞核和所关注的一个生物标志物。图像分析的第一步骤包括通过分割肌动蛋白染色来检测在第一z平面上的微表皮结构。基于几个区域和最小圆度标准与最大圆度标准验证微表皮结构。然后,在通过每个z平面的有效微表皮遮罩内部测量每个生物标志物染色的面积。对于所有均匀的生物标志物染色,测量它们通过不同平面的强度。
[0052]
3d微表皮图像的重建
[0053]
基于每个孔50至80个微表皮结构,建立“平均”3d图像以表示这个孔中的微表皮表型。使用在第一z平面中的肌动蛋白染色检测微表皮结构,并且基于面积和圆度标准来选择微表皮结构。
[0054]
每个微表皮的肌动蛋白网络在每个z平面中分析以确定平均3d结构边缘。在每个
结构的每个z平面中测量生物标志物强度,然后用同一孔中产生的其他结果进行平均。基于在两个先前步骤中生成的数据,产生平均3d重建图像。它由界定结构边缘的网和对应于生物标志物分布和表达的彩色刻度体积(color scaled volume)构成。
[0055]
活力和增殖分析
[0056]
水溶性四唑盐(wst-8)比色细胞增殖试剂盒(promokine,海德堡,德国)提供快速且灵敏的方式以量化增殖和细胞活力。细胞增殖导致形成的甲臜染料的量增加,该甲臜染料的量可以通过使用微量滴定板酶标仪(perkin elmer envision 2103多功能酶标仪,沃尔瑟姆,马萨诸塞州,美国)测量染料溶液在440nm处的吸光度来量化。细胞增殖诱导线粒体脱氢酶的活性增加,该线粒体脱氢酶将四唑盐wst-1裂解成甲臜。将每孔15,000个角质细胞接种在96孔板上,一旦达到细胞融合,使用的药物浓度为血浆浓度的+/-1/2对数。加入10μl比色细胞活力试剂盒并与360μl培养基一起完成,在4小时后在450nm下读取结果以测定细胞活力。在2个实验中获得了6个供体的角质细胞的结果
[0057]
半胱氨酸蛋白酶-3荧光检测试剂盒
[0058]
试剂盒(biotium,弗里蒙特,加利福尼亚州,美国)提供一种均匀的测定系统,用于通过酶反应或哺乳动物细胞中的荧光快速且高度灵敏地检测半胱氨酸蛋白酶-3的活性。荧光底物(ac-devd)2-r110含有两个devd(asp-glu-val-asp)四肽,并且在两个连续步骤中被酶完全水解。第一devd肽的裂解产生单肽ac-devd-r110中间体,其具有的吸收和发射波长类似于r110(ex/em=496/520nm)的吸收和发射波长,但仅具有后者约10%的荧光。第二devd肽的水解释放染料r110,导致显著的荧光增加。将角质细胞以每孔15,000个细胞接种在96孔黑色微板中的100μl培养基中。使它们在37℃、5%co2培养箱中附连并生长过夜。然后将它们以1:2稀释系列的星形孢菌素(一种半胱氨酸蛋白酶3诱导剂)处理20小时[20]。使用490nm的激发波长和535nm的发射波长在perkin elmer envision2103多功能酶标仪上进行成像。将细胞在室温下避光培养15分钟。在2个实验中获得了6个供体的角质细胞的结果
[0059]
统计分析
[0060]
结果表达为平均值+/-sd。所有实验至少一式三份地进行。使用单向方差分析(anova)和学生t检验(student’s t-test)进行统计分析。两组之间的差异的统计显著性在p《0.05的水平下得到接受。
[0061]
结果
[0062]
在体外使用3d微表皮模型对选自主要靶向vegfr的第一代egfri和pan-激酶抑制剂以及靶向与第一代治疗抗性有关的主要突变的第二代疗法和第三代疗法的8种肿瘤分子的影响进行评估。选择药物培养浓度(3nm、10nm、30nm、100nm)以反映临床相关(游离)药物暴露(表2)。通过使用丝聚蛋白、桥粒芯糖蛋白-1和内披蛋白染色的ki-67染色和角质细胞分化对组织尺寸和角质细胞增殖进行分析,从而评估药物影响。
[0063]
增加的微表皮尺寸和ki-67染色随着丝聚蛋白、桥粒芯糖蛋白-1和内披蛋白表达的伴随减少被认为是测试分子的促增殖作用。另一方面,促分化作用被定义为微表皮尺寸和ki-67染色两者的减少以及丝聚蛋白、桥粒芯糖蛋白-1和内披蛋白表达的增加。
[0064]
pan-激酶抑制剂几乎不影响微表皮结构和分化标志物
[0065]
舒尼替尼对表皮尺寸没有影响,并且索拉非尼显著减小表皮尺寸。两种pan-激酶抑制剂都不影响桥粒芯糖蛋白-1和内披蛋白的表达,并且显著减少丝聚蛋白的表达。值得
注意的是,在100nm下实现了pan-激酶抑制剂的这种作用,更低的浓度不影响研究中后续的标志物。舒尼替尼是经评估在最高测试浓度(1μm)下未显示任何毒性的仅有的tki。这些结果表明,vegfri对角质细胞具有促增殖作用。
[0066]
egfri影响表皮结构和分化标志物
[0067]
测试的大部分egfri(表3)(包括阿法替尼、拉帕替尼和达克替尼)以剂量依赖性方式显示出对桥粒芯糖蛋白-1、内披蛋白和丝聚蛋白表达的影响。吉非替尼仅以剂量依赖性方式增加了桥粒芯糖蛋白-1的表达。埃罗替尼和奥希替尼不影响结合蛋白的表达。对于所测试的所有egfri,在1μm下评估的表皮毒性是显著的,干扰表皮发育,达到没有组织可用于进一步数据分析的程度。(表3)在3nm、10nm和30nm的游离血浆药物浓度下,所有第一代和第二代egfri均显示出角质细胞增殖、微表皮尺寸的减少,以及桥粒芯糖蛋白-1、内披蛋白和丝聚蛋白表达的增加,这是促分化作用的证据。
[0068]
表3
[0069][0070]
1,减小,p《0.001;2,减小,p《0.01;3,减小,p《0.05;4,非显著,p》0.05;5,增加,p《0.001;6,增加,p《0.01;7,增加,p《0.05
[0071]
暴露于egfri和vegfri后微表皮生理机能受损。通过免疫染色评估表皮尺寸和蛋白质连接部桥粒芯糖蛋白-1(dsg1)、内披蛋白(ivl)和丝聚蛋白(flg)的表达,并与未处理的对照进行比较。药物通过家族和药物代数来分类。通过对在3nm、10nm、30nm egfri和3nm、10nm、30nm、100nm vegfri下的蛋白质表达的变化进行比较来确定剂量反应。在30nm(efgri)或100nm(vefgri)下*p《0.05;在30nm(efgri)或100nm(vefgri)下**p《0.01,并且在30nm(efgri)或100nm(vefgri)下***p《0.001。
[0072]
有趣的是,开发为靶向耐药性细胞但也提供更好的药物耐受性的第三代egfri,奥希替尼,是在较高浓度(1μm)下未显示对除细胞毒性外的所有参数有任何影响的唯一
egfri。
[0073]
阿法替尼影响角质细胞蛋白表达、活力和增殖
[0074]
阿法替尼(图4a到图4f)处理导致与溶媒相比,3d重建微表皮模型中表皮体积显著减小。以剂量依赖性方式在3nm、10nm、30nm下显著增加内披蛋白和桥粒芯糖蛋白-1表达,并且以剂量依赖性方式在10nm和30nm下显著增加丝聚蛋白表达。高于1μm的较高药物浓度是有毒的,导致表皮坏死。
[0075]
通过测量tewl的速率在rhe模型上评估阿法替尼对表皮屏障功能的影响。与未处理的对照相比,添加凡士林(阴性对照)导致在施用后第1天、第2天、第5天和第7天的tewl速率分别显著降低了48%、77%、75%和82%。在施用后第1天、第2天和第5天,表面活性剂钠十二烷基亚砜(sds,以0.5%浓度用作阳性对照)使tewl速率分别显著提高了98%、77%和58%。在施用sds后第7天,观察到tewl速率的不显著提高。阿法替尼在第2天将tewl速率显著提高了22%,而在第5天和第7天,没有观察到tewl速率的显著变化。
[0076]
其他结果表明阿法替尼以剂量依赖性方式对细胞活力具有显著影响(图5a)。另一方面,在2.59nm和25.89nm下的阿法替尼在细胞凋亡方面未显示出任何影响(图5b)。综上所述,这些结果表明阿法替尼损害微表皮模型中的角质细胞活力和增殖,但它不诱导角质细胞凋亡。
[0077]
用作对照的对乙酰氨基酚未显示出对任何测量参数的影响,包括在1μm下的细胞毒性。
[0078]
测量电容和经皮水分流失(tewl)速率以评估restorative skin therapy itch relief balm和restorative skin therapy oat repairing cream抵消阿法替尼处理对皮肤屏障功能的影响的能力。
[0079]
添加36μl的护肤膏或乳膏制剂,并且用巴斯德吸管(pipette pasteur)在rhe的整个表面上铺展。然后将护肤膏或乳膏制剂在干燥培养箱中稳定至少48小时以去除水含量,以免干扰tewl测量。
[0080]
根据上文阐述的方案添加药物到培养基中,并且培养rhe。在药物和制剂两者组合的情况下,药物需要在制剂之后d+1天添加,以便稳定在rhe顶部的制剂。
[0081]
护肤膏含有以下成分:
[0082]
·
活性成分:盐酸丙吗卡因(0.5%)
[0083]
·
非活性成分:水、甘油、二硬脂基二甲基氯化铵、凡士林、棕榈酸异丙酯、鲸蜡醇、泛醇、聚二甲基硅氧烷、燕麦(oat)粒粉、苄醇、鲸蜡基羟乙基纤维素、氯苯甘油醚、硬脂醇聚醚-20、库拉索芦荟叶提取物、氯化钠、燕麦(oat)粒提取物
[0084]
乳膏含有以下成分:
[0085]
·
水、甘油、二硬脂基二甲基氯化铵、凡士林、棕榈酸异丙酯、鲸蜡醇、泛醇、聚二甲基硅氧烷、燕麦(oat)粒粉、苄醇、硬脂醇聚醚-20、库拉索芦荟叶提取物、氯化钠、燕麦(oat)粒提取物
[0086]
结果示于图7中。
[0087]
讨论
[0088]
在癌症治疗中出现tki已经成功地增加了患者的五年生存率。egfri和vegfri在各
种实体瘤的治疗中已经取得相当大的进展,因为它们的引入和更新换代已经显著提高了它们的效率[21]。通过靶向增殖性细胞,肿瘤治疗可能会导致cadr,其可能中断治疗方案并影响患者的生活质量[7]。对导致cadr的机制仍然知之甚少。迄今为止,tki对角质细胞的影响仍然未知,并且发表的研究仅考虑相对高的药物浓度,而不考虑以慢性方式影响角质细胞的相关血浆浓度。这项工作中呈现的结果首次提供了在cadr病理生理学上对肿瘤治疗的作用模式的更好理解。
[0089]
舒尼替尼和索拉非尼是主要靶向vegfri的两种pan激酶抑制剂,它们分别具有2nm和23.6nm的游离血浆级分,以及1.5nm和59nm的平衡离解常数(kd)。对于舒尼替尼和索拉非尼,在相同浓度范围内进行的微表皮研究对表皮结构没有影响,仅显著增加了丝聚蛋白的表达。值得注意的是,在待评估的药物组中,舒尼替尼是在1μm下不导致角质细胞毒性的唯一药物。可以想象,vegfri对皮肤的负面影响可能由于皮肤血管形成受损而干扰角质细胞生长而引起[22]。使用较高浓度的索拉非尼不存在影响能够确认我们的假设。
[0090]
相比之下,egfri明显地影响基底层的角质细胞生长,导致微表皮模型中表皮体积的减少。阿法替尼在3nm下导致表皮体积减少。另一方面,阿法替尼增加了桥粒芯糖蛋白-1、内披蛋白和丝聚蛋白的表达,表明egfri促进了晚期终末分化,同时减少基底层的角质细胞增殖。
[0091]
令人惊讶的是,奥希替尼对表皮发育没有影响。与前代药物相比,这个数据连同高kd值(155nm)(表2)一起可以通过以下事实解释:奥希替尼靶向在用第一代药物和第二代药物长期治疗后产生的主要突变(t790和c797s)。因此,与野生型受体[23]相比,奥希替尼表现出更高的突变受体抑制,并且几乎不影响本研究中的微表皮发育。
[0092]
阿法替尼是与待评估药物组的最低游离血浆浓度、c
max
和kd相关的egfri的不可逆抑制剂。参见下文的结构。
[0093][0094]
阿法替尼影响研究的所有参数(即,表皮尺寸、皮肤屏障标志物)。因此,检查了对应于游离血浆浓度范围的3nm、10nm和30nm阿法替尼的剂量反应(图4a至图4f)以确定表皮发育中的角质细胞生长。在3nm和30nm下,微表皮尺寸显著减小。此外,内披蛋白、桥粒芯糖蛋白-1和丝聚蛋白均以剂量依赖性方式增加。总之,阿法替尼通过减少基底层处的角质细胞增殖并诱导角质细胞分化来影响所研究的所有标志物,这是一种对皮肤屏障功能具有可测量影响的作用。
[0095]
在重组表皮上研究阿法替尼对屏障功能的功能性后果(图5a和图5b)。在第二天,tewl速率显著提高。这一结果表明阿法替尼快速影响皮肤屏障。在rhe暴露于阿法替尼后第5天的tewl值恢复可能是由于如上文所报告的阿法替尼诱导的内披蛋白、桥粒芯糖蛋白-1和丝聚蛋白的表达增加。已经报告了临床cadr症状在治疗的第一天内出现,然后消失,仅在连续暴露于肿瘤药物后一至两个月再次出现[24]。结果指示阿法替尼诱导tewl的早期提高
与这种临床观察结果一致。cadr的晚期出现可能涉及增殖减少和细胞疲劳。
[0096]
进行进一步分析以阐明阿法替尼对角质细胞的作用。角质细胞的细胞凋亡活性任一测试剂量下没受到影响,表明表皮的尺寸减小不与细胞凋亡有关,而是与细胞数量的减少有关(错误!找不到引用源。所有这些数据表明,cadr通过减少角质细胞增殖而引起,该减少的角质细胞增殖损害了皮肤再生并且导致表皮尺寸减小,而不是通过诱导表皮中的角质细胞凋亡而引起。
[0097]
总之,在药物暴露时,作为一种对损伤侵害的响应,角质细胞经历从增殖性表型到分化性表型的快速转换。在更长的暴露时期内,能够更新表皮的祖代角质细胞的减少能够解释在几周药物暴露后变得明显的皮疹、干燥皮肤的出现。
[0098]
最后,使用免疫疗法的新一代肿瘤治疗还报告了与用小分子靶向tki治疗类似的重要cadr。因此,仍需要更好地理解此类药物对皮肤生理的影响以管理此类病症,使患者得到更好的生活质量。
[0099]
结论
[0100]
评估了肿瘤治疗分子在低于毒性水平的浓度下对表皮发育(体外)的作用。这些相关浓度允许证明肿瘤治疗损害角质细胞生长并因此影响皮肤屏障。这些结果解释了为什么需要在肿瘤治疗期间进行预防以支持皮肤屏障功能,并因此减少此类cadr的出现。
[0101]
应当理解,虽然已以举例的方式示出和描述了本公开的各个方面,但本文受权利要求书保护的本发明并不限于此,而是可根据本专利申请和/或任何衍生专利申请中提出的权利要求的范围以其他方式不同地实施。
[0102]
缩写列表:
[0103]
cadr皮肤型药物不良反应
[0104]
tki酪氨酸激酶抑制剂
[0105]
egfri表皮生长因子受体抑制剂
[0106]
vegfri血管内皮生长因子受体抑制剂
[0107]
3d3维
[0108]
her2人egf受体2
[0109]
cmax最大浓度
[0110]
kd离解常数
[0111]
nm纳摩尔
[0112]
μm微摩尔
[0113]
dmso二甲基亚砜
[0114]
tewl经皮水分流失
[0115]
rhe重建人表皮
[0116]
sds十二烷基硫酸钠
[0117]
pbs磷酸盐缓冲盐水
[0118]
wst-8水溶性四唑盐
[0119]
sds标准偏差
[0120]
mw分子量
[0121]
nsclc非小细胞肺癌
8290.cd-14-0337.
[0149]
24.chu c,choi j,eaby-sandy b,langer cj,lacouture me.osimertinib:a novel dermatologic adverse event profile in patients with lung cancer.oncologist.2018;23:891
–
9.
[0150]
25.li j,brahmer j,messersmith w,hidalgo m,baker sd.binding of gefitinib,an inhibitor of epidermal growth factor receptor-tyrosine kinase,to plasma proteins and blood cells:in vitro and in cancer patients.invest new drugs.2006;24:291
–
7.
[0151]
26.swaisland hc,smith rp,laight a,kerr dj,ranson m,wilder-smith ch等人,single-dose clinical pharmacokinetic studies of gefitinib.clin pharmacokinet.2005;44:1165
–
77.
[0152]
27.togashi y,masago k,fukudo m,terada t,ikemi y,kim yh等人,pharmacokinetics of erlotinib and its active metabolite osi-420in patients with non-small cell lung cancer and chronic renal failure who are undergoing hemodialysis.j thorac oncol.2010;5:601
–
5.doi:10.1097/jto.0b013e3181d32287.
[0153]
28.herbst rs,johnson dh,mininberg e,carbone dp,henderson t,kim es等人,phase i/ii trial evaluating the anti-vascular endothelial growth factor monoclonal antibody bevacizumab in combination with the her-1/epidermal growth factor receptor tyrosine kinase inhibitor erlotinib for patients with recurrent non-small-cell lung cancer.j clin oncol.2005;23:2544
–
55.
[0154]
29.wind s,schnell d,ebner t,freiwald m,stopfer p.clinical pharmacokinetics and pharmacodynamics of afatinib.clin pharmacokinet.2017;56:235
–
50.doi:10.1007/s40262-016-0440-1.
[0155]
30.emea.european medicines agency:emea/h/c/002280-annual report of the european medicines agency 2013.2013;44july.http://www.ema.europa.eu/docs/en_gb/document_library/epar_-_public_assessment_report/human/002280/wc500152394.pdf.
[0156]
31.wind s,schmid m,erhardt j,goeldner rg,stopfer p.pharmacokinetics of afatinib,a selective irreversible erbb family blocker,in patients with advanced solid tumours.clin pharmacokinet.2013;52:1101
–
9.
[0157]
32.hudachek sf,gustafson dl.physiologically based pharmacokinetic model of lapatinib developed in mice and scaled to humans.j pharmacokinet pharmacodyn.2013;40:157
–
76.doi:10.1007/s10928-012-9295-8.
[0158]
33.burris ha,hurwitz hi,dees ec,dowlati a,blackwell kl,o’neil b等人,phase i safety,pharmacokinetics,and clinical activity study of lapatinib(gw572016),a reversible dual inhibitor of epidermal growth factor receptor tyrosine kinases,in heavily pretreated patients with metastatic carcinomas.j clin oncol.2005;23:5305
–
13.doi:10.1200/jco.2005.16.584.
[0159]
34.giri n,masters jc,plotka a,liang y,boutros t,pardo p等人,
investigation of the impact of hepatic impairment on the pharmacokinetics of dacomitinib.invest new drugs.2015;33:931
–
41.
[0160]
35.reckamp kl,giaccone g,camidge dr,gadgeel sm,khuri fr,engelman ja等人,a phase 2trial of dacomitinib(pf-00299804),an oral,irreversible pan-her(human epidermal growth factor receptor)inhibitor,in patients with advanced non-small cell lung cancer after failure of prior chemotherapy and erlotinib.cancer.2014;120:1145
–
54.
[0161]
36.reddy vp,walker m,sharma p,ballard p,vishwanathan k.development,verification,and prediction of osimertinib drug-drug interactions using pbpk modeling approach to inform drug label.cpt pharmacometrics syst pharmacol.2018;7:321
–
30.
[0162]
37.rais r,zhao m,he p,xu l,deeken jf,rudek ma.quantitation of unbound sunitinib and its metabolite n-desethyl sunitinib(su12662)in human plasma by equilibrium dialysis and liquid chromatography
–
tandem mass spectrometry(lc/ms/ms):application to a pharmacokinetic study.biomed chromatogr.2012;26:230
–
3.
[0163]
38.fabian ma,biggs wh,treiber dk,atteridge ce,azimioara md,benedetti mg等人,a small molecule-kinase interaction map for clinical kinase inhibitors.nat biotechnol.2005;23:329
–
36.doi:10.1038/nbt1068.
[0164]
39.villarroel mc,pratz kw,xu l,wright jj,smith bd,rudek1 ma.plasma protein binding of sorafenib,a multi kinase inhibitor:in vitro and in cancer patients.invest new drugs.2012;30:1
–
15.
[0165]
40.davis mi,hunt jp,herrgard s,ciceri p,wodicka lm,pallares g等人,comprehensive analysis of kinase inhibitor selectivity.nat biotechnol.2011;29:1046
–
51.doi:10.1038/nbt.1990.
[0166]
补充数据
[0167][0168]
[0169][0170][0171]
吉非替尼
[0172]
cmaxkd(nm)游离级分[25][19][26]
ꢀꢀꢀ
[0173]
moa:
[0174]
埃罗替尼
[0175]
cmaxkd(nm)游离级分[27][19][27]
[0176]
moa:[28]
[0177]
阿法替尼
[0178]
cmaxkd(nm)游离级分[29][19][30]
[0179]
moa:[31]
[0180]
拉帕替尼
[0181]
cmaxkd(nm)游离级分[32][19][32]
[0182]
moa:[33]
[0183]
达克替尼
[0184][0185]
moa:[35]
[0186]
奥希替尼
[0187]
cmaxkd(nm)游离级分[36][19][36]
[0188]
moa:[23]
[0189]
舒尼替尼
[0190]
cmaxkd(nm)游离级分[37][38][37]
[0191]
索拉非尼
[0192]
cmaxkd(nm)游离级分[39][40][39]
ꢀꢀꢀ
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1