一种抑制单倍体胚胎干细胞二倍化的方法
1.本发明涉及生命科学领域,特别是涉及一种抑制单倍体胚胎干细胞二倍化的方法。
背景技术:
2.单倍体胚胎干细胞由于只含有一套染色体组,且具有干细胞的分化潜能,已经成为功能基因组学和基因工程组学的强力工具。但是单倍体胚胎干细胞在日常培养和分化过程中具有着强烈的自发二倍化趋势,需要不断的流式分选富集单倍体,这极大的限制了单倍体进一步的发展应用。目前,科学家们针对单倍体与二倍体的差异,开发出多种调控策略来抑制单倍体的二倍化现象,但是各种方法均有一定的限制。因此需要开发出更为简单且有效的方法来维持单倍体的比例,进而促进单倍体更为广泛的应用。
技术实现要素:
3.为解决上述技术问题,本发明提出了一种抑制单倍体胚胎干细胞二倍化的方法。本发明通过在单倍体胚胎干细胞中转染外源性的has2基因,实现has2基因的高表达,以达到显著提高单倍体胚胎干细胞的单倍体维持能力的目的。从而在血清培养条件下长时间维持单倍体比例且不需要分选,以便于更好推进单倍体胚胎干细胞的应用。
4.本发明的目的通过以下技术方案实现:一种抑制单倍体胚胎干细胞二倍化的方法,包括如下步骤:步骤一、构建has2基因的表达载体;步骤二、将has2基因的表达载体转染到单倍体胚胎干细胞中,得到待流式分选的细胞;步骤三、自待流式分选的细胞中分选得到has2基因的表达载体转染成功的单倍体胚胎干细胞进行培养。
5.进一步的改进,所述步骤一中的has2基因为小鼠has2基因,所述单倍体胚胎干细胞为小鼠单倍体胚胎干细胞。
6.进一步的改进,所述步骤一包括如下步骤:取表达has2的小鼠细胞总cdna为模版进行pcr,扩增获得has2基因的cds序列,利用overlap pcr方式将has2 cds与t2a egfp片段相连接,电泳验证条带大小后纯化回收,使用bamhi和mlui两种限制性内切酶37℃分别酶切消化扩增片段及pb-cag mcs-pa载体30 min,酶切产物分别纯化回收得到酶切片段和酶切载体,按酶切载体:酶切片段质量比50 ng:150 ng混合,然后利用t4连接酶于16℃反应1 h得到连接产物,连接产物转化至50μl感受态细胞,然后筛选出转化成功的感受态细胞。
7.进一步的改进,所述感受态细胞为大肠杆菌感受态细胞。
8.进一步的改进,所述pb-cag mcs-pa载体的序列如seq id no.1所示。
9.进一步的改进,所述步骤二包括如下步骤:
取转化成功的细胞感受态细胞提取得到 pbase 质粒,采用piggybac转座子系统对长势良好的野生型单倍体胚胎干细胞细胞进行转染,将 pbase 质粒转入野生型单倍体胚胎干细胞,得到待流式分选的细胞。
10.进一步的改进,转染时,2
×
106个细胞电转2μg pbase 质粒和 6μg piggybac has2 oe 质粒;电转仪设置为1400 v,3个脉冲/10 ms。
11.进一步的改进,所述步骤三中,待流式分选的细胞用0.05%的胰蛋白酶消化成单细胞,然后用4μg/ml hoechst 33342 染色,37℃水浴避光孵育15min;细胞筛过滤后用bd facs ariaii进行分选;待流式分选的细胞上机前利用野生型二倍体的胚胎干细胞做为对照,圈定“2n”峰及gfp阴性细胞群体,再将单倍体细胞进行上机,圈定gfp阳性及“1n”峰处的细胞进行分选并继续培养。
12.本发明的有益效果在于:本发明通过在单倍体胚胎干细胞中转染外源性的has2基因,实现has2基因的高表达,以达到显著提高单倍体胚胎干细胞的单倍体维持能力的目的。从而在血清培养条件下长时间维持单倍体比例且不需要分选,以便于更好推进单倍体胚胎干细胞的应用。
附图说明
13.利用附图对本发明做进一步说明,但附图中的内容不构成对本发明的任何限制。
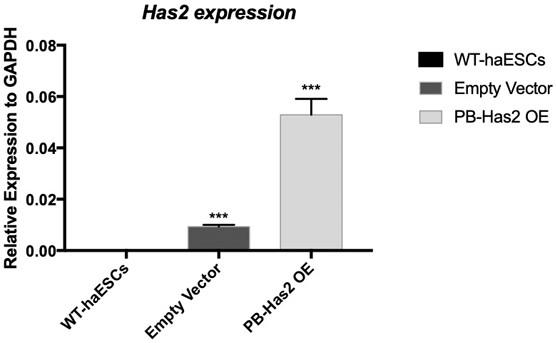
14.图1为载体构建原理图;图2为;转染前野生型细胞生长白光图图3为;转染前野生型细胞绿色荧光图图4为;转染后has2 oe细胞生长白光图图5为;转染后has2 oe细胞绿色荧光图图6为;不同细胞的has2基因表达水平;wt-haescs 野生型单倍体胚胎干细胞;empty vector 转染空载体的单倍体胚胎干细胞;pb-has2 oe 转染pb-has2 oe载体的单倍体胚胎干细胞;图7为;流式分选7天后的野生型单倍体胚胎干细胞中单倍体细胞的比例图8为;流式分选7天后的has2 oe单倍体胚胎干细胞中单倍体细胞的比例图9为;流式分选14天后的野生型单倍体胚胎干细胞中单倍体细胞的比例图10为:流式分选14天后的has2 oe单倍体胚胎干细胞中单倍体细胞的比例
具体实施方式
15.为了使发明的目的、技术方案及优点更加清楚明白,以下结合附图及实例,对本发明进行进一步的详细说明。
16.实施例1材料方法:载体构建取表达has2的小鼠细胞总cdna为模版进行pcr,扩增获得has2基因的cds序列。利用overlap pcr方式将has2 cds与t2a egfp片段相连接,电泳验证条带大小后纯化回收,使用bamhi和mlui两种限制性内切酶37℃同时消化扩增片段及pb-cag mcs-pa载体30 min。酶
切产物再次纯化回收,按载体:片段质量比50 ng:150 ng利用t4连接酶于16℃反应1 h。产物转化至50μg感受态细胞,涂布于lba平板37℃过夜培养。第二天挑取大小合适,边界清晰的单菌落进行菌落pcr验证,挑取条带大小正确的菌株扩大培养,提取质粒并进行测序验证。该过程所用引物信息如下:has2 cds-f:nnnnggatccatgcattgtgagaggtttctatgtgtcchas2 cds-r:gttagcagacttcctctgccctctacatcaagcaccatgtcatactgttgt2a gfp-f:gagggcagaggaagtctgctaacatgcggtgacgtcgaggagaatcctggcccagtgagcaagggcgaggagt2a gfp-r:nnnnacgcgttcacttgtacagctcgtccatgcccolony pcr-f:ctgtaattagctgagcaagaggtaagggcolony pcr-r:gttagcagacttcctctgccctctacatcaagcaccatgtcatactgttg细胞转染用piggybac转座子系统对长势良好的野生型单倍体胚胎干细胞细胞进行转染。2
×
106个细胞电转2μg pbase 质粒和 6μg piggybac has2 oe 质粒。电转仪用为neon (invitrogen),1400 v,3个脉冲,10 ms。
17.流式分析和流式分选待流式分选的细胞用0.05%的胰蛋白酶消化成单细胞,然后用hoechst 33342 (4 μg/ml)染色,37℃水浴避光孵育15min。细胞筛过滤后用bd facs ariaii进行分选。单倍体细胞上机前需要利用野生型二倍体的胚胎干细胞做为对照,圈定“2n”峰及gfp阴性细胞群体。再将单倍体细胞进行上机,圈定gfp阳性及“1n”峰处的细胞进行分选并继续培养。
18.待流式分析的细胞用0.05%的胰蛋白酶消化成单细胞,用75%的乙醇4℃过夜固定。第二天用50 μg /ml的碘化丙啶染色,同时加入2 mg/ml rna酶,37℃水浴避光孵育15min。细胞筛过滤后用bd lsrii sorp进行相关分析。
19.qpcr验证has2表达量取适当野生型单倍体胚胎干细胞(wt-haescs)、转入空载体(empty vector)的单倍体胚胎干细胞及has2 oe的单倍体胚胎干细胞消化为单细胞,离心去上清。细胞沉淀利用1 ml trizol重悬裂解,室温静置5 min,加入0.2 ml氯仿抽提核酸,剧烈震荡15 s,室温静置3 min,于4℃,12000 rpm离心15 min,可见液体分为3层。小心吸取上层水相0.5 ml,等体积加入异丙醇混合均匀,于室温静置10 min。将离心管于4℃,12000 rpm离心10 min,弃上清,肉眼可见管底白色rna沉淀。利用75%乙醇清洗沉淀1次,弃乙醇,晾干后用20 μl depc水定容,nanodrop检测rna含量及质量。取1 μg总rna进行反转录及qpcr验证has2表达量。所用引物如下所示:gapdh qpcr-f:aggtcggtgtgaacggatttggapdh qpcr-r:tgtagaccatgtagttgaggtcahas2 qpcr-f:gttcacaacatgtcacccaattgg
has2 qpcr-r:ccttcaccatctccacagatgagg单倍体维持比例的比较利用流式细胞仪分别分选10000个处于1n峰的野生型单倍体胚胎干细胞及has2 oe的单倍体胚胎干细胞于24孔板中,加入适量培养基于37℃ 5% co2培养箱中培养, 每天更换培养基,2-3天视细胞密度进行传代。在分选后第7、14天取适当细胞进行75%的乙醇固定并分析单倍体细胞比例,实验方法如前所示。发现has2 oe的细胞在体外的长期培养过程中可以更加有效维持单倍体比例。
20.pb-cag mcs-pa载体序列信息如seq id no.1所示。
21.细胞培养:采用一种血清培养方法,体系如下:dmem/f12(gibco)基础培养液,添加10%的kosr(gibco),7%的胎牛血清(bi),1 mm的丙酮酸钠(sigma),0.1 mm的β-巯基乙醇(sigma),100 u/ml的双抗(gibco),1000 u/ml的lif(gibco),3 μm的chir99021(mce)及1 μm的pd0325901(mce)。
22.载体构建原理如图1所示:我们利用piggybac转座子系统进行外源基因的递送,设计为cagp-has2 cds-t2a-egfp-pa的持续表达框。利用cag启动子驱动has2基因和增强型绿色荧光蛋白egfp的表达,其中利用t2a自剪切肽进行连接。
23.细胞系构建:将提取好的无内毒素pb载体和pb酶质粒按3:1的比例对生长状态良好的野生型单倍体胚胎干细胞进行电转染,每106个细胞使用8 μg质粒,经48小时培养后进行流式分选富集gfp阳性的单倍体胚胎干细胞,并进行后续的培养及实验。
24.细胞鉴定:将上述获得的细胞利用trizol法提取总rna,经去除基因组及反转录后利用qpcr验证has2的表达水平,其表达量远高于野生型单倍体胚胎干细胞及空载对照,图6所示。
25.has2 oe细胞单倍体维持比例的比较。将has2过表达成功的细胞系与野生型细胞系经流式分别分选出一万个单倍体细胞在相同条件进行培养。在分选后第7、14天取部分细胞进行单倍体比例的检测。has2过表达的细胞系相较野生型细胞具有更好的维持单倍体比例的能力,其“1n”峰比例明显高于野生型细胞,且“4n”峰比例明显低于野生型细胞。如图7-图10所示。
26.最后应当说明的是,以上实施例仅用于说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当了解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1