磷光主体化合物及包含该化合物的有机发光元件的制作方法
本发明涉及种磷光主体化合物及包含该化合物的有机发光元件。具体来讲,本发明涉及一种有机发光元件,其特征在于,含采用供体-受体-供体(D-A-D)结构来扩大带隙的磷光主体化合物,并通过包含该化合物来呈现蓝色,且具有优秀发光效率。
背景技术:
电致发光元件(electroluminescent device,以下简称“EL元件”)是自发光型显示元件,具有视野广,对比度优秀,响应时间快等优点。
EL元件根据发光层(emitting layer)成型材料,分为无机EL元件和有机EL元件。在此,有机EL元件相较于无机EL元件,不仅亮度、驱动电压以及响应速度等特性优秀,且具有可多色化的优点。
普通的有机EL元件是在基板上部形成阳电极,其阳电极上部依次形成空穴传输层、发光层、电子传输层及阴电极的结构。在此的空穴传输层、发光层及电子传输层是由有机化合物形成的有机薄膜。
具有上述结构的有机EL元件的驱动原理如下:在上述阳电极及阴电极间施加电压,从阳电极注入的空穴经过空穴传输层移动到发光层。一方面,电子从阴电极经过电子传输层注入到发光层,并在发光层区域,载体重新结合生成激子(exiton)。此激子由从激发态转化到基态,从而使发光层的分子发光并形成图像。发光材料根据其发光原理,分为利用一重态激子的荧光材料和利用三重态的磷光材料。磷光材料一般为含有重原子的有机无机化合物结构。由于重原子原本处于禁戒跃迁状态的三重态激子专为容许跃迁状态,从而可以磷光发光。磷光材料可使用75%生成几率的三重态激子,与利用25%一重态激子的荧光材料相比,具有更高的发光效率。
利用磷光材料的发光层是由主体物质,以及从其转移能量来发光的掺质构成,已发布的掺质有利用铱金属化合物的多种材料。关于利用铱化合物的有机发光材料的研究,普林斯顿、南加利福尼亚等大学曾发表过利用铱(Iridium),铂(Platium)金属化合物的多种磷光材料,并正在开发具有更加优秀的发光特性的稳定材料。
对此,本发明人在进行主体物质的研究中,选择供体-受体-供体(D-A-D)结构,采用扩大带隙的设计,其特点是,作为受体中心部的噻吨结构为母核,并在与母核的砜结构相对应的中心原子周围,用1个或2个作为供体的咔唑或咔啉化合物,以对称或非对称结构,将结构内胺和环的烷基或五角至六角环诱导体置换的化合物相结合的情况下,该主体物质设计为具有高三重态能量(ET)并设计成高玻璃转化温度(Tg)和高分子量的非定性物质,阐明此物质可具备寿命长,电泳度高,热稳定性优秀,从而完成了本项发明。
(现有技术文献)
(专利文献1):韩国专利第10-2006-0113935号(电致发光有机元件,公开日期:2006年11月3日)
技术实现要素:
(发明所要解决的课题)
因此,本发明所要实现的技术性课题是提供采用供体-受体-供体(D-A-D)结构并扩大带隙的磷光主体化合物。
并且,本发明所要实现的另一个技术性课题是提供利用供体-受体-供体(D-A-D)结构并扩大能带隙的磷光主体化合物完成的有机发光元件。
(用于解决课题的手段)
为解决上述第1技术性课题,本发明公开下述化学式1所示的磷光主体化合物。上述磷光主体化合物可为蓝色磷光主体化合物。
化学式1
在此,X与Y各自独立,可从咔唑基或咔啉基中选一,上述R1以及R2是各自独立的置换或非置换的官能团,可为氢、氰基、羟基、巯基、卤素原子、置换或非置换的C1-C14的烷基、置换或非置换的C1-C14的烷氧基、置换或非置换的C2-C14的烯基、置换或非置换的C6-C14的芳基、置换或非置换的C6-C14的芳烷基、置换或非置换的C6-C14的芳氧基、置换或非置换的C2-C14的杂芳基、置换或非置换的C2-C14的杂芳烷基、置换或非置换的C2-C14的杂芳氧基、置换或非置换的C5-C14的环烷基、置换或非置换的C2-C14的杂环烷基、置换或非置换的C1-C14的烷羰基、置换或非置换的C7-C30的芳羰基或C1-C14的烷巯基。
为解决上述第2技术性课题,本发明公开一种有机发光元件,其特征在于,包含一双电极间有机膜的有机发光元件,且前述有机膜含可用化学式1所表示的磷光主体化合物。
化学式1
在此,X与Y各自独立,可从咔唑基或咔啉基中选一,上述R1以及R2是各自独立的置换或非置换的官能团,可为氢、氰基、羟基、巯基、卤素原子、置换或非置换的C1-C14的烷基、置换或非置换的C1-C14的烷氧基、置换或非置换的C2-C14的烯基、置换或非置换的C6-C14的芳基、置换或非置换的C6-C14的芳烷基、置换或非置换的C6-C14的芳氧基、置换或非置换的C2-C14的杂芳基、置换或非置换的C2-C14的杂芳烷基、置换或非置换的C2-C14的杂芳氧基、置换或非置换的C5-C14的环烷基、置换或非置换的C2-C14的杂环烷基、置换或非置换的C1-C14的烷羰基、置换或非置换的C7-C30的芳羰基或C1-C14的烷巯基。
(发明的效果)
本发明所涉及的磷光主体化合物采用供体-受体-供体(D-A-D)结构,其能带隙大,作为受体中心部的噻吨(thioxanthene)结构为母核,并在与母核的砜(solfon)结构相对应的中心原子周围,结合作为供体的咔唑或咔啉化合物,提高三重态能量(ET)以及玻璃转化温度(Tg),具有寿命长,高电泳度,热稳定性等特征。
附图说明
图1为根据本发明的实施例所表示的有机发光元件结构的剖面图。
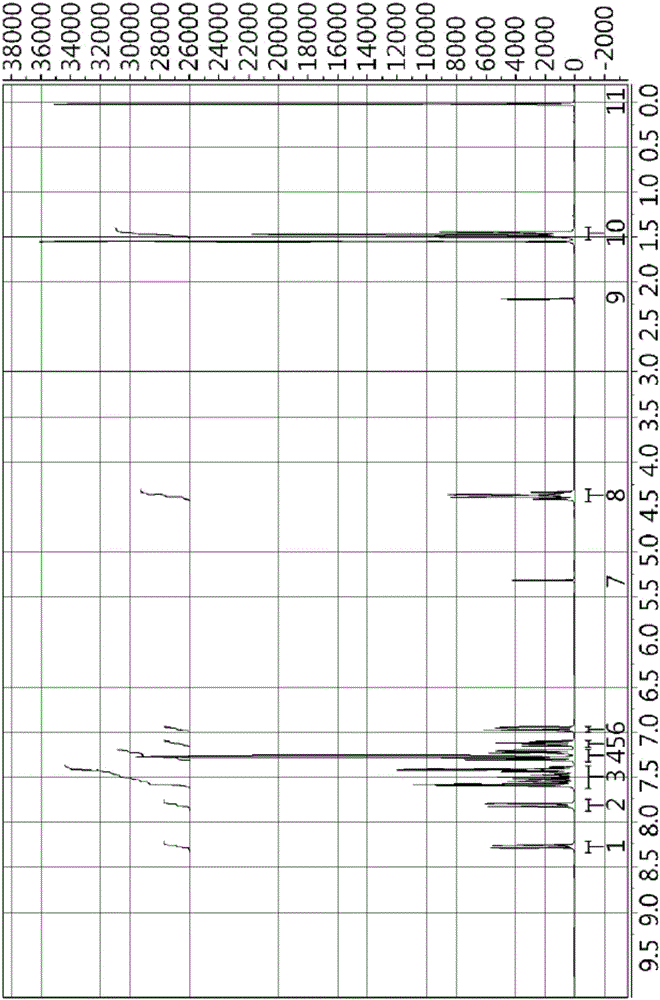
图2为根据本发明的实施例所合成的9,9-双(9-乙基-9H-咔唑-3-基)-9H-噻吨10、10-二氧化物的NMR数据。
具体实施方式
下面,进一步详细说明本发明。
本发明所涉及的磷光主体化合物是为扩大HOMO-LUMO间的带隙,采用并设计为供体-受体-供体(D-A-D)结构;其特征在于,包含作为受体中心部的噻吨结构为母核,在与母核的砜结构相对应的中心原子周围,作为供体的咔唑或咔啉化合物相结合的结构,对应的中心原子周围结合的1个或2个咔唑或咔啉化合物,以对称或非对称结构含结构内胺和环中的烷基或者五角至六角环的诱导体置换的化合物。
具体来讲,本发明所涉及的磷光主体化合物具有如下化学式1所述的结构。
化学式1
在此,X与Y各自独立,可从咔唑基或咔啉基中选一,上述咔啉基可从α-咔啉基、β-咔啉基、γ-咔啉基、δ-咔啉基组成的群选择为当。
并且,上述R1以及R2是各自独立的置换或非置换的官能团,可为氢、氰基、羟基、巯基、卤素原子、置换或非置换的C1-C14的烷基、置换或非置换的C1-C14的烷氧基、置换或非置换的C2-C14的烯基、置换或非置换的C6-C14的芳基、置换或非置换的C6-C14的芳烷基、置换或非置换的C6-C14的芳氧基、置换或非置换的C2-C14的杂芳基、置换或非置换的C2-C14的杂芳烷基、置换或非置换的C2-C14的杂芳氧基、置换或非置换的C5-C14的环烷基、置换或非置换的C2-C14的杂环烷基、置换或非置换的C1-C14的烷羰基、置换或非置换的C7-C30的芳羰基或C1-C14的烷巯基。
本发明所涉及的上述化学式1的代表性化合物,X以及Y分别以咔唑基、α-咔啉基、β-咔啉基、γ-咔啉基、或者δ-咔啉基的如下述化学式2至6所表示。
化学式2
化学式3
化学式4
化学式5
化学式6
上述化学式2至6中,R1至R6为各自独立置换或非置换的官能团,可为氢、氰基、羟基、巯基、卤素原子、置换或非置换的C1-C14的烷基、置换或非置换的C1-C14的烷氧基、置换或非置换的C2-C14的烯基、置换或非置换的C6-C14的芳基、置换或非置换的C6-C14的芳烷基、置换或非置换的C6-C14的芳氧基、置换或非置换的C2-C14的杂芳基、置换或非置换的C2-C14的杂芳烷基、置换或非置换的C2-C14的杂芳氧基、置换或非置换的C5-C14的环烷基、置换或非置换的C2-C14的杂环烷基、置换或非置换的C2-C14的烷羰基、置换或非置换的C7-C14的芳羰基、置换或非置换的C1-C14的烷巯基、并且上述R1至R6的官能团中相邻的基可互相结合并形成基链。
本发明所涉及的上述化学式1或化学式6的化合物,可如下化学式7至11表示为当。
化学式7
化学式8
化学式9
化学式10
化学式11
上述化学式中,“非置换的烷基”或“非置换的烷氧基”是指其烷部分的碳原子数1至14个的烷(例如:甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一基、十二基、十三基、十四基、十五基等等以及其同素异形体),“置换的烷基”或“置换的烷氧基”是指上述非置换的烷部分的氢原子中至少有1个原子被卤素原子,羟基、硝基、氰基、氨基、脒基、肼、腙、羧基或者其盐、C1-C14的烷基、C2-C14的烯基、C6-C14的炔基、C6-C14的芳基、C7-C14的芳烷基、C2-C14的杂芳基,或者C3-C14的杂烷基所置换。
并且,“非置换的烯基”是指其中化学键至少1个以上的碳原子数2至14的烯(例如:乙烯、丙烯、丁烯、戊烯、己烯、等等以及其同素异形体),“置换的烯基”是指上述非置换的烯基中至少有1个氢原子如上述烷基相同的置换基所置换。
“非置换的芳基”可单独或组合利用,是指包含1个以上的环的碳源字数6至14的芳香族碳环,上述环可利用液滴方法来附着或融合。“置换的芳基”是指非置换的芳基中至少有1个氢原子如上述烷基相同的置换基所置换。
“非置换的芳烷基”是指如上述所定义的芳基中一部分氢原子被低级烷基,例如:甲基、乙基、丙基等群所置换。“置换的芳烷基”是指上述非置换的芳烷基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的芳氧基”是指如上述所定义的芳基中的氢原子被置换,例如:苯氧基、萘氧基、二苯氧基。“置换的芳氧基”是指上述非置换的烷氧基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的杂芳基”是指包含N、O、P或S中选择的1、2或者3的杂原子,剩余环原子为C的环原子数2至14的1价单环或非环芳香族2价有机化合物,其具体例有,噻吩基、吡啶基、呋喃基等。“置换的杂芳基”是指上述非置换的杂芳基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的杂芳烷基”是指上述杂芳基的一部分氢原子被低级烷基所置换,“置换的杂芳烷基”是指上述非置换的杂芳基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的杂芳氧基”是指如上述所定义的杂芳基的氢原子相结合。“置换的杂芳氧基”是指上述非置换的杂芳氧基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的环烷基”是指碳原子数4至14个的1价单环,具体包含环己基、戊基等。“置换的环烷基”是指上述非置换的环烷基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的杂环烷基”是指包含N、O、P或S中选择的1、2或者3的杂原子,剩余环原子为C的环原子数1至30的1价单环,上述环烷基中的一部分氢原子被低级烷基所置换。“置换的杂环烷基”是指上述非置换的杂环烷基中1个以上的氢原子如上述烷基相同的置换基所置换。
“非置换的烷羰基”的具体例,有乙酰基、乙基羰基、异丙基羰基、苯羰基、萘羰基、二苯羰基、环己基羰基等,“置换的烷羰基”是指非置换的烷羰基中至少有1个氢原子如上述烷基相同的置换基所置换。
“非置换的芳羰基”的具体例,有苯羰基、萘羰基、二苯羰基等,“置换的芳羰基”是指非置换的芳羰基中至少有1个氢原子如上述烷基相同的置换基所置换。
本发明所涉及的上述化学式1所表示的磷光主体化合物是采用1个分子内有带隙差异的供体-受体-供体(D-A-D)结构,带隙达到3.0Ev以上,因此能量传递优秀,从而可显示出高发光效率。
下面,对利用本发明所涉及的磷光主体化合物的有机发光元件结构及其制作方法进行说明。
本发明所涉及的有机发光元件,可采用常见发光元件结构,根据需求可变更结构。一般来讲,有机发光元件具有包含第1电极(阳电极)和第2电极(阴电极)间的有机膜(发光层)的结构,根据需求,可追加空穴注入层、空穴传输层、空穴抑制层、电子注入层或电子传输层。为说明本发明的发光元件结构附图1。
如图1所示,本发明所涉及的有机发光元件具有阳电极(20)和阴电极(80)间的发光层(50)的结构,在阳电极(20)和发光层(50)间包含空穴注入层(30)和空穴传输层(40),并在发光层(50)和阴电极(80)间包含电子传输层(50)与电子注入层(70)。
一方面,根据本发明实施例的图1中,有机发光元件通过如下工序制造。在此,其仅仅为一个举例,并非受限于此方法。
首先,基板(10)上部涂抹阳电极用物质形成阳电极(20)。在此,基板(10)可使用在此领域普遍使用的基板,尤其优选透明性、表面平滑性、易处理性及防水性优秀的游离基板或透明塑料基板。并且,上述基板上形成的阳电极用物质虽可使用透明且传导性优秀的氧化铟锡(ITO)、氧化锡(SnO2)、氧化锌(ZnO)等,但并非局限于此。
在上述阳电极(20)上部可选择性的形成空穴注入层(HIL)(30)。此时,空穴注入层采用真空蒸镀法或旋涂法等通常方法来形成。对于空穴注入层形成物质,没有特别的限制,可使用CuPc(酞菁铜)或IDE406(Idemitsu Kosan公司产)。
接下来,在上述空穴注入层(30)上部通过真空蒸镀法或旋涂法等通常方法来形成空穴传输层(HTL)(40)。对于上述空穴传输层用物质,没有特别的限制,可使用N,N′-二苯基-N、N′-双(1-萘基)-1,1′-联苯基-4,4′-二胺(NPB)、N,N′-双(3-甲基苯)-N,N′-二苯基-[1,1-二苯基]-4,4′-二胺(TPD)、N,N′-二(萘-1-基)-N,N′-二苯基联苯胺、N,N′-二(萘-1-基)-N,N′-二苯基:α-NPD等。
接下来,在空穴传输层(40)上部形成发光层(EML)(50)。上述发光层形成材料可包含本发明所涉及的磷光主体化合物中选1种以上的发光主体物质,可具有单层或2层以上的多层结构。此时,单独包含化学式1的化合物或混合包含该领域所周知的其他化合物。例如,蓝色发光掺质(FIrppy或FIrpic等的铱化合物)等。基于发光层的组成物质总重量,上述发光层的磷光主体化合物的含量可在1至95重量份的范围内。
上述磷光主体化合物可通过真空蒸镀法形成,并且可通过旋涂法等湿法施工来蒸镀,也可利用激光感应热成像法(LITI)。
在上述发光层(50)上可选择性的形成旨在防止发光物质中形成的激子移动到电子传输层或防止空穴移动到电子传输层(60)的空穴阻挡层(HBL)。关于空穴阻挡层形成物质,没有特别的限制,可使用邻菲啰啉类化合物(例如,BCP)等,并可通过真空蒸镀法或旋涂法等方法形成。
此外,在发光层(50)上可形成电子传输层(ETL)(60),并可利用真空蒸镀法或旋涂法。关于电子传输层形成材料,没有特别的限制,可使用TBPI、铝化合物(例如,ALq3(三(8-羟基喹啉)铝)。
上述电子传输层(60)上部的电子注入层(EIL)(70)可利用真空蒸镀法或旋涂法等方法形成,对于电子注入层(70)形成材料,没有特别的限制,可利用LiF、NaCl、CsF等物质。
接下来,电子注入层(70)上部的阴电极(80)通过真空蒸镀方式来形成,从而完成发光元件。在此,作为阴电极用金属可选锂(Li)、鎂(Mg)、铝(Al)、铝-锂(Al-Li)、钙(Ca)、鎂-铟(Mg-In)鎂-银(Mg-Ag)。
同时,本发明所涉及的有机发光元件具有如图1所示的叠层结构,根据需求可形成1层或2层的中间层,例如,可追加形成空穴阻挡层等。并且发光元件的各层的厚度可在该领域通常范围内,根据需求来决定。
将通过实施例对本发明点予以详细说明,但本发明不受限于下述实施例。
合成例1
9H-噻吨-9-酮10,10-二氧化物的合成
将噻吨-9-酮(Thioxanthen-9-one)10g(47mmol)放进冰醋酸200ml并搅拌30分钟,之后加入H2O2 1.8g(53mmol)回流2小时。确认反应结束后在常温搅拌2小时,过滤产生的沉淀,用n-核苷酸清洗后干燥,获得目的化合物的9H-噻吨-9-酮10,10-二氧化物8.6g(收率75%)。
9,9-双(9-乙基-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物的合成
上述合成的9H-噻吨-9-酮10,10-二氧化物8g(32.75mmol)和9-乙基-9H-咔唑19.18g(98.25mmol)在氮环境下放进反应口并加热80℃。之后,将五氧化二磷23.24g(163.75mmol)溶解在甲磺酸277g的溶液经1个小时慢慢添加到反应溶液并反应24小时。确认反应结束后在常温加入600ml的MeOH并搅拌1小时,过滤生成的沉淀,用MeOH清洗后干燥。获得的固体物中加入丙酮300ml,回流1小时后在常温再搅拌1小时,过滤并用丙酮清洗后再过滤。获得的固体物与二氯甲烷和石油醚1:1混合溶液作为溶离液进行柱色谱分离,获得9,9-双(9-乙基-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物10.9g(收率54%)。关于上述获得的化合物的NMR数据如图2所示。
上述NMR数据具有1至11的峰值,1号峰值有8.29、8.27、8.26,2号峰值有7.81、7.73,3号至6号峰值有6.95、6.96、6.98、6.99、7.13、7.21、7.24、7.24、7.28、7.29、7.32、7.42、7.42、7.44、7.45、7.51、7.56、7.58、7.59、7.60,7号峰值有5.32,8号峰值有4.34、4.37、4.39、4.42,9号峰值有2.19,10号峰值有1.45、1.48、1.50、1.56,11号峰值有0.03。
合成例2
9,9-双(5-乙基-5H-吡啶[3,2-b]吲哚-8-基)-9H-噻吨10,10-二氧化物的合成
将9H-噻吨-9-酮10,10-二氧化物10g(40.94mmol)和5-乙基-5H-吡啶[3,2-b]吲哚24.1g(122.8mmol)在氮环境下全部加到反应口并加热90℃。之后,将五氧化二磷29g(0.205mmol)溶解在甲磺酸345g的溶液经1个小时慢慢加到反应溶液并反应36小时。确认反应结束后在常温加入700ml的MeOH并搅拌1小时,过滤生成的沉淀,用MeOH清洗后干燥。获得的固体物中加入丙酮400ml,回流1小时后在常温再搅拌1小时,过滤并用丙酮清洗后再过滤。获得的固体物与二氯甲烷和石油醚1:2混合溶液作为溶离液进行柱色谱分离,获得9,9-双(5-乙基-5H-吡啶[3,2-b]吲哚-8-基)-9H-噻吨10,10-二氧化物12.73g(收率50.3%)。
合成例3
9,9-双(9-(2-乙基己基)-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物的合成
将9H-噻吨-9-酮10,10-二氧化物5g(20.47mmol)和9-(2-乙基己基)-9H-咔唑17.16g(61.41mmol)在氮环境下全部加到反应口并加热80℃。之后,将五氧化二磷14.5g(0.102mmol)溶解在甲磺酸173g的溶液经1小时慢慢加到反应溶液并反应18小时。确认反应结束后在常温加入500ml的MeOH并搅拌1小时,过滤生成的沉淀,用MeOH清洗后干燥。获得的固体物中加入丙酮300ml,回流1小时后在常温再搅拌1小时,过滤并用丙酮清洗后再过滤。获得的固体物与二氯甲烷和石油醚1:1混合溶液作为溶离液进行柱色谱分离,获得9,9-双(9-(2-乙基己基)-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物9g(收率56%)。
合成例4
9,9-双(7-乙基-7H-苯并[c]咔唑-10-基)-9H-噻吨10,10-二氧化物的合成
将9H-噻吨-9-酮10,10-二氧化物10g(40.94mmol)和7-乙基-7H-苯并[c]咔唑30.13g(122.8mmol)在氮环境下全部加到反应口并加热100℃。之后,将五氧化二磷29g(0.205mmol)溶解在甲磺酸345g的溶液经1个小时慢慢加到反应溶液并反应20小时。确认反应结束后在常温加入900ml的MeOH并搅拌1小时,过滤生成的沉淀,用MeOH清洗后干燥。获得的固体物中加入丙酮700ml,回流1小时后在常温再搅拌1小时,过滤并用丙酮清洗后再过滤。获得的固体物与二氯甲烷和石油醚1:3混合溶液作为溶离液进行柱色谱分离,获得9,9-双(7-乙基-7H-苯并[c]咔唑-10-基)-9H-噻吨10,10-二氧化物13.5g(收率46.1%)。
合成例5
9-(7-乙基-7H-苯并[c]咔唑-10-基)-9-(9-乙基-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物的合成
将9H-噻吨-9-酮10,10-二氧化物8g(32.75mmol)和9-乙基-9H-咔唑9.6g(49.13mmol)和7-乙基-7H-苯并[c]咔唑12.05g(49.13mmol)在氮环境下全部加到反应口并加热90℃。之后,将五氧化二磷23.24g(163.75mmol)溶解在甲磺酸277g的溶液经1小时慢慢加到反应溶液并反应24小时。确认反应结束后在常温加入800ml的MeOH并搅拌1小时,过滤生成的沉淀,用MeOH清洗后干燥。获得的固体物中加入丙酮500ml,回流1小时后在常温再搅拌1小时,过滤并用丙酮清洗后再过滤。获得的固体物与二氯甲烷和石油醚1:2混合溶液作为溶离液进行柱色谱分离并如合成例1的方法处理,获得9-(7-乙基-7H-苯并[c]咔唑-10-基)-9-(9-乙基-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物8.3g(收率38%)。
实验例1
关于上述合成例1所制作的9,9-双(9-乙基-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物,进行了物性评价,其结果如表1所示。
表1
[Table 1]
UVmax:从谱仪以及循环伏安法测量的物质的吸收波长
PLmax:从谱仪以及循环伏安法测量的物质的发光波长
HOMO,LUMO,带隙:从谱仪以及循环伏安法测量的物质的电学特性(若为蓝色,应具备带隙>3.0eV的宽带隙(wide band gab))
T1:从谱仪以及循环伏安法测量的物质的三重态能量(Triplet energy)(在77K下可通过磷光测量确认)
TID:物质的降解温度(可通过TGA确认)
Tm:熔点(melting point)
Tg:玻璃转化温度
本发明所合成的合成例1的主体物质的三重态能量(T1)比掺质(例如:合铱)的三重态能量(2.7eV)具有更高的值,可有效实现能量转移,并且,Tg达到170℃以上,具有热稳定性。
实施例1
ITO基板以发光面积3mm×3mm大小裁定后清洗。将基板装载到真空容器并将基础压力调至1×10-6torr,之后在阳电极ITO上面形成40nm厚度的NPB膜以作为空穴传输层,在其上面再以20nm的厚度和11%的掺质掺杂浓度,用上述合成例1所制作的9,9-双(9-乙基-9H-咔唑-3-基)-9H-噻吨10,10-二氧化物和掺质[FCNIr]膜。然后,在发光层上部真空蒸镀TPBI,形成50nm厚度的电子传输层,用LiF以1.0nm的厚度形成薄膜作为电子注入层,利用Al以500nm的厚度形成薄膜作为阴电极,从而完成有机发光元件的制造。然后进行有关发光特性的评价,其结果如表2所示。
实施例2
与上述实施例1相同的工序条件下,只将发光层主体替代为在合成例2所制作的9,9-双(5-乙基-5H-吡啶[3,2-b]吲哚-8-基)-9H-噻吨10,10-二氧化物后制作有机发光元件,且同样进行发光特性评价,其结果如表2所示。
比较例1
与上述实施例1相同的工序条件下,只将发光层主体替代为mCP(1,3-双(N-咔唑基)苯)物质后制作有机发光元件,且同样进行发光特性评价,其结果如表2所示。
表2
[Table 2]
【符号说明】
10:基板
20:阳电极
30:空穴注入层
40:空穴传输层
50:发光层
60:电子传输层
70:电子注入层
80:阴电极
- 还没有人留言评论。精彩留言会获得点赞!