一种凹凸棒石/Fe3O4/碳复合材料的制备及应用的制作方法
本发明属于重金属废水处理技术领域,具体涉及一种凹凸棒石/fe3o4/碳纳米复合材料的制备方法,本发明还涉及利用上述制备的凹凸棒石/fe3o4/碳纳米复合材料吸附去除水中cr(ⅵ)的应用。
背景技术:
重金属铬是我国优先控制的污染物之一,主要来源于电镀、冶金、制革、印染和化工等行业排放的三废。铬在水体中主要以cr(ⅲ)和两种形态存在,其中cr(ⅵ)是一种急性致癌物质,迁移性和毒性远高于cr(ⅲ),且更易为人体吸收而在体内蓄积。目前,含铬废水的主要处理方法有化学沉淀法、溶剂提取法、反渗透法、还原法和吸附法等。由于吸附法具有操作简单、成本较低、处理效果好等优点,已被广泛用于处理含铬废水。
凹凸棒石是一种具有链层状结构的含水富镁硅酸盐的粘土矿物,具有较大的比表面积、化学活性和良好的吸附性能,已被应用于水处理领域。但是由于凹凸棒石的结构特点导致对水中cr(ⅵ)吸附性能较差。因此,需要对凹凸棒石进行改性以提高对水中cr(ⅵ)的吸附能力。目前,凹凸棒石的改性方法有高温改性、酸改性、有机改性等。这些改性方法存在方法繁琐、成本较高、吸附性能仍较小等缺点。
近年来有学者采用水热碳化法对凹凸棒石进行有机改性,从而提高凹凸棒石的吸附性能。以葡萄糖为生物质碳源,有机改性后的凹凸棒石表面富含丰富的羟基、羧基、酮基、酯基等活性基团,对水中cr(ⅵ)具有较强的吸附性能(langmui,2011,27,8998-9004);壳聚糖作为一种资源丰富的天然高分子聚合物,具有生物相融性、环境友好性等特点,且分子链上含丰富的羟基、氨基等,有学者以壳聚糖为生物质碳源对凹凸棒石进行有机改性,改性产物对水中cr(ⅵ)的吸附性能高于葡萄糖碳化改性产物。但是上述都存在吸附后难以固液分离,限值其在工业化方面的应用。
磁分离法因操作简单、能耗低、不易产生二次污染等优点而备受关注。若将具有磁性的γ-fe2o3或fe3o4引入到凹凸棒石/碳纳米复合材料中,则可以解决该吸附剂吸附后的分离问题。有学者以廉价的天然纳米材料凹凸棒石黏土和废活性白土为原材料,通过铁盐水解和氢气气氛下程序升温煅烧使废活性白土中有机质热裂解碳化的方法,在凹凸棒石表面负载纳米磁性铁氧化物(γ-fe2o3)和碳,制备廉价的凹凸棒石/γ-fe2o3/碳纳米复合材料(硅酸盐学报,2009,34(4):548-553)。虽然凹凸棒石/γ-fe2o3/碳纳米复合材料具有一定的磁性,但是该复合材料的制备过程较为复杂,实验条件要求较高。
以硫酸亚铁铵、葡萄糖和凹凸棒石为原料,采用一步水热法制备了凹凸棒石/fe3o4/碳纳米复合材料(碳素技术,2014,33(1):23-38)。反应方程式如下:
fe2++2oh-→fe(oh)2(1)
3fe(oh)2+0.5o2→fe(oh)2+2feooh+2h2o(2)
fe(oh)2+feooh→fe3o4+h2o(3)
当加入氨水时,发生式(1)反应。由于反应开始前,原料是在空气下搅拌的,所以发生式(2)反应。当转移到高压反应釜中,发生式(3)反应,生成fe3o4颗粒负载在凹凸棒石表面。该方法的优点是制备步骤较少,但是式(2)反应难以控制,这是由于氢氧化亚铁易被空气氧化成氢氧化铁沉淀,在水热反应釜中是不能生成fe3o4颗粒。
技术实现要素:
为克服现有技术的不足,本发明要解决的技术问题是提供一种制备步骤简单、能耗较低和易于控制的凹凸棒石/fe3o4/碳纳米复合材料的制备方法,以期利用该制备出的纳米复合材料实现对水中cr(ⅵ)的吸附去除。
本发明的技术问题是通过以下技术方案予以实现的。
所述凹凸棒石/fe3o4/碳纳米复合材料是通过以下步骤予以制备的:
1)将1.0g六水合三氯化铁和0.5g凹凸棒石粘土加入到乙二醇中,在磁力搅拌条件下加入壳聚糖粉末,得到淡黄色粘稠液体;
所述的六水合三氯化铁和壳聚糖粉末的质量比为1:0.3~4.5。
2)在步骤1)得到的淡黄色粘稠液中加入3.0g无水醋酸钠粉末,并不断搅拌30min,得悬浮液;
3)将步骤2)处理得到的悬浮液转移至100ml聚四氟乙烯反应釜中(装填度≤80%),180℃水热条件下反应12~48h。
4)反应结束自然冷却后磁分离,用无水乙醇和蒸馏水各洗涤3~4次,得到的黑色产物经烘干、研磨、过筛,即得凹凸棒石/fe3o4/碳纳米复合材料。
上述制备得到的凹凸棒石/fe3o4/碳纳米复合材料可以在吸附去除水中cr(ⅵ)中加以应用。
作为一种优化,上述应用的条件是:在298k下,固液质量比为5:4,溶液ph为2~8。
作为进一步的优化,上述溶液的ph=2。
本发明科学原理:
本发明采用水热法一步制备出凹凸棒石/fe3o4/碳纳米复合材料。以凹凸棒石、铁盐和壳聚糖为原料,在水热反应釜中还原性溶剂乙二醇将部分三价铁还原成二价铁,在碱性条件下反应生成磁性fe3o4在凹凸棒石表面成核和生长,壳聚糖碳化为无定型碳负载在凹凸棒石表面,最终形成磁性纳米复合材料。该纳米复合材料表面富含含氧基团和氨基等活性基团,可用于水体中cr(ⅵ)吸附去除;具有一定的磁性,在外加磁场的条件下可实现快速分离,解决了凹凸棒石/碳纳米复合材料吸附后难以分离的问题。本发明制备过程中发生的具体反应方程式如下:
式(2)中atp为凹凸棒石,atp/fe3o4/c为凹凸棒石/fe3o4/c纳米复合材料。
与其他同类发明相比,本发明具有如下优点:
1)采用溶剂热法。本发明采用溶剂热法一步制备出凹凸棒石/fe3o4/c纳米复合材料。该方法制备工艺简单、能耗相对较低、易控制易操作。
2)具有优良的磁学性能。本发明制备的纳米复合材料具有优异的磁学性能,在外部磁场的作用下,能在较短的时间内快速实现固液分离。
3)吸附容量大。本发明提供的吸附剂表面富含oh、cooh和nh2等活性基团,对六价铬具有较强的吸附能力。在298k、ph=2和固液质量比=5/4的条件下,该吸附剂的最大理论吸附量为250mg/g。
4)价格低廉,用途广泛。该复合材料是一种新型的环境净化材料,能被广泛应用于含有重金属离子、有机污染物的生活污水和工业废水的处理。
附图说明
图1是本发明实施例2中制备的磁性凹凸棒石的红外光谱(ftir)图(atp为凹凸棒石,matp@c为凹凸棒石/fe3o4/c纳米复合材料)。
由图1可知,matp@c不仅出现凹凸棒石的特征吸收峰,另发现数个不同峰,在3425cm-1处为o-h和n-h的伸缩振动吸收峰,2929和2882cm-1处为>ch2和-ch3中c-h的伸缩振动吸收峰,1620cm-1处的宽峰为n-h的弯曲振动吸收峰和水热碳化后生成的c=c,1442cm-1处为壳聚糖碳化后形成的c=o吸收峰,以及磁铁矿的特征吸收峰(578cm-1对应的fe-o振动峰)。
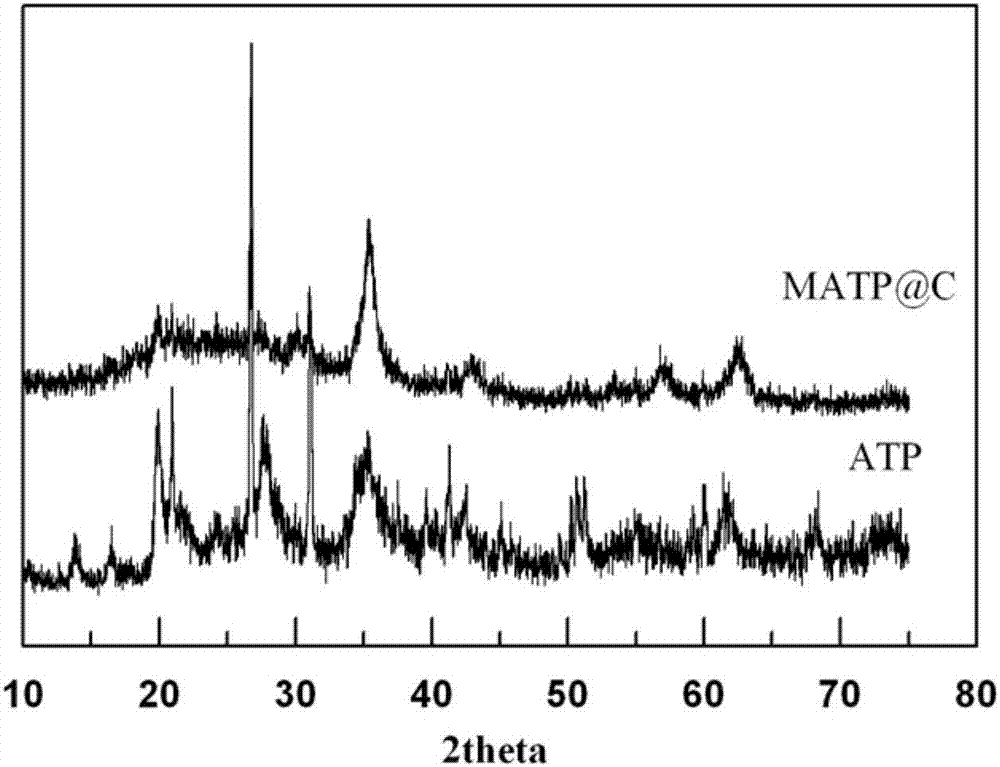
图2是本发明实施例2制备的磁性凹凸棒石的x射线衍射(xrd)图(atp为凹凸棒石,matp@c为凹凸棒石/fe3o4/c纳米复合材料)。
由图2可知,凹凸棒石的特征衍射峰在2θ=8.3°,13.6°,19.8°,27.3°,这和标准卡片完全一致。凹凸棒石/fe3o4/c纳米复合材料不仅有凹凸棒石的特征衍射峰,还有磁铁矿的特征衍射峰(30.2°,35.5,43.2,53.4,57.3)。表明凹凸棒石表面负载磁铁矿颗粒。
图3是本发明实施例2制备的磁性凹凸棒石的磁滞回线图(vsm)。
由图3可知,本发明磁性凹凸棒石具有一定的磁性,能用磁铁进行快速分离。
具体实施方式
下面通过实例,对本发明作进一步详细的描述,但本发明不局限于下述实施例。
实施例1
1)将1.0g六水合三氯化铁和0.5g凹凸棒石加入到70ml乙二醇中,强烈搅拌后加入0.3g壳聚糖粉末,超声分散30min后得到淡黄色粘稠液体;
2)在步骤1)处理得到的粘稠液体中加入3.0g无水醋酸钠粉末,并不断搅拌30min;
3)将步骤2)处理得到的悬浮溶液转移至100ml聚四氟乙烯反应釜中(装填度≤80%),180℃水热条件下反应24h;
4)自然冷却后磁分离,用无水乙醇和蒸馏水各洗涤3~4次,得到的黑色产物放入到电热鼓风干燥箱中60℃烘干、研磨过筛,即得凹凸棒石/fe3o4/c纳米复合材料;
5)称取0.05g实例1中制备的磁性纳米复合材料,加入到40mlk2cr2o7溶液中(ph=2,300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度,计算得到cr(ⅵ)去除率为25.4%。
实施例2
1)同实施例1,所不同的是在磁性纳米复合材料制备过程中添加的壳聚糖为1.5g;
2)称取0.05g步骤1)中制备的吸附剂,加入到40mlk2cr2o7溶液中(ph=2,300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度,计算得到cr(ⅵ)去除率为82.9%。
实施例3
1)同实施例1,所不同的是在磁性纳米复合材料制备过程中添加的壳聚糖为3.0g;
2)称取0.05g步骤1)中制备的吸附剂,加入到40mlk2cr2o7溶液中(ph=2,300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度,计算得到cr(ⅵ)去除率为93.4%。
实施例4
1)同实施例1,所不同的是在磁性碳微球制备过程中添加的壳聚糖为4.5g;
2)称取0.05g步骤1)中制备的吸附剂,加入到40mlk2cr2o7溶液中(ph=2,300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度,计算得到cr(ⅵ)去除率为95.0%。
实施例5
1)同实施例3,所不同的是水热反应时间为12h;
2)称取0.05g步骤1)中制备的吸附剂,加入到40mlk2cr2o7溶液中(ph=2,300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度,计算得到cr(ⅵ)去除率为85.6%。
实施例6
1)同实施例3,所不同的是水热反应时间为48h;
2)称取0.05g步骤1)中制备的吸附剂,加入到40mlk2cr2o7溶液中(ph=2,300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度,计算得到cr(ⅵ)去除率为94.8%。
实施例7
称取0.05g实施例3中制备的吸附剂,加入到40mlk2cr2o7溶液中(300mg/l),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)浓度。当吸附溶液ph=2,cr(ⅵ)去除率为93.4%;当吸附溶液ph=3,cr(ⅵ)去除率为21.5%;吸附溶液ph=4,cr(ⅵ)去除率为16.4%;吸附溶液ph=5,cr(ⅵ)去除率为14.7%;吸附溶液ph=6,cr(ⅵ)去除率为13.6%。
由此可知,实施例3制备的磁性纳米复合材料对水体中cr(ⅵ)的吸附量随着ph的升高而逐渐减小。
实施例8
称取若干份0.050g实施例3中制备的吸附剂,分别加入到20ml重铬酸钾溶液中(ph=2,300mg/l),在298k时振荡,在预先设定时间点取样,磁分离后测定上清液中cr(ⅵ)剩余浓度,计算结果列于表1中。
表1吸附动力学
由表1可知,本发明提供的吸附剂对cr(ⅵ)吸附速率较快,在吸附1h后去除率接近90%。
实施例9
称取若干份0.050g实施例3中制备的吸附剂,分别加入到40ml不同浓度(100~600mg/l)重铬酸钾溶液中(ph=2),在298k时振荡至吸附平衡,磁分离后测定上清液中cr(ⅵ)剩余浓度,计算结果列于表2中。
表2吸附等温线
对表2数据进行f和l型线性拟合,结果符合l型吸附。根据l型方程计算理论最大吸附量为250mg/g。
以上所述是本发明的优选实施方案,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!