利用纳米细孔的目标检测的制作方法
纳米级与微米级颗粒(例如循环肿瘤细胞、细菌与病毒)的检测具有广泛的临床应用。目前可用的方法包括免疫组织化学法和基于核酸的检测法,并且在可以进行灵敏的检测之前通常需要进行细胞增殖。
分子检测和定量也是重要的,且可以根据分子类型使用不同的方法进行。例如,核苷酸序列可以借助其与探针或引物的序列互补性通过杂交和/或扩增,或者在少数情况下,利用识别该序列的蛋白质来检测。另一方面,蛋白质通常通过特异性地识别和结合该蛋白质的抗体来检测。在这一点上,酶联免疫吸附分析(ELISA)高度商业化并且广泛使用。
也存在用于检测或者定量其它的各种不同大分子或小分子的方法,例如碳水化合物、化学化合物、离子和元素。
对于分子和颗粒(例如肿瘤细胞和病原生物体)的检测高灵敏的方法和系统具有广泛应用,尤其是在临床上用于例如病原体检测和疾病诊断。另外,此类检测可以:允许个性化的医疗和健康计划;有利于有效药物化合物和生物疗法的搜索;使得临床医生能够鉴定由病人身体产生的异常激素、离子、蛋白质或者其它分子和/或鉴定被摄入或者注射到病人体内的毒物、非法药物或其它有害化学物质的存在。
目前可用于检测分子和颗粒的技术通常是昂贵的、费力的、高技能要求的和/或费时的。存在着对于改进的检测技术的需要,其快速、便宜和方便地得到准确结果。
技术实现要素:
本文所公开的各个方面可以满足上述一个或多个需求。本文所描述的系统和方法各自具有几个方面,其中没有单一的一个方面单独地负责其所需的特性。非是限制通过以下权利要求表达的本公开的范围,现在将简要讨论一些更突出的特征。在考虑此论述后,特别是在阅读标题为“详细描述”的部分后,将了解本文所描述的样本特征是如何提供改进的系统和方法的。
在一个实施方式中,本公开提供了一种用于测定样品中是否存在目标分子或颗粒的方法,所述方法包括:(a)将样品接触(i)包含能够结合目标分子或颗粒的配体和一个结合结构域的融合分子,和(ii)包含融合分子的结合结构域能够与其结合的至少一个结合基序的聚合物支架,该接触在允许目标分子或颗粒结合配体且结合结构域结合结合基序的条件下进行;(b)将聚合物加载到一装置中,该装置包括将其内部空间分成两个容积的细孔,且该装置配置为使聚合物通过该细孔从一个容积到另一个容积,其中该装置包括配置为识别通过细孔的物体的传感器;以及(c)利用传感器确定与结合基序结合的融合分子是否与目标分子或颗粒结合,从而检测样品中目标分子或颗粒的存在或不存在。
在一些方面,所述目标分子选自蛋白质、肽、核酸、化学化合物、脂质、受体、离子和元素。
在一些方面,所述目标颗粒选自蛋白质复合体和蛋白质聚集体、肽聚集体、蛋白质/核酸复合体、片段化的或完全组装的病毒、细菌、细胞和细胞聚集体。
在一些方面,所述用于测定样品中是否存在目标分子或颗粒的方法的步骤(a)先于步骤(b)执行。在一些方面,步骤(b)先于步骤(a)执行。
在一些方面,所述方法进一步包括施加疑似改变目标分子或颗粒与配体之间的结合的条件,并再次进行确定。在一些方面,所述条件选自移除样品中的目标分子或颗粒、添加与目标分子或颗粒或者配体竞争结合的试剂及改变pH值、盐浓度或温度。
在一些方面,结合基序包含用于结合结合结构域的化学修饰。在一些方面,所述化学修饰选自乙酰化、甲基化、小泛素样修饰蛋白化(summolation)、糖基化、磷酸化和氧化。
在一些方面,所述聚合物包括脱氧核糖核酸(DNA)、核糖核酸(RNA)、肽核酸(PNA)、DNA/RNA杂合体或者多肽。在一些方面,所述聚合物为合成支架。
在一些方面,所述结合结构域选自螺旋-转角-螺旋、锌指结构、亮氨酸拉链、翼状螺旋、翼状螺旋-转角-螺旋、螺旋-环-螺旋和HGM-盒。
在一些方面,所述结合结构域选自锁核酸(LNA)、肽核酸(PNA)、转录激活因子样效应物核酸酶(TALEN)、成簇的规律间隔短回文重复序列(CRISPR)、肽、树状聚合物和适体(DNA和/或蛋白质)。
在一些方面,所述配体是蛋白质。在一些方面,配体选自抗体、抗体片段、表位、激素、神经递质、细胞因子、生长因子、细胞识别分子、核酸、肽和受体。在一些方面,配体是适体(如DNA、蛋白质或DNA/蛋白质)。在一些方面,配体是小分子化合物。
在一些方面,所述结合结构域和配体通过共价键、氢键、离子键、金属键、范德华力、疏水相互作用或平面堆叠相互作用(planar stacking interaction)连接,或作为连续多肽翻译,从而形成融合分子。
在一些方面,所述方法进一步包括使样品与能够结合目标分子、目标颗粒或目标/配体复合物的可检测标记接触。
在一些方面,所述聚合物包含至少两个结合基序单元。
在一些方面,所述聚合物包含至少两个不同的结合基序。在这样的方面,所述样品与至少两种融合分子(其各自包含能够结合所述至少两个不同结合基序中不同的一个结合基序的不同结合结构域),和能够结合不同目标分子或颗粒的不同配体接触;并且所述传感器被配置来确定与各个结合基序结合的融合分子是否结合目标分子或颗粒。
在一些方面,所述传感器包含进一步配置成在所述两个容积之间施加电压的电极。
在一些方面,所述装置包括上腔室、中腔室和下腔室,其中上腔室通过第一细孔与中腔室连通,且中腔室通过第二细孔与下腔室连通。
在一个方面,第一细孔和第二细孔的直径为约1纳米至约100纳米。此类细孔适合于检测如蛋白质和核酸的分子。在一个方面,第一细孔和第二细孔直径大至约50,000纳米,其可适合于检测较大颗粒,例如肿瘤和细菌细胞。
在一些方面,所述细孔彼此间隔约10纳米至约1000纳米。在一些这样的方面,所述细孔之间的距离被调整为使得聚合物支架可以同时通过第一和第二细孔两者延伸。在其它方面,所述细孔彼此间隔大于1000纳米。
在一些方面,各个腔室包含用于连接到电源的电极。
在一些方面,所述方法进一步包括在所述结合基序在通过至少一个细孔之后沿相反方向移动聚合物,以便再次确定与各个结合基序结合的融合分子是否结合目标分子或颗粒。
本文也提供了检测目标分子或颗粒的存在的试剂盒、套装或混合物。在一些方面,所述试剂盒、套装或混合物包含(a)融合分子,其自身是能够结合目标分子或颗粒的配体以及结合结构域,(b)聚合物支架,其含有结合结构域能够与其结合的至少一个结合基序,(c)含有将装置的内部空间分成两个容积的细孔的装置,其中该装置被配置成允许聚合物通过细孔从一个容积到另一个容积,且其中该装置还包括配置为确定结合基序是否(i)在配体结合目标分子或颗粒的同时结合融合分子,(ii)在配体未结合目标分子或颗粒的同时结合融合分子,或者(iii)不结合融合分子的传感器。在一些方面,所述装置进一步包含第二细孔,其进一步分隔所述装置的内部空间以使得存在三个容积:上腔室、中腔室和下腔室。
在一些方面,试剂盒、套装或混合物进一步包含疑似含有目标分子或颗粒的样品。在一些方面,所述样品进一步包含能够结合目标分子、颗粒、配体/目标复合体或配体/颗粒复合体的可检测标记。
附图说明
作为本公开的实施方案提供了仅通过举例方式阐明特征的附图,其不是为了限制。
图1说明了用本公开的方法的一个实施方式检测目标分子或颗粒。
图2提供了更具体的实施例的说明,其中双链DNA作为聚合物支架,且人类免疫缺陷病毒(HIV)包膜蛋白作为配体。该组合用于检测抗HIV抗体。
图3展示了三种示例分子的代表性和理想化的电流分布,表明目标分子(或颗粒)和融合分子之间的结合可以在通过纳米细孔时是可以被检测到,因为与单独的融合分子或单独的DNA相比,它的电流分布不同。具体来说,图3A显示了与在实验缓冲液中和施加的正电压的高盐浓度(>0.4M氯化钾,例如1M氯化钾)相一致的电流分布,产生通过细孔的正电流。作为另一个例子,图3B显示了与在实验缓冲液中和也是在施加的正电压下的低盐浓度(<0.4M氯化钾,例如100mM氯化钾)相一致的电流分布。作为另一个例子,图3C显示了与在实验缓冲液中和施加的负电压下的低盐浓度(<0.4M氯化钾,例如100mM氯化钾)相一致的电流分布。
图4阐明了本技术通过在聚合物支架中包括不同的结合基序的多路复用能力。这种多路利用可以利用一个纳米细孔或超过一个纳米细孔完成。
图5(I)-(III)阐述了具有分隔多个腔室的至少两个细孔的纳米细孔装置。
具体来说,图5(I)是一个双重细孔芯片用于各细孔的独立电压控制(V1或V2)和电流测量(I1或I2)的双重放大器电子配置的示意图。显示了三个腔室A-C,其除了共同的细孔外空间上分隔开。
图5(II)是其中从电学上说,通过构建最小化所有接入电阻的装置而从而有效地解耦I1和I2,V1和V2主要施加各个纳米孔的电阻上的示意图。
图5(III)描述了其中竞争电压用于控制的示意图,用箭头表示各个电压力(voltage force)的方向。
图6a-6c说明了具有连接两个腔室的一个细孔的纳米细孔装置以及其使用的示例结果。具体来说,图6a描述了纳米细孔装置的示意图。图6b描述了一种代表性的电流迹线(current trace),其显示了因为双链DNA通过纳米细孔而导致的堵塞事件。电流幅值偏移量(ΔI=I0-IB)和持续时间tD被用于量化通过事件。图6c描绘了一种散点图,其显示对于16分钟时间内记录的所有堵塞事件的电流量(ΔI)相对于转位时间(tD)的变化。
图7a-7b描述了在按照本发明制造的纳米细孔装置的一个实施方式中测量的电流迹线。所提供的电流迹线表明,未结合的dsDNA在低于0.4M的KCl浓度下导致电流增强事件。电流增强在提供的实验中表现为向下偏移,这是由于电压和电流都是负的(如图3C中)。具体来说,在-200毫伏0.1M氯化钾中,使用直径10-11纳米的细孔单独DNA的对照实验中,5.6kb dsDNA支架(图7a)导致短暂的电流增强事件,其幅度为50-70皮安和持续时间为10-200微秒。同样地,48kb的λDNA(图7b)导致幅度50-70皮安和持续时间50-2000微秒的电流增强事件。
图8描述了聚合物支架的示意图。具体来说,图8显示了5631kb dsDNA支架以及总共10个VspR结合位点的位置。在10个VspR结合位点中,5个是一种14个碱基对的序列,3个是不同的18个碱基对的序列,和2个是27个碱基对的序列。还显示了结合位点之间的距离(以碱基对计)。
图9a和9b各自显示了支架正穿过纳米细孔的纳米细孔实施方式的示意图。也各自显示了如通过公开的纳米细孔装置的一个实施方式测量的与支架通过相关的所得电流分布。特别是,图9(a)和9(b)比较了单独DNA支架(a)和VspR结合DNA(b)的事件。具体而言,(a)显示了描绘5631kb dsDNA支架通过细孔的图示,以及当支架通过细孔时的典型电流增强事件(向下50皮安偏移,持续100微秒)。(b)显示了描绘与正在通过细孔的dsDNA支架结合的多个VspR的图示,以及当VspR结合支架通过细孔时的典型电流衰减事件(向上150皮安偏移,持续1.1毫秒)。在施加电压为-100毫伏时,开放通道电流是负的,所以向下事件对应电流增强事件,且向上事件对应电流衰减事件(如图3c中)。尽管基线为显示的目的归零,偏移方向保持。
图10显示了另外的十个代表性的以与VspR结合支架通过细孔相一致的电流分布中描绘的电流衰减事件。所有偏移与电流衰减一致;基线为了显示的目的归零。
图11显示了在180毫伏和1M KCl下使用直径16-18纳米的纳米细孔进行的5.6kb的dsDNA支架和RecA蛋白的试验中捕获的电流分布中描绘的两个代表性电流事件。第一事件与未结合的dsDNA或可能游离的RecA(或多个相结合的RecA蛋白)通过细孔相一致,平均电流衰减280皮安,持续70微秒。第二事件与RecA结合支架通过细孔一致,平均电流衰减1.1纳安,持续2.7毫秒。RecA结合事件通常表现出更深的堵塞和更长的持续时间。
图12描述了另外的四个电流分布,其各自展现出与RecA结合支架通过细孔相一致的代表性电流事件。
图13显示散点图和直方图,其描绘了在用本文描述方法的实施方式进行的一个实验中在10分钟时间内记录的所有1385个事件。在所描绘的图表中,对于每个事件提供一个数据点。特别的,所描绘的图表显示了:(a)最大电导(以nS计)(最大电流偏移(皮安)除以电压(毫伏))与持续时间(以秒计),持续时间按对数尺度;(b)最大电导偏移值的概率直方图;(c)平均电导(平均电流偏移除以电压)与持续时间,持续时间按对数尺度;(d)平均电导值的概率直方图;和(e)对数尺度的持续时间的概率直方图。
图14(a-c)阐明了来自检测DNA/RecA复合体和DNA/RecA复合体上的RecA抗体的纳米细孔装置上的结果,以及将这些复合体与未结合DNA及与游离RecA区分的结果。
具体来说,图14(a)是凝胶迁移试验。具体地,DNA/Reca/mAb ARM191凝胶迁移实验(EMSA)的道有:1)梯状物,顶部条带5000bp;2)RecA标记缓冲液中的仅支架DNA;3)DNA/RecA复合体,1:1的RecA蛋白比理论RecA结合位点;4)DNA/RecA/Ab复合体,DNA/Rec与1:2000稀释的单克隆抗体ARM191孵育;5)Ab标记缓冲液中的仅DNA支架;和6)与单克隆抗体(ARM191)混合的支架DNA。
图14(b)显示了DNA(230皮安,0.1毫秒)、DNA/RecA(390皮安,1.1毫秒)和可能的DNA/蛋白/抗体(860皮安,1.5毫秒)的代表性事件。RecA结合DNA事件的幅度比前面附图(图11-13)中都小,因为用来测量这些事件的细孔相当大(直径27-29纳米)。
图14(c)描述了(i)|ΔI|相对tD的散点图和(ii)叠加的两个独立实验的|ΔI|水平概率直方图。在单独RecA对照实验中,0.5uM RecA(*)在180毫伏、1M氯化钾中用直径20纳米细孔进行测量,在10分钟的时间内产生767个事件。注意,在这些条件下,仅0.6%的RecA事件超过标准(600皮安,0.2毫秒)。在另一个实验中,三种试剂按顺序添加到1M LiCl中。首先,0.1uM的DNA用直径为20纳米的细孔在200毫伏下测量,以0.1个事件/秒产生了402个事件。在细孔增大到27纳米后,加入1.25nM的DNA/RecA(·),以1.44个事件/秒产生了3387个事件。最后,加入1.25nM的DNA/RecA/Ab(O),以4.49个事件/秒产生了4953个事件。超过(600皮安,0.2毫秒)标准的事件从单独DNA的0%单调增加到添加DNA/RecA的5.2%(176)并最高到添加DNA/RecA/Ab的9.8%(485)。尽管RecA可能在LiCl中具有增加的事件持续时间,如对于DNA所示的,但事件幅度不太可能明显朝向(600皮安,0.2毫秒)的标准偏移。
图15显示了与本发明实施方式一致的聚合物支架的示意图。具体而言,图15(a)显示了用于各个实验的5.6kb dsDNA支架,所述支架已经工程化以结合12聚体肽-核酸(PNA)分子,每个PNA有3个用于结合抗生物素蛋白(例如,中性抗生物素蛋白和/或单价链霉亲和素)的生物素化位点。图15(b)中还显示了鉴定支架上25个不同的PNA结合位点,其定位多达75个抗生物素蛋白生物标志物结合位点。
图16(a)-(c)显示了:(a)5.6kb dsDNA支架通过纳米细孔的示意图;(b)游离中性抗生物素蛋白通过纳米细孔的示意图;(c)标记有PNA的dsDNA通过纳米细孔的示意图,PNA的所有三个生物素位点被中性抗生物素蛋白结合;和(d)在按照本发明制造的纳米细孔装置中在细孔上方的腔室中测量的相应电流迹线。在图16(d)中,电流迹线描绘了来自单独DNA、单独中性抗生物素蛋白和DNA/PNA/中性抗生物素蛋白复合体的独立纳米细孔试验的记录电流中的代表性转位事件。正如实施例中详细阐述的,D/P/N实验中更深和更长的事件模式确定为DNA/PNA/中性抗生物素蛋白事件,且明显区别于单独DNA或单独中性抗生物素蛋白事件。
图17(a)-(c)显示了:(a)在用直径10-11纳米的细孔在200毫伏下的三个独立实验所有记录事件的电流偏移与持续时间(|ΔI|与tD)的散点图,所述实验包括:(D)1nM下单独5.6kb dsDNA,在16分钟的时间内产生1301个事件;(N)80nM下的单独中性抗生物素蛋白,在11分钟的时间内产生2589个事件;和(D/P/N)60pM的DNA/PNA/Neut复合体,在7.3分钟的时间内产生4198个事件。D/P/N亚群与N和D对照实验群体重叠,其中DPN实验中的大多数事件匹配未结合N事件特征;(b)三个数据集中|ΔI|的水平概率直方图。插图显示了tD>0.08毫秒的578个DPN事件的子集的直方图,其试图从D/P/N数据集删除非DNA事件(来自对照,8%的N事件和54%的D事件tD>0.08毫秒)。此类DPN事件在|ΔI|上具有很大散布,此类长持续时间事件中252个(总数的6%)超过2.4纳安,而对照组中,只有18(0.7%)个N事件和33(2.5%)个D事件(|ΔI|,tD)>(2.4纳安,0.08毫秒);和(c)DNA/PNA/中性抗生物素蛋白凝胶迁移实验(EMSA),具有道:1)定标梯状物,顶部条带5000bp;2)标记缓冲液中的仅DNA;3)DNA/PNA+相对生物素3倍过量的中性抗生物素蛋白;4)DNA/PNA+相对生物素7倍过量的中性抗生物素蛋白;5)DNA/PNA+相对生物素16倍过量的中性抗生物素蛋白;6)DNA/PNA+相对生物素36倍过量的中性抗生物素蛋白;和7)标记缓冲液中的PNA/DNA。
一些或所有的附图是示例的示意图;因此,他们不一定描绘了展现的元件的实际相对大小或位置。附图是为了阐明一个或多个实施方式的目的而而呈现的,应明确理解它们不是被用来限制以下权利要求的范围或含义。
具体实施方式
在本申请的全文中,文字涉及本发明的装置、组合物、系统和方法的各种实施方式。所描述的各种实施方式旨在提供各种说明性例子,而不应该被解释为可选种类的描述。相反,应该注意的是,此处提供的各种实施方式的描述在范围上可能有重叠。此处讨论的实施方式仅仅是说明性的,并不是要限制本发明的范围。
在本公开的全文中,各种出版物、专利和公开的专利说明书均通过明确的引文被引用。这些出版物、专利和公开专利说明书的公开内容通过引用由此作为整体并入本公开中。
如说明书和权利要求中使用的,单数形式“一”、“一个”和“该”包括复数指代,除非上下文另外有明确规定。例如,术语“一电极”包括多个电极,包括其混合体。
如本文中使用的,术语“包含”意指所述系统、装置和方法包含所列举的成分或步骤,但不排除其它的成分或步骤。“基本上由……组成”在用于定义系统、装置和方法时意指排除对于组合有任何实质意义的其它成分或步骤。“由……组成”意指排除其它成分或步骤。通过这些过渡术语中各自限定的实施方式在本发明的范围内。
所有包括范围的数值表达,例如距离、大小、温度、时间、电压和浓度,是近似值,其按照0.1的增量变化((+)或(-))。需要明白的是,虽然并不总是所有数值表达前明确加有术语“大约”。也需要明白,尽管并不总是明确地表述,此处所描述的成分只是示例性的,并且此类成分的等价物是本领域中已知的。
如本文中使用的,“包含分隔内部空间的细孔的装置”指的是具有在结构内包含开口的细孔的装置,该结构将内部空间分隔成多于一个容积或腔室。
分子检测
本公开提供了用于分子检测和定量的方法和系统。另外,所述方法和系统也可以被配置来测量分子与另一分子结合的亲和力。此外,此类检测、定量和测量可以用多路复用方式进行,从而大大地提高其效率。
图1提供了所公开的方法和系统的一个实施方式的说明。更具体地说,所述系统包括能够结合待检测或定量的目标分子105的配体104。所述配体104可以是能够结合聚合物支架109上的特定结合基序101的结合部分(称为“结合结构域”)103的部分或者与该结合结构域103连接。总起来说,配位体104和结合结构域103形成融合分子102。在各种不同的实施方式中,融合分子102的两种组分(即配体104和结合结构域103两者)以高亲和力和特异性结合其各自的目标(例如,分别为目标分子105和结合基序101)。
因此,如果都存在于溶液中,融合分子102在一端通过结合基序101与结合结构域103之间的特异性的识别和结合而结合于聚合物支架(或简单地说,“聚合物”)109,且在另一端通过配体104与目标分子105之间的相互作用结合于目标分子105。此类结合导致形成包含聚合物109、融合分子102和目标分子105的复合体。
形成的复合体可以使用包括纳米细孔(或简单地说,细孔)107和传感器的装置108检测。细孔107是分隔两个容积的结构中的纳米级或微米级的开口。传感器107可以位于细孔107内部或邻近细孔107,或者另外地在两个容积内。传感器被配置为识别通过细孔107的物体。例如,在一些实施方式中,传感器通过检测可测量参数的变化来识别通过细孔107的物体,其中所述变化指示穿过所述细孔107的物体。这个装置在全文中被称为“纳米细孔装置”。在一些实施方式中,纳米细孔装置108包括用于将聚合物109跨细孔107从一个容积移动到另一容积的手段,例如连接到电源的电极。由于聚合物109可以是带电的或经修饰以包含电荷,这类手段的一个实例产生跨细孔107的电位或电压以促进和控制聚合物109的运动。在优选实施方式中,传感器包含一对电极,其被设置成同时检测物体的通过和提供跨细孔107的电压。在这个实施方式中,电压钳或膜片钳被用来提供跨细孔的电压和测量通过细孔的电流。
当包含形成的复合体的样品装载到纳米细孔装置108中时,纳米细孔装置108可以配置为使聚合物109通过细孔107。当结合基序101在细孔内或者邻近细孔107时,基序101的结合状态可以被传感器检测。
本文中使用的结合基序的“结合状态”是指结合基序是否结合于具有相应的结合结构域的融合分子,以及融合分子是否也结合于目标分子。基本上,所述结合状态可以是三种可能状态之一:(i)结合基序是游离的且没有结合于融合分子(见图3中的305);(ii)结合基序结合于没有与目标分子结合的融合分子(见图3中的306);或(iii)结合基序结合于与目标分子结合的融合分子(见图3的307)。
结合基序结合状态的检测可以通过各种方法实现。在一个方面,借助于结合基序在各种状态下的不同大小,当结合基序通过细孔时,不同的大小导致跨过细孔的不同电流。在一个方面,如图3A所示,当施加正电压且实验缓冲液中KCl浓度大于0.4M时,在305、306和307通过细孔时所测得的电流信号301分别为信号302、303和304。所有三种事件类型在KCl浓度大于0.4M时经历电流衰减,从而引起正向电流减小。三个信号302,303和304可以通过电流偏移量(高度)和/或电流偏移的持续时间(宽度)来彼此区分,或通过信号中区分这三种事件类型的任何其他特征来彼此区分。也可能304通常不同于302和303,但302和303彼此通常不是不同的,在这种情况下,与穿越分子结合的生物标志物的稳定检测仍然是可以实现的。在另一个方面,如图3B所示,当施加正电压且实验缓冲液中KCl浓度小于0.4M时,在312、313和314通过细孔时测得的电流信号308分别为信号309、310和311。在小于0.4M的KCl浓度下dsDNA单独通过导致电流增强事件(309)。这在Smeets,Ralph MM等人发表的研究“Salt dependence of ion transport and DNA translocation through solid-state nanopores.”Nano Letters 6.1(2006):89-95中已经证明。因此,信号309可以通过相对于开放通道基线电流水平(308)的事件振幅方向(极性)(除了三个信号通常具有不同的电流偏移量(高度)和/或电流偏移持续时间(宽度)外),或通过信号中区分这三种事件类型的任何其他特征而与310和311区分。在另一个方面,如图3C所示,当施加负电压且实验缓冲液中KCl浓度小于0.4M时,在319、320和321通过细孔时测得的负电流信号315分别为信号316、317和318。与利用带正电压的信号309、310和311相比,信号316、317和318具有相反的极性,因为施加的电压具有相反的(负)极性。在图3实施方式的所有方面,传感器包含连接到电源并可以检测电流的电极。因此,任一或两个电极用作“传感器”。在这个实施方式中,电压钳或膜片钳用于同时提供跨细孔的电压和测量通过细孔的电流。
在某些方面,如图1所示的试剂106被添加到复合体中以辅助检测。这一试剂能够结合目标分子或配体/目标分子的复合体。在一个方面,所述试剂包括电荷(或正或负)以利于检测。在另一个方面,所述试剂增加大小以利于检测。在另一方面,所述试剂包括可检测标记,如荧光团。
在此情况下,状态(iii)的鉴别表明聚合物-融合分子-目标分子复合体的形成。换言之,目标分子被检测到。
颗粒检测
本公开在某些方面也提供了检测、定量和测量颗粒的方法和系统,所述颗粒如蛋白质、蛋白质聚集体、寡聚物或蛋白质/DNA复合体,或者细胞和微生物,包括病毒、细菌和细胞聚集体。
在某些方面,在将装置分隔成两个容积的结构内的细孔具有允许颗粒如病毒、细菌、细胞或细胞聚集体通过的大小。能够结合待检测或定量的目标颗粒的配体可以包括在纳米细孔装置中的溶液中,使得配体可以通过结合结构域和结合基序结合独特的目标颗粒和聚合支架以形成复合体。很多此类颗粒在其表面上具有独特的标志物,该标志物可以被配体特异性地识别。例如,肿瘤细胞可以具有在细胞表面上表达的肿瘤抗原,且细菌细胞可以具有附着于细胞膜上的内毒素。
在溶液中加载到纳米细孔装置中的所形成的复合体与聚合物支架一起穿过细孔移动时,细孔内或邻近细孔的复合体的结合状态可以被检测,使得结合于配体的目标微生物可以使用与本公开中其他地方描述的分子检测方法类似的方法来鉴定。
聚合物支架
适用于本公开的技术中的聚合物支架是能够装载到纳米细孔装置中并且从一端到另一端穿过细孔的支架。
聚合物的非限制性的例子包括核酸,如脱氧核糖核酸(DNA)、核糖核酸(RNA)或肽核酸(PNA)、树状聚合物和线性化的蛋白质或肽。在一些方面,DNA或RNA可以是单链的或双链的,或者可以是DNA/RNA杂合分子。
在一个方面,聚合物是合成的或化学修饰的。化学修饰可以帮助稳定聚合物,将电荷添加到聚合物以提高迁移率,保持线性度或者提高或改变结合特异性。在一些方面,化学修饰是乙酰化、甲基化、小泛素样修饰蛋白化、氧化、磷酸化、糖基化或添加生物素。
在一些方面,所述聚合物是带电的。DNA、RNA、PNA和蛋白在生理条件下通常是带电的。此类聚合物可以进一步修饰以增加或减少所带电荷。其他聚合物可以进行修饰以引入电荷。聚合物上的电荷可用于驱动聚合物通过纳米细孔装置的细孔。例如,带电的聚合物可以通过施加跨细孔的电压而穿过细孔移动。
在一些方面,当电荷引入聚合物时,电荷可以添加在聚合物的末端。在一些方面,电荷分布在整个聚合物上。
在一个实施方式中,带电聚合物的每个单元在选定的pH值下带电。在另一个实施方式中,带电聚合物包含足够的带电单元以通过静电力拉入并穿过细孔。例如,含有足够的实体的肽可以在选定的pH下带电(赖氨酸、天冬氨酸、谷氨酸等)以用于本文所述的装置和方法中。同样地,包含甲基丙烯酸和乙烯的共聚物是用于本发明目的的带电聚合物,如果存在用于本文所述装置和方法中的足够的甲基丙烯酸残基的带电羧酸基团。在一个实施方式中,带电聚合物在聚合物的一个末端处或靠近该末端包含一个或多个带电单元。在另一个实施方式中,带电聚合物在聚合物的两个末端处或者靠近两个末端包含一个或多个带电单元。一个共聚物的例子是包绕在蛋白周围的DNA(例如DNA/核小体)。共聚物的另一个例子是在N端和C端与DNA偶联的线性化蛋白质。
结合基序与结合结构域
对于核酸和多肽作为聚合物支架,结合基序可以是被结合结构域识别的核苷酸或肽序列。在一些实施方式中,结合结构域是形成蛋白质的功能部分的肽序列,虽然结合结构域不必须是蛋白质。对于核酸,例如,存在特异性地识别并结合序列(基序)(如启动子、增强子、胸腺嘧啶-胸腺嘧啶二聚体)和某些二级结构(如弯曲的核苷酸和具有单链断裂的序列)的蛋白质。
在一些方面,结合基序包含引起或有助于结合结构域的识别和结合的化学修饰。例如,甲基化的DNA序列可以被转录因子、DNA甲基转移酶或者甲基化修复酶识别。在其它实施方式中,生物素可以被结合到抗生物素蛋白家族成员中,并被其识别。在此类实施方式中,生物素形成结合基序,和抗生物素蛋白或抗生物素蛋白家族成员是结合结构域。
能够特异性地识别核苷酸结合基序的分子,尤其是蛋白质,是本领域中已知的。例如,蛋白结构域如螺旋-转角-螺旋、锌指、亮氨酸拉链、翼状螺旋、翼状螺旋-转角-螺旋、螺旋-环-螺旋和HMG盒已知能够结合核苷酸序列。
在一些方面,结合结构域可以是锁核酸(LNA)、所有类型的蛋白质核酸(例如bisPNAs、γ-PNA)、转录激活因子样效应物核酸酶(TALEN)、成簇的规律间隔短回文重复序列(CRISPR)或适体(如DNA、RNA、蛋白质或其组合)。
在一些方面,结合结构域是DNA结合蛋白(例如锌指蛋白)、抗体片段(Fab)、化学合成的粘合剂(例如PNA、LNA、TALENS或CRISPR)或合成聚合物中的化学修饰(即反应性部分)(例如,硫醇盐、生物素、胺、羧酸酯)中的一个或多个。
目标分子/颗粒和配体
在本公开的技术中,目标分子或颗粒通过其与融合分子中的配体的结合来检测或定量,该融合分子结合于聚合物支架。目标分子或颗粒和相应的结合配体可以相互识别并结合。对于颗粒,可以存在适用于配体结合的表面分子或标志物(因此标志物和配体形成结合对)。
能够实现目标分子或颗粒表面的分子的结合对的例子包括,但不限于,抗原/抗体(或抗体片段);激素、神经递质、细胞因子、生长因子或细胞识别分子/受体;和离子或元素/螯合剂或离子结合蛋白,如钙调素。结合对也可以是具有互补序列的单链核酸,酶和底物,互相结合的蛋白复合体的成员,酶和辅因子,酶和其一个或多个抑制剂(变构的或其他),核酸/蛋白质,或可通过半胱氨酸约束肽检测的细胞或蛋白质。
在一些实施方式中,配体是蛋白质、蛋白质支架、肽、适体(DNA或蛋白质)、核酸(DNA或RNA)、抗体片段(Fab)、化学合成分子、化学反应性官能团或任何其他合适的与目标分子形成结合对的结构。
因此,任何需要检测或定量的目标分子,如蛋白质、肽、核酸、化学化合物、离子和元素,都可以找到相应的结合配体。对于大多数蛋白质和核酸,可以容易地制备抗体或互补序列或者适体。
同样地,对于颗粒可以容易地发现或制备结合配体(如抗体和适体),所述颗粒如蛋白质复合体和蛋白质聚集体、蛋白质/核酸复合体、片段化和或完全组装的病毒、细菌、细胞和细胞聚集体。
融合分子
“融合分子”意思是指包含两个功能区(结合结构域和配体)的分子或复合体。结合结构域能够结合聚合物支架上的结合基序,和配体能够结合目标分子。
在一些方面,融合分子通过用键或力将两个区域连接来制备。这样的键和力可以是,例如共价键、氢键、离子键、金属键、范德华力、疏水相互作用或平面堆叠相互作用。
在一些方面,融合分子,例如融合蛋白,可以从重组编码核苷酸作为单一的分子表达。在一些方面,融合分子是具有结合结构域和适用于本技术中的配体的天然分子。
对于连接结合结构域与配体以形成融合分子存在很多选择。例如,组成成分可以通过功能化连接体化学耦合而连接,如游离胺、羧酸偶联、硫醇盐、酰肼或叠氮化物(点击)化学作用或者结合结构域和配体可以形成一个连续转录本。
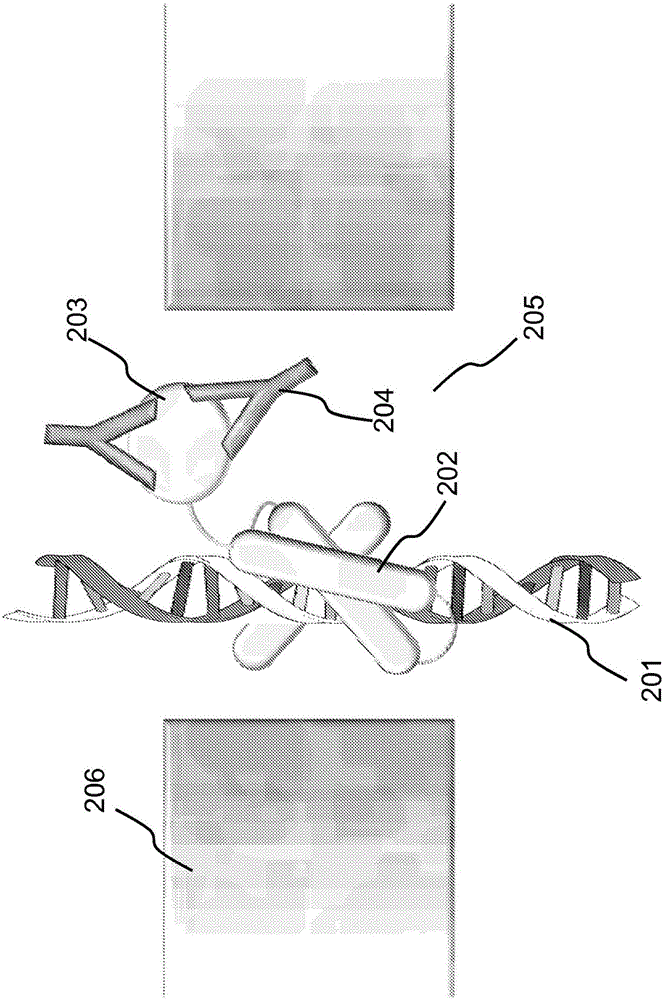
图2阐示了图1中所示系统的更具体的实施方式。在图2中,融合分子是包括锌指蛋白或结构域202和人免疫缺陷病毒(HIV)包膜蛋白203的嵌合蛋白。锌指蛋白202可以结合聚合物支架双链DNA 201上的合适的核苷酸序列;HIV包膜蛋白203可以结合抗HIV抗体204,它可能存在于用于检测的生物样品(例如,来自病人的血液样品)中。
当双链DNA 201通过纳米细孔装置206的细孔205时,纳米细孔装置206可以检测融合分子是否结合于DNA 201以及结合的融合分子是否结合于抗HIV抗体204。
结合亲和力的测量
本公开的技术也可以用于测量两个分子之间的结合亲和力,以及确定其他结合动力学。例如,在结合基序通过纳米细孔装置的细孔后,该装置可重新配置为反转聚合物支架的移动方向(如下所述),以使得结合基序可以再次通过细孔。
在结合基序再次进入细孔之前,可以改变加载到纳米细孔装置的样品中的条件。例如,改变条件可以是从样品中移除目标分子、添加与目标分子或配体竞争结合的试剂及改变pH值、盐或温度中的一种或多种。
在改变的条件下,结合基序可以再次通过细孔。因此,目标分子是否仍然结合于融合分子可以被检测以确定改变的条件是如何影响结合的。
在一些方面,一旦结合基序处于细孔中,其在条件改变的同时仍保留在那里,且因此改变的条件的影响可以原位测量。
可选地或另外地,聚合物支架可以包含多个结合基序,且每个结合基序可以结合于可以与一个或多个特定的目标分子或颗粒结合的融合分子。当各结合基序通过细孔时,样品的条件可以改变,从而允许连续地检测配体和目标分子或颗粒之间改变的结合。
多路复用
在一些方面,与上述包含多个相同种类的结合基序相反,聚合物支架可以包含多种类型的结合基序,其各自具有不同的相应结合结构域。在这样的实施方式中,样品可以包含多种类型的融合分子,每种类型包含所述不同的相应结合结构域中的一种和对于不同的相应的目标分子或目标微生物的配体。
多路复用的另一种方法包括在试验过程中测定不同支架分子的集合,每种不同的支架结合不同的融合分子。为了确定哪些目标分子在溶液中,相同类型的支架被标记以使得传感器可以鉴别哪种融合分子结合于该特定的支架。这可以,例如,通过用不同长度或大小的聚乙二醇分子条码标记(barcoding)各种类型的支架实现。
用这样的设置,单一聚合物支架可以用于检测多种类型的目标分子或目标微生物(如细菌或病毒)或者目标细胞(例如,循环的肿瘤细胞)。图4阐述了这样一种方法。此处,双链DNA 403被用作聚合物支架,双链DNA 403包含多个结合基序:两个拷贝的第一结合基序404,两个拷贝的第二结合基序405和一个拷贝的第三结合基序406。
当DNA通过具有两个同轴细孔401和402的纳米细孔装置407时,各结合基序的结合状态被检测,其中两个拷贝的结合基序404都结合于相应的目标分子,两个拷贝的结合基序405均结合于相应的目标分子;并且结合于结合基序406的融合分子没有结合于相应的目标分子。
以这种方式,利用单一聚合物和单一纳米细孔装置,本公开的技术可以同时检测多种不同的目标分子或目标微结构(如聚合物、微生物或细胞)。此外,通过确定结合基序结合的多少拷贝结合于目标分子或目标微生物并通过调整影响结合的条件,所述系统可以获得更详细的结合动力学信息。
纳米细孔装置
所提供的纳米细孔装置包括在将其内部空间分为两个容积的结构中形成通孔的至少一个细孔,以及至少一个配置为识别通过细孔的物体(例如通过检测指示物体的参数的变化)的传感器。
纳米细孔装置中的细孔是纳米级或微米级的。在一个方面,每个细孔的大小允许小或大分子或者微生物通过。在一个方面,每个细孔直径至少约1纳米。可选地,每个细孔直径至少约2纳米、3纳米、4纳米、5纳米、6纳米、7纳米、8纳米、9纳米、10纳米、12纳米、13纳米、14纳米、16纳米、17纳米、18纳米、19纳米、20纳米、25纳米、30纳米、35纳米、40纳米、45纳米、50纳米、60纳米、70纳米、80纳米、90纳米或100纳米。
在一个方面,细孔直径不超过约100纳米。可选地,细孔直径不超过约95纳米、90纳米、85纳米、80纳米、75纳米、70纳米、65纳米、60纳米、55纳米、50纳米、45纳米、40纳米、35纳米、30纳米、25纳米、20纳米、15纳米或10纳米。
在一些方面,每个细孔的直径至少约100纳米、200纳米、500纳米、1000纳米、2000纳米、3000纳米、5000纳米、10000纳米、20000纳米或30000纳米。在一个方面,细孔直径不超过约100000纳米。可选地,细孔直径不超过约50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、5000纳米、4000纳米、3000纳米、2000纳米或1000纳米。
在一个方面,细孔直径在约1纳米和约100纳米之间,或者可选地,在约2纳米和约80纳米,或在约3纳米和约70纳米,或在4约纳米和约60纳米,或在约5纳米和约50纳米,或在约10纳米和约40纳米,或在约15纳米和约30纳米之间。
在一些方面,纳米细孔装置中的细孔是较大尺度的,用于大微生物或细胞的检测。在一个方面,每个细孔的大小允许大的细胞或微生物通过。在一个方面,每个细孔直径至少约100纳米。可选地,每个细孔直径为至少约200纳米、300纳米、400纳米、500纳米、600纳米、700纳米、800纳米、900纳米、1000纳米、1100纳米、1200纳米、1300纳米、1400纳米、1500纳米、1600纳米、1700纳米、1900纳米、2000纳米、2500纳米、3000纳米、3500纳米、4000纳米、4500纳米或5000纳米。
在一个方面,细孔直径不超过约100000纳米。可选地,细孔直径不超过约90000纳米、80000纳米、70000纳米、60000纳米、50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、5000纳米、4000纳米、3000纳米、2000纳米或1000纳米。
在一个方面,细孔的直径在约100纳米和约10000纳米之间,或者可选地在约200纳米和约9000纳米之间,或在约300纳米和约8000纳米之间,或在约400纳米和约7000纳米之间,或在约500纳米和约6000纳米之间,或在约1000纳米和约5000纳米之间,或在约1500纳米和约3000纳米之间。
在一些方面,纳米细孔装置进一步包括用于将聚合物支架移动跨过细孔的手段和/或用来识别通过细孔的物体的手段。进一步的细节在下面提供,以双细孔装置为背景描述。
与单细孔纳米细孔装置相比,双细孔装置可以更容易配置从而提供聚合物跨细孔运动的速度和方向的良好控制。
在一个实施方式中,纳米细孔装置包括多个腔室,各腔室通过至少一个细孔与相邻的腔室连通。在这些细孔中,两个细孔(即第一细孔和第二细孔)被放置为使得允许至少一部分聚合物移出第一细孔并进入第二细孔。此外,所述装置包括能够在运动过程中识别聚合物的传感器。在一个方面,该识别需要确定聚合物的单个成分。在另一个方面,该识别需要确定与聚合物结合的融合分子和/或目标分子。当采用单一传感器时,该单一传感器可包含两个放置在细孔两端的用于测量跨细孔离子电流的电极。在另一个实施方式中、单一传感器包含电极以外的部件。
在一个方面,所述装置包括通过两个细孔连接的三个腔室。具有三个以上腔室的装置可以很容易地设计以在三腔室装置任一侧或在三个腔室中任何两个腔室之间包括一个或多个额外的腔室。同样地,装置中可以包括连接腔室的超过两个细孔。
在一个方面,两个相邻腔室之间可以有两个或更多个细孔,以允许多个聚合物同时从一个腔室移动到下一个腔室。这样的多细孔设计可以提高装置中聚合物分析的通量。
在一些方面,所述装置进一步包括用于将聚合物从一个腔室移动到另一个腔室的手段。在一个方面,该移动导致同时跨第一细孔和第二细孔两者加载聚合物。在另一个方面,所述手段进一步使聚合物能够在同一方向上通过两个细孔移动。
例如,在三腔室两细孔装置(“两细孔”装置)中,每个腔室可以包含用于连接到电源的电极,从而可以在腔室之间跨各个细孔施加单独的电压。
根据本发明的一个实施方式,提供了包括上腔室、中腔室和下腔室的装置,其中上腔室通过第一细孔与中腔室连通,且中腔室通过第二细孔与下腔室连通。这种装置可以具有此前在名称为双重细孔装置的美国公开No.2013-0233709中披露的任何尺寸或其他特征,该文献在此通过引用整体并入本文。
在如图5(I)所示的一些实施方式中,所述装置包括上腔室505(腔室A)、中腔室504(腔室B)和下腔室503(腔室C)。腔室通过两个分离层或膜(502和501)分隔开,每个分离层或膜具有单独的细孔(511或512)。此外,每个腔室包含用于连接到电源的电极(521、522或523)。上、中和下腔室的标注是相对表述,且并不表示,例如,上腔室相对于地面被放置在中腔室或下腔室之上,反之亦然。
各细孔511和512独立地具有允许小或大的分子或微生物通过的大小。在一个方面,每个细孔直径为至少约1纳米。可选地,每个细孔直径为至少约2纳米、3纳米、4纳米、5纳米、6纳米、5纳米、7纳米、8纳米、9纳米、10纳米、11纳米、12纳米、13纳米、14纳米、15纳米、16纳米、17纳米、18纳米、19纳米、20纳米、25纳米、30纳米、35纳米、40纳米、45纳米、50纳米、60纳米、70纳米、80纳米、90纳米或100纳米。
在一个方面,细孔直径不超过约100纳米。可选地,细孔直径不超过约95纳米、90纳米、85纳米、80纳米、75纳米、70纳米、65纳米、60纳米、55纳米、50纳米、45纳米、40纳米、35纳米、30纳米、25纳米、20纳米、15纳米或10纳米。
在一个方面,细孔直径在约1纳米和约100纳米之间,或者可选地在约2纳米和约80纳米之间,或在约3纳米和约70纳米之间,或在约4纳米和约60纳米之间,或在约5纳米和约50纳米之间,或在约10纳米和约40纳米之间,或在约15纳米和约30纳米之间。
在其他方面,每个细孔直径为至少约100纳米、200纳米、500纳米、1000纳米、2000纳米、3000纳米、5000纳米、10000纳米、20000纳米或30000纳米。在一个方面,每个细孔直径为50000纳米至100000纳米。在一个方面,细孔直径不超过约100000纳米。可选地,细孔直径不超过约50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、4000纳米、3000纳米、2000纳米或1000纳米。
在一些方面,细孔基本上呈圆形。本文所用的“基本上圆形”是指至少约80或90%为圆柱体形式的形状。在一些实施方式中,细孔形状为方形、矩形、三角形、椭圆形或六角形。
细孔511和512独立地具有各自的深度(即两个相邻容积之间延伸的细孔长度)。在一个方面,每个细孔深度至少约0.3纳米。可选地,每个细孔深度是至少约0.6纳米、1纳米、2纳米、3纳米、4纳米、5纳米、6纳米、7纳米、8纳米、9纳米、10纳米、11纳米、12纳米、13纳米、14纳米、15纳米、16纳米、17纳米、18纳米、19纳米、20纳米、25纳米、30纳米、35纳米、40纳米、45纳米、50纳米、60纳米、70纳米、80纳米或90纳米。
在一个方面,每个细孔深度不超过约100纳米。可选地,深度不超过约95纳米、90纳米、85纳米、80纳米、75纳米、70纳米、65纳米、60纳米、55纳米、50纳米、45纳米、40纳米、35纳米、30纳米、25纳米、20纳米、15纳米或10纳米。
在一个方面,细孔的深度在约1纳米和约100纳米之间,或者可选地在约2纳米和约80纳米之间,或在约3纳米和约70纳米之间,或在约4纳米和约60纳米之间,或在约5纳米和约50纳米之间,或在约10纳米和约40纳米之间,或在约15纳米和约30纳米之间。
在一些方面,纳米细孔穿过膜延伸。例如,细孔可以是插入脂质双层膜中的蛋白质通道,或者其也可以是通过钻孔、刻蚀或以其他方式通过固态基质(如二氧化硅、氮化硅、石墨烯或由这些或其他材料的组合形成的层)形成细孔来工程化。在一些方面,纳米细孔的长度或深度足够大,从而形成连接两个在其它方面分隔的容积的通道。在一些此类方面,每个细孔的深度大于100纳米、200纳米、300纳米、400纳米、500纳米、600纳米、700纳米、800纳米或900纳米。在一些方面,每个细孔的深度不超过2000纳米或1000纳米。
在一个方面,细孔以约10纳米和约1000纳米之间的距离间隔开。在一些方面,细孔之间的距离大于1000纳米、2000纳米、3000纳米、4000纳米、5000纳米、6000纳米、7000纳米、8000纳米或9000纳米。在一些方面,细孔间距不超过30000纳米、20000纳米或10000纳米。在一个方面,细孔间距为至少约10纳米,或者可选地为至少约20纳米、30纳米、40纳米、50纳米、60纳米、70纳米、80纳米、90纳米、100纳米、150纳米、200纳米、250纳米或300纳米。在另一个方面,细孔间距不超过约1000纳米、900纳米、800纳米、700纳米、600纳米、500纳米、400纳米、300纳米、250纳米、200纳米、150纳米或100纳米。
在又一个方面,细孔之间的距离在约20纳米和约800纳米之间,在约30纳米和约700纳米之间,在约40纳米和约500纳米之间,或在约50纳米和约300纳米之间。
两个细孔可以在任何位置排列,只要它们允许腔室之间的流体连通并具有规定的大小和间距。在一个方面,细孔的布置使得它们之间没有直接堵塞。仍然在一个方面,细孔基本上是同轴的,如图5(I)中所示。
在一个方面,如图5(I)所示,装置通过分别在腔室503、504和505中的电极521、522和523连接到一个或多个电源。在一些方面,电源包含电压钳或膜片钳,其可以提供跨各细孔的电压并独立地测量通过各细孔的电流。在这个方面,电源和电极配置可以将中腔室设置成两个电源的共同地线。在一个方面,一个或多个电源配置为在上腔室505(腔室A)和中腔室504(腔室B)之间施加第一电压V1,和在中腔室504和下腔室503(腔室C)之间施加第二电压V2。
在一些方面,第一电压V1和第二电压V2是独立可调的。在一个方面,中腔室被调节为相对于两个电压的地电压。在一个方面,中腔室包含用于在各个细孔和中腔室中的电极之间提供电导的媒介。在一个方面,中腔室包含用于在各个细孔和中腔室中的电极之间提供电阻的媒介。保持相对于纳米细孔电阻足够小的这样一个电阻有利于跨细孔的两个电压和电流解耦,这有助于电压的独立调节。
电压的调节可用于控制腔室内带电颗粒的运动。例如,当两个电压设置为极性相同时,适当带电的颗粒可以从上腔室顺序地移动到中腔室和到下腔室,或者反过来。在一些方面,当两个电压被设置成相反极性时,带电颗粒可以从上腔室或下腔室移动到中腔室并停留在那里。
装置中电压的调节可以特别地用于大分子如带电聚合物的运动的控制,其足够长以同时跨两个细孔。在这个方面,分子移动的方向和速度可以通过电压的相对幅度和极性来控制,如下所述。
所述装置可以包含适合容纳液体样品,(特别是生物样品)的材料和/或适合于纳米加工的材料。在一个方面,此类材料包括介电材料,例如但不限于硅、氮化硅、二氧化硅、石墨烯、碳纳米管、TiO2、HfO2、Al2O3或其它金属层,或这些材料的任何组合。在一些方面,例如,约0.3纳米厚的单片石墨烯膜可用作细孔承载膜。
作为微流体装置且容纳双细孔微流体芯片设施的装置可以通过多种手段和方法来制造。对于由两个平行的膜构成的微流体芯片,两个膜可以同时通过单波束钻孔以形成两个同心细孔,尽管与任何适合的校准技术协同在膜的两侧使用不同的波束也是可能的。概括地说,外壳确保腔室A-C的密封分离。在图5(II)显示的一个方面,外壳在电压电极521、522和523及纳米细孔511和512之间提供最小接入电阻,以确保每个电压主要跨各细孔施加。
在一个方面,所述装置包含微流体芯片(标记为“双核心芯片”),其由通过间隔体连接的两个平行的膜构成。每个膜包含通过膜中心用单波束钻孔形成的细孔。进一步,所述装置优先具有用于芯片的外壳。外壳确保腔室A-C的密封分离,并为电极提供最小接入电阻以确保每个电压主要跨各细孔施加。
更具体地说,细孔-承载膜可以用具有5-100纳米厚的硅、氮化硅或二氧化硅窗口的透射电子显微(TEM)格栅制造。间隔体可采用绝缘体(如SU-8、光刻胶、PECVD氧化物、ALD氧化物、ALD氧化铝)或蒸发的金属材料(如银、金或铂),且占据在膜之间的腔室B的否则为水性的部分中的小空间而用于分隔膜。支持器置于由腔室B的最大体积部分构成的水性浴中。腔室A和C可以通过更大直径的通道(对于低接入电阻)达到,这导致膜密封。
聚焦的电子或离子束可以用来通过膜钻细孔,并自然对准。细孔也可以通过对每层施加适当束聚焦来雕刻(收缩)至更小尺寸。任何单一纳米细孔钻孔方法也可以用来在两个膜中钻出细孔对,考虑对于给定方法可能的钻孔深度和膜的厚度。预钻微细孔到规定的深度和然后通过膜的剩余部分钻出纳米细孔对于进一步优化膜的厚度也是可能的。
另一个方面,生物纳米细孔插入到固态纳米细孔中以形成杂化细孔可用于双细孔方法中的任一或两个细孔。生物细孔可以增加离子电流测量的灵敏度,且在仅单链多核苷酸捕获和控制在双细孔装置中(例如,用于测序时)是有用的。
通过在装置的细孔处存在的电压,带电分子可以通过腔室之间的细孔移动。移动的速度和方向可以通过电压的大小和极性控制。此外,由于丙个电压可以各自独立地调节,所以带电分子的运动方向和速度可以在各腔室中精细地控制。
一个例子涉及带电聚合物支架,例如DNA,其长度大于包括两个细孔的深度加两个细孔之间的距离的综合距离。例如1000bp的dsDNA长度约为340纳米,且显著大于间隔20纳米的两个10纳米深细孔跨越的40纳米距离。第一步中,将多核苷酸加载到上腔室或下腔室中。由于其在pH约7.4的生理条件下带负电荷,多核苷酸可以跨施加电压的细孔移动。因此,第二步中,相同极性且大小相同或相近的两个电压施加于细孔以顺序地跨两个细孔移动多核苷酸。
大致在多核苷酸到达第二细孔的时候,可以改变一个或两个电压。由于两个细孔之间的距离选择为比多核苷酸的长度短,当多聚核苷酸到达第二细孔时,它也在第一细孔中。因此,在第一细孔处的电压极性的迅速改变产生动将多核苷酸拉离第二细孔的力,如图5(III)所示。
假设所述两个细孔具有相同的电压-力影响,且|V1|=|V2|+δV,值δV>0(或<0)可以在V1(或V2)方向上进行调节以获得可调的运动。在实践中,虽然各个细孔处电压诱导的力不会由于V1=V2而相同,校准实验可以确定对于给定的双细孔芯片产生相等的拉力的适当偏置电压;且围绕该偏置电压的变化然后可以用于定向控制。
如果,在此时上,第一细孔处电压诱导力的大小小于第二细孔处电压诱导力的大小,则多核苷酸继续穿越两个细孔移向第二细孔,但速度较低。在这个方面,很容易理解,多核苷酸运动的速度和方向可以通过两个电压的极性和大小来控制。正如下面将进一步描述的,运动这种精细控制有着广泛的应用。
因此,在一个方面,提供了用于控制带电聚合物通过纳米细孔装置的运动的方法。所述方法需要(a)将包含带电聚合物的样品加载到上述任一实施方式的装置的上腔室、中腔室或下腔室之一中,其中该装置被连接到用于在上腔室与中腔室之间提供第一电压和在中腔室与下腔室之间提供第二电压的一个或多个电源;(b)设置初始第一电压和初始第二电压以使聚合物在腔室之间移动,从而使聚合物跨第一和第二细孔定位;且(c)调节第一和第二电压以使两个电压都产生带电聚合物拉离中腔室的力(电压竞争模式),其中两个电压在受控条件下大小不同,以使得带电聚合物沿任一方向且以受控的方式跨两个细孔移动。
为了在步骤(c)中建立电压竞争模式,各个细孔处的电压各自施加的相对作用力针对所用的各双细孔装置来确定,并且这可以利用校准实验完成通过观察不同电压值对多核苷酸运动的影响来进行,这可以通过探测多核苷酸的已知位置和可检测特征(这些特征的例子之后在本公开中详细阐述)来测量。例如,如果力在各个公共电压下是等同的,则在各细孔处使用相同的电压值(上腔室和下腔室中相对于接地的中腔室具有共同的极性)在不存在热扰动的情况下(布朗运动的存在和影响在下面讨论)产生零值净运动。如果力在各个公共电压下并不相等,达到相等的力包括在公共电压下产生较弱力的细孔处确定和使用较大的电压。电压竞争模式的校准可对于每个双细孔装置和对于特定带电聚合物或分子(其特征影响特定带电聚合物或分子通过各个细孔时的力)进行。
在一个方面,含带电聚合物的样品加载到上腔室中,且初始第一电压设置为将带电聚合物从上腔室拉到中腔室,且初始第二电压设置为将聚合物从中腔室拉到下腔室。同样地,样品可以初始加载到下腔室中,且带电聚合物可以拉到时中腔室和上腔室。
在另一方面,含带电聚合物的样品加载到中腔室中;初始第一电压设置成将带电聚合物从中腔室拉到上腔室;且初始第二电压设置成将带电聚合物从中腔室拉到下腔室。
在一个方面,步骤(c)中调节的第一电压和第二电压在大小上高达两个电压之间的差异/差额的约10倍至约10000倍。例如,两个电压可以分别为90毫伏和100毫伏。两电压的大小(约100毫伏)为它们之间的差异/差额的(10毫伏)的约10倍。在一些方面,电压的大小高达两个电压之间的差异/差额的至少约15倍、20倍、25倍、30倍、35倍、40倍、50倍、100倍、150倍、200倍、250倍、300倍、400倍、500倍、1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍或9000倍。在一些方面,电压大小不超过两个电压之间的差异/差额的约10000倍、9000倍、8000倍、7000倍、6000倍、5000倍、4000倍、3000倍、2000倍、1000倍、500倍、400倍、300倍、200倍或100倍。
在一个方面,在步骤(c)中第一电压和第二电压的实时或在线调节是采用专用的硬件和软件以高达数百兆赫的时钟频率通过主动控制或反馈控制进行的。第一电压或第二电压或两者的自动控制是基于第一或第二或两个离子电流测量值的反馈。
传感器
如上所述,在各个方面,纳米细孔装置还包含一个或多个传感器用于完成结合基序的结合状态的识别。
所述装置中使用的传感器可以是任何适合用于识别分子或颗粒(如聚合物)的传感器。例如,传感器可以配置为通过测量与聚合物相关的电流、电压、pH值、光学特征或停留时间来识别聚合物。在其他方面,传感器可以被配置为识别聚合物的一个或多个单独组分或者与该聚合物结合的一种或多种组分。传感器可以由配置为检测可测量参数的变化的任何组件形成,其中此变化指示聚合物、聚合物组分或优选地,与该聚合物结合的组分。在一个方面,传感器包括放置在细孔两侧的一对电极以测量在分子或粒子(特别是聚合物)移动通过细孔时的跨细孔离子电流。在某些方面,在通过细孔的聚合物片段结合于融合分子和/或融合分子-目标分子复合体时,跨细孔离子电流发生可测量的变化。此类电流变化对应于,例如,存在的融合分子和目标分子的存在、不存在和/或大小以可预测的、可测量的方式发生改变。
在一个实施方式中,传感器测量聚合物、聚合物的组分(或单元)或与该聚合物结合的组分的光学特征。此类测量的一个例子包括通过红外(或紫外)光谱鉴定特定单元独特的吸收带。
当使用停留时间测量时,基于特定组分通过传感装置花费的时间长度,组分的大小可以与特定的组分相关联。
更进一步,在针对聚合物单元检测的实施方式中,传感器在传感装置的远端可以包含酶,其中该酶能够将聚合物的末端单元与倒数第二个单元分离,从而提供了聚合物的单一分子单元。单一分子,如单一核苷酸或氨基酸,然后可以通过细孔转位,且可能被检测到或不被检测到。然而,当酶遇到结合的目标分子时,酶不能切割倒数第二个单元,且因此变为失速的(stalled)或跳跃到下一个可用切割位点,从而释放出与单一单元具有相当大小差异的片段,且因此被检测。检测可以如本申请中描述的用传感器来完成,或者用如质谱的方法进行检测。用来测量此类单元的方法是本领域已知的,且包括Cal Tech开发的那些方法(见,例如,spectrum.ieee.org/tech-talk/at-work/test-and-measurement/a-scale-for-weighing-single-molecules)。这种分析的结果可以与传感装置的结果进行比较以确认分析的准确性。
在一些实施方式中,传感器用与各个相关位点或各个相关目标分子形成不同的非共价键的试剂功能化。在这个方面,间隙足够大以允许有效测量。例如,当传感器用试剂功能化来检测dsDNA支架上5纳米的DNA特征时,可以用7.5纳米的间隙,因为DNA宽2.5纳米。
用功能化传感器的通道传感称为“识别隧道效应(recognition tunneling)”。使用当前技术,带有识别隧道效应的扫描隧道显微镜(STM)识别在侧邻短DNA低聚物中的其它碱基的DNA碱基。正如已描述的,识别隧道效应可以对于使用者期望检测的分子提供对于独特定向的氢键设计的“通用阅读器”。大多数报道的是核酸的识别,但是,它在本文中被修改以用于检测支架上的目标分子。
常规识别隧道效应的一个局限是,它仅可以检测随机结合在间隙中或在显微镜运动过程中恰好处入间隙中的的自由扩散的分子,没有在间隙中明确捕获的方法。然而,STM设备的共同缺点可以通过在纳米细孔通道的电极隧道间隙内并入对于灵敏度优化的识别试剂来消除。
因此,在一个实施方式中,传感器包括用试剂进行的表面修饰。在一个方面,该试剂能够与每个相关位点或粘附的目标分子形成非共价键。在特定的方面,所述键为氢键。试剂的非限制性的例子包括4-巯基苯甲酰胺和1-H-咪唑-2-甲酰胺。
此外,本技术的方法可以为一个或多个识别隧道位点提供DNA传递速率控制,各识别隧道位点位于一个或两个纳米细孔通道中,且电压控制可确保每个目标分子停留于各个位点用于稳健识别的充分时间。
本公开的装置和方法中的传感器可以包含金、铂、石墨烯或碳,或者其他合适的材料。在特定的方面,传感器包括由石墨烯制成的部件。石墨烯可以起到导体和绝缘体的作用,因此通过石墨烯和跨纳米细孔的隧道电流可以测序转位DNA。
在一些实施方式中,隧道间隙的宽度为约1纳米至约20纳米。在一个方面,间隙的宽度为至少约1纳米,或者可选地至少约1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、12或15纳米。在另一个方面,间隙的宽度不大于约20纳米,或者可选地不大于约19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3或2纳米。在一些方面,此宽度在约1纳米与约15纳米之间,在约1纳米和约10之间纳米,在约2纳米和约10纳米之间,在约2.5纳米和约10纳米之间,或在约2.5纳米和约5纳米之间。
在其它实施方式中,隧道间隙适用于检测微米级颗粒(如病毒、细菌和/或细胞),且宽度约1000纳米到约100000纳米。在一些实施方式中,间隙宽度在约10000纳米和80000纳米之间,或在约20000纳米和50000纳米之间。在另一个实施方式中,间隙宽度在约50000纳米和100000纳米之间。在一些实施方式中,间隙宽度不大于100000纳米、90000纳米、80000纳米、70000纳米、60000纳米、50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、5000纳米、4000纳米、3000纳米、2000纳米或1000纳米。
在一些实施方式中,所述传感器是电传感器。在一些实施方式中在通过的目标分子或者可测标记具有独特的荧光印记时,传感器检测荧光检测手段。细孔出口处的辐射源可以用来检测该印记。
实施例
本技术进一步参考以下实施例和实验进行定义。对于本领域技术人员明显的是许多修饰可以在不背离本发明的范围的情况下实行。
实施例部分开始首先指出了在生物标志物检测中使用聚合物支架和融合分子的主要原因。主要理由是,在特定大小阈值以下的单独生物标志物用纳米细孔是检测不到的,如Calin Plesa,Stefan W.Kowalczyk,Ruben Zinsmeester,Alexander Y.Grosberg,Yitzhak Rabin,和Cees Dekker,“Fast translocation of proteins through solid state nanopores.”Nano letters 13,no.2(2013):658-663中对于不同大小的蛋白质证明的。此外,即使那些可检测的生物标志物也可能是不可分辨的。生物标志物产生与大小/电荷相当的所有其它分子相同的纳米细孔印记,从而无法区分。通过使用支架和融合分子,这两个问题都可以避免。特别地,我们通过实施例证明,对支架上的代表性融合分子的检测是可以完成的,且进一步地对于支架上融合分子的目标分子也可以检测。有了这种能力,通过对融合分子的配体结构域适当改造以实现对感兴趣的目标分子的特异性可以实现区分。
实施例1:固态纳米细孔实验中的单独DNA
纳米细孔装置使用灵敏的电压钳放大器在测量通过开放细孔的离子电流I0的同时施加跨细孔的电压V(图6a)。当单个带电分子如双链DNA(dsDNA)被捕获并通过电泳驱动通过细孔时(图6b),测得的从I0至IB的电流偏移及偏移量ΔI=I0-IB和持续时间tD用来表征事件。在实验过程中记录多个事件后,对这些事件的分布(图6c)进行分析来表征相应分子。这样,纳米细孔为生物分子测定提供了一种简单、无标记、纯电子的单分子方法。
在图6所示的DNA实验中,在氮化硅(SiN)基底中制造的单一纳米细孔是在100纳米厚SiN膜中的直径40纳米的细孔(图6a)。图6b中,代表性的电流迹线显示了由5.6kb的dsDNA在200毫伏和1M氯化钾下以单行方式(未折叠)通过一个10纳米厚SiN中的11纳米直径细孔引起的堵塞事件。平均开放通道电流I0=9.6纳安,平均事件振幅IB=9.1纳安,和持续时间tD=0.064毫秒,偏移幅度ΔI=I0-IB=0.5纳安。图6C中,散点图展示了在16分钟内记录的所有1301个事件的|ΔI|相对tD。
在图7所示的DNA实验中,单独dsDNA在100mM KCl下导致电流增强事件。这在Smeets,Ralph MM等人发表的研究“Salt dependence of ion transport and DNA translocation through solid-state nanopores.”Nano Letters 6.1(2006):89-95)中证明。此研究表明,尽管对于0.4M的氯化钾浓度振幅偏移ΔI=I0-IB>0,该偏移对于低于0.4M的氯化钾浓度具有相反的极性(ΔI<0)。由于这是氯化钾浓度低于0.4M的负电压(-200毫伏)试验,我们看到,相对于基线(315),DNA事件具有与图3C中所示的相同的极性(316)。
实施例2-结合于DNA支架的VspR蛋白和纳米细孔检测
VspR蛋白是来自霍乱弧菌的90kDa蛋白质,其以高微摩尔亲和力直接结合dsDNA(见参考文献:Yildiz,Fitnat H,Nadia A.Dolganov和Gary K.Schoolnik,“VpsR,a Member of the Response Regulators of the Two-Component Regulatory Systems,Is Required for Expression of Biosynthesis Genes and EPSETr-Associated Phenotypes in Vibrio cholerae 01 El Tor.”Journal of bacteriology 183,No.5(2001):1716-1726)。在使用纳米细孔技术的目标检测的这一实例中,VspR作为具有位点特异性DNA结合结构域以及配体特异性结合位点的融合分子发挥作用,此配体特异性结合位点可针对检测多种目标(包括抗体或糖)的目的进行工程化。在这个示例中,我们证明了DNA支架上的VspR作为模型融合分子的检测。支架包含10个VspR特异性结合位点(图8)。为了保持VspR对于dsDNA结合的亲和力,我们使用0.1M KCl,在此盐浓度下单独DNA的转位引起电流增强,如实施例1和图7所示。5.631kb的DNA支架共包含10个VspR结合位点:一种序列(14个碱基对)的5个,不同序列(18个碱基对)的3个,和第三序列(27个碱基对)的2个。这三种不同的序列可能不以相同亲和力结合VspR。在实验中,VspR蛋白浓度在记录缓冲液中为18nM,且在标记(结合步骤)过程中为180nM。这造成VspR蛋白质相对于DNA上的结合位点18倍过量。实验在pH 8(VspR蛋白的pI为5.8)的条件下进行。将Kd和DNA浓度纳入考虑中,仅0.1-1%的DNA应该被VspR完全占据,更大百分比被部分占据,且未知的一定剩余百分比的DNA完全没有结合。在纳米细孔实验过程中溶液中还存在游离VspR蛋白。
图9显示了两个代表性的事件。在采用VspR的实验中,VspR浓度为18nM(1.6毫克/升),10nM结合位点。支架浓度为1nM,导致每6.6秒的捕获。从这一点看,使用10ul样品的理论灵敏度为116pM(0.01毫克/毫升)。细孔大小为直径和长度15纳米。电压为-100毫伏,并注意到负电压产生负电流,所以向上的偏移对应于衰减事件,如对于VspR结合DNA事件显示的(图9b),而向下偏移产生正向偏移,如对于未结合DNA支架事件显示的(图9a)。这和图3C中的理想化信号模式和条件一致,DNA的事件(316)相比于融合分子结合的DNA事件(320)具有更快的持续时间和相反极性。因此,这一附图的关键现象是,与未结合DNA事件相比,VspR结合事件具有相反的信号极性。图10展示了另外10个代表性的电流衰减事件,其与VspR结合的支架通过细孔一致。在10分钟的记录中有90个这样的事件,与每6.6秒1个VspR结合事件相对应。事件是振幅上50到150皮安的衰减和0.2到2毫秒的持续时间。如所述的,图9-10中向下事件对应电流增强事件,和向上偏移事件对应电流衰减事件,且尽管基线为显示目的归零,这种偏移方向被保持。
实施例3-结合DNA支架的RecA蛋白和纳米细孔检测
RecA蛋白构成融合分子的元件,且这一实施例证明了利用这些元件来检测目标生物标志物的能力。具体而言,融合分子由RecA的结合DNA的部分(即DNA结合结构域)和RecA引诱生物标志物(抗RecA蛋白抗体)的部分(表位)组成。DNA和RecA蛋白实验首先在抗RecA蛋白抗体不存在和然后在其存在的情况下进行。
试剂DNA/RecA由包被在RecA中的5.6kb的dsDNA支架分子组成。RecA是参与DNA修复的38kDa的细菌蛋白,其能够沿着dsDNA聚合(见[C Bell,Structure and mechanism of Escherichia coli RecA ATPase.Molecular microbiology,58(2):358-366,2005年1月])。此试剂通过将60nM的支架与112μM的RecA蛋白在10mMγ-S-ATP、70mM Tris-HCl pH 7.6,10mM MgCl和5mM DTT(New England Biolabs)中孵育而产生。γ-S-ATP被包括是因为在RecA结合ATP的情况下RecA以更高亲和力与dsDNA结合。由于RecA可以将ATP水解为ADP,从而降低其对DNA的亲和力,不可水解的γ-S-ATP类似物会阻止了这种向ADP的转化,且因此维持较高亲和力的状态。尽管RecA与DNA的比率为每个可能的3-bp结合位点一个RecA分子,我们预期不是所有的RecA蛋白都结合且因此溶液中存在游离的RecA,正如在其它纳米细孔研究中观察到的(见Smeets,R.M.M.,S.W.Kowalczyk,A.R.Hall,N.H.Dekker和C.Dekker,“Translocation of RecA coated double-stranded DNA through solid-state nanopores.”Nano letters 9,NO.9(2008):3089-3095以及Kowalczyk,Stefan W.,Adam R.Hall和Cees Dekker,“Detection of local protein structures along DNA using solid-state nanopores.”Nano letters 10,NO.1(2009):324-328)。DNA/RecA样品然后调节到1M氯化钾或氯化锂,10mM EDTA,并在纳米细孔实验中测试,或者过量RecA蛋白采用凝胶过滤除去(Thermo Scientific Spin Columns)。
在一组实验中,我们使用了在30纳米厚的SiN膜中形成的16-18纳米直径的细孔,在pH 8的1M氯化钾中施加180毫伏电压。在单独的对照实验中,未结合的5.6kb dsDNA支架产生95%在2100-400皮安的范围内和530-500微秒的事件。而且,游离RecA事件为2100-600皮安和20-200微秒。最后,RecA结合DNA事件通常为更深的堵塞,范围在0.51-3纳安,持续时间更长(0.200-3毫秒)。RecA结合DNA的代表性事件如图11和图12所示。这些事件具有有趣的模式,在Kowalczyk等人的论文[“Detection of local protein structures along DNA using solid-state nanopores.”Nano letters 10,no.1(2009):324-328]中,作者试图推断结合到各个DNA的RecA纤丝的位置和长度;然而,这是推测性的,因为它假设了均一的细孔通过速率,虽然另一项研究表明dsDNA不以均匀的速率通过细孔[Lu,Bo等人,“Origins and consequences of velocity fluctuations during DNA passage through a nanopore.”Biophysical journal 101.1(2011):70-79]。图13a和图13c分别在垂直轴上展示了最大和平均电流偏移(通过电压归一化),和在水平轴是显示事件持续时间。两个事件图表都在10分钟内记录1385个事件。振幅通过电压归一化从而给出事件电导偏移值,这在纳米细孔的研究论文中是常见的。例如,在200毫伏时14nS的平均电导等同于2.8纳安的平均电流大小。在振幅(或等价地,电导)和持续时间中存在两个可观测的亚群,更深和更长持续时间事件可归因于RecA结合的DNA,且更快更浅的事件可归因于溶液中的游离RecA。我们通过进行单独RecA对照实验验证了作为游离RecA的更快更浅亚群的身份。这也在早期研究[Smeets,R.M.M.,S.W.Kowalczyk,A.R.Hall,N.H.Dekker和C.Dekker,“Translocation of RecA coated double-stranded DNA through solid-state nanopores.”Nano letters 9,NO.9(2008):3089-3095]中得到验证。察看最大电流偏移值(图13a-b)而不是平均值(图13c-d)使得亚群事件更明显。注意,RecA结合DNA与未结合DNA事件模式与图3A中的模型信号模式相一致。
在单独的实验中,RecA蛋白抗体用于证明目标抗体的检测。通过将一纳摩尔的DNA/RecA与以1:10000稀释的抗RecA单克隆抗体(ARM191,Fisher Scientific)或者多克隆抗血清RecA(由马萨诸塞大学医学院教授Ken Knight博士惠赠)孵育30分钟,DNA/RecA试剂结合抗体生物标志物而形成DNA/RecA/Ab复合体。电泳迁移率变动实验,1x TBE缓冲液中的5%TBE聚丙烯酰胺凝胶,通过将复合体与仅DNA或适当的对照的迁移进行比较用于测试DNA/RecA和DNA/RecA/抗体复合体。
纳米细孔实验利用不同直径的细孔中以200毫伏在1M氯化锂中进行:在单独DNA对照过程中20纳米,且然后在加入RecA结合的DNA复合体后扩大到27纳米。在凝胶迁移实验中,图14a展示了DNA/RecA/mAb高于DNA/RecA的明显偏移,其则远高于5.6kb dsDNA支架。此复合体用纳米细孔实验性地测试。具体来说,0.1nM DNA被添加到细孔上方的腔室,且在10分钟的记录后,加入1.25nM的DNA/RecA。在另一记录期后,加入1.25nM DNA/RecA/mAb。在溶液中具有Ab结合的复合体时,观察到与其他两种复合体类型(DNA、DNA/RecA)特有的事件模式不匹配的新的多层事件类型(图14b)。在每个实验阶段中记录的事件的ΔI相对于tD的分布(图14)表明,RecA结合DNA事件的持续时间tD更长,且多达3倍的事件的平均振幅偏移ΔI在加入DNA/RecA/mAb后大于0.6nA。在这一数据集中用于标记事件为Ab结合的简单标准是(ΔI,tD)>(0.6纳安,0.2毫秒)。确定在未结合DNA事件中几乎不存在但在RecA结合事件(有或没有也结合到DNA/RecA的抗体)的很大部分中存在的最佳印记对于纳米细孔上方溶液中RecA结合DNA复合体的存在的检测是有用的。为了抗体检测的目的,我们在此基础上更进一步,旨在确定在未结合DNA和RecA结合DNA事件类型中几乎不存在但在具有也结合到DNA/RecA的抗体的RecA结合事件的很大部分中存在的最佳印记。这为纳米细孔上方溶液中RecA结合DNA复合体的存在的检测提供了标准。由于这些DNA和RecA和RecA抗体实验是在高于0.4M的KCl浓度下用正电压完成的,我们看到在图14b中的事件模式与图3A中的理想化模式相当。
实施例4:包含PNA和生物素的融合分子用于目标蛋白检测
前面的实施例探讨了与RecA包被dsDNA复合体结合的RecA抗体的检测。由于RecA非特异性地结合3bp区域,且因此RecA抗体可以结合dsDNA上的任何RecA,也希望的是证明允许目标特异性结合于特定位点的途径。特别地,我们使用5.6kb的dsDNA支架,其经工程化以结合12聚体肽-核酸(PNA)分子,其中各个PNA有3个用于结合抗生物素蛋白家族成员(例如,中性抗生物素蛋白和/或单价链霉亲和素)的生物素化位点(图15a)。支架有25个不同位点,其一直可以定位高达75个抗生物素蛋白生物标志物结合位点(图15b)。我们的数据(图16)表明,DNA/PNA/Neut引起高于其他背景事件类型(单独未结合DNA、单独中性抗生物素蛋白、单独PNA/中性抗生物素蛋白)的可检测的事件印记,且因此可以被标记为完全组装(即DNA/PNA/中性抗生物素蛋白)事件。在此设定中,正是完全组装的DNA/PNA/中性抗生物素蛋白复合体起到支架+融合分子的作用。在实施例的其余部分中,我们提供了足够的细节来证明DNA/PNA/中性抗生物素蛋白复合体可以用纳米细孔来检测。
在此设定中,融合分子含有两个独立的结构域,一个结合独特的DNA序列和另一个结合到抗中性抗生物素蛋白抗体。DNA结合结构域是蛋白质核酸分子(PNA),其结合在整个支架上重复25次的独特序列(GAAAGTGAAAGT,uSeq1)(图15b)。PNA分子类似于具有A、T、C、G碱基的寡核苷酸,其能够与其互补序列配对,但是与磷酸酯骨架样典型寡核苷酸相反,其骨架是蛋白质。这消除了由磷酸酯骨架提供的负电荷,且因此,PNA分子可以通过置换互补DNA链来并入dsDNA中,从而对涵盖PNA分子的短延伸片段产生新的DNA/PNA杂合体。实验中采用的PNA的序列为GAA*AGT*GAA*AGT,其中*表示生物素通过与赖氨酸偶联在γ位点并入PNA骨架中,且因此每个PNA有三个生物素分子(PNABio)。为了产生融合分子结合支架,60nM支架加热至95摄氏度2分钟,冷却至60摄氏度并与10倍过量的针对可能结合位点的PNA在15mM NaCl中孵育1小时,然后冷却到4摄氏度。过量的PNA在10mM Tris-HCl pH 8中透析(20k MWCO,Thermo Scientific)2小时。此DNA/PNA复合体然后用10倍过量中性抗生物素蛋白蛋白(Pierce/Thermo Scientific)标记到可能的生物素位点(假设透析过程中PNA 60%还原)。反应如之前描述的进行电泳以评估度、浓度和潜在聚集。这一试剂DNA/PNA/中性抗生物素蛋白(D/P/N)存储在-20摄氏度下备用。
图17a-b显示的数据比较了来自三个独立实验(单独DNA、单独中性抗生物素蛋白和D/P/N试剂)的ΔI相对于tD的分布。在D/P/N实验中最大的|ΔI|事件最有可能是因为D/P/N复合体(图16d),从而为将事件标记为融合分子结合的(即,具有结合的PNA和中性抗生物素蛋白的支架)提供了简单的标准。具体来说,如果对于该事件|ΔI|>4纳安,我们可以标记事件为“融合分子结合的”。对于图17中的数据集,D/P/N实验中9.3%(390)的事件|ΔI|>4纳安,而在对照中仅0.46%的D事件和0.16%的N事件超过4纳安。在使用7纳米直径细孔,1M KCl,200毫伏施加电压的独立实验中(数据未显示),在0.4nM浓度下仅PNA和中性抗生物素蛋白的对照中,没有事件(0%)超过4纳安。应用我们的数学标准,随机变量Q={标记事件的分数}具有二项分布,并利用这一和其它统计建模工具,我们可以计算这一数据集的99%置信区间为Q=9.29±1.15%。因为9.29%>0.46%(最大的假阳性%)完全满足Q的99%置信区间,我们具有阳性测试结果,且在8分钟数据采集内。事实上,同样的99%置信区间对于仅具有前60秒数据的这个数据集获得。凝胶迁移(图17c)表明,支架DNA迁移以中性抗生物素蛋白依赖性的方式迟滞;这引导我们在这一初步实验中使用10倍浓度,因此表现为所有DNA被标记且产生近乎同质的群体。我们没有看到DNA/PNA复合体的偏移,虽然在使用了较短DNA的另一个DNA/PNA纳米细孔研究中观察到偏移(Alon Singer,Meni Wanunu,Will Morrison,Heiko Kuhn,Maxim Frank-Kamenetskii和Amit Meller,“Nanopore based sequence specific detection of duplex DNA for genomic profiling.”Nano letters 10,No.2(2010):738-742)。
需要明白,虽然本发明结合上述实施方式进行了描述,但上述描述和实施例旨在说明,而不是限制本发明的范围。本发明范围内的其他方面、优点和修改对于本发明所属技术领域的技术人员是明显的。
- 还没有人留言评论。精彩留言会获得点赞!