一种定量检测CD79α的酶联免疫试剂盒的制作方法
本发明属于生物
技术领域:
,涉及一种检测CD79α的酶联免疫检测试剂盒及其制备方法。
背景技术:
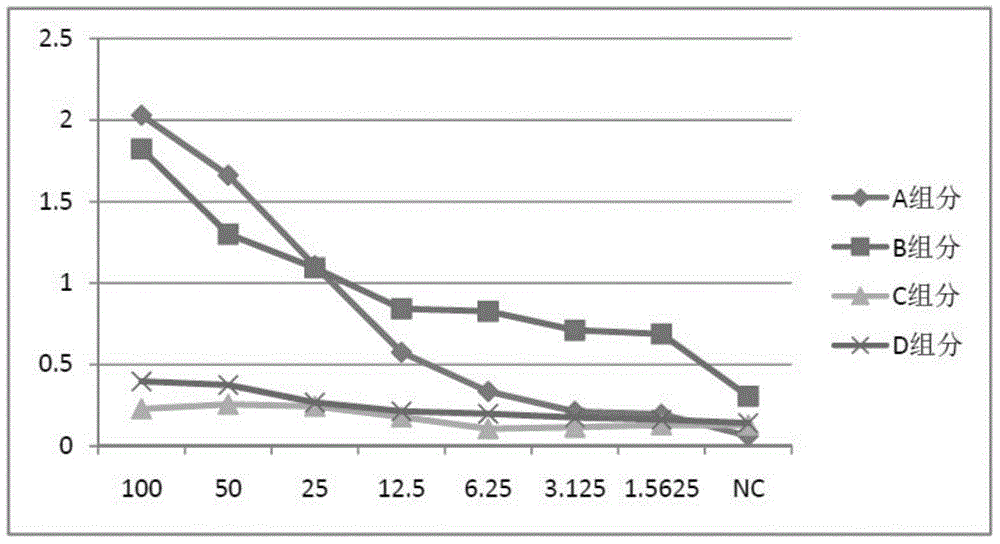
:CD79α属免疫球蛋白超家族(IgSF)成员。在B细胞淋巴瘤、大部分的急性B淋巴细胞白血病和骨髓瘤中阳性表达,作为CD20的一个辅助检测因子,广泛用于B细胞及其来源肿瘤的识别。CD79α表达的阳性部位在胞膜和胞浆。CD79α是B细胞的广谱标记物,从前B开始到成熟的浆细胞都可以标记。CD79α向B细胞末端分化调节过程中会与CD79β有部分免疫反应交叉。CD79α可用于B细胞淋巴瘤CD79α(+)、前B细胞急性淋巴细胞白血病(ALL)CD79α(+)和急性T细胞淋巴细胞白血病CD79α(-)的鉴别。临床上用于检测CD79α的方法主要是采用免疫组织化学,但这种方法实验过程操作较复杂,所需时间长,灵敏度低,不能进行定量分析,所用试剂对实验人员危害较大;所需仪器设备昂贵,技术水平要求较高,不利于临床快速检测。而且,采用免疫组织化学法需进行活检,收集样本费时费力。活检组织肿瘤切片要求熟练和细致的技术,做出非常好的切片很难,它要求厚薄均匀、切片完整;肿瘤细胞形态复杂,分化程度各异,对病理医生的经验和操作水平要求高。此外,CD79α蛋白在肿瘤细胞会分泌或破裂后渗透到循环系统中。因此,有必要开发新的定量检测CD79α的试剂盒。技术实现要素:针对现有技术的不足,本发明的目的是提供一种简便、快捷、实用、灵敏、高效的检测CD79α的酶联免疫试剂盒。本发明所述的一种定量检测CD79α的酶联免疫试剂盒,所述试剂盒包括:包被联合捕获抗体的酶标板、封闭液、洗涤液、CD79α标准品溶液、底物显色液、终止液、抗CD79α单抗检测抗体、辣椒过氧化物酶标记的链亲和素;其中,所述联合捕获抗体包括由CD79α蛋白免疫实验动物所得的抗CD79α多克隆抗体与抗CD79α单克隆抗体。根据本发明所述的酶联免疫试剂盒的进一步特征,所述联合捕获抗体的包被浓度为每种抗体10-100ng/100ul,检测抗体的浓度为200ng/ml。根据本发明所述的酶联免疫试剂盒的进一步特征,所述抗CD79α单抗是用序列为SEQIDNO:1的多肽制备。根据本发明所述的酶联免疫试剂盒的进一步特征,所述抗CD79α单抗是根据以下方法制备的:将纯化的序列为SEQIDNO:1的多肽与KLH偶联后免疫SPF级Balb/c鼠,所得小鼠脾脏与骨髓瘤细胞SP2/0融合后筛选得到3株杂交瘤细胞株,杂交瘤细胞分泌所得抗体用ProteinG/A亲和柱进一步纯化,得到抗CD79α单抗。根据本发明所述的酶联免疫试剂盒的进一步特征,所述的封闭液为pH7.2磷酸盐缓冲液中加入0.01%吐温20,5%的脱脂奶粉和多糖,其中多糖的浓度范围在0.5至10mg/ml之间,多糖选自:蔗糖、甘露糖、乳糖、海藻糖的一种或两种以上的组合。所述的CD79α蛋白用0.1mM的Isopropylβ-D-1-thiogalactopyranoside(IPTG)诱导CD79α所述的联合捕获抗体的浓度为每种抗体10-100ng/100ul,检测抗体的浓度为200ng/ml。所述的包被液为保证能够长期保存,于0.05MpH9.6的碳酸盐缓冲液中添加了0.01%的硫柳汞作为防腐剂。所述抗CD79α单抗是用序列为SEQIDNO:1的多肽制备。所述抗CD79α单抗是根据以下方法制备的:将纯化的序列为SEQIDNO:1的多肽与KLH偶联后免疫SPF级Balb/c鼠,所得小鼠脾脏与骨髓瘤细胞SP2/0融合后筛选得到3株杂交瘤细胞株,杂交瘤细胞分泌所得抗体用ProteinG/A亲和柱进一步纯化,得到抗CD79α单抗。所述的封闭液为pH7.2磷酸盐缓冲液中加入0.01%吐温20、5%的脱脂奶粉和起支持保护作用的多糖,其中多糖的浓度范围在0.5至10mg/ml之间,多糖类型可为蔗糖,甘露糖、乳糖,海藻糖其中的一种或几种组合。所述试剂盒抗原标准品的含量在1.5至100mg/ml之间。本发明所述的定量检测CD79α的酶联免疫试剂盒,其有益效果在于:(1)本发明克服膜蛋白不适于作为ELISA试剂的缺陷,采用特殊的纯化方式获得可溶性膜蛋白,再采用膜蛋白免疫动物获得多克隆抗体作为本发明试剂盒的捕获抗体,使试剂在反应体系中更加稳定。(2)采用了联合捕获抗体,由融合蛋白免疫实验动物所得的抗CD79α多克隆抗体与抗CD79α单克隆抗体组成,由此增加抗原抗体的结合位点,增加试剂盒的灵敏度,背景值低。因为CD79α的膜蛋白特性及不易包被在固相载体中,所以必须增加检测的灵敏度,而加入.01%吐温20是为了减少非特异吸附,刚好与弥补了联合抗体可能产生的假阳性。(3)本发明所述的试剂盒克服了传统的免疫组化方法的种种缺陷,其本试剂盒可测定到低至15mg/L的CD79α水平,能够用于白血病等血液肿瘤疾病的检测和危险性预测。(4)普通抗原抗体反应ELISA体系采用5%脱脂奶粉与1%牛血清白蛋白等传统封闭液,对膜蛋白抗原抗体反应体系的封闭效果往往很难令人满意,而本发明所述的试剂盒是通过使用加了多糖和吐温-20的封闭液,对于包被蛋白具有一定的保护作用,减少了非特异性吸附,特别是对于CD79α这类膜蛋白的构象有一定的支持作用。附图说明图1是单独抗CD79α抗体包被的ELISA试剂盒与联合抗体包被的ELISA试剂盒的灵敏度对比。图2是在相同条件下采用不同封闭液的对比实验结果。具体实施方式为使本发明更加容易理解,下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。实施例1:多克隆抗体的制备1.基因和蛋白序列的来源人CD79α基因序列可参见XM_002829281,来自NCBI。根据CD79α的基因序列,合成分别位于阅读框上游和下游的引物。上游引物:caccatggctgggggtccaggagtcctcca下游引物:ttctcgagtcacggcttctccagctggac人CD79α基因全长为681bp,编码226个氨基酸,其中N-端1至32位氨基酸为信号肽。蛋白序列来源:BAD97091,来自NCBI。用于制备单抗的多肽序列为CSRGLQGTYQDVGSLNIGDVQLEK(SEQIDNO.1)。2.表达质粒的构建和高表达工程菌株的获得表达载体构建方法:通过PCR扩增得到目的人CD79α基因,用NdeI+XhoI双切酶PCR产物及pET28a质粒将两个片段用T4DNA连接酶进行连接,连接产物转化进入大肠杆菌DH5α,在含有氨苄青霉素的LB平板上挑选克隆,小量制备质粒,通过双酶切/PCR鉴定筛选出阳性克隆。大量扩增确证的pET28a/CD79α质粒,用NdeI+XhoI双切酶鉴定;pET28a/CD79α质粒经测序验证后,转化进入大肠杆菌DE3,在含有氨苄青霉素的LB平板上挑选阳性克隆并进行质粒酶切鉴定,小量制备质粒,通过双酶切/PCR鉴定筛选出阳性克隆,获得含有CD79α的重组质粒工程菌。3.CD79α蛋白的表达纯化用0.1mM的Isopropylβ-D-1-thiogalactopyranoside(IPTG)诱导上述CD79α重组质粒工程菌DE3-pET28a,18℃过夜,低温诱导避免大量外源蛋白的表达对宿主菌产生的毒害。收集细菌,采用超声波破碎,经离心(12,000g,4℃)收集上清获得粗蛋白。粗蛋白采用0-0.02M的还原剂,4-8M的变性剂重悬。所述的还原剂可为巯基乙醇、TCEP或DTT,变性剂可为尿素或盐酸胍。粗提的融合蛋白跑SDS-PAGE电泳后,PAGE胶用4摄氏度预冷的0.1至0.5mol/L的KCL染色3min,切下目的条带捣碎放入透析袋内,将透析袋放在水平电泳槽上,加入PBS缓冲液跑1小时,将正负极反转再跑1小时后回收透析袋中的溶液,再放入冻干机中冻干。此法操作简单,不用反复换透析液,比常规的透析复性法更节省时间和更有效率。4.CD79α多抗的制备以上述纯化的CD79α蛋白免疫SPF级新西兰兔:初次免疫时将弗氏完全佐剂与抗原150μl(50μg)等体积混合,充分乳化后,皮下多点注射。2周后,对新西兰兔进行再次免疫,并改用弗氏不完全佐剂,注射体积和方法不变,此后每隔2周对新西兰兔继续免疫,共免疫3次。待新西兰兔血清效价达到要求后准备进行心脏采血,采血前三天对新西兰兔腹腔注射50μg抗原进行冲击免疫。5.CD79α抗体的制备纯化将上述抗CD79α抗血清采用GEHealthcare公司的HiTrapProteinG/A并将纯化后的抗体进行分装冻干。实施例2.CD79α单抗的制备采用常规方法制备单抗:用于制备单抗的多肽序列CSRGLQGTYQDVGSLNIGDVQLEK(SEQIDNO.1)与KLH偶联后免疫SPF级Balb/c鼠,所得小鼠脾脏与骨髓瘤细胞SP2/0融合后筛选得到3株杂交瘤细胞株,杂交瘤细胞分泌所得抗体用ProteinG/A亲和柱进一步纯化,得到抗CD79α单抗。采用间接ELISA从3株杂交瘤细胞株中挑选出1株与多抗组合为联合捕获抗体。实施例3:检测CD79α的酶联免疫试剂盒组建检测CD79α的酶联免疫试剂盒,使其所含下述组分:1.包被抗CD79α多抗和抗CD79α单抗和作为捕获抗体的酶标板;2.pH值为7.2,含5%脱脂奶粉,0.01%吐温20,海藻糖,0.1mol/L的磷酸盐缓冲液为封闭液;3.pH值为7.2,含0.5%吐温20,0.1mol/L的磷酸盐缓冲液的洗涤液;4.CD79α标准品溶液;5.底物显色液由显色液A和显色液B组成,显色液A液为过氧化氢,显色液B液为邻苯二胺或四甲基联苯胺;6.终止液为2M硫酸溶液;7.生物素化抗CD79α单抗(货号130-10122)作为检测抗体8.辣椒过氧化物酶标记的链亲和素。实施例4:检测CD79α的酶联免疫试剂盒的应用方法采用实施例3所构建的酶联免疫试剂盒采用双抗体夹心法来检测CD79α,具体检测步骤是:(1)包被:将捕获抗体固定在固相聚苯乙烯支撑物上,用包被液稀释(pH9.6碳酸盐溶液),4摄氏度包被12小时。其中联合捕获抗体的浓度范围为10-100ng每100ul;(2)封闭:采用pH值为7.2,含5%脱脂奶粉、0.01%吐温20、多糖、0.1mol/L的磷酸盐缓冲液,其中多糖的浓度范围在0.5至10mg/ml之间。(3)加入标准品与待测血清:将已知浓度的标准品按比例稀释加入微孔板中,设立空白对照。再将待测血清样本加入其它微孔板。(4)加入检测抗体:加入生物标记的检测抗体与链亲和素各孵育半个小时,检测抗体的浓度范围为200ng/ml。该检测抗体购自美国瑞博奥生物科技有限公司,货号为130-10122。(5)加入底物与终止液。实施例5:检测CD79α的酶联免疫试剂盒的质量分析1.本发明试剂盒的灵敏度按照实施例3的步骤加入各组分,将采用单独抗CD79α多克隆抗体,单独抗CD79α单克隆抗体包被的试剂与采用联合抗体包被的试剂盒进行对比实验。将CD79α抗原标准品配制成1.5625,3.125,6.25,12.5,25,50,100ng/100ul7个浓度梯度,按照优化后的ELISA条件测定,绘制标准曲线。如图1所示,ELISA检测方法的标准品线性范围为1.5625~100mg/L,采用联合抗体的结果比采用单独抗体的OD值高(最低检测值的1/2>对照值),提示增加了灵敏度。结果如下表1:标准品浓度(mg/L)OD450值(联合抗体)OD450值(单独多抗)OD450值(单独单抗)1002.032.6640.944501.6612.3570.794251.1061.7060.45512.50.5751.1750.1966.250.3340.8430.0793.1250.2110.7190.0671.56250.1950.5610.051NC0.0610.3710.0492.本发明试剂盒的特异性正确检定不存在的被检物质的能力(无假阳性),取决于联合捕获抗体和检测抗体的纯度及特异性。(1)包被:将捕获抗体固定在固相聚苯乙烯支撑物上,用包被液稀释(pH9.6碳酸盐溶液),4摄氏度包被12小时。其中捕联合获抗体的浓度范围为10-100ng每100ul;(2)封闭:采用pH值为7.2,含5%脱脂奶粉,0.01%吐温20,多糖,0.1mol/L的磷酸盐缓冲液,其中多糖的浓度范围在0.5至10mg/ml之间。(3)加入各个抗原蛋白:将已知浓度的抗原蛋白(CD79α,CD38,IGF1,CD23,CEBPB,角蛋白)稀释加入微孔板中。(4)加入检测抗体:加入生物标记的检测抗体与链亲和素孵育各半个小时,其中检测抗体浓度范围为200ng/ml。(5)加入底物与终止液。交叉反应结果如下表2:交叉反应物CD79αCD38IGF1CD23CEBPB角蛋白8OD检测值1.8230.1650.1490.1570.2120.161实施例6:封闭液的确定按照实施例3的步骤加入各组分,在相同条件下采用不同封闭液的对比实验。封闭液A,组分为:pH值为7.2,含5%脱脂奶粉,0.01%吐温20,多糖,0.1mol/L的磷酸盐缓冲液,其中多糖的浓度范围在0.5至10mg/ml之间。封闭液B,组分为:pH值为7.2,含5%脱脂奶粉,多糖,0.1mol/L的磷酸盐缓冲液,其中多糖的浓度范围在0.5至10mg/ml之间。封闭液C,组分为:pH值为7.2,含5%脱脂奶粉,0.1mol/L的磷酸盐缓冲液,。封闭液D,组分为:pH值为7.2,含1%酪蛋白钠盐,0.1mol/L的磷酸盐缓冲液。将CD79α抗原标准品配制成1.5625、3.125、6.25、12.5、25、50、100ng/100ul7个浓度梯度,按照优化后的ELISA条件测定,绘制标准曲线。比对结果如下表3:标准品浓度(mg/L)A组分B组分C组分D组分1002.031.8230.2270.396501.6611.30.2550.374251.1061.0930.2430.26612.50.5750.8420.1770.2126.250.3340.8270.1050.1973.1250.2110.710.1140.1741.56250.1950.6870.1280.161NC0.0610.3050.1280.14如图2所示,加入相同的标准品,检测采用不同封闭液的ELISA结果显示,A组封闭液背影值低,检测灵敏度最高,而未采用多糖的C、D组份检测灵敏度低。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1