丙烯酸的检测的制作方法
总体上,本发明涉及快速灵敏的用于检测丙烯酸或其衍生物的存在或不存在的方法。本发明还涉及用于检测丙烯酸或其衍生物的存在或不存在的探针。
背景技术:
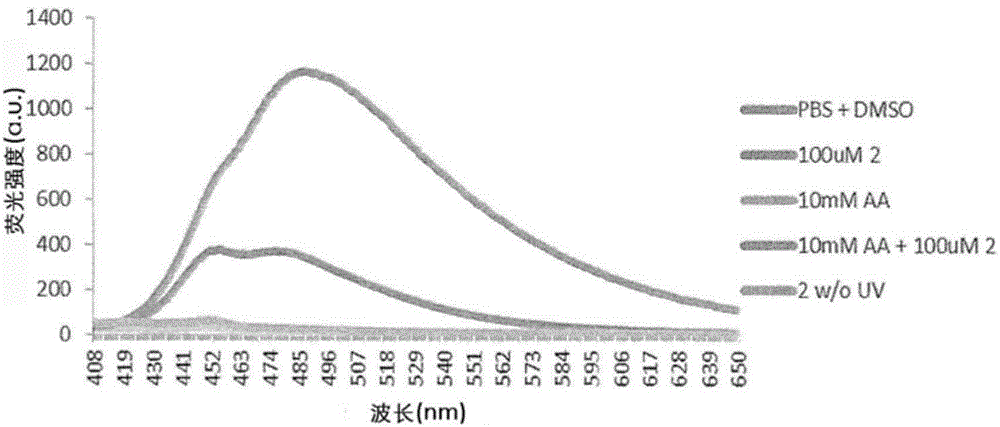
:丙烯酸可广泛用作用于工业生产宽范围的丙烯酸酯和聚合物的原料,用于诸如塑料、胶乳、超吸收聚合物、表面涂层、纺织品、粘合剂和密封剂的应用。2012年全球对丙烯酸的需求超过136亿美元,到2018年可能会增加到200亿美元。在丙烯酸的生产中通常使用的原料之一可以是丙烯,其通常可以衍生自石油化学来源。然而,近年来,通过替代的、可持续的、生物可再生来源来生产丙烯酸似乎很感兴趣。为了生产绿色丙烯酸(包括其衍生物)或者衍生自生物质和废弃物的那些丙烯酸,需要用灵敏的特异性测定法检测丙烯酸或其衍生物的能力。用于丙烯酸或其衍生物的快速高通量检测方法可以用于促进微生物丙烯酸生产者的菌株工程化和相关酶的工程化以改善体内丙烯酸生产。还可能需要高灵敏度的方法以提高确定任何丙烯酸或其衍生物的存在或不存在的准确性。这样的方法也可以用于检测来自塑料的丙烯酸酯污染物。这种高灵敏度的方法可用于检测由河流或饮用水中的丙烯酸酯污染物引起的环境污染。一些目前可用的用于检测丙烯酸或其衍生物的方法可以包括色谱方法,例如与质谱检测联用的气相色谱(GC)和高压液相色谱(HPLC)。然而,这些色谱方法中存在的限制可能包括繁琐的样品制备程序和待用作检测传感器的化合物的化学衍生化。这些方法倾向于具有低通量,并且可能不适合筛选大量化学品。因此,需要提供克服或至少改善上述一个或多个缺点的用于检测丙烯酸或其衍生物的存在或不存在的方法。这些优点中的一些可以包括改善的检测灵敏度和通量。该方法还应该能够更快速地检测丙烯酸或其衍生物的存在或不存在。还需要提供能够快速检测丙烯酸或其衍生物的存在或不存在的探针。该探针还应该能够克服或至少改善上述一个或多个缺点。技术实现要素:根据第一方面,提供用于检测样品中丙烯酸或其衍生物的存在或不存在的方法,所述方法包括以下步骤:(a)将包含二芳基四唑化合物的探针引入所述样品;(b)将所述样品暴露于光;以及(c)基于在所述步骤(c)之后由所述样品发射的荧光,检测所述样品中丙烯酸或其衍生物的存在或不存在。与常规的检测方法,例如气相或液相色谱相比,如上所述的方法允许快速和高通量感测。可以有利地消除对繁琐的样品提取/制备或待用作检测传感器的化合物的化学衍生化的需要。也可以减少庞大的检测设备的使用。能够通过该方法检测的丙烯酸或其衍生物可以包括但不限于丙烯酰胺、丙烯酸酯或其它基于丙烯酸盐/酯的化合物。有利地,依赖于二芳基四唑和丙烯酸或其衍生物之间的反应的本发明方法可以能够在光活化后的90秒内完成,从而提高检测速度。用于光活化的光可以是紫外光(UV)。如上述方法中所述的二芳基四唑化合物可具有式(I):其中R1至R10中的每一个独立地选自由以下组成的组:氢、氧、硫、卤素、羟基、任选地被取代的烷基、任选地被取代的酰基、任选地被取代的酯、任选地被取代的氨基、任选地被取代的胺、任选地被取代的酰胺、任选地被取代的羧酸、任选地被取代的羰基、任选地被取代的脲、任选地被取代的烷氧基、任选地被取代的烷基氧基、任选地被取代的烯基、任选地被取代的炔基、任选地被取代的磺酰胺、任选地被取代的氨基磺酰胺、任选地被取代的磺酰脲、任选地被取代的肟、任选地被取代的环烷基、任选地被取代的芳基、任选地被取代的杂环烷基和任选地被取代的杂芳基。有利地,所述二芳基四唑可以在R1至R10中的每一处独立地包含不同类型的任选取代基,用于提高检测的效率或准确性。特别地,所述二芳基四唑化合物可以选自由以下组成的组:在本发明方法的步骤(a)中引入的二芳基四唑化合物可以至少1nM的浓度存在于样品中。在如上所述的方法中,探针可以被生物素化。通过将生物素化试剂连接至探针,可以使用具有极高亲和力、快速结合速率和高特异性的物质例如抗生蛋白链菌素和抗生物素蛋白来分离生物素化探针。生物素化提高检测的准确性,因为它允许更有效地捕获生物素化探针。此外,生物素化探针-丙烯酸/丙烯酸衍生物缀合物的亲和纯化潜在地移除复杂(例如生物学)样品中存在的可能(例如通过自发荧光)混淆分析的物质。在所公开的本发明方法的步骤(b)中,暴露可以在10nm至1mm范围的任何波长下发生。特别地,波长可以是302nm。使用这些波长的检测有利地避免了使用复杂的发光源。所述样品暴露于光可以在酸性或碱性条件下发生。在如上所述的方法的步骤(b)中,暴露步骤可以进一步包括形成反应性中间体的步骤。该反应性中间体可以是包含腈亚胺偶极的化合物。该腈亚胺偶极能够与丙烯酸或其衍生物反应以产生吡唑啉环加成物,所述吡唑啉环加成物可以是荧光的。有利地,这些步骤允许通过荧光方法检测丙烯酸或其衍生物。因此,暴露于光后获得的荧光样品可以是包含荧光吡唑啉的环加成物。为了提高检测的准确性,在将探针引入含有丙烯酸或其衍生物的样品之前,丙烯酸或其衍生物可能必须以至少100nM的浓度存在。本发明方法可以用于检测微生物中丙烯酸或其衍生物的存在或不存在,而不在这些生物体例如细菌中诱导细胞毒性。根据另一方面,提供用于检测样品中丙烯酸或其衍生物的存在或不存在的探针,其中所述探针包含二芳基四唑化合物。该探针可以提供如上所述的优点。二芳基四唑化合物可具有如上所示的式(I)。如上所定义的探针可以选自由以下组成的组:有利地,探针可以如上所述被生物素化。根据另一方面,提供如上所定义的探针用于检测丙烯酸或其衍生物的存在或不存在的用途。以这种方式使用该探针提供如上所述的优点。根据另一方面,提供包含如上所定义的探针用于检测丙烯酸或其衍生物的存在或不存在的试剂盒,其中使所述探针与丙烯酸或其衍生物接触。该试剂盒能够提供如上所述的优点。定义本文所用的以下词语和术语应当具有所指示的含义:在下文或如本公开通篇所述的许多取代基的定义中,取代基可以是末端基团或桥连基团。此举旨在表明该术语的使用意在包括其中基团是分子的两个其它部分之间的连接体以及其中基团是末端部分的情况。使用术语烷基作为实例,一些出版物使用术语“亚烷基”用于桥连基团,因此在这些其它出版物中,术语“烷基”(末端基团)与“亚烷基”(桥连基团)之间有所区别。在本公开中,未作出这样的区别,大多数基团可以是桥连基团或末端基团。短语“任选地被取代的”广泛地意为该术语所指的基团可以未被取代,或者可以被一个或多个独立地选自但不限于以下的基团取代:氧、硫、卤素、烷基、酰基、酯、氨基、酰胺、羧酸、羰基、脲、烷氧基、烷基氧基、烯基、炔基、磺酰胺、氨基磺酰胺、磺酰脲、肟、环烷基、芳基、杂环烷基和杂芳基。通常,如果这些基团含有碳原子,则它们具有1至12个碳原子。本文所用的术语“卤素”或者变体例如“卤化物(halide)”或“卤代(halo)”是指氟、氯、溴和碘或者元素周期表的第17族元素。术语“烷基”可以指在链中具有1至12个碳原子或落在该范围内的任何数目的碳原子的直链或支链烷基。示例性烷基包括甲基(Me)、乙基(Et)、正丙基、异丙基、丁基、异丁基、仲丁基、叔丁基(tBu)、戊基、异戊基、叔戊基、己基、异己基等。术语“酰基”可以指-C(O)-R基团,其中R是任选地被取代的C1-C12-烷基、C2-C12-烯基、具有3至12个碳原子的环烷基,或者具有6个或更多个碳原子的芳基,或者具有1至3个选自N、S或O的杂原子的5至6元环杂环烷基或杂芳基。术语“酯”在其含义内包括-O-C(O)-烷基-和-C(O)-O-烷基-。本文所用的术语“氨基”可以指形式-NRaRb的基团,其中Ra和Rb分别选自包括但不限于以下的组:氢、任选地被取代的烷基、任选地被取代的烯基、任选地被取代的炔基和任选地被取代的芳基。术语“氨基”可以包括如下所定义的胺基团(即-NH2)或被取代的胺基团。本文所用的术语“酰胺”可以指形式-C(O)-NRc-烷基-的基团,其中Rc选自包括但不限于以下的组:氢、任选地被取代的烷基、任选地被取代的烯基和任选地被取代的芳基。本文所用的术语“胺”是指形式NRdRe-烷基-的基团,其中Rd和Re分别选自包括但不限于以下的组:氢、任选地被取代的烷基、任选地被取代的烯基和任选地被取代的芳基。“酰胺”和“胺”中的-烷基-可以任选地被取代,并且优选具有2至12个碳原子,更优选2至6个碳原子或者落在这些范围内的任何数目的碳原子。术语“羧酸”或变体例如“羧基”可以意指具有含-C(O)OH的基团的分子。术语“羰基”可以指具有基团Rf-C(O)-Rg的分子,其中Rf和Rg可以是任选地被取代的C1-C12-烷基、C2-C12-烯基、具有3至12个碳原子的环烷基,或者具有6个或更多个碳原子的芳基,或者具有1至3个选自N、S或O的杂原子的5至6元环杂环烷基或杂芳基。该术语可包括酮。本文所用的术语“烷氧基”或变体例如“醇盐”或“烷基氧基”可以指-O-烷基。代表性实例包括例如甲氧基、乙氧基、正丙氧基、异丙氧基、叔丁氧基等。术语“烯基”在其含义内包括具有2至12个碳原子或落在该范围内的任何数目的碳原子并且在烷基链中的任何位置具有至少一个呈E、Z、顺式或反式立体化学(当适用时)的双键的二价(“亚烯基”)直链或支链不饱和脂族烃基。烯基的实例包括但不限于乙烯基(ethenyl)、乙烯基(vinyl)、烯丙基、1-甲基乙烯基、1-丙烯基、2-丙烯基、2-甲基-1-丙烯基、2-甲基-1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1,3-丁二烯基、1-戊烯基、2-戊烯基、3-戊烯基、4-戊烯基、1,3-戊二烯基、2,4-戊二烯基、1,4-戊二烯基、3-甲基-2-丁烯基、1-己烯基、2-己烯基、3-己烯基、1,3-己二烯基、1,4-己二烯基、2-甲基戊烯基、1-庚烯基、2-庚烯基、3-庚烯基、1-辛烯基、1-壬烯基、1-癸烯基等。除非另有说明,否则本文所用的术语“炔基”可以指具有2至12个碳原子或落在该范围内的任何数目的碳原子并且含有至少一个三键的支链或非支链烃基,例如乙炔基(acetylenyl)、乙炔基(ethynyl)、正丙炔基、异丙炔基、正丁炔基、异丁炔基、叔丁炔基、辛炔基、癸炔基等。本文所用的术语“环烷基”可以指仅由碳和氢原子组成的稳定的非芳族单环或多环烃基,其可包括稠合或桥接的环系,具有3至15个碳原子或落在该范围内的任何数目的碳原子。“环烷基”可以通过单键连接至分子的其余部分。“环烷基”可以是饱和的,即仅含有C-C单键。单环环烷基的实例包括例如环丙基、环丁基、环戊基、环己基、环庚基和环辛基。本文所用的术语“芳族基团”或者变体例如“芳基”或“亚芳基”可以指具有6至12个碳原子或落在该范围内的任何数目的碳原子的芳族烃的一价(“芳基”)和二价(“亚芳基”)单环、多环、共轭和稠合基团。这种基团的实例包括苯基、联苯基、萘基、菲基等。术语“杂环烷基”可以指在至少一个环中含有至少一个选自氮、硫、氧的杂原子,优选1至3个杂原子的饱和单环、双环或多环的环。每个环可以是3至12元或者具有在该范围内的任何数目的碳原子。杂环烷基取代基的实例包括吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、哌嗪基、四氢吡喃基、吗啉基、1,3-二氮杂环庚烷、1,4-二氮杂环庚烷、1,4-氧氮杂环庚烷和1,4-氧硫杂环庚烷。术语“杂烷基”是指在链中具有2至12个原子或落在该范围内的任何数目的原子、其中一个或多个原子是选自S、O和N的杂原子的直链或支链烷基。示例性杂烷基包括烷基醚、仲烷基胺和叔烷基胺、烷基硫醚等。本文所用的术语“杂芳基”可以指包含约5至约12个环原子,优选约5至约10个环原子或落在该范围内的任何数目的原子、其中一个或多个所述环原子是单独或组合的除碳以外的元素(例如氮、氧或硫)的芳族单环或多环环系统。术语“杂芳基”还可以包括与如上所定义的芳基稠合的如上所定义的杂芳基。合适的杂芳基的非限制性实例包括吡啶基、吡嗪基、呋喃基、噻吩基、嘧啶基、吡啶酮(包括N-取代的吡啶酮)、异唑基、异噻唑基、唑基、噻唑基、吡唑基、呋咱基、吡咯基、吡唑基、三唑基、1,2,4-噻二唑基、吡嗪基、哒嗪基、喹喔啉基、酞嗪基、羟吲哚基、咪唑并[1,2-a]吡啶基、咪唑并[2,1-b]噻唑基、苯并呋咱基、吲哚基、氮杂吲哚基、苯并咪唑基、苯并噻吩基、喹啉基、咪唑基、噻吩并吡啶基、喹唑啉基、噻吩并嘧啶基、吡咯并吡啶基、咪唑并吡啶基、异喹啉基、苯并氮杂吲哚基、1,2,4-三嗪基、苯并噻唑基等。术语“杂芳基”还指部分饱和的杂芳基部分,例如四氢异喹啉基、四氢喹啉基等。杂芳基可以任选地被取代。词语“基本上”不排除“完全地”,例如“基本上不含”Y的组合物可完全不含Y。必要时,词语“基本上”可以从本发明的定义中省略。除非另有说明,否则术语“包含(comprising和comprise)”和其语法变体意欲表示“开放”或“包括性”用语,使得它们不仅包括所列举的要素,而且还允许包括其它未列举的要素。如本文所用,术语“约”在制剂的组分的浓度的背景下,通常意指所述值的+/-5%,更通常所述值的+/-4%,更通常所述值的+/-3%,更通常所述值的+/-2%,甚至更通常所述值的+/-1%,且甚至更通常所述值的+/-0.5%。在本公开通篇内,某些实施方案可以范围形式公开。应了解,呈范围形式的描述仅仅是为了方便和简洁且不应当被解释为对所公开范围之保护范围的硬性限制。因此,对一个范围的描述应当被认为已经具体地公开了所述范围内的所有可能的子范围以及单个数值。例如,范围诸如从1至6的描述应被认为具体地公开了子范围,诸如从1至3、从1至4、从1至5、从2至4、从2至6、从3至6等,以及该范围内的单个数值,例如1、2、3、4、5和6。这无关于范围的宽度而适用。某些实施方案在本文中也可以被广泛地和一般性地进行描述。落在一般性公开范围内的每个较窄的类和亚一般性的组也构成本公开的一部分。这包括具有从所述类中去除任何主题的附带条件或否定性限制的实施方案的一般性描述,无论所排除的材料是否在本文中具体叙及。具体实施方式现将公开如上所述方法的示例性、非限制性实施方案。所述用于检测样品中丙烯酸或其衍生物的存在或不存在的方法可包括以下步骤:(a)将包含二芳基四唑化合物的探针引入所述样品;(b)将所述样品暴露于光;以及(c)基于在步骤(c)之后由所述样品发射的荧光,检测所述样品中丙烯酸或其衍生物的存在或不存在。有利地,与常规方法例如但不限于GC、气相色谱质谱(GCMS)、液相色谱或HPLC等相比,该方法可以高通量提供丙烯酸或其衍生物的快速检测。该方法可以利用无毒性探针且因此允许本发明方法用于在体外或体内检测丙烯酸或其衍生物。可通过本发明方法检测的丙烯酸或其衍生物可包括但不限于丙烯酰胺、丙烯酸酯或任何其它基于丙烯酸盐/酯的化合物。这些丙烯酸盐/酯衍生物也可以是丙烯酸或其衍生物的任何丙烯酸盐、酯、共轭碱。基本上,这些衍生物或丙烯酸盐/酯可以含有乙烯基,即彼此双键键合的两个碳原子,其又直接连接至羰基碳。丙烯酸盐/酯或基于丙烯酸盐/酯的化合物还可以包括基于丙烯酸盐/酯的聚合物或甲基丙烯酸盐/酯(甲基丙烯酸的盐和酯)。如上所述的样品可以是含有丙烯酸或其衍生物的任何样品。所述样品可以包含微生物。该生物体可以是病毒、细菌、任何动物或植物细胞等。该生物体可以能够产生任何丙烯酸或其衍生物。产生丙烯酸的细菌的实例可包括丙酸梭菌(Clostridiumpropionicum)和埃氏巨球形菌(Megasphaeraelsdenii)。在本发明方法的步骤(a)中,可以将探针引入目标样品中。探针可以包含二芳基四唑化合物。所述二芳基四唑化合物可以具有式(I):其中R1至R10中的每一个独立地选自由以下组成的组:氢、氧、硫、羟基、卤素、任选地被取代的烷基、任选地被取代的酰基、任选地被取代的酯、任选地被取代的氨基、任选地被取代的胺、任选地被取代的酰胺、任选地被取代的羧酸、任选地被取代的羰基、任选地被取代的脲、任选地被取代的烷氧基、任选地被取代的烷基氧基、任选地被取代的烯基、任选地被取代的炔基、任选地被取代的磺酰胺、任选地被取代的氨基磺酰胺、任选地被取代的磺酰脲、任选地被取代的肟、任选地被取代的环烷基、任选地被取代的芳基、任选地被取代的杂环烷基、任选地被取代的杂烷基、任选地被取代的醇和任选地被取代的杂芳基。由式(I)涵盖的二芳基四唑化合物的一些实例可以选自由以下组成的组:特别地,所述二芳基四唑化合物可以是存在于式(I)的二芳基四唑化合物上的取代基R1至R10可影响其检测效力。如下文实施例1至7中所示,当用于检测相同的化合物例如丙烯酸时,不同的二芳基四唑化合物可以显示不同的荧光强度。对此的一种可能的解释是,当二芳基四唑与丙烯酸或其衍生物反应时,取代基R1至R10可能体积大并且因此引起空间位阻。另一种可能是取代基可以具有不同的电离程度,而一些假设不是所有的二芳基四唑化合物都以相同的方式反应。因此,不同程度的电离和取代可导致当二芳基四唑与丙烯酸或其衍生物反应时可形成的吡唑啉荧光团的光电子学中的变化的推拉效应。这种变化的光物理效应导致不同的荧光强度。因此,某些效应可能主导并影响二芳基四唑与丙烯酸或其衍生物的反应的动力学,其可进而影响荧光发射的速度或强度。用于本发明方法的探针可以被生物素化。任何生物素化试剂可以被连接或缀合至探针或二芳基四唑。这种生物素化试剂的实例可以是生物素。本领域技术人员已知的其它生物素化试剂可以与本发明方法的步骤(a)中使用的探针一起使用。生物素化探针或用作探针的二芳基四唑的优点是提高检测的效率和准确性。这是因为这些生物素化试剂可以结合例如抗生蛋白链菌素、抗生物素蛋白或中性链亲和素的特异性分子,所述特异性分子可以对这些生物素化试剂具有极高亲和力、快速结合速率和高特异性。这种相互作用可有助于分离生物素化探针,从而如实施例14中所示增强检测。一旦包含如上所定义的二芳基四唑化合物的探针与样品混合,可以如本发明方法的步骤(b)中所述将样品暴露于光。这种暴露有助于光活化反应。这种暴露可以在电磁谱的任何波长下发生。也可以使用落在电磁谱内的任何波长范围。暴露波长可以在10nm至1mm的范围内或者为落在该范围内的任何其它波长。特别地,可以使用302nm的波长。使用这种波长避免了对复杂的发光器件的需要。可以注意到,本发明方法涉及在二芳基四唑和丙烯酸或其衍生物之间的光活化的1,3-偶极环加成反应。在特定波长(例如302nm)下进行光照射时,二芳基四唑可经历裂环反应以产生高反应性腈亚胺偶极并释放氮气。该腈亚胺偶极随后可以与丙烯酸或丙烯酸酯亲偶极物质反应以产生在光活化时可以发射荧光的吡唑啉环加成物。基于上述,该方法可以进一步包括形成反应性中间体的步骤。当二芳基四唑与丙烯酸或其衍生物反应时可以形成该反应性中间体,可以基于与1,3-偶极环加成相同的机理。该反应性中间体可以是包含腈亚胺偶极的化合物。腈亚胺可以被分类为共享具有一般结构Rx-CN-NRy的共同官能团的一类有机化合物,所述官能团对应于键合到腈的N-末端的胺的共轭碱。因此,当在本上下文中使用时,Rx和Ry可以独立地为包含1至12个碳或落在该范围内的任何数目的碳原子的任选地被取代的有机部分。这种有机部分可以包含如对R1至R10所定义的任选取代基。根据本发明方法的步骤(c),样品在暴露于可见光或UV或任何其它形式的光照射后可变成荧光的。如果是这种情况,它可以指示丙烯酸或其衍生物的存在。如果在光活化或暴露于可见光或UV之后样品没有发射荧光,则样品中可能不存在丙烯酸或其衍生物。暴露于光之后的荧光样品可归因于包含荧光吡唑啉的环加成物。可以注意到,由吡唑啉环加成物发射的荧光强度可以取决于待检测的丙烯酸或其衍生物中存在的化学取代基。丙烯酸或其衍生物可具有与其连接的供电子或吸电子化学取代基,其可影响二芳基四唑反应。这些化学取代基可能体积大并且在二芳基四唑反应期间引起空间位阻。在如本文所定义的方法中,在将探针引入样品之前,丙烯酸或其衍生物可能需要以至少100nM、200nM、300nM、400nM或500nM的浓度存在。检测所需的丙烯酸的最小浓度可以为至少100nM、200nM、300nM、400nM或500nM。同时,检测丙烯酰胺所需的最小浓度可以为100nM至1μM。待检测的丙烯酰胺的最小浓度可以低于或高于100nM至1μM的范围。因此,当涉及检测其它基于丙烯酸盐/酯的衍生物时,这些浓度限值可不同。至于待使用的二芳基四唑化合物的浓度,其可需要为至少1nM、10μM或落在1nM至10μM之间的任何浓度。待使用的二芳基四唑化合物的浓度可以取决于丙烯酸或其衍生物的浓度。因此,检测所需的二芳基四唑化合物的浓度可以小于10μM。在可被检测到之前需要可用的丙烯酸或其衍生物的浓度也可以取决于所使用的二芳基四唑化合物的量。本发明方法可以在整个pH范围,即1至14进行。本发明方法可以在酸性、中性或碱性条件下进行。酸性条件可以在pH1至6的范围下发生,而碱性条件可以在pH8至14的范围下发生。中性条件可以在pH7下发生。因此,步骤(a)至(c)中的任一个可以在如上所述的任何pH条件下进行。特别地,在本发明方法的步骤(b)中的样品暴露于光可以在碱性条件下发生。根据本公开,可以存在用于检测样品中丙烯酸或其衍生物的存在或不存在的探针,其中所述探针包含如上所述的二芳基四唑化合物。所述二芳基四唑化合物可以具有式(I):其中R1至R10中的每一个独立地选自由以下组成的组:氢、氧、硫、羟基、卤素、任选地被取代的烷基、任选地被取代的酰基、任选地被取代的酯、任选地被取代的氨基、任选地被取代的胺、任选地被取代的酰胺、任选地被取代的羧酸、任选地被取代的羰基、任选地被取代的脲、任选地被取代的烷氧基、任选地被取代的烷基氧基、任选地被取代的烯基、任选地被取代的炔基、任选地被取代的磺酰胺、任选地被取代的氨基磺酰胺、任选地被取代的磺酰脲、任选地被取代的肟、任选地被取代的环烷基、任选地被取代的芳基、任选地被取代的杂环烷基、任选地被取代的醇、任选地被取代的杂烷基和任选地被取代的杂芳基。所述二芳基四唑化合物可以选自由以下组成的组:特别地,如上所述,所述二芳基四唑化合物可以是可以通过本发明的探针检测的丙烯酸或其衍生物如上所述。所述探针可以与样品混合,其中后者可以如上所定义。所述探针可用于体外或体内检测。样品可以包含或可以不包含丙烯酸或其衍生物。样品可以是如上所定义的微生物。可以将所述探针生物素化以增强检测。可能存在检测丙烯酸或其衍生物所需的探针的最小浓度。该浓度可以取决于样品中存在的丙烯酸或其衍生物的量。样品中探针的浓度可能需要为至少1nM、10μM或者1nM至10μM之间的任何浓度范围。探针的浓度可以取决于待检测的丙烯酸或其衍生物的浓度。因此,检测所需的探针的浓度可以小于或大于10μM。在将探针引入样品之前,丙烯酸或其衍生物可能需要以至少100nM、200nM、300nM、400nM或500nM的浓度存在。检测所需的丙烯酸的最小浓度可以为至少100nM、200nM、300nM、400nM或500nM。同时,丙烯酰胺被检测所需的最小浓度可以为100nM至1μM/100μM所用的探针或二芳基四唑。丙烯酰胺被检测所需的最小浓度可以在100nM至1μM之间或在该范围之外。当涉及检测其它基于丙烯酸盐/酯的衍生物时,上述浓度限值可能不同。当二芳基四唑与丙烯酸或其衍生物反应时,包含二芳基四唑化合物的探针可以发射荧光。所发射的荧光的强度和检测速度可以取决于如上所讨论的因素。本公开还提供如上所定义的探针用于检测丙烯酸或其衍生物的存在或不存在的用途。该探针可以包含如上所定义的二芳基四唑化合物,因此能够提供上述优点。根据本公开,可以存在包含如上所定义的探针的试剂盒。该试剂盒能够使任何使用者通过使所述探针与丙烯酸或其衍生物接触来检测丙烯酸或其衍生物的存在或不存在。基于上述公开内容,本发明方法还可进一步用于检测含有末端烯烃的化合物,其包括以下步骤:(1)将样品与生物素化探针一起孵育以形成混合物,(2)在适当的波长下照射所述混合物以使所述生物素化探针与可能存在于样品中的含有末端烯烃的化合物缀合,(3)使用抗生蛋白链菌素珠捕获缀合物,(4)充分洗涤珠并洗脱缀合物珠,以及(5)测量洗脱的缀合物的荧光,以确定样品中含有末端烯烃的化合物的不存在或存在。磁性抗生蛋白链菌素珠可用于帮助分离或捕获或收集缀合的珠。如上所述的待检测的化合物可以包含末端烯烃,并且这样的末端烯烃可以包括但不限于丙烯酸、丙烯酰胺或丙烯酸酯等。用于检测这样的化合物的试剂盒可以由任何本领域技术人员基于上述方法而获得。附图说明附图说明了所公开的实施方案并且用于解释所公开的实施方案的原理。然而,应了解,附图设计为仅用于说明的目的,而不是作为本发明限制的定义。[图1a]描绘了如实施例1中所例示的二芳基四唑化合物1(100μM,随10mM丙烯酸)的所得荧光发射光谱。[图1b]描绘了如实施例2中所例示的二芳基四唑化合物2(100μM,随10mM丙烯酸)的所得荧光发射光谱。[图1c]描绘了如实施例3中所例示的二芳基四唑化合物3(100μM,随10mM丙烯酸)的所得荧光发射光谱。[图1d]描绘了如实施例4中所例示的二芳基四唑化合物4(100μM,随10mM丙烯酸)的所得荧光发射光谱。[图1e]描绘了如实施例6中所例示的二芳基四唑化合物6(100μM,随10mM丙烯酸)的所得荧光发射光谱。[图1f]描绘了如实施例7中所例示的二芳基四唑化合物7(100μM,随10mM丙烯酸)的所得荧光发射光谱。[图2]描绘了如实施例9中所例示的二芳基四唑化合物4和各种浓度的丙烯酸之间的反应的荧光发射光谱。[图3]显示了如实施例9中所例示的在向100μM二芳基四唑化合物4中添加不同浓度的丙烯酸时荧光的增加倍数。[图4]显示了在254nm和370nm的两种UV吸光度下使用HPLC的实施例10的动力学研究,实施例10涉及二芳基四唑化合物4(表示为A)和丙烯酸之间的反应。[图5]显示了如实施例10中所例示的含有二芳基四唑化合物4和丙烯酸的反应混合物在不同时间间隔的荧光发射(开启)。[图6a]显示了当丙烯酸的浓度为100mM时比较实施例1的GCMS结果。[图6b]显示了当丙烯酸的浓度为100mM时比较实施例1的放大的GCMS结果。[图6c]显示了当丙烯酸的浓度为100mM时丙烯酸峰的质谱数据。[图7a]显示了当丙烯酸的浓度为10mM时比较实施例1的GCMS结果。[图7b]显示了当丙烯酸的浓度为10mM时比较实施例1的放大的GCMS结果。[图8a]显示了当丙烯酸的浓度为1mM时比较实施例1的GCMS结果。[图8b]显示了当丙烯酸的浓度为1mM时比较实施例1的放大的GCMS结果。[图9a]显示了当丙烯酸的浓度为750μM时比较实施例1的GCMS结果。[图9b]显示了当丙烯酸的浓度为750μM时比较实施例1的放大的GCMS结果。[图10a]显示了当丙烯酸的浓度为500μM时比较实施例1的GCMS结果。[图10b]显示了当丙烯酸的浓度为500μM时比较实施例1的放大的GCMS结果。[图11a]显示了当丙烯酸的浓度为250μM时比较实施例1的GCMS结果。[图11b]显示了当丙烯酸的浓度为250μM时比较实施例1的放大的GCMS结果。[图12a]显示了当丙烯酸的浓度为100μM时比较实施例1的GCMS结果。[图12b]显示了当丙烯酸的浓度为100μM时比较实施例1的放大的GCMS结果。[图13a]显示了当丙烯酸的浓度为10μM时比较实施例1的GCMS结果。[图13b]显示了当丙烯酸的浓度为10μM时比较实施例1的放大的GCMS结果。[图14a]显示了当不存在丙烯酸时比较实施例1的GCMS结果。[图14b]显示了当不存在丙烯酸时比较实施例1的放大的GCMS结果。[图15a]显示了在溶菌肉汤(Lysogenybroth)(LB)培养基中关于丙烯酸标准品的实施例11的荧光测定结果。[图15b]显示了在基础培养基中关于丙烯酸标准品的实施例11的荧光测定结果。[图16a]显示了基于实施例12的二芳基四唑与丙烯酸的反应的pH依赖性。[图16b]显示了基于实施例12的二芳基四唑与丙烯酰胺的反应的pH依赖性。[图17]比较了如实施例13中所示的在不同pH下丙烯酸和两种不同等级的丙烯酰胺的荧光测量。[图18]比较了如实施例13中所示的在各种浓度下检测的丙烯酰胺的荧光结果。[图19]比较了如实施例13中所示的在不同油介质存在下在复合有机/洗涤剂混合物中检测的丙烯酰胺的荧光结果。[图20]比较了如实施例13中所示的在不同油介质中检测的丙烯酰胺的荧光结果。[图21]显示了如实施例13中所示的对于丙烯酸和丙烯酰胺的荧光探针的pH依赖性。[图22a]显示了使用生物素化探针的关于各种浓度的丙烯酰胺的实施例14的荧光测量。[图22b]显示了使用未生物素化探针的关于各种浓度的丙烯酰胺的实施例14的荧光测量。[图22c]显示了如实施例14中所示的使用抗生蛋白链菌素珠对生物素化探针和未生物素化探针的分离效果。[图23]显示了使用生物素化探针的关于各种浓度的丙烯酰胺的实施例14的荧光测量。[图24]显示了如实施例15中所例示的使用化合物4在大肠杆菌中的丙烯酸的检测。在底部最右侧图中显示了小棒,其表示10μm的比例尺(参见图24底部右侧的DIC图像)。[图25a]描绘了如实施例15中所例示的在含有未处理、用丙烯酸、二芳基四唑化合物4或两者处理的5mM3-丁炔酸的培养基中生长的丙酸梭菌中存在的丙烯酸(和/或反应中间体)的检测。在底部最右侧图中显示了小棒,其表示2μm的比例尺(参见图25a底部右侧的DAPI图像)。[图25b]显示了从如图25a中所示的实验的细胞裂解物检测到的丙烯酸的荧光信号,使用荧光读板器对所述信号进行定量测量。[图26]显示了从丙酸梭菌和大肠杆菌的细菌细胞裂解物检测到的丙烯酸的荧光信号,所述丙酸梭菌和大肠杆菌在未处理(26a)或用5mM和10mM3-丁炔酸(分别为26b和26c)处理的培养基中生长。实施例将进一步参照具体实施例更详细地描述本发明的非限制性实施例和比较实施例,其不应被解释为以任何方式来限制本发明的范围。二芳基四唑的合成细节和吡唑啉产物的表征所有化学品和溶剂均购自商业来源并且未经纯化直接使用。使用SiliCycleP60硅胶(40-63μm,)进行快速色谱法。使用BrukerAvanceIII400记录1HNMR光谱,并且使用TMS或氘代溶剂作为内标(TMS,0.00;CDCl3,7.26;C6D6,7.15;DMSO-d6,2.50)以ppm报告化学位移。多重性报告如下:s=单峰,d=双峰,t=三重峰,q=四重峰,m=多重峰,b=宽峰。在75.4MHz下记录13CNMR光谱,并且使用氘代溶剂作为内标(CDCl3,77.0;DMSO-d6,39.5;C6D6,128.0)以ppm报告化学位移。使用Waters3100单四级杆LCMS系统进行LC-MS分析。使用PhenomenexKinetex2.6uXB-C18柱(50×4.6mm)进行动力学研究。流速为1mL/min,并且如图所示,UV检测设定为254nm和370nm。气相色谱在ShimadzuGCMSQP2010上使用30.0m×0.25mm,0.25μm内径的HP-INNOWAX柱进行,其以10℃/min从40℃至250℃程序化。使用TecanInfiniteM1000进行荧光检测。实施例1-二芳基四唑化合物1和吡唑啉产物1P的合成和表征下面的反应方案1a显示了二芳基四唑化合物1的反应途径。反应方案1a将4-甲酰基苯甲酸甲酯(0.824g,5mmol)溶于乙醇(50mL)中,并添加苯磺酰肼(0.863g,5mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤并用冷乙醇洗涤。然后将沉淀溶于吡啶(30mL)中用于下一反应。将苯胺(0.465g,0.46mL,5mmol)单独溶于水:乙醇(1:1,8mL)中,并添加浓HCl(1.3mL)。也将NaNO2(0.346g,5mmol)单独溶于水(2mL)中。将苯胺溶液在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至苯胺溶液中。将反应混合物在冰浴中逐滴添加至来自第一反应的冷却产物中。将反应混合物在室温下搅拌1小时。然后用乙酸乙酯(100mL×3)进行萃取。向合并的有机层中添加3MHCl(250mL),并剧烈搅拌10分钟。将有机层浓缩,并用己烷使产物沉淀。将产物进一步用冷己烷洗涤。己烷在用于洗涤产物之前在冰中孵育。用于洗涤的孵育己烷的温度为约0℃至10℃。在随后的实施例中重复这种冷却己烷温度的方法,以获得浅橙色固体(0.538g,38%)。1HNMR(400MHz,氯仿-d)δ8.35(dd,J=8.2,0.6Hz,2H),8.24-8.18(m,4H),7.63-7.56(m,2H),7.56-7.50(m,1H),3.97(s,3H)。13CNMR(101MHz,CDCl3)δ166.52,164.41,136.87,131.92,131.28,130.24,129.89,129.75,127.01,119.97,52.32。HRMS(ESI)C15H12N4O2的计算值为280.096[M+H+],实验值为280.096。下面的反应方案1b显示了吡唑啉产物1P的反应途径。反应方案1b将二芳基四唑化合物1(20mg,0.0713mmol)和丙烯酸(24.5μL,5摩尔当量)的4mL乙酸乙酯(EA)溶液用302nmUV灯照射3小时。通过减压移除过量的溶剂和试剂,以产生粗产物,随后通过硅胶柱色谱法(己烷(Hex):EA,1:1)对所述粗产物进行纯化。收集到作为黄色固体的产物1P。1HNMR(400MHz,HRMS(ESI)C18H16N2O4的计算值为324.1115[M+H+],实验值为324.111。实施例2-二芳基四唑化合物2和吡唑啉产物2P的合成和表征下面的反应方案2a显示了二芳基四唑化合物2的反应途径。反应方案2a将4-甲酰基苯甲酸甲酯(0.820g,5mmol)溶于乙醇(50mL)中,随后添加苯磺酰肼(0.862g,5mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤,用冷乙醇洗涤,并溶于吡啶(30mL)中以形成溶液A。然后将4-氟苯胺(0.555g,0.48mL,5mmol)溶于水:乙醇(1:1,8mL)和浓HCl(1.3mL)中。将NaNO2(0.345g,5mmol)溶于水(2mL)中。将两种混合物在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至4-氟苯胺溶液中以形成溶液B。在冰浴中将溶液B逐滴添加至溶液A中。然后将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(100mL×3)萃取。向合并的有机层中添加3MHCl(250mL),随后剧烈搅拌10分钟。将有机层浓缩,并用己烷使产物沉淀。将产物用冷己烷洗涤,以获得浅粉色固体(0.777g,52%)。1HNMR(400MHz,氯仿-d)δ8.36-8.29(m,2H),8.24-8.16(m,4H),7.29(dd,J=9.1,7.9Hz,2H),3.97(s,3H)。13CNMR(101MHz,CDCl3)δ166.46,164.49,164.40,161.91,131.97,131.07,130.24,126.97,121.96,121.87,116.90,116.67,52.33。HRMS(ESI)C15H11FN4O2的计算值为298.0865[M+H+],实验值为298.0866。下面的反应方案2b显示了吡唑啉产物2P的反应途径。反应方案2b将二芳基四唑化合物2(20mg,0.0671mmol)和丙烯酸(23μL,5摩尔当量)的4mL乙酸乙酯溶液用302nmUV灯照射3小时。通过减压移除过量的溶剂和试剂,以产生粗产物,随后通过硅胶柱色谱法(己烷:EA,1:1)对所述粗产物进行纯化。收集到作为黄色固体的产物2P。1HNMR(400MHz,HRMS(ESI)C18H15FN2O4的计算值为342.1022[M+H+],实验值为342.1016。实施例3-二芳基四唑化合物3和吡唑啉产物3P的合成和表征下面的反应方案3a显示了二芳基四唑化合物3的反应途径。反应方案3a将4-甲酰基苯甲酸甲酯(0.820g,5mmol)溶于乙醇(50mL)中,随后添加苯磺酰肼(0.859g,5mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤,用冷乙醇洗涤,并溶于吡啶(30mL)中以形成溶液A。然后将2,4-氟苯胺(0.645g,0.50mL,5mmol)溶于水:乙醇(1:1,8mL)和浓HCl(1.3mL)中。将NaNO2(0.345g,5mmol)溶于水(2mL)中。将两种混合物在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至2,4-氟苯胺溶液中以形成溶液B。在冰浴中将溶液B逐滴添加至溶液A中。然后将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(100mL×3)萃取。向合并的有机层中添加3MHCl(250mL),并剧烈搅拌10分钟。将有机层浓缩,并用己烷使产物沉淀。将产物用冷己烷洗涤,以获得红色固体(0.173g,11%)。1HNMR(400MHz,氯仿-d)δ8.35-8.30(m,2H),8.23-8.18(m,2H),7.91(td,J=8.6,5.6Hz,1H),7.19-7.10(m,2H),3.97(s,3H)。13CNMR(101MHz,CDCl3)δ206.88,129.90,129.11,127.89,127.14,77.32,77.20,77.00,76.68,30.89。HRMS(ESI)C15H10F2N4O2的计算值为316.0765[M+H+],实验值为316.0772。下面的反应方案3b显示了吡唑啉产物3P的反应途径。反应方案3b将二芳基四唑化合物3(20mg,0.0633mmol)和丙烯酸(21.7μL,5摩尔当量)的4mL乙酸乙酯溶液用302nmUV灯照射3小时。通过减压移除过量的溶剂和试剂,以产生粗产物,随后通过硅胶柱色谱法(己烷:EA,1:1)对所述粗产物进行纯化。收集到作为黄色固体的产物3P。1HNMR(400MHz,HRMS(ESI)C18H14F2N2O4的计算值为360.0929[M+H+],实验值为360.0922。实施例4-二芳基四唑化合物4和吡唑啉产物4P的合成和表征下面的反应方案4a显示了二芳基四唑化合物4的反应途径。反应方案4a将4-甲酰基苯甲酸(1.000g,6mmol)溶于乙醇(100mL)中,随后添加苯磺酰肼(1.160g,6mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤,用冷乙醇洗涤,并溶于吡啶(30mL)中以形成溶液A。然后将苯胺(0.587g,0.60mL,5mmol)溶于水:乙醇(1:1,8mL)和浓HCl(1.3mL)中。将NaNO2(0.455g)溶于水(2mL)中。将两种混合物在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至苯胺溶液中以形成溶液B。在冰浴中将溶液B逐滴添加至溶液A中。然后将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(100mL×3)萃取。向合并的有机层中添加3MHCl(250mL),并剧烈搅拌10分钟。移除溶剂,然后溶于二氯甲烷中。用己烷使产物沉淀。将产物用冷己烷洗涤,以获得红色固体(0.820g,45%)。1HNMR(400MHz,甲醇-d4)δ8.39-8.34(m,2H),8.27-8.22(m,4H),7.71-7.66(m,2H),7.63(d,J=7.3Hz,1H)。13CNMR(101MHz,MeOD)δ147.01,141.50,141.48,129.93,129.60,127.95,127.89,127.44,127.41,125.52,119.62。HRMS(ESI)C14H10N4O2的计算值为266.0805[M+H+],实验值为266.0804。下面的反应方案4b显示了吡唑啉产物4P的反应途径。反应方案4b将二芳基四唑化合物4(20mg,0.0751mmol)和丙烯酸(25.8μL,5摩尔当量)的4mL二氯甲烷和甲醇溶液用302nmUV灯照射3小时。通过减压移除过量的溶剂和试剂,以产生粗产物,随后通过硅胶柱色谱法(MeOH:DCM,3:17)对所述粗产物进行纯化。收集到作为黄色固体的产物4P。1HNMR(400MHz,HRMS(ESI)C17H14N2O4的计算值为310.0948[M+H+],实验值为310.0954。实施例5-二芳基四唑化合物5的合成和表征下面的反应方案5a显示了二芳基四唑化合物5的反应途径。反应方案5a将对甲苯甲醛(1.000g,8mmol)溶于乙醇(60mL)中,随后添加苯磺酰肼(1.433g,8mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤,用冷乙醇洗涤,并溶于吡啶(30mL)中以形成溶液A。然后将1,4-苯二胺(0.905g,8mmol)溶于水:乙醇(1:1,10mL)和浓HCl(1.3mL)中。将NaNO2(0.583g,8mmol)溶于水(2mL)中。将两种混合物在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至1,4-苯二胺溶液中以形成溶液B。在冰浴中将溶液B逐滴添加至溶液A中。然后将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(100mL×3)萃取。向合并的有机层中添加3MHCl(250mL),并剧烈搅拌10分钟。将有机层浓缩,以获得红色固体。将粗产物用柱色谱法(己烷:EA1:1)纯化,收集为黄色固体(1.149g,54.9%)。1HNMR(400MHz,氯仿-d)δ8.47-8.39(m,1H),8.02-7.97(m,2H),7.76(s,1H),7.54(d,J=7.2Hz,1H),7.51-7.46(m,2H),7.46-7.42(m,2H),7.12(d,J=7.9Hz,2H),2.32(s,3H)。13CNMR(101MHz,CDCl3)δ148.27,140.92,138.32,133.17,130.26,129.34,128.93,127.85,127.31,29.62,21.39。HRMS(ESI)C14H13N5的计算值为251.1161[M+H+],实验值为251.1171。下面的反应方案5b显示了吡唑啉产物5P的反应途径。反应方案5b当使用化合物5时,似乎未观察到荧光。这可能是由于可能由在二芳基四唑的一个芳基上存在胺官能团引起的荧光的内部猝灭。已知胺基团能够参与分子内光诱导电子转移(PET),这是引起荧光猝灭的可能机制。实施例6-二芳基四唑化合物6和吡唑啉产物6P的合成和表征下面的反应方案6a显示了二芳基四唑化合物6的反应途径。反应方案6a将对甲苯甲醛(1.000g,8mmol)溶于乙醇(60mL)中,随后添加苯磺酰肼(1.433g,8mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤,用冷乙醇洗涤,并溶于吡啶(30mL)中以形成溶液A。然后将4-甲氧基苯胺(1.067g,8mmol)溶于水:乙醇(1:1,10mL)和浓HCl(1.3mL)中。将NaNO2(0.583g,8mmol)溶于水(2mL)中。将两种混合物在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至4-甲氧基苯胺溶液中以形成溶液B。在冰浴中将溶液B逐滴添加至溶液A中。然后将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(100mL×3)萃取。向合并的有机层中添加3MHCl(250mL),并剧烈搅拌10分钟。将有机层浓缩,以获得红色固体。将粗产物用柱色谱法(己烷:EA5:1)纯化,以获得橙红色固体(0.8921g,41.6%)。1HNMR(400MHz,氯仿-d)δ8.11(d,J=8.2Hz,2H),8.09-8.06(m,2H),7.32-7.29(m,2H),7.05-7.01(m,2H),3.86(s,3H),2.41(s,3H)。13CNMR(101MHz,CDCl3)δ165.05,160.46,140.62,129.62,126.90,121.37,114.69,55.73,21.53。HRMS(ESI)C15H14N4O的计算值为266.1166[M+H+],实验值为266.1168。下面的反应方案6b显示了吡唑啉产物6P的反应途径。反应方案6b将二芳基四唑化合物6(20mg,0.0751mmol)和丙烯酸(25.7μL,5摩尔当量)的4mL乙酸乙酯溶液用302nmUV灯照射3小时。通过减压移除过量的溶剂和试剂,以产生粗产物,随后通过硅胶柱色谱法(MeOH:DCM,1:20)对所述粗产物进行纯化。收集到作为黄色固体的产物6P。HRMS(ESI)C18H18N2O3的计算值为310.1325[M+H+],实验值为310.1317。实施例7-二芳基四唑化合物7和吡唑啉产物7P的合成和表征下面的反应方案7a显示了二芳基四唑化合物7的反应途径。反应方案7a将苯甲醛(1.000g,8mmol)溶于乙醇(60mL)中,随后添加苯磺酰肼(1.623g,8mmol)。将混合物在室温下搅拌1小时,然后用水(100mL)猝灭,并在室温下搅拌15分钟。将沉淀过滤,用冷乙醇洗涤,并溶于吡啶(30mL)中以形成溶液A。然后将4-甲氧基苯胺(1.067g,8mmol)溶于水:乙醇(1:1,10mL)和浓HCl(1.3mL)中。将NaNO2(0.583g,8mmol)溶于水(2mL)中。将两种混合物在冰浴中冷却5分钟,然后在冰浴中将NaNO2溶液逐滴添加至4-甲氧基苯胺溶液中以形成溶液B。在冰浴中将溶液B逐滴添加至溶液A中。然后将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(100mL×3)萃取。向合并的有机层中添加3MHCl(250mL),并剧烈搅拌10分钟。将有机层浓缩,以获得红色固体。对粗产物进行柱色谱法(DCM:MeOH9:1),以获得红色固体(1.420g,59.7%)。1HNMR(400MHz,氯仿-d)δ8.23(dd,J=7.9,1.7Hz,2H),8.09(d,J=9.1Hz,2H),7.53-7.47(m,3H),7.04(d,J=9.1Hz,2H),3.87(s,3H)。13CNMR(101MHz,CDCl3)δ163.68,159.20,129.10,127.60,125.68,120.09,113.37,54.35。HRMS(ESI)C14H12N4O的计算值为252.1003[M+H+],实验值为252.1011。下面的反应方案7b显示了吡唑啉产物7P的反应途径。反应方案7b将二芳基四唑化合物7(20mg,0.0793mmol)和丙烯酸(27.2μL,5摩尔当量)的4mL乙酸乙酯溶液用302nmUV灯照射3小时。通过减压移除过量的溶剂和试剂,以产生粗产物,随后通过硅胶柱色谱法(MeOH:DCM,1:20)对所述粗产物进行纯化。收集到作为黄色固体的产物7P。1HNMR(400MHz,HRMS(ESI)C17H16N2O3的计算值为296.1169[M+H+],实验值为296.1161。实施例1至7的结果实施例1至7证明了当前所述的用于检测丙烯酸的荧光测定方法的灵敏度和通量。本发明方法可利用光可诱导的生物正交化学,其涉及在二芳基四唑和丙烯酸或其衍生物之间的光活化的1,3-偶极环加成反应。这可以或可以不进一步扩展至烯烃。在302nm下光照射时,二芳基四唑经历裂环反应,从而产生高反应性腈亚胺偶极并释放N2。该腈亚胺偶极可以与亲偶极物质反应以产生能够发荧光的吡唑啉环加成物。已经测试了如上所合成的七种二芳基四唑检测丙烯酸的存在或不存在的能力。化合物5、6和7被设计成在芳环上结合倾向于提高反应速率的供电子基团。由于最高占据分子轨道提升效应(HOMO提升效应),在N-苯基环中存在供电子取代基可以导致反应速率的增加。当腈亚胺偶极的HOMO能级增加时,环加成反应的速率能够被加速。七种二芳基四唑化合物与丙烯酸之间的反应的荧光结果示于下表1中。[表1]“a”表示使100μM的每种化合物与10mM或100μM的丙烯酸反应。在302nm下进行1分钟的光照射。使所有七种化合物与丙烯酸反应,并测量它们的荧光性质。结果总结在上表1中。化合物1、2、3、6和7产生了为背景约3倍的中度荧光增加。化合物5似乎对丙烯酸无反应性,几乎没有或没有荧光产物形成。有趣的是,在100μM丙烯酸存在下,化合物4在光活化时产生最高荧光开启信号(132倍增加)。化合物4的丙烯酸检测下限在使用302nm的UV光进行1分钟光活化时为500nM。因此,本公开的二芳基四唑化合物能够用于检测丙烯酸或其衍生物的存在或不存在。如上所述,化合物5似乎未表现出荧光,这是因为可能存在由在二芳基四唑的一个芳基上存在胺官能团引起的荧光的内部猝灭。已知胺基团能够参与分子内光诱导电子转移(PET),这是能够引起荧光猝灭的机制。实施例8-实施例1至7的二芳基四唑和丙烯酸之间的反应的荧光表征将含有二芳基四唑(0.022mmol)和丙烯酸(0.02至0.050mmol)的溶液用手持式302nmUV灯照射1分钟。在黑色96孔板中进行实验,总反应体积为100μL。表1中所示的最大激发波长用于每次扫描。使用10μM丙烯酸的反应的荧光发射光谱示于图1a至图1f中。其中省略任一反应物的对照实验的光谱也描绘于图1a至图1f中的每一个中。相应地,对照实验未观察到荧光开启信号。可观察到,在不存在UV活化下未观察到荧光开启。如在图1a至图1f中可以看出,只有含有二芳基四唑化合物和丙烯酸两者的孔的光谱在光活化时显示最高强度曲线。实施例9-二芳基四唑化合物4的检测限如前所述,化合物4的丙烯酸检测下限在使用302nm的UV光进行1分钟光活化时为500nM丙烯酸。下表2显示了浓度及其相应的荧光增加。[表2]化合物4的浓度100μM100μM100μM100μM丙烯酸的浓度100μM10μM1μM500nM荧光增加倍数132171.581.12每种浓度的化合物4和丙烯酸的发射光谱绘制于图2中。可以观察到,丙烯酸或其衍生物的浓度影响荧光强度。图3还显示了在向100μM二芳基四唑化合物4中添加不同浓度的丙烯酸时荧光增加倍数之间的关系。实施例10-使用HPLC和荧光的光活化环加成的反应监测将10mM化合物4溶于二氯甲烷和甲醇(1:1)中。将10mM丙烯酸的单独溶液溶于甲醇中。然后将10μL的10mM化合物4和10μL的10mM丙烯酸溶于80μL甲醇中。剧烈搅拌后,将混合物分别用302nmUV灯照射0秒、15秒、30秒、45秒、60秒、90秒和120秒。从每个样品取出反应溶液的等分试样(10μL),并立即注入HPLC柱中。通过在254nm和370nm下的UV吸光度监测每个样品中的化合物4(表示为A)和吡唑啉产物4P(表示为B)。3分钟后施加5%至90%MeOH的线性梯度历时10分钟,然后保持恒定10分钟,随后为历时7分钟的90%至5%MeOH线性下降梯度。化合物4和产物4P分别在约13.4分钟和12.4分钟洗脱。涉及二芳基四唑化合物4和丙烯酸的动力学反应研究通过如上所述用HPLC监测0至120秒来进行。在15秒时观察到中间体和产物4P两者。观察到反应在90秒内完成,此时,原料化合物4几乎用尽(参见图4)。15秒后发生反应混合物的荧光开启。将左侧小瓶至右侧小瓶分别标记为未UV活化、15秒、30秒、45秒、60秒、90秒、120秒UV活化。所有样品用相同的方法制备,其中将1μL的1mM化合物4和1μL的1mM丙烯酸溶于98μL甲醇中。在活化期间所有样品瓶子和UV灯之间的距离相等。反应混合物在15秒内表现出高的荧光开启(参见图5)。实施例11-在LB培养基和基本培养基中丙烯酸标准品的荧光测定使用本公开的检测方法,通过使100μM化合物4与在LB培养基和基本培养基中的丙烯酸接触1分钟光活化来进行荧光测定。这些培养基通常用于丙烯酸的微生物合成。在光活化完成之前容易地检测到荧光。与比较实施例1中所例示的气相色谱法相比,这显著更快。与实施例10中所示的HPLC方法相比,该方法还提供更高的通量,实施例10仅设法在13.4分钟之前完成化合物4和吡唑啉产物4P的洗脱。因此,图15a显示当所使用的培养基是LB时荧光强度与丙烯酸(标记为AA)的浓度之间的关系。图15b显示当所使用的培养基是基本培养基时荧光强度与丙烯酸(标记为AA)的浓度之间的关系。该实施例还表明,本发明方法能够使用所公开的二芳基四唑化合物来体外检测丙烯酸。实施例12-二芳基四唑反应的pH依赖性为了进一步研究化合物4和丙烯酸之间的反应,假设荧光的大量增加可能是由于化合物4中存在的苯甲酸基团,而不是其它例示化合物的其余部分。化合物4含有唯一的可电离基团,因此,去质子化可有助于由含有羧酸基团的吡唑啉产物4P发射的高荧光。为了证实上述情况,化合物4与丙烯酸(AA)之间的反应以及化合物4与丙烯酰胺(衍生物)之间的反应在pH1至pH13的缓冲液中进行。图16a和图16b显示吡唑啉产物的荧光在碱性pH下更强,在pH为约8至11下,特别是在pH9下观察到最高荧光。生色团的去质子化似乎导致吡唑啉产物的更高荧光强度。这两个图中的对照实验表明,二芳基四唑探针在所有测试的pH下都不是荧光的。实施例13-丙烯酸或其衍生物的检测进行了丙烯酸和其一种衍生物,即丙烯酰胺的实验比较。考虑的因素包括但不限于pH范围、检测所需的丙烯酰胺的量和不同油介质的影响。由于基于实施例1至7的结果,化合物4显示最高荧光,因此在本实施例中使用该化合物进行检测。在整个pH范围内,100μM丙烯酸和两种不同等级的丙烯酰胺,特别是凝胶电泳丙烯酰胺(GE)和分子生物学丙烯酰胺(MB)用100μM化合物4进行测试。化合物4和丙烯酸/丙烯酰胺之间的反应在磷酸盐缓冲液(具有所示的不同pH)中在10%DMSO中进行,在302nm下的光活化时间为1分钟。使用荧光酶标仪测量荧光。丙烯酸在pH11.0下显示信号检测峰,而丙烯酰胺在pH9.0下显示峰。该比较的结果示于图17中。显然,本公开的检测方法能够检测丙烯酸盐/酯衍生物。化合物4也用于体外检测丙烯酰胺。化合物4和丙烯酰胺之间的反应在具有10%DMSO的pH9.0的磷酸盐缓冲液中进行,在302nm下的光活化时间为1分钟。如图18中所示,使用100μM化合物4,使用荧光酶标仪可以容易地检测到1μM至100μM的丙烯酰胺浓度。在含有1%Tween-20的pH9.0的磷酸盐缓冲液中的10%(v/v)不同的油中掺入10mM丙烯酰胺(凝胶电泳等级)。对照未受污染。这些混合物的反应设定为用100μM化合物4,在302nm下的光活化时间为1分钟。使用荧光酶标仪测量荧光。如图19所支持的,显示化合物4能够检测复合有机/洗涤剂混合物中的丙烯酰胺。在含有1%Tween-20的pH9.0磷酸盐缓冲液中的10%(v/v)不同的油用100μM化合物4进行测试,在302nm下的光活化时间为1分钟。使用荧光酶标仪测量荧光。向日葵油中双键的存在可能是该油具有最高荧光测量的原因。因此,当使用本发明方法时,“双键”可能导致不准确的读数或可能作为污染物。结果示于图20中。在pH7至13的范围内,100μM丙烯酸和丙烯酰胺(凝胶电泳等级)用100μM化合物4进行测试。化合物4和丙烯酸/丙烯酰胺之间的反应在磷酸盐缓冲液(具有不同的所示pH)中在10%DMSO中进行,在302nm下的光活化时间为1分钟。使用荧光酶标仪测量荧光。丙烯酸在pH10.0下显示信号检测峰,而丙烯酰胺在pH9.0下具有荧光峰。结果示于图21中。实施例14-使用生物素化探针的检测在pH9.0缓冲液中的不同浓度的丙烯酰胺用100μM生物素化化合物4(参见图22a)或未缀合的化合物4(参见图22b)在溶液中进行测试,在302nm下的光活化时间为1分钟。使用荧光酶标仪获取荧光读数。使用抗生蛋白链菌素珠,与丙烯酰胺缀合的生物素化探针被下拉并分离(参见图22c),并且对应于增加量的丙烯酰胺检测到增加的荧光。对照包含未生物素化探针用于下拉,其显示背景珠荧光。基于此,生物素化提高本检测方法的速度和准确性。从图23可以观察到生物素化探针也对丙烯酸起作用。左侧的两个小瓶仅含有生物素化化合物4。左侧的第一个(最左边的)小瓶暴露于UV达2分钟,但未显示荧光。左侧的第二个小瓶未暴露于UV。另一方面,布置于右侧的两个小瓶含有与丙烯酸混合的生物素化化合物4。布置于右侧的第一个(左)小瓶在通过UV光活化的2分钟内观察到荧光。布置于右侧的第二个(最右边的)小瓶未显示任何荧光,因为它没有暴露于UV。在如图23中所示的这组实验中,探针含有与生物素基团缀合的化合物4。实施例15-体内检测在该实施例中测试化合物4在体内作为丙烯酸传感器的用途。使大肠杆菌细胞生长至晚对数期(OD600约为1.0),并在37℃下用100μM丙烯酸处理10分钟。洗涤后,将细胞用100μM化合物4处理,并在37℃下在黑暗中孵育30分钟。将细胞洗涤,沉淀,悬浮于1×PBS中,并封固在载玻片上。然后将它们暴露于302nm的UV光达1分钟,并在室温下恢复约2小时后在荧光显微镜(使用DAPI滤光片)下成像。对照细胞包括未处理的细胞;单独用丙烯酸或化合物4处理并且未经UV处理的细胞。图24中的结果显示,细菌细胞仅在丙烯酸和化合物4两者存在下发荧光。已经显示在两种细菌种类中丙烯酸作为代谢中间体产生,所述两种细菌种类例如但不限于丙酸梭菌和埃氏巨球形菌。在这些微生物中,乳酸至丙酸的还原通过丙烯酰辅酶A中间体进行。为了测试针对丙烯酸的体内产生的二芳基四唑传感器,将化合物4应用于丙酸梭菌细胞。使丙酸梭菌细胞在缺氧室中生长至晚对数期(OD600约为1.0),并用100μM化合物4处理。在37℃下在黑暗中孵育30分钟后,将细胞洗涤,沉淀,悬浮于PBS缓冲液中,并封固在载玻片上。将细胞暴露于302nm的UV光达1分钟,并在室温下恢复约2小时后在荧光显微镜(使用DAPI滤光片)下成像。对照细胞包括用丙烯酸和化合物4处理以观察阳性荧光的细胞;未处理的细胞和单独用丙烯酸处理并且未经UV处理的细胞。图25a和图25b中的结果显示在添加100μM丙烯酸的对照实验中和在丙酸梭菌细胞中细胞都是荧光的。图25b显示丙酸梭菌裂解物的荧光结果。这表明在这些细胞中丙烯酸中间体的产生,并且二芳基四唑探针能够检测它们。图26显示了在未处理(26a)或用5mM和10mM3-丁炔酸(分别为26b和26c)处理的培养基中生长的丙酸梭菌和大肠杆菌的细菌细胞裂解物的荧光信号。将细胞裂解物用500mM二芳基四唑化合物4处理用于荧光检测。使用来自如上段中所示的相同实验的这些细胞裂解物,使用荧光读板器定量测量荧光信号。因此,这表明本公开的二芳基四唑探针可用于检测丙烯酸或其衍生物。作为酰基辅酶A脱氢酶抑制剂的3-丁炔酸能够促进丙烯酰辅酶A在细胞中的积累。在丙酸梭菌中,丙烯酰辅酶A通常转化成丙酰辅酶A。然而,在3-丁炔酸的存在下,该反应被抑制。因此,在含有3-丁炔酸的细胞中,荧光信号较高,表明丙烯酸含量较高。丙酸梭菌天然产生丙烯酸,但大肠杆菌可能不会天然产生丙烯酸。比较实施例1-气相色谱如上所述,在进一步的实验中使用化合物4来检测丙烯酸。化合物4和丙烯酸之间的反应在水中进行,在302nm下的光活化时间为1分钟。使用100μM化合物4,使用荧光酶标仪可以容易地检测到1μM至100μM的丙烯酸浓度(参见图3和实施例9)。将该结果与不使用本公开设想的二芳基四唑化合物的丙烯酸的GC检测进行比较。用于GC分析的样品必须提取到挥发性有机溶剂(例如乙醚)中,然后才能进行分析。GC分析的检测限为250μM(参见下表3),而使用实施例9和11中所公开的荧光测定可容易地检测到100μM的所提取丙烯酸。GC的耗时的样品提取过程不提供高通量筛选方法。[表3]将丙烯酸(6.8μL,99μmol)溶于溶菌肉汤(LB)培养基(993.2μL)中,并剧烈搅拌10秒,然后用LB稀释至其各自的浓度。可使用基本培养基来替换LB培养基。将1000μL每种浓度的样品转移至2mL微量离心管(eppendorftube)中,并用30-50μL5MHCl酸化。将每个样品剧烈搅拌约10秒,并静置3至5分钟。测试每个样品的pH以确保pH≤2。然后向酸化的样品中添加乙醚(1000μL×2)用于提取。然后将合并的乙醚层浓缩至约60μL用于气相色谱质谱。提取的样品不允许完全蒸发,因为它将影响GCMS结果。在约17.4分钟的保留时间检测到丙烯酸。各种浓度的丙烯酸的GCMS结果示于图6a至图14c中。图6c显示当丙烯酸的浓度为100mM时丙烯酸峰的质谱数据。与在90秒之前或甚至在1分钟之前检测丙烯酸的本公开的方法相比,该GC方法较慢。工业适用性如本文所定义的方法使得能够通过使如上所述的二芳基四唑与含有丙烯酸或其衍生物的样品接触或混合来检测丙烯酸或其衍生物的存在或不存在。如果检测到丙烯酸或其衍生物,则这种混合物的光活化可导致混合物发荧光。有利的是,该荧光感测方法可以提供快速检测丙烯酸或其衍生物的方法,而不需要例如GCMS和HPLC的那些繁琐的样品制备。可以消除化学衍生化和庞大的检测设备,因为检测依赖于荧光。另外有利的是,与常规方法例如GCMS、液相色谱或HPLC等相比,本发明方法还可以允许高通量检测。本发明方法还可以使用非细胞毒性化合物作为检测探针。因此,本发明的方法和探针可用于在体外和体内检测丙烯酸或其衍生物。相应地,如本文所述的探针可以用于如上所述的本检测方法中,并且这种探针可以具有上述优点。所述探针可以进一步生物素化以提高检测效率和准确性。当使用或用于检测丙烯酸或其衍生物时,包含这种探针的试剂盒也可具有上述优点。显而易见的是,在不脱离本发明的精神和范围的情况下,在阅读上述公开内容之后,本发明的各种其它修改和调整对于本领域技术人员将是显而易见的,并且所有这样的修改和调整均意欲在所附权利要求的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1