用于羰基检测和定量的方法和装置与流程
本申请要求2015年5月4日提交的美国临时申请62/156,441,2015年4月20日提交的美国临时申请62/149,988以及2014年6月27日提交的美国临时申请62/018,448的优先权,其全部内容在此参考并入。
发明领域
本发明涉及羰基检测和定量领域,具体地涉及生物样品中的含羰基部分的浓度的检测和定量。
背景技术:
含羰基部分的检测是已知的,但是生物样品中的特定低浓度的特定含羰基部分的精确检测仍不清楚。已知羰基用于在高温下引发邻苯二胺和对苯二胺的聚合以产生随后用于制备产品的固体聚合物的用途,但是苯二胺衍生物用于检测在一些生物样品中的含羰基部分的方法中的用途仍不清楚。此外,测量溶液中的荧光物质的荧光以确定对应于该物质的分子的存在情况以及对给定样品中此类分子的浓度进行定量是已知的。对生物样品中的羰基进行进一步分析是已知的,参见例如2003年11月6日公开的公开号US 2003/0208133和2011年1月6日公开的公开号US 2011/0003395,其全部内容并入本申请。
附图简述
图1A显示了具有降低的表面活性剂依赖性的替代苯二胺衍生物。
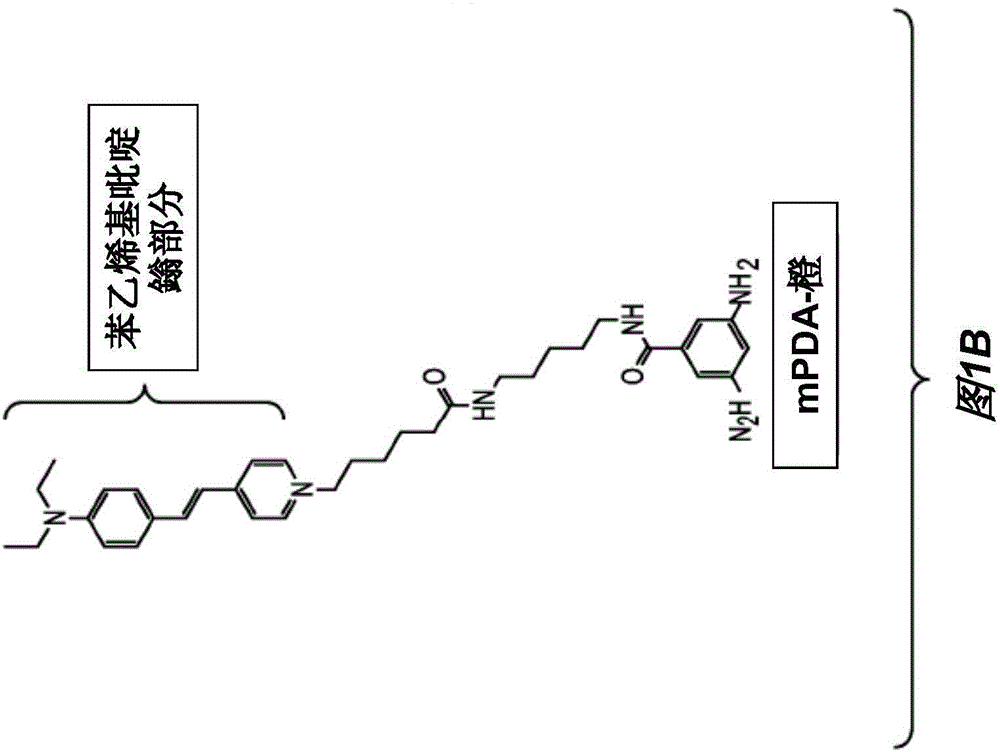
图1B显示了替代苯二胺衍生物。
图1C显示了合成图1B中所示的替代苯二胺衍生物的途径。
图1D显示了图1B中所示的替代苯二胺衍生物对醛引发的间苯二胺聚合的Fret应答的图示。
图1E显示了描绘在1μΜ己醛存在下图1B中所示的替代苯二胺衍生物的荧光增加的图表。
图2显示了描述mPDA与1-己醛的反应的发射光谱作为时间的函数的图表。
图3显示了描述随着mPDA与作为含羰基部分的1-己醛的反应时间而变化的荧光增加的图表。
图4A显示了描述作为0.01至0.4%(w/v)的十二烷基硫酸钠(“SDS”)浓度的函数,随着与1-己醛反应的时间而变化的荧光增加的图表。
图4B显示了描述在SDS浓度为0.2%SDS时,与空白比较的随着与1-己醛反应的时间而变化的荧光增加的图表。
图4C显示了描述在SDS浓度为0.4%SDS时,与空白比较的随着与1-己醛反应的时间而变化的荧光增加的图表。
图5显示了展示作为1-己醛浓度的函数的荧光的图表。
图6显示了描述作为醛链长的函数的相对荧光的图表。
图7显示了描述所选择的小的芳族胺的相对荧光的图表。
技术实现要素:
本发明的一个实施方式涉及一种检测生物样品中的含羰基部分的方法,所述方法包括将苯二胺衍生物添加至盐水溶液中从而形成苯二胺溶液;将来自生物样品的含羰基部分添加至所述苯二胺溶液中从而形成荧光溶液;和检测来自所述荧光溶液的荧光。
本发明的另一个实施方式涉及一种含有醇、盐、表面活性剂、苯二胺衍生物和含羰基部分的溶液。
本发明的又一个实施方式涉及一种含有间苯二胺衍生物与含羰基部分的产物的基本上无沉淀的溶液。
本发明的另一个实施方式涉及一种检测和测量生物样品中含羰基部分的浓度的方法,所述方法包括:
a)从所述生物样品中分离含羰基部分;
b)将所述含羰基部分添加至含有苯二胺衍生物的水溶液中以形成荧光溶液;和
c)在预先确定的波长下测量从所述荧光溶液发射的荧光。
本发明的另一个实施方式涉及一种检测和测量人类呼吸样品中的醛浓度的方法,所述方法包括:
a.将来自所述人类呼吸样品的所述醛捕获至二氧化硅上;
b.在微酸性条件下在醇中形成包含盐、缓冲剂、表面活性剂的溶液;
c.将苯二胺衍生物添加至步骤b的溶液中;
d.将所捕获的醛洗脱至步骤c的溶液中;
e.测定步骤c的溶液的荧光信号;
f.测定步骤d的溶液的荧光信号;
g.从来自步骤f的荧光信号中减去来自步骤e的荧光信号;和
h.将来自步骤g的所得荧光信号净值与已知醛的标准荧光进行比较,以确定在所
述荧光溶液中的醛浓度。
本发明的另一个实施方式涉及一种装置,所述装置包括:
a)具有基底的呼吸室,该基底承载来自动物呼吸的含羰基部分;和
b)具有水溶液的流体室,所述水溶液含有醇、盐、表面活性剂和缓冲剂。
本发明的又一个实施方式涉及一种用于检测和定量生物样品中含羰基部分的浓度的装置,该装置包括基底,所述基底具有加入其中的活性反应性捕捉剂。
本发明的另一个实施方式涉及一种用于检测生物样品中含羰基部分的方法,所述方法包括下述步骤:提供具有加入其中的活性反应性捕捉剂的基底,在所述基底上捕获来自所述生物样品的含羰基部分,和形成包含经染色的含羰基部分的溶液。
本发明的又一个实施方式涉及一种用于检测生物样品中含羰基部分的方法,所述方法包括下述步骤:
a.提供基底;
b.将活性反应性捕捉剂加入所述基底;
c.将含羰基部分捕获于所述基底上;和
d.将所述活性反应性捕捉剂和含羰基部分从所述基底洗脱至溶液中,从而形成经染色的含羰基部分。
本发明的另一个实施方式涉及一种检测生物样品中含羰基部分的方法,所述方法包括将荧光发色团添加至盐水溶液从而形成荧光发色团溶液;将来自所述生物样品的含羰基部分添加至所述荧光发色团溶液从而形成荧光溶液;和检测来自所述荧光溶液的荧光。
具体实施方式
下述描述和附图是说明性的,并且不被解释为限制性的。描述了许多具体细节以提供对本公开的透彻理解。然而,在某些情况中,未描述熟知或常规细节以避免模糊该描述。本说明书中对“一个实施方式”或“实施方式”的指代意指与实施方式结合描述的特定特性、结构或特征包括在本公开的至少一个实施方式中。本公开中对一个或另一个实施方式的指代可以是(但不一定是)对相同实施方式的指代;并且此类指代意指实施方式中的至少一个,而不是相互排除其他实施方式的独立的或替代的实施方式。
在本申请的上下文中以及在各术语使用的特定上下文中,在本说明书中使用的术语一般具有其在本领域中的通常含义。在下文或本说明书的其他地方讨论了用于描述本公开的某些术语,以便为从业人员提供关于本公开的描述的额外指导。为方便起见,可以突出显示某些术语,例如使用斜体和/或引号标记。使用突出显示对术语的范围和含义不具有影响;在相同上下文中无论术语是否被突出显示,其范围和含义是相同的。
因此,替代语言和同义词可用于本申请讨论的任何一个或多个术语。无论在本申请中是否对术语进行详细阐述或讨论,均不会赋予其任何特殊意义。本申请提供了某些术语的同义词。叙述一个或多个同义词不排除使用其他同义词。在包括任何本申请讨论的术语示例的本说明书中的任何地方对实施例的使用仅是说明性的,并且不旨在进一步限制本公开或任何示例性术语的范围和含义。
本发明涉及一种用于检测、定量和测定优选地在生物样品中,且优选地在生物样品中为低浓度的含羰基部分(“CCM”)(包括醛)的方法和装置。就此而言,将CCM定义为包括一种或多种不同的含羰基部分。
如在本申请中使用的,“生物样品”被以其最广泛的含义进行指代,并且包括固体和液体或从自然界(包括个体、体液、细胞系、组织培养物或任何其他来源)获得的任何生物样品。如所指出的,生物样品包括体液或气体,如呼吸、血液、精液、淋巴液、血清、血浆、尿液、滑液、脊髓液、痰、脓、汗,以及来自环境的液体样品,如植物提取物、池塘水等。固体样品可以包括动物或植物体部分,包括但不限于毛发、指甲、叶子等。用于本发明的一个实施方式的优选生物样品是人类呼吸。
CCM是具有至少一个羰基的化合物。羰基是在大量化学化合物中出现的二价基团>C=0。该基团由双键连接至氧原子的碳原子组成。羰基官能团最常见于三种主要类型的有机化合物中:醛、酮和羧酸。如在本申请中使用的,“醛”具有其常规化学含义,本发明的方法可用于检测生物样品中的醛浓度。特别地,本发明可用于检测醛的各种形式,包括但不限于:1-己醛、丙二醛,4-羟基壬烯醛、乙醛、1-丙醛、2-甲基丙醛、2,2-二甲基丙醛、1-丁醛和1-戊醛。
由基底捕捉的CCM的量可变化,但是通常对于由200mg的50-270目(300-50μm)粒子组成且床直径为12.5mm的基底来说,一般而言,其等于在呼气进入如呼气分析仪的管之后在人类呼吸中的量。优选地,其为75至0.1ppb(400至4皮摩尔),更优选地为20ppb至0.01ppb(80至0.4皮摩尔)。
本发明适合于“混合&读取”和“实时”测定形式以检测CCM。本发明可以应用于检测溶液中的CCM。本发明可以通过添加初级捕获(如下文所讨论的在基底上)和释放(如下文所讨论的从负载基底洗脱)过程而应用于检测气相中的痕量CCM。优选地在该过程的一个步骤中,将气相CCM(例如来自人类呼吸的醛)捕获在基底上。
本发明的基底有利地由固体(但不必是刚性的)材料形成。该固体基底可由各种材料的任意一种形成,如膜、纸、非织造网、针织物、机织物、泡沫、玻璃等。例如,用于形成固体基底的材料可以包括但不限于天然的、合成的或经合成改性的天然材料,如多糖(例如纤维素材料(如纸)和纤维素衍生物(如醋酸纤维素和硝化纤维素));聚醚砜;聚乙烯;尼龙;聚偏二氟乙烯(PVDF);聚酯;聚丙烯;二氧化硅;无机材料,如失活氧化铝、硅藻土、MgSO4、或在多孔基质中均匀分散的其他无机细碎材料,与聚合物(如氯乙烯、氯乙烯丙烯共聚物和氯乙烯-乙酸乙烯酯共聚物);布,天然的(例如棉)和合成的(例如尼龙或人造丝);多孔凝胶,如硅胶、琼脂糖、葡聚糖和明胶;聚合物膜,例如聚丙烯酰胺等等。优选地,基底是任选地在玻璃料之间隔开的二氧化硅固相基质。选择基底的尺寸,使得由该基底捕捉可测量量的CCM。该尺寸可以改变,但一般而言其为约2mL,优选地为约1mL,更优选地为约0.25mL。
基底通常由具有50-60埃孔的粒子的床组成,所述床具有50至270目(300-50μm)和75至300mg的质量,优选60-120目(250-125μm)和100至200mg的质量,更优选50-120目(210-125μm)和125至175mg的质量。
在该过程的另一步骤中,将诸如苯二胺衍生物的荧光发色团添加至洗脱溶液,以形成苯二胺溶液。可用于本发明的苯二胺衍生物包括但不限于多种苯二胺衍生物(包括但不限于间苯二胺(“mPDA”)及其衍生物)和图1A和图1B中所示的那些,且mPDA优选用于检测醛(包括但不限于1-己醛)。尽管某些p-PDA或o-PDA衍生物可用于本发明的方法,但是它们不可用于检测1-己醛,因为它们产生不能用于下文所讨论的基于光学的检测的混浊胶体悬浮体。
其他苯二胺衍生物包括下述或其混合物:
其中R1、R2、R3、R4各自独立地选自下组:H、烷基、取代的烷基、烷氧基、取代的烷氧基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨基羰基、氨基硫代羰基、氨基羰基胺、氨基硫代羰基氨基、氨基羰氧基、氨基磺酰基、氨基磺酰氧基、氨基磺酰氨基,脒基、羧基、羧基酯、(羧基酯)氨基、(羧基酯)氧基、氰基、卤代、羟基、SO3-、磺酰基、取代的磺酰基、磺酰氧基、硫代酰基、硫醇基、烷硫基、取代的烷硫基、酰基、取代的芳基、杂芳基、取代的杂芳基、环烷基、取代的环烷基、杂环和取代的杂环。
参考图1B,显示了mPDA-橙(mPDA-Orange),即4-[2-[4-(二乙胺基)苯基-乙烯基]-1-[1-(3,5-二亚胺基苯甲酰胺)-戊基氨基-5-氧基己基]吡啶鎓。该mPDA衍生物mPDA-橙利用a)对环境变化的敏感性和b)调节mPDA-醛引发的聚合对表面活性剂的依赖性的潜力。在图2C中示出了用于合成mPDA-橙的方案。基本方案为通过烷基酰胺连接体将mPDA与苯乙烯基吡啶鎓部分偶联。
随着分子加入醛引发的mPDA聚合物中,mPDA-橙显示出量子产率提高。此外,苯乙烯基吡啶鎓部分的激发和发射性质提供来自mPDA聚合物的FRET(Forster能量转移)产生的信号。苯乙烯基吡啶鎓部分显示出最大值在470nm处的宽激发和在570nm处的发射最大值。激发图与提供了与mPDA聚合物的发射图的充分重叠,以提供基于FRET的信号产生。基于Fret的信号产生通过在mPDA聚合物处的激发(405nm)和在570nm处的苯乙烯基吡啶鎓部分的发射表现。图1D中显示了mPDA-橙对醛引发的mPDA聚合的FRET应答的图示。
由于引发聚合物所需的高浓度的苯乙烯基吡啶鎓的淬灭,因而单独的mPDA-橙的直接醛引发聚合不会产生应答信号。预期仅当mPDA-橙包含在mPDA和mPDA-橙的混合物中时才会产生应答。实际上,仅当mPDA-橙以1,000:1至10,000:1的显著稀释的摩尔比mPDA/mPDA-橙掺杂入mPDA时才观察到醛应答。在图1E中阐明了对醛的应答。当将1μΜ己醛添加至体系时,在405nm处激发时观察到mPDA-橙在570nm的发射增加。当在470-490nm处直接激发mPDA-橙苯乙烯基吡啶鎓部分时,未观察到发射增加。该应答在背景值上约3X,参见图1E,此处条件为7mM mPDA、5μΜmPDA-橙(摩尔比15,000:1)、90mM NaCl、15%乙醇、0.1%SDS、50mM pH 2.5的柠檬酸盐。该激发在405nm处,发射在575-585nm处。可以看出,在不存在醛时,该背景水平维持相当稳定,导致mPDA-橙加入的自引发似乎是最小的。尽管与单独的mPDA的15X相比,mPDA-橙应答为小得多的3X,该衍生物具有几个优点:1)由在激发与发射之间的大Stokes位移提供的增加的波长辨别度和2)增强的基线稳定性。
一般而言,在苯二胺溶液中苯二胺衍生物浓度为0.5mM至25mM。对于mPDA而言,在苯二胺溶液中mPDA浓度一般为0.5至21mM,优选为2至10mM,以及对于醛类(如1-己醛)而言最佳为5mM。尽管如上所述,对于mPDA-橙而言,必需将其稀释为低摩尔比(优选1000-10,000)mPDA。
一般而言,洗脱溶液包括盐、缓冲剂、表面活性剂和有机溶剂。盐浓度可为5mM至200mM,优选20mM至80mM;缓冲剂浓度可为25mM至200mM,优选40mM至60mM;以及表面活性剂浓度可为0.05%(1.7mM)至0.4%(13.9mM),优选0.15%(5.2mM)至0.25%(8.7mM)。最佳使用0.2%或6.96mM。盐可以是任何对荧光溶液无负面影响且控制洗脱溶液中的盐析效应的盐,并且可以包括NaCl、LiCl、KCl、硫酸盐和磷酸盐及其混合物,优选为NaCl。
使用缓冲剂使洗脱溶液维持微酸性,优选在pH 2和4.5之间,更优选为pH 2.5。缓冲剂可以是硼酸盐缓冲剂、磷酸盐缓冲剂、柠檬酸盐缓冲剂,有机缓冲剂(如HEPES(1-哌嗪乙烷磺酸)或TRIS(三(羟甲基)氨基乙烷)缓冲剂),优选使用柠檬酸盐缓冲剂以检测醛。
表面活性剂可以包括癸基硫酸钠、十二烷基硫酸钠(“SDS”)、十四烷基硫酸钠以及Standapol ES-1,优选SDS包括SDS的C10、C12和C14形式的SDS。还可以使用Trition X-100、Ninate 11、Georpon 71、Tetraonic 1357、Cremapor-el、Chemal la-9、Silwet L7900、Surfynly468、表面活性剂10G和Tween 80,但是它们与优选的洗脱溶液、CCM 1-己醛和mPDA未提供良好的结果。
在不存在SDS时,如下文所讨论的聚合和醛应答被严重抑制。mPDA是高度水溶性的,SDS的存在可以提供将mPDA组织和定位至基质中的支架,以促进聚合反应。
溶剂可以包括EtOH、MeOH、丙醇和异丙醇的水溶液,优选15%EtOH。
盐浓度与苯二胺浓度的摩尔比是重要的。一般而言,该比例应为0.03至0.5。对于CCM1-己醛而言,发现0.165的mPDA/NaCl的摩尔比提供最佳应答。
实施本发明的方法的温度范围优选为15至35℃,更优选为25至30℃。
对于诸如1-己醛的醛而言,洗脱溶液的一个优选实施方式包括33mM NaCl、50mM柠檬酸盐、pH 2.5、15%EtOH和0.2%SDS。其他优选的洗脱溶液包括50mM柠檬酸盐、pH2.5、15%丙醇和0.4%癸基硫酸钠。
使用含有苯二胺衍生物的洗脱溶液时,将CCM洗脱至苯二胺溶液中以形成荧光溶液。CCM和mPDA反应形成荧光物质,通过测量荧光溶液中荧光物质发射的荧光而检测荧光物质在荧光溶液中的存在情况。
醛含量通过如下方式进行定量:监测信号上升(终点)和/或信号变化速率(动力学),和将此类数据与呼吸的羰基群样品进行比较,其中对于给定的mPDA浓度而言,所述信号变化速率作为醛浓度的函数而变化。实施中必需滤除所选择羰基以外的羰基的影响。具有两种一般测定形式或检测模式。其通常描述为终点和动力学。在终点测定中,将体系孵育设定时间并读取信号。在该点的信号反映了体系中分析物的量。对于阳性测定而言,分析物浓度越高,信号增加越大。在动力学测定中,在设定的持续时间内监测变化速率。变化速率与分析物的量相关。优选地,在本发明中使用终点测定。
测定测量可以根据标准测定实践在典型的荧光光谱仪上进行,包括常规扫描光谱仪、酶标仪或基于LED/二极管的光谱仪。出于说明的目的,图2中所示的数据通过如下方式获得:将总共2mL的反应溶液和醛混合至标准荧光比色杯中,使用LED/二极管光谱仪在特定时间片时测量强度增加以模拟终点测定。所使用的LED/二极管光谱仪由具有LED源的Ocean Optics Jazz光谱仪和经由光纤联接至Qpod-e(Quantum Northwest)温度控制荧光样品架的二极管检测组成。使用紫色LED(电压:3.3V,I:0.03A)产生405nm激发。使用发射设置为495-505nm带通和250毫秒积分的ILX-51 18二极管检测检测信号。与大多数基于荧光的测定一样,最佳设置取决于所使用光谱仪的通量和杂散光排斥特性,并且必须针对每个仪器根据经验确定。
在一个优选的实施方式中,苯二胺衍生物在溶液中与CCM反应以产生荧光发射或荧光物质。据信苯二胺衍生物氧化偶联至CCM,苯二胺衍生物聚合为二聚体、三聚体、低聚物和/或聚合物。尽管聚合由CCM的存在调节且具有剂量应答,但并不清楚CCM是否实际上成为增长的聚合物的一部分。
可以将使用CCM聚合苯二胺衍生物的过程描述为分散聚合。聚苯二胺已经用于构造不同形状、管、球等的纳米结构和胶体分散体。然而,如果聚合产生大的高分子量结构,则在溶液中出现沉淀,这在本发明中可能妨碍光学检测。因而必须选择用于本发明的方法中的成分以避免在荧光溶液中具有抑制CCM检测和定量的元素。
本发明利用CCM调节(引发、催化和加速)苯二胺衍生物的氧化偶联和聚合的能力以检测和定量生物样品中痕量的醛、酮和含羰基的分析物。苯二胺的氧化偶联和聚合产生发色和荧光物质。在mPDA和醛的情况下,聚合物或多聚体的形成产生在405nm处的宽光吸收带和在505nm处的相关发射带。在<350nm的UV区域发现单体吸收。因此,可以方便地通过常规吸收或荧光光谱法跟踪聚合物的产生。就此而言,应意识到吸收和发射带可取决于CCM和所选择的苯二胺衍生物而不同,但是可用于实施本发明的所有此类条带均为本发明的一部分。
例如,参考图2,显示了在1μΜ1-己醛存在下作为时间函数的mPDA反应的发射光谱。荧光溶液的条件为:1μΜ1-己醛、5.4mM mPDA、33mM NaCl、50mM柠檬酸盐(pH2.5)、15%EtOH和0.1%SDS。发射作为时间的函数显著增加。
参考图3,观察了在具有和不具有醛(“空白”)的情况下的反应和应答。荧光溶液的条件为:1μΜ1-己醛、5.4mM mPDA、33mM NaCl、50mM柠檬酸盐(pH 2.5)、15%EtOH和0.1%SDS。发射增加程度和增加速率取决于在苯二胺溶液中的醛浓度。醛浓度越高,观察到越大和越迅速的信号增加。在不存在醛时,“空白”发生缓慢逐渐的小的信号上升,表明在检测条件下mPDA的缓慢聚合。推测该聚合是由于存在诸如铁的痕量氧化剂、活性氧物质和其他引发剂。加入CCM后,观察到相比于空白或背景的显著信号增强。特别值得注意的是变化速率易于追踪。因此,检测系统适于动力学和终点测定设计和检测模式。可以在特定时间点(例如15分钟(时间片))或通过监测作为醛函数的斜率来对应答进行定量。动力学速率足够缓慢而不需要迅速和高精度的反应物添加。聚合反应通过CCM(如醛)进行调节及其用作CCM定量传感器是在本说明书中描述的另一个新发现和应用。其他替代包括标签、染色或标记CCM以供随后分析。
参考图4A、4B和4C,显示了CCM引发的与苯二胺衍生物的聚合反应对环境条件和反应体系的组分(如SDS浓度)敏感。在这些图中的荧光溶液的条件为:1μΜ1-己醛、5.4mM mPDA、33mM NaCl、50mM柠檬酸盐(pH 2.5)和15%EtOH。例如,反应和醛测定性能取决于盐含量、mPDA含量、表面活性剂、pH和温度。由于反应涉及单体向聚合物的“准相”转变,不足的mPDA浓度产生具有有限信号变化的缓慢反应。相比之下,大过量的mPDA导致非常迅速的反应和限制光学检测的不溶性沉淀物的形成。此外,大过量导致增加的背景或“空白”信号。
参考图4A,信号作为SDS浓度的函数增加。在0.4%的SDS浓度时,信号增加为在0.2%时观察到信号的几乎3倍。
图4B和图4C分别显示了在0.2%SDS和0.4%SDS时的醛应答与空白的比较。SDS浓度的增加也会导致“空白”或背景信号的增加。信号和背景二者均由SDS浓度调节,且最佳SDS浓度不能仅通过监测信号应答来确定。因此,必须对SDS浓度进行优化以提供信号和背景信号产生之间的最大区分。对于特定实施方式而言,最佳SDS浓度落入窄的浓度带内,并且小的偏差可导致增加的可变性并限制测定灵敏度。
参考图5,显示了经背景校正的作为1-己醛浓度函数的mPDA的荧光应答。从0.1至1μΜ1-己醛观察到线性应答。数据点是三次重复样品的平均值。在将醛加入苯二胺溶液后20分钟时测量信号。在这些条件下(25℃下10.8mM mPDA、65.5NaCl、50mM柠檬酸盐(pH 2.5)、0.2%SDS),可获得0.1μM的溶液检测限(LOD)。
参考图6中的图表,对于脂族醛,mPDA显示出作为链长函数的不同应答。图表显示了在醛加入后20分钟时在下述条件下的荧光信号:5.4mM mPDA、33mM NaCl、50mM柠檬酸盐(pH 2.5)、15%EtOH和0.1%SDS。在20分钟时测量信号,并将该时间片用作假终点分析方法。对于脂族醛,相对应答随脂族链长而增加。乙醛的应答仅为对于1-己醛观察到的应答的12%。相比之下,癸(C10)醛的应答比1-己醛高出30%。
在使用本发明的方法时,芳族二胺的性质也是考虑的重要因素。O-PDA是高反应性的,并发生快速一般氧化。o-PDA的高反应性阻碍了其用作本发明的优选实施方式中的醛传感器。参考图7,显示了二胺子集的相对荧光应答,并阐明了位置和电子效应二者对醛荧光应答的影响。传统芳族供电子效应和吸电子效应应该调节苯二胺衍生物对聚合的反应性和敏感性。在优选条件下,甚至当暴露于过量的醛时,也没有观察到硝基苯二胺和萘二胺的醛应答。已发现醛检测是基于反应聚合的调节。如果选择的分子是高反应性的和易于被引发而聚合的,则一般氧化剂能够促进反应过程,并可能限制其用作传感器。另一方面,如果分子“过于”稳定,则聚合过程变得受到抑制且不能由醛充分促进,并且需要更强的氧化剂以产生应答。
本发明还包括一种用于使用本发明的方法的装置。该装置包括优选由塑料制成的呼吸室,且在呼吸室中具有基底。基底由上文所讨论的材料且优选二氧化硅制成。基底承载来自动物呼吸的含羰基部分,例如醛。该装置还包括流体室。流体室包含水溶液,该水溶液含有醇(例如15%EtOH)、盐(例如NaCl)、表面活性剂(例如SDS)和缓冲剂(例如柠檬酸盐)。该溶液还可以包含苯二胺衍生物,如mPDA。
下述实施例显示了一种使用本发明测定人类呼吸样品中是否含有可测量的醛浓度和在呼吸中的醛浓度的方法。使用上文所讨论的方法,进行一系列荧光测量以提供已知包含在人类呼吸样品(群体)中的各种特定醛及其混合物的标准,以及此类各种标准品及其混合物的浓度的标准。使用这些标准,能够测定在人类呼吸样品中特定醛或醛混合物的存在情况和此类特定醛或醛混合物的浓度。一般而言,在一个实施方式中,步骤如下:
a.将来自人类呼吸样品的醛捕获至二氧化硅上;
b.在微酸性条件下在醇中形成包含盐、缓冲剂、表面活性剂的溶液;
c.将苯二胺衍生物添加至步骤b的溶液中;
d.将所捕获的醛洗脱至步骤c的溶液中;
e.测定步骤c的溶液的荧光信号;
f.测定步骤d的溶液的荧光信号;
g.从来自步骤f的荧光信号中减去来自步骤e的荧光信号;和
h.将来自步骤g的所得荧光信号净值与已知醛的标准荧光(校正曲线,即经测定对已知浓度的应答)进行比较,以确定在荧光溶液中的醛浓度。简而言之,这是“y”轴值的比较以提供“x”轴值,或者已知y和校正函数y=f(x)来解x。
在本发明的另一个实施方式中,基底可预负载有共价附接至CCM的活性反应性捕捉剂(“试剂”),其包括但不限于荧光肼或氨氧基化合物。氨氧基化合物的一些实例如下:氨氧基5(6)四甲基罗丹明(氨氧基5(6)TAMRA),优选5或6的单一异构体;和氨氧基5(6)羧基荧光素(氨氧基5(6)FAM),优选5或6的单一异构体,例如氨氧基-C5-5-FAM。其它包括氨氧基-7-氨基-3-乙酰基-4-甲基香豆素-6-磺酸;5-氨氧基乙酸罗丹明B;和二硝基苯肼。在前述实例中,反应性基团被指定为不具有连接基团,这是本领域技术人员熟知的。除前述以外,肼或酰肼形式包括在本发明内。优选地,试剂具有一定极性。
例如,对于由200mg 50至270目(300-50μm)的粒子组成且具有12.5mm的床直径的基底而言,试剂的量可以为5.5mg至0.1mg,优选地为2.5mg至0.4mg。
在本发明的又一个实施方式中,使用双溶液方法。在基底负载CCM后,将CCM洗脱至“冲洗”溶液中,所述冲洗溶液通常包含30%乙醇,优选50mM柠檬酸盐、30%乙醇且pH 2.5。将试剂加入冲洗溶液,从而产生经染色的CCM。然后将该溶液通过另一基底(优选二氧化硅玻璃料叠堆),以捕获经染色的CCM。然后使用第二“冲洗”溶液从具有捕获于其中的经染色的CCM的基底上洗脱经染色的CCM,所述第二冲洗溶液包含高于50%乙腈和优选90%乙醇。该第二实施方式的益处之一是基线读数不是去噪所必须的。
除非上下文另有明确要求,在整个说明书和权利要求书中,词语“包括(comprise)”、“包括(comprising)”等应以包括的意义解释,而不是排他或穷举的意义;即“包括,但不限于”的意义。此外,当用于本申请中时,词语“此处”、“上文”、“下文”和相似含义词语应指本申请整体而不是本申请的任何特定部分。在上下文允许的情况下,上述使用单数或复数的具体实施方式中的单词也可以分别包括复数或单数。在两个或更多个项目的列表的指代中的词语“或”涵盖该词语的所有以下解释:列表中的项目的任意一个,列表中的所有项目和列表中项目的任意组合。
本公开的实施方式的上述详细描述并非旨在为穷举的或将教导限于上文公开的精确形式。尽管上文出于说明的目的描述了本公开的具体实施方式和实施例,但是如相关领域的技术人员将认识到的,在本公开范围内的各种等同修改是可能的。例如,当方法以给定顺序呈现时,替代实施方式可以不同顺序进行该方法,可以删除、移动、添加、细分、组合和/或修改一些方法步骤以提供替代或子组合。此外,本申请指出的任何特定数字均仅是实例:替代实施方式可以采用不同的值或范围。
根据上述具体实施方式可以对本公开进行这些和其他改变。尽管上述说明书描述了本公开的某些实施方式,并且描述了预期的最佳模式,但是无论上述内容在文字上如何详细,都可以以很多方式实施教导。体系的细节可以在其实施细节方面大幅变化,同时仍包含在本公开所公开的主题中。如上文所示,当描述本公开的某些特征或方面时使用的特定术语不应被认为暗示该术语在本申请中被重新定义为限于与该术语相关的本公开的任何具体特征、特性或方面。一般而言,在下述权利要求中使用的术语不应被解释为将本公开限制在说明书中公开的具体实施方式,除非上述具体实施方式部分明确地定义了这些术语。因此,本公开的实际范围不仅涵盖所公开的实施方式,而且涵盖根据权利要求实践或实施本公开的所有等同方式。
因此,尽管已经示出并描述了本发明的示例性实施方式,但是应当理解,本申请使用的所有术语是描述性的而不是限制性的,并且本领域的普通技术人员在不脱离本发明的精神和范围的前提下可以进行很多改变、修改和替换。
- 还没有人留言评论。精彩留言会获得点赞!