Prokineticin2作为银屑病生物标志物及其应用的制作方法
本发明涉及一种Prokineticin2(简称PK2)作为银屑病生物标志物及其应用,具体是内源性的调节肽prokineticin2(简称PK2)作为银屑病生物标志物及其应用,属于医学分子生物学技术领域。
背景技术:
:
在皮肤病领域,银屑病(psoriasis)是一种常见的以红斑,鳞屑为主要表现的,最为常见的慢性复发性复杂疾病,被世界卫生组织列为20世纪人类皮肤病领域两大顽症之一,本病发病率在白种人中高达2%,而在中国人群中为0.123%,国内约有500万的个体罹患,并以每年净增10万病例的速度递增。银屑病该病俗称“牛皮癣”,易复发难根治并且迁延不愈,而且患者容易出现关节损害,造成运动障碍。银屑病患者通常受到不同程度的歧视,其生活质量比其他慢性病患者更为糟糕,有调查研究表明,银屑病人的生活质量仅高于抑郁症患者[1]。更重要的是,银屑病患者承受着疼痛、瘙痒、甚至出血等的生理压力。然而,由于银屑病的病因尚不清楚,其临床异质性及明显的多基因遗传方式表明诸多因素的联合作用参与其发生发展,其中主要有遗传因素、感染、药物、紧张应激以及免疫因素等[2]。银屑病特异性的生物标志物对银屑病的诊断、治疗以及病理机制的阐述都意义重大[2]。传统寻找的银屑病生物标志物是从银屑病人的血液或血浆中寻找表达水平上调的一些因子、细胞或介质。作为银屑病候选的生物标志物很多,但目前并没有能够满足临床上有效、灵敏和特异要求从而能够转化到临床应用的生物标志物[2]。
银屑病发病机理复杂,至今不明。目前公认此病相关因素较多,如遗传、感染、精神因素、内分泌因素、代谢障碍、免疫功能紊乱等。其中,免疫异常已经得到公认是银屑病的重要因素。典型的银屑病患者的皮肤病理切片中可见,角质细胞过度增生,向下(即向基底细 胞层)生长而形成“杵状”突出;向上在表皮部位形成多层重叠的角质细胞,由于角化不全,这些表皮细胞中含有细胞核,在角质细胞之间有明显的、散在的中性粒细胞浸润,形成“微脓疡”。因此,银屑病的病理中至少有下列两个因素:炎症/免疫细胞;角质细胞过度增生并角化不全。
目前在银屑病皮损部位发现的炎症/免疫细胞有单核巨噬细胞、郎格汉斯细胞、树突状细胞、Th1、Th17/Th22细胞等T细胞亚群以及中性粒细胞等。与此相关的炎症因子介导了银屑病皮损的发生。目前发现相关的重要炎症因子有TNF-a、IL-17、IL-22/IL-23等等。而且免疫细胞分泌的多种细胞因子参与银屑病的病理过程,如IL-1、IL-2、IL-8、IFN-γ等可刺激角质形成细胞的增生,血管内皮生长因子、内皮素等参与真皮毛细血管的扩张与增殖。
PK2是一种分泌型的多肽分子[3,4],是存在于人体和动物组织中的具有多种功能的分泌蛋白质,他们参与机体许多组织的多种活动,包括:胃肠道平滑肌收缩;促进卵巢和睾丸的血管生成;诱导肾上腺皮质来源的内皮细胞增生、迁移和穿通;作为生存因子调节先天和后天免疫系统,包括造血干细胞和淋巴细胞等的生长、生存及功能;神经元存活;疼痛感觉。另外,还有报道指出:PK2具有血管增生、促进炎症发生等功能[5],而血管增生以及炎症是银屑病重要的两个病理特征。银屑病和伤口愈合有很多共同点和相关性。比如,血管增生和表皮细胞增殖;还有文献表明银屑病可以增加创伤愈合率,但是其增加愈合率的影响机制却不清楚。而PK2、IL-1之间的联系如何,与银屑病的发生与发展关系如何,经文献检索,未见与本发明相同的公开报道。
参考文献:
1.Boehncke,W.H.and S.Boehncke,More than skin-deep:the many dimensions of the psoriatic disease.Swiss Med Wkly,2014.144:p.w13968.
2.Di Meglio,P.,F.Villanova,and F.O.Nestle,Psoriasis.Cold Spring Harb Perspect Med,2014.4(8).
3.Negri,L.,et al.,Nociceptive sensitization by the secretory protein Bv8.Br J Pharmacol,2002.137(8):p.1147-54.
4.Negri,L.,et al.,Bv8/Prokineticin proteins and their receptors.Life Sci,2007.81(14):p.1103-16.
5.Negri,L.,et al.,Biological activities of Bv8analogues.Br J Pharmacol,2005.146(5):p.625-32.
技术实现要素:
:
鉴于现有技术的缺陷,本发明的目的之一是提供一种与银屑病预测与监测相关的特异性的生物标志物PK2。
进一步地,主要通过检测银屑病人血液和皮肤中所述的生物标记物PK2的表达量来预测
或监测银屑病。
本发明的目的之二是提供特异性的生物标志物PK2在银屑病检测或治疗中的用途。
进一步地,特异性的生物标志物PK2作为药物靶标/或治疗靶标在制备治疗银屑病药物方面的应用。
本发明的目的之三是提供PK2在制备伤口愈合作用的相关药物的应用。
本发明Prokineticin 2作为检测银屑病的生物标记物,其特征在于,所述的生物标记物为内源性的调节肽prokineticin2(PK2)。
通过检测银屑病人血液和皮肤中所述的生物标记物PK2的表达量。
生物标记物PK2在银屑病检测或治疗中的用途。
所述的生物标记物PK2在银屑病检测或治疗中的用途,其特征在于:所述的生物标记物PK2作为药物靶标和/或治疗靶标在制备检测银屑病的试剂或治疗银屑病药物方面的用途。
生物标记物PK2在治疗伤口愈合药物中的用途。
发明人发现PK2具有促进伤口愈合和银屑病发生的新的生物学功能,可以通过检测银屑病人血液和皮肤中PK2的表达作为检测银屑病发生或发展的生物标志物。
在本发明的一个实施例中,发明人通过研究证实:通过双抗体夹心酶联免疫技术(ELISA)检测,银屑病人血液中PK2的浓度约为健康人的6.5倍,皮肤中的PK2浓度约为健康人的13倍。同时高效液相色谱法(HPLC)分析银屑病人皮肤中PK2的含量也远远高于健康人,IHC的分析结果也表明银屑病人皮肤中PK2的表达要远远高于健康人。所以PK2在银屑病人的血液和皮肤中是表达上调的。
另一个实施例4应用银屑病动物模型K14-VEGF转基因小鼠,对PK2进行过表达或敲降,并对小鼠模型的银屑病症状进行分析。实施例4中实验结果表明,PK2过表达能显著加重银屑病病症,而敲降PK2的表达,则可减缓银屑病的发病进程。角质细胞及巨噬细胞分泌IL-1,分泌的IL-1一方面可以作用于成纤维细胞诱导成纤维细胞分泌细胞因子促进成纤维细胞及角 质细胞的分化增殖,另一方面可以促进PK2的分泌,形成恶性循环维持银屑病的持续发生。
实施例5通过鸡胚尿囊膜实验也证实了PK2可以促进血管生成,并使血管发生扭曲从而加重银屑病的病症。
因此,在银屑病人血液和皮肤样本中,PK2的含量要远远高于健康人。在本发明另外一个实施例中,发明人发现在咪喹莫特诱导的小鼠银屑病模型和K14-VEGF转基因的银屑病小鼠皮肤中,PK2的表达也比正常小鼠要高。而在与银屑病人血液同时检测的其他自身免疫性疾病,如克罗恩病、溃疡性结肠炎、动脉粥样硬化以及I型糖尿病病人血液中PK2并没有表达升高,而且相关实验证明PK2可以促进银屑病的发生,所以可以通过检测病人血液中PK2的浓度对银屑病进行检测。
可见,PK2可以作为银屑病特异性的生物标记物。K14-VEGF转基因小鼠模型中,敲降PK2可以缓解银屑病的病症,所以PK2还可以作为银屑病的治疗靶标,通过中和PK2的作用或降低PK2的表达来减缓银屑病的病症,提示PK2可作为银屑病治疗的关键靶标。另外,由于伤口愈合和银屑病有很多相似之处,本发明实施例6表明:PK2还可以促进小鼠伤口愈合。
另外在对银屑病的研究过程中发现PK2还可以显著促进伤口愈合。
本发明首次发现PK2具有促进银屑病发生的功能,并通过检测银屑病人皮肤和血液中的PK2的表达,可以检测银屑病的发生或发展,因此,P2可作为银屑病发生或发展的特异性的生物标志物;同时将PK2作为靶标对银屑病的治疗具有很好的效果,对银屑病的治疗提供了新的靶标。此外,本发明还涉及PK2可促伤口愈合的活性,为伤口愈合提供了新的药物模板。
附图说明:
图1表示:HPLC法检测健康人皮肤中PK2含量;
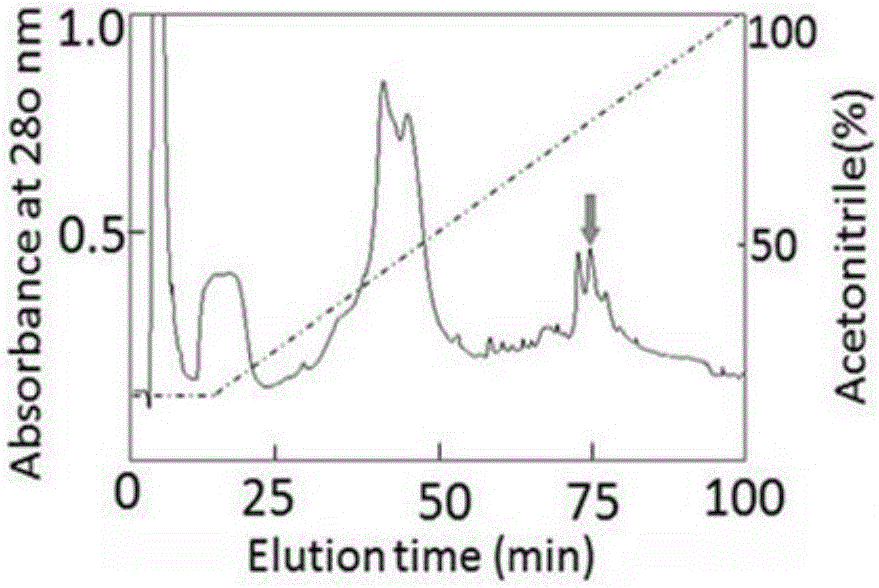
图2表示:HPLC法检测银屑病病人皮肤中PK2含量;
图3表示:质谱鉴定通过分子量判断箭头所示峰为PK2;
图4表示:IHC检测正常人皮肤和银屑病人皮肤中PK2的表达对比;
图5表示:IHC检测正常人皮肤和银屑病人皮肤中PK2含量对比;
图6表示ELISA法检测PK2在健康人和银屑病人皮肤中含量对比;
图7表示ELISA法检测PK2在正常人、以及其他自身免疫性疾病(CD,UC,AS,diabetes)血液中的含量对比;
图8显示western blot方法检测咪喹莫特诱导的小鼠银屑病模型和K14-VEGF转基因银屑病小鼠模型皮肤中PK2的表达与正常小鼠的比较。**p<0.01。
图9-15显示PK2过表达和敲降对K14-VEGF转基因小鼠银屑病指标的影响。其中C:control,NaCl(0.9%)solution;S:sh-PK2,retrovirus of psh-PK2(knock-down of PK2);NS:negative control of sh-PK2;P:PLVX-PK2,the lentivirus of PK2-PLVX-puro(overexpression of PK2);NP:negative control of PLVX-PK2,the lentivirus of empty PLVX-puro.
图9表示小鼠耳朵红度的显微照片;
图10表示小鼠耳朵红度的定量;
图11表示小鼠耳朵肿胀度;
图12表示小鼠耳朵肿胀度定量;
图13表示小鼠耳朵重量;
图14表示小鼠耳朵厚度;
图15表示小鼠淋巴结重量;
图16-18显示PK2与阳性对照EGF对伤口愈合的作用;
图16表示术后第1,3,5,7天创面愈合图;
图17表示第1,3,5,7天PK2处理组伤口创面缩小的动力曲线图;
图18表示第1,3,5,7天EGF处理组伤口创面缩小的动力曲线图。
具体实施方式:
下面结合附图对本发明做详细说明,实施例的作用仅是解释而非限定本发明。
图1-图7显示不同检测方法检测的银屑病人与健康人皮肤和血液中PK2含量的比较。其 中,显示不同检测方法检测的银屑病人与健康人皮肤和血液中PK2含量的比较,
实施例1:银屑病人和健康人血液和皮肤中PK2含量检测对比
血液中PK2的检测为常规的酶联免疫吸附测定方法(ELISA),试剂盒购自cusabio.com。具体步骤按照说明书进行操作。皮肤中PK2的检测采用反向高压液相色谱(RP-HPLC)、免疫组织化学(IHC)、ELISA三种方法。在进行RP-HPLC和ELISA之前,将定量的皮肤组织匀浆,进行蛋白定量之后进行检测。
如图1-7所示,图1表示:HPLC法检测健康人皮肤中PK2含量;图2表示:HPLC法检测银屑病病人皮肤中PK2含量;图3表示:质谱鉴定通过分子量判断箭头所示峰为PK2;图4表示:IHC检测正常人皮肤和银屑病人皮肤中PK2的表达对比;图5表示:IHC检测正常人皮肤和银屑病人皮肤中PK2含量对比;图6表示ELISA法检测PK2在健康人和银屑病人皮肤中含量对比;图7表示ELISA法检测PK2在正常人、以及其他自身免疫性疾病(CD,UC,AS,diabetes)血液中的含量对比。结果表明:
通过研究表明:通过双抗体夹心酶联免疫技术(ELISA)检测,银屑病人血液中PK2的浓度约为健康人的6.5倍,皮肤中的PK2浓度约为健康人的13倍。PK2在银屑病人的皮肤和血液中的表达都高于健康人,但在其他自身免疫性疾病(CD,UC,AS,diabetes)血液中并没有明显变化(p<0.01),所以,PK2可能是银屑病特异性指标。
实施例2:银屑病小鼠与正常小鼠皮肤中PK2检测
取咪喹莫特诱导小鼠银屑病模型皮肤匀浆液和K14-VEGF转基因银屑病小鼠模型皮肤匀浆液与正常小鼠皮肤匀浆液,进行PK2的western blot。
结果如图8所示,咪喹莫特诱导的银屑病小鼠皮肤和K14-VEGF转基因银屑病小鼠模型皮肤中的PK2表达明显高于正常小鼠皮肤(p<0.01),结果表明高效液相色谱法(HPLC)分析银屑病人皮肤中PK2的含量也远远高于健康人,IHC的分析结果也表明银屑病人皮肤中PK2的表达要远远高于健康人,所以PK2在银屑病人的血液和皮肤中是表达上调的。
实施例3:PK2过表达慢病毒与敲降逆转录病毒的构建
慢病毒载体构建:将小鼠PK2目的基因与PLVX-puro慢病毒载体经EcoRI和BamHI双酶切后,将PK2连接到PLVX-puro载体。
逆转录载体构建:根据Cheng,M.Y.et al文献,设计有效的针对小鼠PK2的siRNA序列,化学合成相应的寡核苷酸序列CATAAGGATCTGCACACC TATCTCGAGATAGGTGTGCAGATCCTTATGTTTT,并合成上述序列的无序序列AGTACTGCTTACG ATACGGTTCAAGCGACCGTATCGTATTAGCAGTACTTTT作为对照序列。并将合成的序列连接到已用BamHI和EcoRI酶切好的RNAi-Ready pSIREN-RetroQ逆转录病毒载体,构成psh-PK2或是psh-Scr。
慢病毒包装:将构建好的慢病毒载体PLVX-PK2与其辅助质粒pMDlg/PRRE、Prsv-REV和pMD2.G用Fugene 6(Promega,美国)共转染293T细胞。同时包装不含目的基因的慢病毒作为对照。
逆转录病毒包装:将构建好的逆转录病毒载体psh-PK2用xfect polymer(Clontech,美国)转染EcoPackTM 2-293细胞。同时包装psh-Scr逆转录病毒作对照。具体包装步骤如下:
(1)转染前24h,调整细胞密度为6×105细胞/ml,重新接种于T175的细胞培养瓶中,37℃。待细胞密度达70%~80%时即可用于转染。转染前2h将细胞培养基更换为无血清培养基。
(2)将所制备的各DNA溶液按转染试剂说明书与转染试剂共转染相应包装细胞。
(3)培养8h后倒去含有转染混和物的培养基,每瓶细胞加入PBS液,轻轻左右晃动一下培养瓶以洗涤残余的转染混和物,然后倒去。
(4)每瓶细胞中加入含10%血清的新的细胞培养基,于37℃、5%CO2培养箱内继续培养48小时。
病毒的收获及浓缩:收集转染后48小时(转染即可为0小时计起)的细胞上清液,可加入新鲜培养基继续培养24小时,收集合并上清,于4℃,4000g离心10min,除去细胞 碎片。收集上清,超速离心机P28S转头25000rpm 4℃离心2.5小时。离心结束后,去掉上清,收集管底病毒并进行滴度测定。
实施例4:PK2在K14-VEGF转基因小鼠中过表达及敲降对小鼠银屑病指标的影响
将实施例3中的病毒注入小鼠体内,实现PK2的过表达及敲降来检测PK2在K14-VEGF转基因小鼠中过表达及敲降对小鼠银屑病指标的影响。
对PK2表达的影响分析:分别取给药前及给药后的10、20、30天小鼠皮肤,IHC分析PK2的表达,取小鼠血液ELISA分析PK2表达。
分别取给药前及给药后的10、20、30天分析小鼠的银屑病指标,K14-VEGF转基因小鼠银屑病症状主要体现在小鼠耳朵上,包括小鼠耳朵红度,肿胀度,重量,厚度,而淋巴结的重量则反映了炎症情况。
如图9-15所示,PK2过表达可以显著加重银屑病的上述症状,说明PK2能够加重银屑病的病情,而抑制PK2可以缓解银屑病的上述症状则更加说明PK2在银屑病发生过程中起到促进作用,PK2可以作为治疗银屑病的一个靶标。
实施例5:鸡胚尿囊膜实验
选取6日龄鸡胚,70%酒精擦拭消毒蛋壳表面,在蛋壳上开一大小约1cm×1cm的方形天窗,用消毒的镊子小心掀开下面的壳膜,暴露出鸡胚绒毛尿囊膜后,用经过灭菌的小滤纸片或医用明胶海绵作为载体小心贴附在尿囊膜上,再将不同浓度的样品滴加在载体上,用灭菌医用胶布封住天窗后,放在37℃生化培养箱继续培养3天后,于解剖镜下观察鸡胚血管生成的情况。结果表明,PK2可以促进血管生成并且会导致血管扭曲,这个症状与银屑病加重的症状非常相似。
实施例6:PK2对伤口愈合的作用
用1%戊巴比妥钠溶液腹腔注射麻醉小鼠,用电推子剔除其背部毛发,经酒精消毒后,在其背部两侧对称地开两个直径约为8mm的圆形创面。一边作为对照,另一边给药或阳性对 照。其中对照为0.9%的NaCl溶液,给药组为100μg/ml PK2 10μl,阳性对照为100μg/ml鼠源EGF重组蛋白10μl,每天给药两次,隔天用相机拍摄记录创面变化情况,并用尺子测量创面,记录创面变化。将开创面第1天的创面定为100%,术后第3,5,7天的创面面积与刚开创面第1天进行比较后得到百分比值绘成折线图。
PK2对伤口愈合的作用,如图16-18所示,与对照组相比,PK2能明显促进小鼠全皮层创伤愈合,并且在创伤愈合早期(创伤愈合第3天)效果尤为明显。在第3天的效果比阳性对照EGF的效果还要突出。对照组地3、5和7天的伤口面积占第一天伤口面积的比例分别为77.8、44.6和32.1%,PK2处理组相应的值为42.8、21.6和7.6%,而EGF阳性对照组分别为77、20.8和9.8%。
因此,以PK2主要对创伤愈合早期有显著作用。
- 还没有人留言评论。精彩留言会获得点赞!