B细胞恶性肿瘤相关抗原表达量检测试剂盒及检测方法与流程
本发明涉及生物技术领域,具体涉及一种B细胞恶性肿瘤相关抗原表达量检测试剂盒。本发明还涉及B细胞恶性肿瘤相关抗原表达量检测方法,应用流式细胞术检测B-NHL肿瘤细胞的CD20、CD22抗原表达量。
背景技术:
恶性淋巴瘤是发生于淋巴结和(或)结外淋巴组织的肿瘤,是一组可以高度治愈的肿瘤。对于淋巴瘤目前国际上统一分为两大类,即霍奇金淋巴瘤(H odgkin Lymphoma,HL)和非霍奇金淋巴瘤(Non-Hodgkin Lymphoma,NHL)。NHL根据淋巴细胞起源的不同,又可分为B细胞、T细胞和自然杀伤(Natur al Killer,NK)细胞淋巴瘤,其中约70%~85%的NHL来源于B淋巴细胞。2008年的WHO病理分类将NHL分为更多种不同的疾病体和亚型,其中弥漫大B细胞淋巴瘤(DLBCL)是NHL中最常见的类型,占成人NHL的30%~40%;滤泡淋巴瘤(FL)是惰性NHL中最常见类型;套细胞淋巴瘤(MCL)约占NHL发病率的3%~10%;伯基特淋巴瘤(Burkitt’s Lymphoma)占全部NH L发病率的3%~5%,占儿童NHL的40%。
目前恶性淋巴瘤的主要治疗手段包括化疗、放疗和生物免疫治疗。造血干细胞移植可以作为某些年龄小于60岁、一般状态良好的对化疗敏感的高危初治和复发患者的选择。以DLBCL为例,20年来CHOP方案一直是其标准的一线化疗方案。最近10年来其治疗取得了巨大进步,主要体现在剂量密度/剂量强度化疗和利妥昔等单克隆抗体用于一线治疗,使患者的生存率有了进一步提高。高剂量化疗联合自体造血干细胞移植是一种增加剂量强度的治疗,一些研究应用高剂量化疗作为巩固治疗,成功减低了年轻、高危患者的复发。
单克隆抗体是B淋巴细胞和骨髓瘤细胞杂交形成的杂交瘤细胞产生的,其重链和轻链所形成的结构域可以识别和结合特异抗原。近年来是单克隆抗体发展的黄金期,单克隆抗体药物以其高特异性、有效性和安全性正在发展成为国际药品市场上一大类新型诊断和治疗药物,日益成为癌症及其他疾病治疗市场的新宠。95%以上的B-NHL有CD20抗原的表达,CD20抗原可作为免疫治疗B细胞淋巴瘤的理想作用位点。CD20抗原是一种非糖基化的细胞膜磷蛋白,其分子量为3500kd,目前研究发现,CD20抗原是信号传递通道复合物的一部分,其功能类似于钙离子通道,参与调节B淋巴细胞的生长和分化。CD20抗原的表达严格限制在前B淋巴细胞的晚期和成熟B淋巴细胞,在造血干细胞、祖细胞和其它正常组织中没有CD20抗原的表达。当B淋巴细胞分化为分泌抗体的浆细胞时,CD20抗原的表达也随之消失。
利妥昔单克隆抗体(Manthera,美罗华)是由罗氏制药公司生产的抗CD20嵌合型单克隆抗体。它能特异性地与B淋巴细胞表面CD20抗原结合,通过补体依赖的细胞毒作用、抗体依赖的细胞毒作用和诱导细胞凋亡清除体内的B淋巴细胞。1997年11月,FDA批准将Manthera应用于复发或难治性的CD20阳性B细胞低度恶性或滤泡型淋巴瘤,目前Manthera也正式用于中、高度恶性淋巴瘤或与其它药物联用,而且具有很好的治疗效果。
CD22分子是一个跨膜唾液酸糖蛋白,为免疫球蛋白超家族的成员之一,其分子量为130~140KD。CD22表达于成熟B淋巴细胞、晚期前B淋巴细胞及早期前B淋巴细胞的胞质中,分化为浆细胞后消失,CD22与B细胞的发育密切相关。CD22可以在85%以上的B-NHL中检测到。依帕珠单克隆抗体(E pratuzumab)是继Manthera之后,又一个针对B细胞抗原CD22的单克隆抗体。CD22与抗体结合后,迅速发生抗原抗体复合物的细胞内化,继而使得胞内部分的CD22分子发生磷酸化而影响BCR的功能。Epratuzumab的抗肿瘤作用,可能是由于Epratuzumab与CD22分子结合后,干扰了细胞信号的正常传导,从而使细胞更容易发生凋亡。Ⅰ期和Ⅱ期临床研究显示,Epratuzumab的毒副作用轻,耐受性良好,对于滤泡型和弥漫大B细胞型淋巴瘤有较好疗效,且可能与Manthera具有协同作用,很有希望成为治疗B细胞NHL的治疗药物。
传统检测B-NHL细胞表面抗原表达的方法为免疫组化法,是应用免疫学基本原理,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原,对其进行定位、定性及相对定量的研究。因为免疫组化法的结果需要人工通过显微镜或荧光显微镜观察,结果易受主观影响,且不能用于抗原分子的表达定量检测中。另外当患者经过单抗药物治疗后,标本中的细胞数量会出现明显减低,因免疫组化法的灵敏度有限,很容易造成假阴性的结果。免疫组化检测的样本多为淋巴结活检标本,而一些不易取材或无明显病灶的淋巴瘤则无法应用免疫组化方法进行检测。
酶联免疫吸附剂测定(Enzyme Linked Immμnosorbent Assay,ELISA)是采用抗原与抗体的特异反应将待测物与酶连接,通过酶与底物产生颜色反应,进行定量测定。目前已建立了ELISA检测CD20、CD22单克隆抗体的方法。已开发出相应的商品化试剂盒,可以检测血清、血浆、组织匀浆液、细胞上清培养液等样本中的含量。但是ELISA方法仅可检测液体中可溶性蛋白的含量,即检测B细胞分泌到血液或骨髓中的CD20、CD22抗体的含量而无法直接检测细胞表面的抗原表达量,且此方法容易受抗体、时间、温度等干扰,出现假阳性。
随着单克隆抗体药物的快速发展与广泛应用,寻找到一种快速、方便、灵敏及准确评价单抗药物疗效的方法也变得尤为重要。且单克隆抗体药物价格昂贵,从卫生经济学考虑也需要有一种检测手段可以评价用药效果。放射性核素标记方法可测定每个细胞表面某种分子的数目,具有特异性强且灵敏度高的特点。放射性核素标记方法是将非标记抗原与放射性标记抗原同时竞争结合物(如抗体)上有限的结合位点,然后将结合抗原和未结合的游离抗原分离,用仪器测定放射性分布,利用标准曲线确定样本中待测物含量。但缺点是受核素半衰期的限制且需特别防止其放射性污染。而且目前国内尚未开发出用于CD20、CD22检测的放射免疫测定试剂盒。
综上所述,如何对B淋巴细胞的CD20和CD22抗原表达实现快速、准确的定量检测分析,成为当前亟待解决的技术问题。
技术实现要素:
本发明的目的在于克服现有技术中B淋巴细胞CD20和CD22抗原表达定量分析技术的不足,提供了B细胞恶性肿瘤相关抗原表达量检测试剂盒及检测方法,可快速、准确的实现对B淋巴细胞CD20和CD22抗原表达的定量检测分析,有效的指导相应单抗药物对B-NHL的靶向治疗。
为了实现上述技术目的,本发明实施例提供的一种技术方案为:
一种B细胞恶性肿瘤相关抗原表达量检测试剂盒,其试剂包括不同的荧光标记的抗CD45抗体和抗CD19抗体,以及抗CD20或CD22抗体。
优选的,所述抗CD45抗体的荧光标记为Percp。
优选的,所述抗CD19抗体的荧光标记为APC。
优选的,所述抗CD20或CD22抗体的荧光标记为PE。
作为前述技术方案的优选,所述试剂还包括红细胞裂解液和磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS)。
本发明实施例提供的另一种技术方案为:
一种B细胞恶性肿瘤相关抗原表达量检测方法,包括步骤如下:
S1.采集检测标本:抽取B淋巴细胞非霍奇金淋巴瘤患者的外周血或骨髓作为检测标本;
S2.加入抗体及荧光染色:将所述检测标本中加入使用不同的荧光标记的抗CD45抗体和抗CD19抗体,以及抗CD20或CD22抗体,并混匀;
S3.流式细胞术检测:对所述检测标本进行孵育和红细胞裂解后,使用流式细胞术进行检测,设门分型得到CD19+CD20+或CD19+CD22+的靶标细胞荧光强度;
S4.测定标准曲线:使用流式细胞术在所述检测标本同等条件下测定Qua ntiBRITE PE Beads荧光,获得Beads(微球)平均荧光强度与抗原表达量的标准曲线;
S5.计算抗原表达量:将所述靶标细胞荧光强度值代入标准曲线换算得到所述检测标本中B淋巴细胞CD20或CD22平均抗原表达量。
优选的,执行步骤S2前,对所述检测标本进行白细胞计数,将所述检测标本的细胞浓度调至3×107/mL。
优选的,步骤S4测定所述标准曲线时,使用流式细胞仪检测QuantiBRIT E PE Beads荧光强度,以前向角/侧向角设门得到Beads;根据PE荧光强度在将Beads分群,并得到每群Beads的荧光强度均值;根据Beads提供的分子量和得到的所述每群Beads的荧光强度均值拟合得到所述标准曲线。
优选的,步骤S2中,加入所述检测标本的所述不同的荧光标记的抗体为:CD45Percp和CD19APC,以及CD20PE或CD22PE。
优选的,对所述检测标本进行设门分型时,在CD45Percp-SSC图中设门得到CD45阳性的淋巴细胞,进一步在CD45Percp-CD19APC图中设门得到CD45+CD19+的B淋巴细胞;进一步在CD19APC-CD20PE图中设门得到所述CD19+CD20+的靶标细胞,或在CD19APC-CD22PE图中设门得到所述CD19+CD22+的靶标细胞。
流式细胞术(Flow Cytometry,FCM)是一种在功能水平上对单细胞或其它生物粒子进行定量分析和分选的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,与传统的荧光镜检查相比,具有速度快、精度高、准确性好、灵敏度高、环境友好、操作简便等优点。流式细胞术可以同时检测样本细胞的前向角散射(Forward Scatter,FSC)、侧向角散射(Side Scatter,SSC)及多个荧光通道强度,通过选择合适的荧光抗体及正确的设门可以准确知道各群细胞的抗体表达情况,传统的流式细胞术主要是测定表达目标抗原细胞所占的比例,以及对目标抗原的表达做定性分析,即判断抗体表达是否为阴性、弱阳性或强阳性,而很少对抗体表达做定量分析。
本发明以流式细胞术为基础,通过引入PE微球的方法检测患者外周血及骨髓中正常或异常B淋巴细胞CD20、CD22的抗原表达量,与现有的其它检测方法比较,具有可以定量检测,可直接检测细胞表面的抗原表达量,可直观的反映B-NHL的特点;其所用标本量少,操作简单、快捷,无环境污染。定量检测结果可用于指导临床CD20、CD22单抗药物对B-NHL的靶向治疗,以及对治疗预后进行判断。
附图说明
图1所示为本发明实施例B细胞恶性肿瘤相关抗原表达量检测方法的基本流程图;
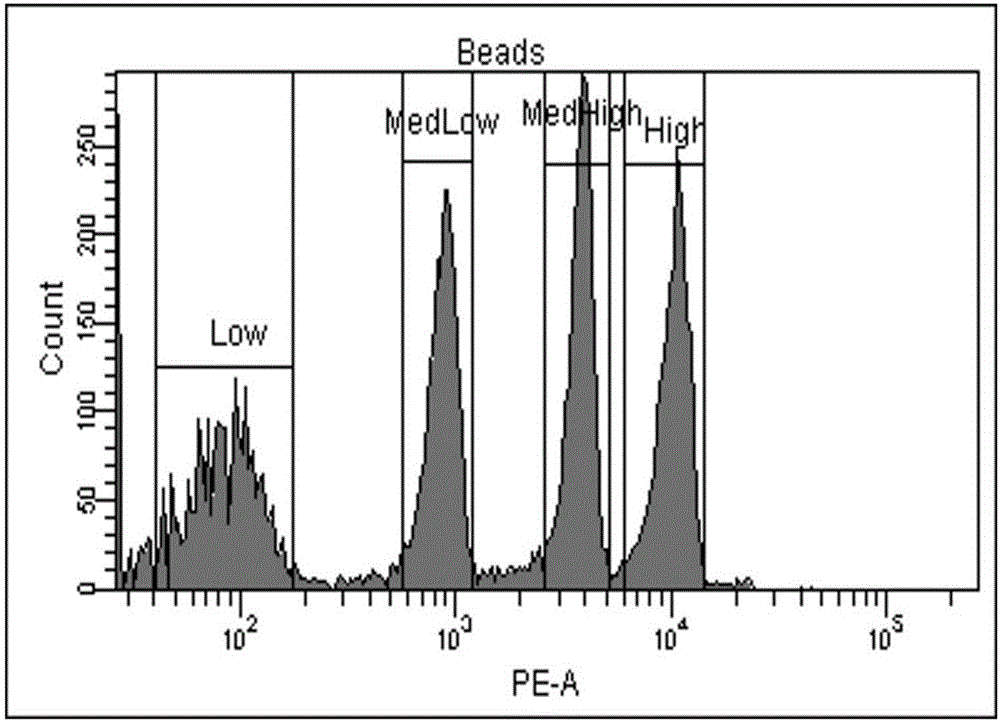
图2所示为本发明实施例中QuantiBRITE PE Beads的微球PE荧光强度的Count-PE直方图;
图3所示为本发明实施例中测定获得微球平均荧光强度和抗原表达量对数值的标准曲线;
图4所示为本发明实施例一使用BD FACSDIVA软件分析数据样本管获得的B淋巴细胞分型结果,得到的是CD20+的靶标细胞;
图5所示为本发明实施例二使用BD FACSDIVA软件分析数据样本管获得的B淋巴细胞分型结果,得到的是CD22+的靶标细胞。
具体实施方式
以下结合附图通过实施例对本发明做进一步说明,以便更好地理解本发明。
本发明的技术方案将所述试剂盒应用于所述检测方法,使用流式细胞术检测B-NHL患者外周血及骨髓中的B淋巴细胞的CD20和CD22抗原表达量。
本发明一种B细胞恶性肿瘤相关抗原表达量检测试剂盒的实施例,其试剂包括不同的荧光标记的抗CD45抗体和抗CD19抗体,以及抗CD20或抗C D22抗体。
作为一种优选的实施方式,前述试剂盒中,抗CD45抗体的荧光标记为P ercp,抗CD19抗体的荧光标记为APC,抗CD20或CD22抗体的荧光标记为PE;试剂还可包括红细胞裂解液和PBS。
实施例一:
本发明一种B细胞恶性肿瘤相关抗原表达量检测方法的实施例,如图1所示,包括步骤如下:
S1.采集检测标本:抽取B-NHL患者的外周血或骨髓作为检测标本;
S2.加入抗体及荧光染色:将检测标本中加入使用不同的荧光标记的抗C D45抗体、抗CD19抗体和抗CD20抗体并混匀;
S3.流式细胞术检测:对检测标本进行孵育和红细胞裂解后,使用流式细胞术进行检测,设门分型得到CD19+CD20+的靶标细胞荧光强度;
S4.测定标准曲线:使用流式细胞术在检测标本同等条件下测定QuantiB RITE PE Beads荧光,获得Beads平均荧光强度与抗原表达量的标准曲线;
S5.计算抗原表达量:将靶标细胞荧光强度值代入标准曲线换算得到检测标本中标靶细胞表面CD20抗原表达量。
具体的检测技术方案如下:荧光标记的抗体使用CD45Percp/CD19APC/CD20PE;
试剂用量及添加标准,标本与抗体的添加比例为:细胞浓度调至3×107个/mL,向流式管中加70μL标本;单次检测(test)中,试剂按照试剂说明添加CD45Percp 10μL/test、CD19APC 5μL/test、CD20PE 20μL/test,确保抗体充足;
使用美国BD公司(Becton,Dickinson and Company)的QuantiBRITE P E Beads,同时根据QuantiBRITE PE Beads中不同Beads群的平均荧光强度及Beads上的分子量绘制标准曲线。将检测标本中粒细胞的CD20的平均荧光强度带入标准曲线,计算出中性粒细胞上CD20的平均抗原表达量。
作为一种优选的实施方式,具体操作流程为:
步骤S1中,抽取B-NHL患者的外周血作为检测标本,对检测标本进行白细胞计数,将细胞浓度调至3×107/mL;
步骤S2中,取一支专用的流式管,向流式管中加入CD45-Percp 10μL、CD19APC 5μL、CD20PE 10μL;向流式管内加入检测标本70μL,低速涡旋混匀;
步骤S3中,将混匀检测标本室温避光孵育20min;向流式管内加入红细胞裂解液1mL,低速涡旋混匀,室温避光裂解红细胞10min;裂解结束后立即以1500r/min离心5min,离心结束后弃上清,然后向管内加入1mL PBS,低速涡旋混匀,以1500r/min离心5min;离心结束后弃上清;向管内加入0.5mL的PBS重悬细胞,低速涡旋混匀,24h内使用流式细胞仪上机检测;在检测时,调节好个通道电压,收集P1门内细胞100万;
步骤S4中,取一支PE Beads,加入500μL缓冲液(0.3%甲醛溶液),与前述检测标本同样条件使用流式细胞仪上机检测;应用BD FACSDIVA软件分析数据,在SSC-FSC散点图中设门得到Beads,绘制如图2所示的Count-P E的直方图中,根据PE荧光强度的不同将Beads分为Low、MedLow、MedH igh和High四个群,得到每群Beads的荧光强度的均值;以Beads提供的分子量的对数值为横坐标与测定获得的Beads荧光强度均值的对数值为纵坐标,拟合得到如图3的Beads荧光强度和抗原表达量的标准曲线;
步骤S5中,应用BD FACSDIVA软件分析检测标本的流式管,如图4所示:
在CD45 Percp-SSC图中设门得到CD45阳性且SSC较小的淋巴细胞,CD45 Percp-CD19 APC图中设门的到CD45+CD19+的B淋巴细胞,在CD19 APC-CD20PE图中得到CD19+CD20+的靶标细胞,读取靶标细胞的荧光强度的均值,取对数代入Beads荧光强度和抗原表达量的标准曲线,得到CD20抗原表达量的对数值,从而得到B淋巴细胞的CD20平均抗原表达量。
实施例二:
本实施例与实施例一所用的试剂盒及检测流程基本相同,区别在于将加入流式管试剂中的抗CD20抗体替换为抗CD22抗体,即荧光标记的抗体使用CD45 Percp/CD19 APC/CD22 PE;设门时也将针对CD20的设定改为针对CD22进行。
步骤S5中,应用BD FACSDIVA软件分析检测标本的流式管,如图5所示:
在CD45Percp-SSC图中设门得到CD45阳性且SSC较小的淋巴细胞,CD45 Percp-CD19 APC图中设门的到CD45+CD19+的B淋巴细胞,在CD19 APC-CD22 PE图中得到CD19+CD22+的靶标细胞,读取靶标细胞的荧光强度的均值,取对数代入Beads荧光强度和抗原表达量的标准曲线,得到CD22抗原表达量的对数值,从而得到B淋巴细胞的CD22平均抗原表达量。
在本发明中,上标“+”代表阳性,即表示该抗原在细胞表面有表达。
若未特别指明,以上各实施例中所用技术手段为本技术领域技术人员的常规手段,所用原料均为可取得的市售产品。
应理解,上述实施例只为说明本发明的技术构思及特点,其目的在于供本领域技术人员了解本发明的内容并据以实施,并非具体实施方式的穷举,并不能以此限制本发明的保护范围。凡根据本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的保护范围当中。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤特异抗原及其应用的制作方法与工艺
- 用于制备具有增加的特异性基因表达的树突细胞的方法和包含使用所述方法制备的树突细胞的用于治疗或预防自身免疫性疾病的组合物与流程
- 一种兼有NK细胞特质的抗原特异性T细胞的制备方法与流程
- 一种特异性肿瘤抗原NSE的CTL识别表位肽及其应用的制作方法与工艺
- 一种特异性肿瘤抗原SF的CTL识别表位肽及其应用的制作方法与工艺
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 特异性识别胃癌细胞的DNA适配子GCA‑5及其应用的制造方法与工艺
- 一种制备结直肠癌抗原特异性T细胞的方法与流程
- 用作诱导抗原特异性T细胞反应的免疫原性增强剂的融合蛋白的制造方法与工艺