一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法与流程
本发明涉及分析化学技术领域,进一步涉及核酸适配体技术,具体涉及一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法。
背景技术:
赭曲霉毒素A(OTA)是一种具有很强毒性的真菌毒素,其毒性在真菌毒素家族中位列第二位,仅次于黄曲霉毒素。OTA在自然界分布广泛,不仅污染谷物粮食,还严重污染动物性食品,对人类构成极大的威胁。鉴于食品安全问题关乎整个社会的安危,是受到国家及人民高度关注的大问题,建立OTA的高灵敏简便快速分析方法越发受到科研人员的重视。
目前,很多基层食品检测部门较多采用薄层层析法进行OTA的定量检测,这也是较早的一种OTA的检测方法,但其存在灵敏度较差、检测周期长、所需试剂较多、重现性差等缺点,已然不能满足现阶段对OTA的检测要求。另外,常见的OTA检测方法还有高效液相色谱-荧光检测法、毛细管电泳-二极管阵列检测法、液相-质谱联用法、固相萃取荧光检测法等,但这些方法通常对样品中毒素纯度做了较高要求,且所使用的相关设备价格昂贵,故存在检测周期长、成本高等一些缺点,导致无法满足大批量样本快速筛查的需要。另外,OTA作为一种小分子物质,其分子量为403.82,是典型的半抗原,故有基于OTA免疫抗体分子作为识别元件的免疫检测方法,例如免疫传感、酶联免疫法等。这些方法虽然灵敏度高、特异性好,但也存在一定的局限性,比如抗体分子制备周期长、成本较高、稳定性差、易失活及易受pH、温度等环境因素影响而变性,故在不同程度上限制了免疫方法检测OTA的开展。
近年来,核酸适配体技术在分析化学尤其是微量物质的定量检测中展现出了突出的技术优势。核酸适配体是通过SELEX技术体外筛选出来的能够特异性结合目标配体的寡聚核苷酸片段。以其特有的高亲和力和特异性,可作为识别探针和生物传感器,与蛋白质类抗体相比,核酸适体不仅能高效、特异性地识别和结合各种生物目标分子,还具有易标记、易合成、性质稳定等优势。然而,要获得可行的检测方法,建立高效的适配体传感器是关键所在,首先适体传感器在分子水平上应当满足实验所选择的发光体系的要求,采用何种标记物,标记物在传感器上的连接方法等都需要进行针对性设计;此外,选择何种分离载体和捕获探针可以完整收集信号物质并实现与信号物质含量成规律的发光反应,也需要根据发光体系、标记物、适配体等物质的性质进行设计;除此之外,发光体系的选择关乎最终检测结果与被检测物质真实含量之间的关系,因此也是影响检测效果的重要因素。
技术实现要素:
本发明旨在针对现有技术的技术缺陷,提供一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,以解决现有技术中OTA检测方法所适用的OTA浓度范围较窄的技术问题。
本发明要解决的另一技术问题是现有技术中适用于较宽OTA浓度范围的OTA检测方法,其准确性较低。
为实现以上技术目的,本发明采用以下技术方案:
一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,包括以下步骤:
1)通过氨羧反应将氨基修饰的OTA适体固定在羧基磁性微球表面,得到磁性微球-OTA适体复合物;
2)向步骤1)所得的磁性微球-OTA适体复合物中先后加入待测样品和生物素化的报告序列,充分反应;
3)取固相与SA-HRP溶液混合后共孵育,取固相即得到辣根过氧化酶标记的适体传感器;
4)将步骤3)所述辣根过氧化酶标记的适体传感器与HRP化学发光底物混匀,而后检测发光信号CL值。
作为优选,步骤1)包括以下操作:取磁性微球,利用0.05~0.2M的咪唑缓冲溶液洗涤,而后取固相重悬于含有EDC的咪唑缓冲溶液中,于35~39℃震荡孵育15~25min,而后以磁性微球与氨基修饰的OTA适体用量比为2:(1~2)(μg:pmol)的比例加入氨基修饰的OTA适体,于35~39℃震荡反应50~70min。
作为优选,步骤1)还包括以下操作:于35~39℃震荡反应50~70min后,取固相利用PBST缓冲溶液洗涤。
作为优选,步骤1)还包括以下操作:利用PBST缓冲溶液洗涤后,取固相加入8~12%的PVP溶液,于35~39℃条件下震荡50~70min,而后取固相利用PBST缓冲溶液洗涤,即得到磁性微球-OTA适体复合物。
作为优选,步骤2)包括以下操作:向步骤1)所得的磁性微球-OTA适体复合物中加入待测样品,于35~39℃条件下震荡50~70min,取固相利用PBST缓冲溶液洗涤,取固相与含有生物素化的报告序列的BA杂交液混合,在35~39℃震荡反应50~70min,取固相利用PBST缓冲溶液洗涤。
作为优选,步骤2)中BA杂交液中生物素化的报告序列的含量为15~25pmol。
作为优选,步骤2)中BA杂交液的加入量与步骤1)中氨基修饰的OTA适体用量之比为5:(1~2)(μL:pmol)。
作为优选,步骤3)所述SA-HRP溶液是稀释倍数为1:10000的SA-HRP溶液。
作为优选,步骤3)所述共孵育是在35~39℃条件下震荡50~70min。
作为优选,在以上技术方案中所述的取固相,均是通过磁性分离移去上清液实现的。
作为优选,所述检测发光信号CL值,是利用BPCL微弱化学发光仪实现的。
在以上技术方案中,所述咪唑缓冲液可依据本领域的一般技术常识选择常规的配方配制。所述PBST缓冲液是含有137mM NaCl,2.7mM KCl,10mM Na2HPO4·12H2O,2mM KH2PO4,0.05%Tween20的水溶液,其pH是7.2~7.6。所述BA杂交液是含有20mM Tris,0.5M NaCl的水溶液,其pH是7.8~8.2。
在以上技术方案中,所述生物素化的报告序列是指序列如下所示的核酸-生物素复合物:5’-CACCCACACCCGATC-biotin-3’;该物质可自试剂销售公司定制、购得。所述氨基修饰的OTA适体是序列如下所示的核酸-氨基复合物:5’-GATCGGGTGTGGGTGGCGTAAAGGGAGCATCGGACA-NH2-3’,该物质同样可自试剂销售公司定制、购得。步骤2)中待测样品中的OTA与生物素化的报告序列二者均与标记于磁性微球上的OTA适体具有结合作用,二者的加入量在其结合反应中满足以下条件:OTA适体相对于待测样品中的OTA过量,而待测样品中的OTA与生物素化的报告序列二者总量相对OTA适体过量,也就是说,待测样品和生物素化的报告序列与磁性微球-OTA适体混合后,待测样品中的OTA完全与OTA适体相结合,而剩余未结合的OTA适体完全与生物素化的报告序列相结合,仅剩余的生物素化的报告序列游离于体系中;具体的用量可参照本发明具体实施方式来确定。步骤2)所述的充分反应,是指待测样品中的OTA、生物素化的报告序列二者与磁性微球上的OTA适体之间结合反应充分。
在利用本发明方法执行检测时,可以先利用该方法对一组具有浓度梯度且已知浓度的OTA标准溶液进行检测,以绘制出OTA浓度与发光信号CL值之间的线性关系,而后再对待测样品执行检测,将检测结果带入上述线性关系以获得实际检测值。其中标注曲线的绘制是利用本发明方法绘制的,而其中注入浓度梯度的选择、图表模式的选择、误差的校正等可以依照本领域的一般技术常识确定。
本发明提供了一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,该技术方案以羧基磁性微球作为分离载体,在磁性微球表面构建OTA的夹心式适体传感器,基于HRP能够催化鲁米诺化学发光体系产生化学发光信号,以HRP作为标记物标记于传感器上,利用传感器中所加OTA浓度与磁性微球表面HRP固定量的负相关性,实现了OTA的HRP标记化学发光检测。该技术方案基于核酸适配体的高亲和性,利用OTA与报告序列竞争结合OTA适体,从而得到了待测OTA浓度与磁性微球表面报告序列固定量的负相关关系。最后通过对磁性微球表面固定的报告序列进行HPR标记,以HRP作为检测探针进行化学发光检测。利用HRP催化鲁米诺体系产生化学发光的原理,建立磁性微球表面HRP固定量与化学发光强度的对应关系,在保证检测精度的基础上拓宽了适用的OTA浓度范围。
附图说明
图1是本发明检测方法的原理示意图。
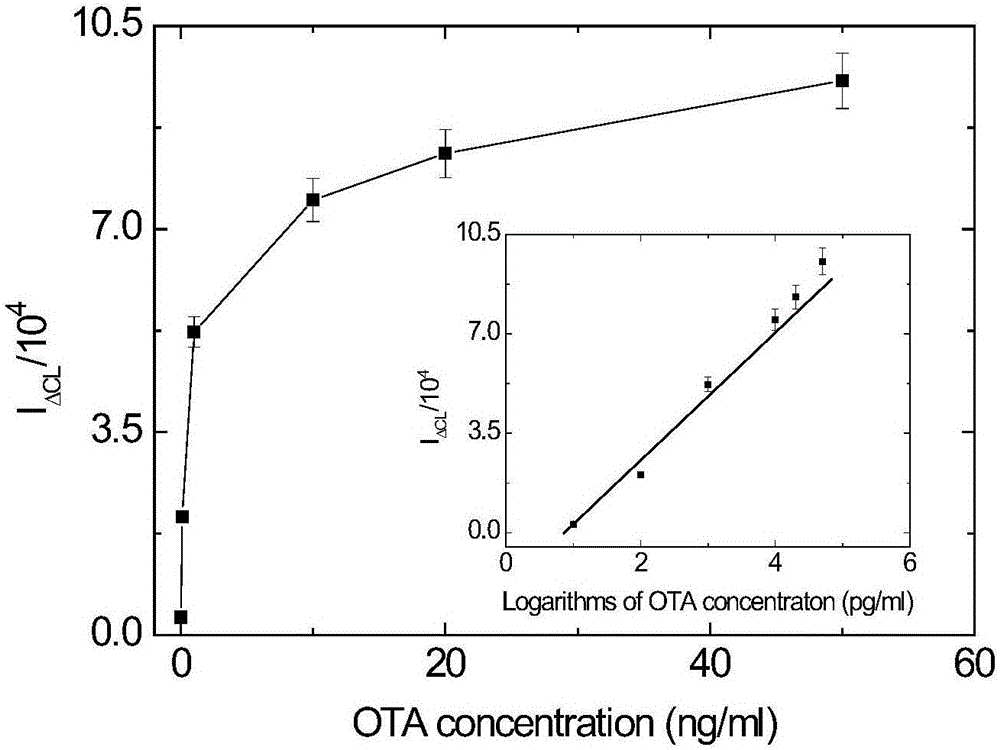
图2是本发明实施例1中的标准曲线图。
图3是本发明实施例1中对本发明检测方法的特异性考察实验结果。
具体实施方式
以下将对本发明的具体实施方式进行详细描述。为了避免过多不必要的细节,在以下实施例中对属于公知的结构或功能将不进行详细描述。
以下实施例中所使用的近似性语言可用于定量表述,表明在不改变基本功能的情况下可允许数量有一定的变动。因此,用“大约”、“左右”等语言所修正的数值不限于该准确数值本身。在一些实施例中,“大约”表示允许其修正的数值在正负百分之十(10%)的范围内变化,比如,“大约100”表示的可以是90到110之间的任何数值。此外,在“大约第一数值到第二数值”的表述中,大约同时修正第一和第二数值两个数值。在某些情况下,近似性语言可能与测量仪器的精度有关。
除有定义外,以下实施例中所用的技术和科学术语具有与本发明所属领域技术人员普遍理解的相同含义。
以下实施例中所用的试验试剂耗材,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法;以下实施例中的定量试验,均设置三次重复实验,结果取平均值;以下实施例中的%,如无特别说明,均为质量百分含量。
在以下实施例中:所述生物素化的报告序列是指序列如下所示的核酸-生物素复合物:5’-CACCCACACCCGATC-biotin-3’;
所述氨基修饰的OTA适体是序列如下所示的核酸-氨基复合物:
5’-GATCGGGTGTGGGTGGCGTAAAGGGAGCATCGGACA-NH2-3’;二者均购于上海生工生物有限公司。
实施例1
1实验原理
本实验以羧基磁性微球作为分离载体,在磁性微球表面构建OTA的夹心式适体传感器,基于HRP能够催化鲁米诺化学发光体系产生化学发光信号,以HRP作为标记物标记于传感器上,利用传感器中所加OTA浓度与磁性微球表面HRP固定量的负相关性,实现了OTA的HRP标记化学发光检测。首先通过氨羧结合反应将氨基OTA适体固定在羧基磁性微球表面;然后分别加入不同浓度的OTA与等量且过量的生物素化报告序列,由于OTA与OTA适体的特异性结合能力高于OTA适体与报告序列之间的互补配结合力,故OTA会优先与OTA适体反应,从而固定在磁性微球表面的生物素化报告序列与加入的OTA浓度呈负相关性,即加入的OTA浓度越高,通过与OTA适配互补杂交固定在磁性微球表面的生物素化报告序列量就越少。最后,加入SA-HRP,通过生物素-链霉亲和素反应将HRP固定在磁性微球表面,通过化学发光检测磁性微球表面HRP的量,间接定量微球表面固定的生物素化报告序列,从而间接实现OTA的定量检测。当没有OTA存在时(即空白组),CL信号值到达最高。当加入一系列不同浓度的OTA时,随着OTA浓度的增大,CL信号值逐渐变小,然则对比空白组CL信号值所引起的化学发光变化量(ΔCL)逐渐增大。因此,添加不同浓度OTA所引起的ΔCL与OTA浓度呈正相关。实验原理图如图1所示。
2实验方法
2.1辣根过氧化酶适体传感器制备
取40μg羧基磁性微球于1.5mL离心管中,通过磁性分离除去上清液。取100μL 0.1M咪唑缓冲液(pH6.0)洗涤磁性微球,重复三次;加入含有EDC的咪唑缓冲溶液100μL,使羧基磁性微球悬浮于其中,在37℃下恒温震荡活化20min;然后向磁性微球悬浮液中加入30pmol氨基OTA适体,在37℃下恒温震荡反应1h,通过氨羧反应使OTA适体固定在磁性微球表面;通过磁性分离去除上清液,磁性微球用100μL PBST缓冲溶液(137mM NaCl,2.7mM KCl,10mM Na2HPO4·12H2O,2mM KH2PO4,0.05%Tween20,pH7.4)洗涤以除去多余的未固定到磁性微球表面的OTA氨基适配体,重复三次;随后加入10%PVP溶液100μL,在37℃下恒温震荡反应1h,封闭磁性微球表面多余的结合位点,从而减少后续反应中的非特异性吸附;通过磁性分离去除上清液,用100μLPBST缓冲溶液洗涤磁性微球,重复三次;加入一系列不同浓度的OTA溶液,在37℃下恒温震荡反应1h,使OTA与适配体充分特异性结合;通过磁性分离去除上清液,磁性微球用100μL PBST缓冲溶液洗涤以除去多余的游离OTA,重复三次,向磁性微球中加入100μL含有20pmol bio-reporter DNA的BA杂交液(20mM Tris,0.5M NaCl,pH8.0),在37℃下恒温震荡反应1h,使bio-reporter DNA与磁性微球表面未与OTA特异性结合的OTA氨基适配体互补杂交,从而固定在磁性微球表面;通过磁性分离去除上清液,磁性微球用100μL PBST缓冲溶液重复洗涤三次,洗去多余的bio-reporter DNA,最后向磁性微球中加入100μL稀释倍数为1:10000的SA-HRP溶液,在37℃下恒温震荡反应1h,使SA-HRP通过生物素与链霉亲和素间的高亲和力固定到磁性微球上;取100μL PBST缓冲溶液重复洗涤磁性微球三次,待测。
2.2化学发光检测
将上述制备好适体传感器复合物悬浮于50μL HRP化学发光底物A液中,转移至圆柱形玻璃测量瓶中,然后再向测量瓶中加入50μL HRP化学发光底物B液,混合均匀,随后放入化学发光检测器中测定,化学发光信号由BPCL微弱化学发光仪测量,并由仪器所连的电脑终端显示并记录,取化学发光信号峰值为最终信号值。
2.3辣根过氧化物酶适体传感器性能评价
本发明通过对自酿葡萄酒样本进行加标回收试验,从而评价本方法的准确性及精密度。实验选用了C18固相萃取小柱对葡萄酒中的OTA进行提取净化,C18小柱使用前分别用2mL乙腈和2mL水活化。先取5mL葡萄酒样品加入5mL水,分别按照1、5、10ng/mL水平添加OTA标准品,混合作为上样液进行上样;再分别用10mL水淋洗,2mL甲醇-冰乙酸(99.5:0.5,v/v)进行洗脱,控制流速1mL/min;最后,洗脱液在50℃下用氮气吹干,再用1mL甲醇溶解,0.45μm有机滤膜过滤,滤液即为待测液。随后用本方法对待测液进行化学发光检测,计算加标样品回收率。
另外,本发明还选取了两种食品中常见的真菌毒素AFB1和ZEN以及两种与OTA结构类似的物质WF、NAP对本方法的选择特异性进行考察。实验分别取10ng/mL OTA及与其等物质量浓度的AFB1、ZEN、WF、NAP采用本方法进行分析检测,并观察分别加入AFB1、ZEN、WF、NAP后化学发光信号值的变化。
3实验结果
3.1标准曲线的建立
在优化实验条件下(40μg羧基磁性微球,30pmol氨基OTA适体,30pmol生物素化报告序列,1:10000稀释倍数的SA-HRP),通过在辣根过氧化酶适体传感器中添加一系列不同浓度的OTA,进行化学发光法进行检测,从而建立OTA化学发光检测标准曲线。结果如图2所示,在OTA浓度为0.01~50ng/mL范围内,ΔCL信号值(Y)与OTA浓度(X)的对数值呈良好的线性关系(Y=22490.6X-19524.9,r2=0.9898)。本方法最低检出限为0.01ng/mL。
3.2辣根过氧化物酶适体传感器性能评价
在优化实验条件下(40μg羧基磁性微球,30pmol氨基OTA适体,30pmol生物素化报告序列,1:10000稀释倍数的SA-HRP),本发明分别对添加了10ng/mL的OTA及等水平的AFB1、ZEN、Wararin、NAP的辣根过氧化酶适体传感器进行化学发光检测,考察该传感器的特异性。实验结果如图3所示,添加OTA组的ΔCL信号值远远高于其他四组,说明该传感器对OTA有很高选择特异性,利用本方法进行OTA检测不会受到其他物质的影响。本发明推断,该传感器对OTA的高特异性主要依赖于OTA适体对OTA的特异性。
另外,本发明选取了三个不同浓度水平的OTA(1、5、10ng/mL)进行加标回收实验。结果如表1所示,平行三次测定,平均回收率在98.5%~109.3%之间,相对标准偏差在5.2%~7.7%之间。
表1葡萄酒样品加标回收率
4实验结论
本发明利用羧基磁性微球作为分离及固定载体,在其表面组装了OTA适体传感器,并以HRP作为检测标记物。利用核酸适配体技术及HRP催化鲁米诺-过氧化氢体系化学发光的特性,实现了OTA的高特异性、高灵敏度、快速定量检测。在优化实验条件下(40μg羧基磁性微球,30pmol氨基OTA适体,30pmol生物素化报告序列,1:10000稀释倍数的SA-HRP),OTA浓度在0.01~50ng/mL范围内与化学发光信号值的下降幅度(ΔCL信号值)成正比(Y=22490.6X-19524.9,r2=0.9898),最低检测为0.01ng/mL。葡萄酒样品平均加标回收率在在98.5%~109.3%之间,相对标准偏差在5.2%~7.7%之间(n=3)。经考察,本法具有较高特异性,不受其他物质干扰。
实施例2
一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,包括以下步骤:
1)通过氨羧反应将氨基修饰的OTA适体固定在羧基磁性微球表面,得到磁性微球-OTA适体复合物;
2)向步骤1)所得的磁性微球-OTA适体复合物中先后加入待测样品和生物素化的报告序列,充分反应;
3)取固相与SA-HRP溶液混合后共孵育,取固相即得到辣根过氧化酶标记的适体传感器;
4)将步骤3)所述辣根过氧化酶标记的适体传感器与HRP化学发光底物混匀,而后检测发光信号CL值。
在以上技术方案的基础上,满足以下条件:
步骤1)包括以下操作:取磁性微球,利用0.1M的咪唑缓冲溶液洗涤,而后取固相重悬于含有EDC的咪唑缓冲溶液中,于37℃震荡孵育20min,而后以磁性微球与氨基修饰的OTA适体用量比为4:3(μg:pmol)的比例加入氨基修饰的OTA适体,于37℃震荡反应60min,取固相利用PBST缓冲溶液洗涤,取固相加入10%的PVP溶液,于37℃条件下震荡60min,而后取固相利用PBST缓冲溶液洗涤,即得到磁性微球-OTA适体复合物。
步骤2)包括以下操作:向步骤1)所得的磁性微球-OTA适体复合物中加入待测样品,于37℃条件下震荡60min,取固相利用PBST缓冲溶液洗涤,取固相与含有生物素化的报告序列的BA杂交液混合,在37℃震荡反应60min,取固相利用PBST缓冲溶液洗涤。
步骤2)中BA杂交液中生物素化的报告序列的含量为20pmol。
步骤2)中BA杂交液的加入量与步骤1)中氨基修饰的OTA适体用量之比为10:3(μL:pmol)。
步骤3)所述SA-HRP溶液是稀释倍数为1:10000的SA-HRP溶液。
步骤3)所述共孵育是在37℃条件下震荡60min。
以上所述的取固相,均是通过磁性分离移去上清液实现的。
实施例3
一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,包括以下步骤:
1)通过氨羧反应将氨基修饰的OTA适体固定在羧基磁性微球表面,得到磁性微球-OTA适体复合物;
2)向步骤1)所得的磁性微球-OTA适体复合物中先后加入待测样品和生物素化的报告序列,充分反应;
3)取固相与SA-HRP溶液混合后共孵育,取固相即得到辣根过氧化酶标记的适体传感器;
4)将步骤3)所述辣根过氧化酶标记的适体传感器与HRP化学发光底物混匀,而后检测发光信号CL值。
在以上技术方案的基础上,满足以下条件:
步骤1)包括以下操作:取磁性微球,利用0.05M的咪唑缓冲溶液洗涤,而后取固相重悬于含有EDC的咪唑缓冲溶液中,于35℃震荡孵育15min,而后以磁性微球与氨基修饰的OTA适体用量比为2:1(μg:pmol)的比例加入氨基修饰的OTA适体,于35℃震荡反应50min,取固相利用PBST缓冲溶液洗涤,取固相加入8%的PVP溶液,于35℃条件下震荡50min,而后取固相利用PBST缓冲溶液洗涤,即得到磁性微球-OTA适体复合物。
步骤2)包括以下操作:向步骤1)所得的磁性微球-OTA适体复合物中加入待测样品,于35℃条件下震荡50min,取固相利用PBST缓冲溶液洗涤,取固相与含有生物素化的报告序列的BA杂交液混合,在35℃震荡反应50min,取固相利用PBST缓冲溶液洗涤。
步骤2)中BA杂交液中生物素化的报告序列的含量为15pmol。
步骤2)中BA杂交液的加入量与步骤1)中氨基修饰的OTA适体用量之比为5:1(μL:pmol)。
步骤3)所述共孵育是在35℃条件下震荡50min。
实施例4
一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,包括以下步骤:
1)通过氨羧反应将氨基修饰的OTA适体固定在羧基磁性微球表面,得到磁性微球-OTA适体复合物;
2)向步骤1)所得的磁性微球-OTA适体复合物中先后加入待测样品和生物素化的报告序列,充分反应;
3)取固相与SA-HRP溶液混合后共孵育,取固相即得到辣根过氧化酶标记的适体传感器;
4)将步骤3)所述辣根过氧化酶标记的适体传感器与HRP化学发光底物混匀,而后检测发光信号CL值。
在以上技术方案的基础上,满足以下条件:
步骤1)包括以下操作:取磁性微球,利用0.2M的咪唑缓冲溶液洗涤,而后取固相重悬于含有EDC的咪唑缓冲溶液中,于39℃震荡孵育25min,而后以磁性微球与氨基修饰的OTA适体用量比为1:1(μg:pmol)的比例加入氨基修饰的OTA适体,于39℃震荡反应70min,取固相利用PBST缓冲溶液洗涤,取固相加入12%的PVP溶液,于39℃条件下震荡70min,而后取固相利用PBST缓冲溶液洗涤,即得到磁性微球-OTA适体复合物。
步骤2)包括以下操作:向步骤1)所得的磁性微球-OTA适体复合物中加入待测样品,于39℃条件下震荡70min,取固相利用PBST缓冲溶液洗涤,取固相与含有生物素化的报告序列的BA杂交液混合,在39℃震荡反应70min,取固相利用PBST缓冲溶液洗涤。
步骤2)中BA杂交液中生物素化的报告序列的含量为25pmol。
步骤2)中BA杂交液的加入量与步骤1)中氨基修饰的OTA适体用量之比为5:2(μL:pmol)。
步骤3)所述共孵育是在39℃条件下震荡70min。
以上所述的取固相,均是通过磁性分离移去上清液实现的。
实施例5
一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,包括以下步骤:
1)通过氨羧反应将氨基修饰的OTA适体固定在羧基磁性微球表面,得到磁性微球-OTA适体复合物;
2)向步骤1)所得的磁性微球-OTA适体复合物中先后加入待测样品和生物素化的报告序列,充分反应;
3)取固相与SA-HRP溶液混合后共孵育,取固相即得到辣根过氧化酶标记的适体传感器;
4)将步骤3)所述辣根过氧化酶标记的适体传感器与HRP化学发光底物混匀,而后检测发光信号CL值。
在以上技术方案的基础上,满足以下条件:
步骤1)包括以下操作:取磁性微球,利用0.08M的咪唑缓冲溶液洗涤,而后取固相重悬于含有EDC的咪唑缓冲溶液中,于36℃震荡孵育19min,而后以磁性微球与氨基修饰的OTA适体用量比为5:3(μg:pmol)的比例加入氨基修饰的OTA适体,于38℃震荡反应55min。
步骤2)包括以下操作:向步骤1)所得的磁性微球-OTA适体复合物中加入待测样品,于38℃条件下震荡58min,取固相利用PBST缓冲溶液洗涤,取固相与含有生物素化的报告序列的BA杂交液混合,在36℃震荡反应62min,取固相利用PBST缓冲溶液洗涤。
步骤3)所述SA-HRP溶液是稀释倍数为1:10000的SA-HRP溶液。
实施例6
一种基于辣根过氧化酶标记适体传感器的OTA化学发光检测方法,包括以下步骤:
1)通过氨羧反应将氨基修饰的OTA适体固定在羧基磁性微球表面,得到磁性微球-OTA适体复合物;
2)向步骤1)所得的磁性微球-OTA适体复合物中先后加入待测样品和生物素化的报告序列,充分反应;
3)取固相与SA-HRP溶液混合后共孵育,取固相即得到辣根过氧化酶标记的适体传感器;
4)将步骤3)所述辣根过氧化酶标记的适体传感器与HRP化学发光底物混匀,而后检测发光信号CL值。
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,并不用以限制本发明。凡在本发明的申请范围内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!